霍山石斛多糖单克隆抗体的制备及多糖组织分布研究
王长顺
(合肥工业大学,安徽合肥 230009)
霍山石斛多糖单克隆抗体的制备及多糖组织分布研究
王长顺
(合肥工业大学,安徽合肥 230009)
[目的]探讨霍山石斛多糖口腔注射后多糖在小鼠体内的分布状况。[方法]以霍山石斛原球茎中提取的一种多糖与牛血清白蛋白偶联后作为抗原,免疫小鼠获得单克隆抗体,以获得的单克隆抗体为一级抗体对小鼠进行免疫组织化学试验。[结果]证实了CDAP活化法可有效偶联多糖与蛋白质,且以制备的偶联物能引起小鼠免疫反应从而制备出所需的单克隆抗体,利用获得的活性较高、特异性较好的单克隆抗体得到多糖在小鼠组织的分布图。[结论]该方法可为霍山石斛多糖进入机体后分布情况提供科学依据。
霍山石斛;多糖;单克隆抗体;免疫组织化学
霍山石斛(Dendrobiumhuoshanense)俗称米斛,是兰科石斛属的草本植物,主产于大别山区的安徽省霍山县,具有滋养阴津、护肝利胆、补益脾胃、降低血糖、抑制肿瘤及增强免疫力等特点[1]。目前,口服霍山石斛多糖进入机体内,引起活性的物质为多糖大分子还是多糖被分解后小分子引起的活性还不明确。单克隆抗体自问世以来,被广泛应用于生物学领域,多糖类单克隆抗体的制备技术亦十分成熟,王厚延等[2]、姚文兵[3]先后成功地制备出了六味地黄多糖及灵芝多糖的单克隆抗体,为植物多糖药理研究打下了良好的基础。免疫组织化学是单克隆抗体代表性应用之一,利用带显色剂标记的特异性抗体在组织细胞原位通过抗原抗体反应和组织化学反应的呈色现象,可以对相应的抗原进行定性、定位、定量的研究。为此,笔者以霍山石斛一种盐洗多糖为材料,制备出其单克隆抗体,对灌胃后的小鼠做免疫组织化学试验,探讨引起多糖活性的物质为大分子多糖还是多糖小分子片段。
1 材料与方法
1.1材料
1.1.1试材。霍山石斛多糖由合肥工业大学生物与食品工程学院中草药与功能食品研究所提供。SPF级昆明小白鼠(25±3 g)购自安徽医科大学实验动物中心,合格证号:皖医实动准9901。
1.1.2试剂。1-氰基-4-二甲氨基吡啶四氟硼酸酯(CDAP)、牛血清白蛋白(BSA)、弗氏佐剂等,购自Sigma公司;HRP标记的羊抗小鼠Ig,购自武汉博士德生物工程有限公司;RPMI-1640培养基,购自赛默飞世尔生物有限公司。
1.1.3仪器。紫外可见分光光度计,北京瑞利分析仪器公司;CO2培养箱,SANYO公司;BM-Ⅱ型病理组织包埋机,安徽电子科学研究所;LeicaRM2145组织切片机,上海五相仪器仪表有限公司。
1.2方法
1.2.1多糖与蛋白的偶联及分离纯化。将20 mg多糖溶于水,配成10 mg/mL溶液,边漩涡震荡边加入150 μL用乙腈配成的浓度为100 mg/mL CDAP溶液(加入过快,多糖会沉淀出来),30 s后加入150 μL 0.2 mol/L TEA, 2 min后加入2 mL 20 mg/mL的BSA溶液(用pH 7.5的0.15 mol/L HEPES缓冲液溶解),4 ℃反应过夜,再加入1 mL 3%乙醇胺溶液(用pH 7.5的0.75 mol/L HEPES缓冲液稀释)终止反应,以0.15 mol/L氯化钠为流动相、葡聚糖凝胶柱S-500为介质分离偶联物,在280和490 nm处分别测蛋白与多糖的吸光值[4]。
1.2.2小鼠免疫。免疫前1 d剪鼠尾采集血液,收集血清作为对照。初次免疫取体重20~25 g BALB/c雌性KM小鼠5只,称取600 μg多糖与蛋白偶联物充分溶于0.75 mL生理盐水中,吸入5 mL注射器中。将弗氏完全佐剂放入37 ℃水浴中预热,振荡2 min,使弗氏完全佐剂中的结核分枝杆菌均匀重悬后用5 mL注射器吸取0.75 mL弗氏完全佐剂,通过带Luer-lock的双乳化接头将抗原与弗氏完全佐剂连接,平稳推动活塞,使弗氏完全佐剂与抗原充分乳化,滴一滴乳化液于水中,小乳滴在水面形成稳定的油珠。将乳化剂推入到一个注射器中,接上针头,对小鼠进行多点皮下注射免疫,每只小鼠注射总量为200 μL。14 d后第1次加强免疫,将弗氏完全佐剂改为弗氏不完全佐剂与多糖蛋白偶联物乳化,小鼠皮下多点注射。28 d后第2次加强免疫,操作同第1次。36 d 后收集小鼠血清测血清中抗体的效价,与免疫前血清一起比较对抗原的反应性。若检测显示血清效价<1∶1 000,42 d 后第3次加强免疫,方法同第1次;若检测显示血清效价>1∶1 000,不进行任何处理。52 d后将多糖蛋白偶联物用无热原的生理盐水溶解,不加佐剂进行融合前的冲击免疫,每只200 μL。有效途径为静脉注射,如不适合静脉注射则腹腔注射。第55天眼球取血,收集血清留作阳性对照,收获脾细胞与骨髓瘤细胞融合[5-8]。其中,对照组分别以多糖与牛血清白蛋白为免疫原注射小鼠皮下,方法同上。
1.2.3血清效价的检测。称取适量抗原,用抗原包被液溶解,制成160 μg/mL的溶液,加入到96孔酶标板中,每孔100 μL,2~8 ℃放置14~16 h后甩掉液体,用洗涤液洗3次,拍干。每孔加入100 μL封闭液,37 ℃孵育1 h。甩干液体,洗涤液洗3次,拍干,用稀释液将小鼠血清按一定比例梯度稀释,血清:PBS的体积比分别为1∶100、1∶1 000、1∶4 000、1∶16 000、1∶64 000,每孔各加100 μL,37 ℃孵育1 h后洗板3次,加入100 μL 1∶5 000稀释的辣根过氧化物酶(HRP)标记的羊抗小鼠Ig,37 ℃温育30 min,洗板3次,每孔再加入TMB底物终止液100 μL,温室避光作用20 min,在酶标板上读取450 nm处吸光值,P/N≥2.1为阳性,否则为阴性[9-13]。
1.2.4脾细胞与骨髓瘤细胞融合。
1.2.4.1骨髓瘤细胞制备。在杂交瘤细胞融合前10 d,将骨髓瘤细胞以8-杂氮鸟嘌呤(8-AG,15~20 mg/L培养基)处理,连续培养7 d,除去含次黄嘌呤鸟嘌呤磷酸核糖转移酶(HGPRT)的骨髓瘤细胞,然后用含15%胎牛血清(FBS)的RPMI1640培养液对骨髓瘤进行增殖培养,使细胞浓度在融合当天达到105个/mL,细胞用无血清培养基在4 ℃条件下1 500 r/min离心5 min,弃上清,洗3次,防止血清中蛋白质干扰膜融合,计数,重悬,调至细胞浓度为1×107个/mL。
1.2.4.2脾细胞的获取。无菌取脾脏,加不含血清的培养基于培养皿中,300目纱布研磨,收集过滤后的细胞悬液,用无血清培养基洗3次,计数,离心,去上清,至室温待用。
1.2.4.3细胞融合。将上述脾细胞与骨髓瘤细胞按5∶1于离心管中混合,1 500 r/min离心5 min,将上清倒干净,置于37 ℃水浴中,1 min内边震荡边加1 mL 1 g/mL的聚乙二醇(PEG-1500),静置1 min后,2 min内缓慢加入2 mL预热的无血清的培养基,4 min内边混合边加入8 mL完全培养基,4 ℃条件下1 500 r/min离心10 min,去上清。再加入含15%胎牛血清的RPMI1640培养基,混匀后,将融合的细胞和滋养细胞移至培养瓶中,混合均匀,调至浓度为6.67×105个/mL,混匀后移至96孔板中,每孔150 μL,放到培养箱中,37 ℃,5% CO2(体积分数)培养过夜,然后加入50 μL含20%FBS的RPMI1640完全培养基和4倍浓度的HAT培养4 d,4 d后半量换液,一周要换液3次,2周后用HT培养基代替HAT培养基,连续培养3 d后,即可用含10% FBS的RPMI1640培养基培养[14-16]。
1.2.5杂交细胞的筛选。融合后的杂交瘤细胞经含HAT和HT的培养基筛选后,存在多个脾细胞与一个骨髓瘤细胞融合或一个脾细胞与多个骨髓瘤细胞融合等现象,且多数为不能分泌所需抗体的杂交瘤细胞,需初步筛选出含有能分泌所需抗体的杂交瘤细胞孔,因杂交瘤细胞分泌的抗体会溶入到培养基中,取适量培养杂交瘤细胞的培养基,以160 μg/mL的多糖蛋白偶联物包被96孔酶标板,采用间接ELISA法检测培养基中抗体的效价。
1.2.6杂交细胞亚克隆。采用酶联免疫吸附试验筛选出能分泌与抗原结合的抗体的孔,采用有限稀释法进行亚克隆,克隆前1 d,用同系从未接触过目的抗原的小鼠腹腔巨噬细胞制备滋养细胞,调节浓度为2×105个/mL,加到96孔板,每孔100 μL。取5 000个活的杂交瘤细胞,加入5 mL含HT完全培养基的聚丙烯锥形管中,依次进行10倍稀释,可得浓度分别为100和10个细胞/mL的细胞悬液,在已添加过滋养细胞的96孔细胞培养板中每个孔加100 μL,使每个培养孔中分别含100、10、1个细胞/孔。分离筛选出阳性克隆,再进行2轮亚克隆筛选。
1.2.7腹水抗体的制备。
1.2.7.1单克隆抗体制备方法的选择。单克隆抗体的生产既可以采用动物体作为生物反应器进行生产,又可以采用人工生物反应器培养杂交瘤细胞进行生产,结合实验室现有的实际条件以及考虑到人工培养中不可避免的污染问题,该试验选择雄性小鼠体内诱生法,通过诱发实体瘤或腹水瘤,从腹水中提取McAb,该方法简单、经济,且可以有效避免因污染而导致细胞株的丢失问题[17-19]。
1.2.7.2杂交瘤细胞的注入。计划注射杂交瘤细胞前14 d小鼠腹腔注射0.5 mL液体石蜡,第12天用新鲜的培养基传代杂交瘤细胞,使其处于对数生长期,注射前用血球计数法确定活细胞比例达90%~100%,并用50 mL尖底离心管200 g 离心5 min,弃上清,用PBS重悬,使活细胞含量为10×106个/mL,每只小鼠腹腔注射0.5 mL杂交瘤细胞悬液[20-23]。
1.2.7.3单克隆抗体的收获。小鼠腹腔注射杂交瘤细胞7 d后观察小鼠腹腔(或称重),若腹腔肿大则进行第1次收获腹水(一般小鼠体重不超过20%)。用18号针头刺入小鼠腹腔,针头直接对准10 mL离心管,若腹水不宜流出,需轻柔挪动针头继续引流。收获的腹水1 500 g离心10 min,除去腹水中的细胞,第2次取腹水应在第1次穿刺的48 h之后进行,离心之后的腹水应在-20 ℃下保存。所有腹水收集完后离心,分装在5 mL无菌离心管中并保存在-70 ℃条件下,每次使用取1管。
1.2.8抗体的纯化与鉴定。
1.2.8.1纯化。采用硫酸铵沉淀法将腹水在2 500 r/min下离心20 min,然后倒在一个洁净的烧杯中,置于磁力搅拌器上,缓慢加入等体积的饱和硫酸铵溶液,在4 ℃下混合12 h。3 000 g离心30 min,弃上清(保留上清做后续检测)向沉淀中缓慢加入150 mmol/L PBS溶液搅拌均匀,PBS大概为原液的50%。将预处理的抗体用20倍的PBS溶液透析,每2 h更换一次,更换3次[24]。
1.2.8.2紫外分光光度计鉴定法。含有芳香族氨基酸残基(色氨酸、苯丙氨酸及酪氨酸)的蛋白质会在波长约280 nm处吸收光线能量。依据这3种氨基酸的已知数值,每种蛋白质都有不同的消光系数。对于免疫球蛋白,其成分的差异在很大程度上可以被忽略。吸光度越大,其蛋白质浓度越高,其中在浓度为1.0 mg/mL时,IgG、IgM、IgA、IgE的吸光度分别为1.36、1.18、1.32、1.53。
1.2.8.3SDS-聚丙烯酰胺凝胶电泳鉴定。聚丙烯酰胺凝胶为网状结构,具有分子筛效应,SDS-PAGE凝胶电泳是在聚丙烯酰胺凝胶系统中引进SDS(十二烷基硫酸钠),SDS会与变性的多肽结合,并使蛋白带负电荷,由于多肽结合SDS的量几乎总是与多肽的分子量成正比而与其序列无关,因此SDS多肽复合物在丙稀酰胺凝胶电泳中的迁移率仅与多肽的大小有关。分离胶与浓缩胶的配比见表1。

表1 分离胶和浓缩胶的制备
1.2.8.4间接ELISA鉴定法。获得的抗体不仅需要知道其浓度与纯度,还需知道其是否为所需抗体及其活性,采用间接ELISA法解决以上问题,方法同“1.2.3”血清效价的检测,将血清换成制备的抗体。
1.2.9免疫组化。免疫组化是应用免疫学基本原理——抗原抗体反应,即抗原与抗体特异性结合的原理,通过化学反应使标记抗体的显色剂显色来确定组织细胞内抗原,对其进行定位、定性及定量的分析。小鼠灌胃0.2 mL霍山石斛多糖(浓度150 mg/kg)后,分别取出小肠、肝、脾、肾和肺,PBS溶液洗涤后置于4%的中性甲醛溶液中固定6 h,进行免疫组织化学分析。
2 结果与分析
2.1免疫抗原的纯度由图1可知,多糖与蛋白的出峰时间分别为65和63管左右,47~58管多糖与蛋白发生了偶联,收集此部分的偶联物经浓缩、透析,0.22 μm微孔滤膜过滤后上高效液相得到HPLC图,从图2可看出在19.087 min出现最高峰,且出峰较对称,可知获得的多糖蛋白偶联物成分较单一。
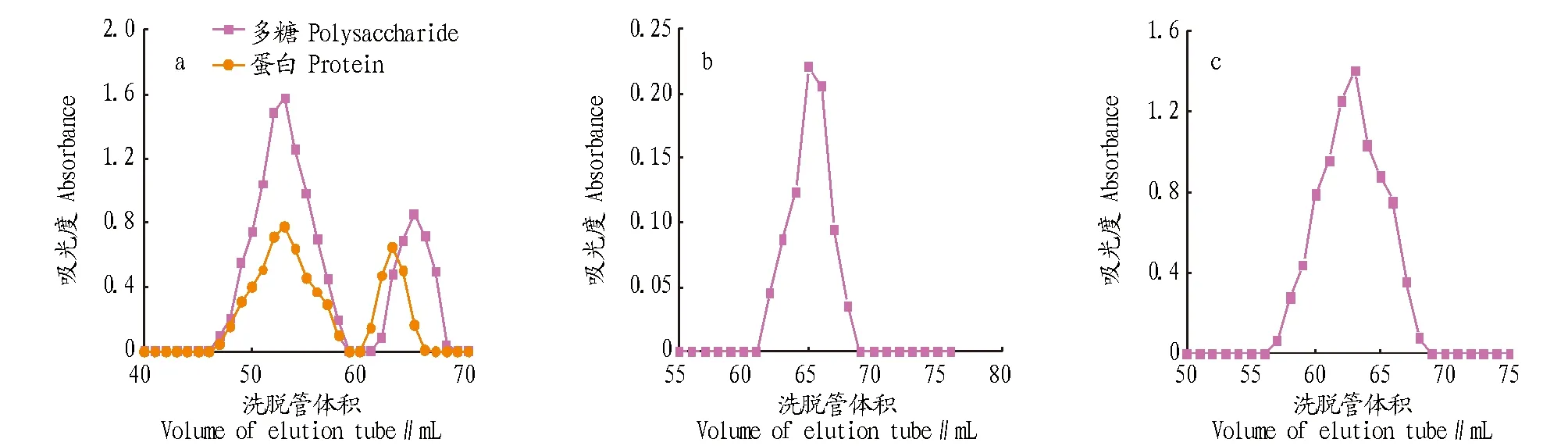
图1 多糖-蛋白偶联物(a)、多糖(b)和BSA(c)层析洗脱曲线Fig.1 Polysaccharide-protein conjugate(a), polysaccharide(b) and BSA(c) chromatography elution curve
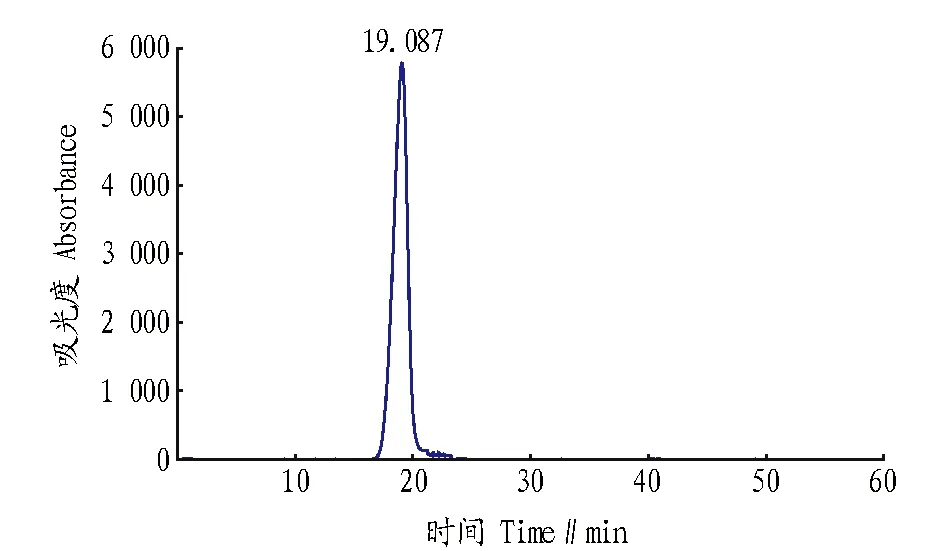
图2 多糖-蛋白偶联物的HPLC图Fig.2 HPLC of polysaccharide-protein conjugate
2.2血清效价的检测以多糖-蛋白偶联物作为抗原免疫小鼠,从表2可以看出,经免疫后小鼠血清对多糖-蛋白偶联物表现出明显的抗原-抗体反应,说明小鼠血清中具有较高的抗多糖-蛋白偶联物的抗体。
2.3抗体鉴定
2.3.1抗体浓度的测定。采用考马斯亮蓝法和紫外分光光度计法测定抗体的浓度:将制备的单抗稀释10倍后,通过考马斯亮蓝法在595 nm处测得吸光值为0.735,根据蛋白质标准曲线y=0.006 4x+0.165算出蛋白质含量约为0.89 mg/mL。取适量的抗体等量稀释后,通过紫外分光光度计测得在280 nm处的吸光度为0.62,根据免疫球蛋白吸光系数可算出单抗的浓度为0.91 mg/mL。
2.3.2SDS-PAGE。SDS为一种阴离子去污剂,其通过裹包多肽骨架可使蛋白质变性并使整条多肽链带负电荷,且所带的负电荷远远超过了蛋白原有的电荷量,消除了不同分子
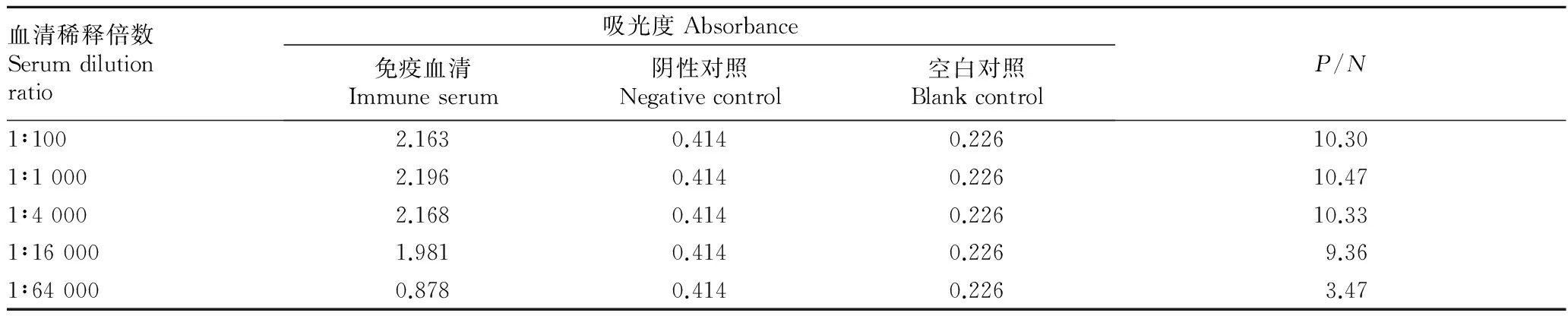
表2 多糖-蛋白偶联物为免疫原的血清效价检测
间的电荷差异和结构差异,这样,样品的迁移率并不取决于蛋白质原有的电荷量而是由相对分子质量的大小决定。从图3可以看出,完整的单克隆抗体与70 kDa蛋白质标准品的迁移位置基本一致,下面有较浅的条带可能是抗体碎片或纯化过程中未除去的杂蛋白,且浓度较低。

图3 单克隆抗体的SDS-PAGEFig.3 Monoclonal antibodies SDS-PAGE
2.3.3间接ELISA法鉴定抗体。以多糖-蛋白偶联物包被酶标板,试验组用制备的单抗作为一抗,空白组用等量PBS,通过间接ELISA法在450 nm处测吸光值。通过5次平行试验得到,试验组在450 nm处有明显吸光值,较空白组高很多,说明制备的抗体中有能特异性结合多糖的抗体,且抗体的活性较好。
2.4多糖的组织分布由图4可知,小肠中有明显的显色反应(红色荧光),其他组织均没有,说明霍山石斛多糖可以原型分布于肠腔中。许多研究已经表明,霍山石斛多糖具有显著的免疫调节效应,除肠腔外在其他组织均未检测到霍山石斛多糖,可能表明霍山石斛多糖不被机体吸收,而是通过调节肠道黏膜免疫活性以达到调节机体系统免疫的功能;或霍山石斛多糖以原型被吸收后降解成片段发挥作用,也有可能在肠腔中被降解后进入体内发挥作用,无论是哪种降解方式,可能由于多糖抗原表位被破坏,导致该试验未能检测到多糖在肠腔以外其他组织中的分布。

注:a1、b1为肠组织;a2、b2为脾组织;a3、b3为肺组织;a4、b4为肝组织;a5、b5为肾组织。Note: a1, b1. Intestinal tissue; a2, b2. Spleen tissue; a3, b3. Lung tissue; a4, b4. Hepatic tissue; a5, b5. Renal tissue.图4 空白对照组(a)和试验组(b)多糖在不同组织中的分布(×200)Fig.4 Distribution of blank control group(a) and test group(b) polysaccharides in different tissues
3 结论
(1)经HPLC分析证明试验所用的霍山石斛多糖为均一多糖,CDAP法可有效将多糖与牛血清白蛋白偶联在一起,且经葡聚糖凝胶S-500分离得到的多糖-蛋白偶联物的成分均一。
(2)以制备的多糖-蛋白偶联物为免疫原免疫小鼠,将获得的脾细胞与骨髓瘤细胞融合后制备杂交瘤细胞,经过多轮筛选,能筛选出稳定分泌抗霍山石斛多糖单克隆抗体的杂交瘤细胞。
(3)将能稳定分泌抗霍山石斛多糖单克隆抗体的杂交瘤细胞注入小鼠腹腔后,通过小鼠腹水可以大量制备单克隆抗体。经硫酸铵沉淀法纯化后获得的抗霍山石斛多糖单克隆抗体,鉴定后证明对霍山石斛多糖具有较高的特异性结合能力。
(4)通过免疫组织化学试验发现,除肠腔外在其他组织均未检测到霍山石斛多糖,出现这种情况有2种可能:一种是霍山石斛多糖通过调节肠道黏膜免疫活性来达到调节机体免疫功能;第2种可能是多糖进入肠腔后被分解成片段,这些片段进入各组织中发挥作用,而由于这些片段上的抗原表位被破坏了,因此,制备的单克隆抗体未能特异性地识别到它们。
[1] 罗建平,查学强,姜绍通.药用霍山石斛原球茎的液体悬浮培养[J].中国中药杂志,2003,28(7):611-614.
[2]王厚延,杨俊卿.六味地黄活性多糖抗体制备及其亲和性的研究[C]//第八届全国中药和天然药物学术研讨会与第五届全国药用植物和植物药学学术研讨会论文集.武汉:中国植物学会,2005:361-364.
[3]姚文兵.灵芝多糖GLP免疫原优化及单克隆抗体制备[J].中国天然药物,2007,5(6):448-452.
[4] SHAFER D E,TOLL B. Activation of soluble polysaccharides with 1-cyano-4-dimet hylaminopyridinium tetrafluoroborate (CDAP) for use in protein-polysaccharide conjugate vaccines and immunological reagents. II. Selective crossl inking of proteins to CDAP-activated polysaccharides[J].Vaccine,2000,18:1273-1281.
[5] HUTCHINS W A,ADKINS A R.Molecular characterization of a monoclonal antibody production in response to a group C meningococcal polysaccharide peptide mimic[J]. Molecular immunology,1996,33(6):503-510.
[6] DE ST GROTH S F,SCHEIDEGGER D.Production of monoclonal antibodies: Strategy and tactics[J]. Journal of Immunol Ogical Methods,1980,35(1/2):1-21.
[7] DE LOS TOYOS J R, MÉNDEZ F J,VAZQUEZ F,et al.Functional analysis of pneumolysin by use of monoclonal antibodies[J]. Infection and immunity,1996,64(2):480-484.
[8] ZIOUTI N, TRIANTAPHYLLIDOU I E, ASSOUTI M,et al.Solid phase assays in glycoconjugate research: Applications to the analysis of proteoglycans, glycosaminoglycans and metalloproteinases[J].Journal of pharmaceutical and biomedical analysis,2004,34(4):771-789.
[9] VARNUM S M,WOODBURY R. A protein microarray ELISA for screening biological fluids[J]. Biological sciences division,2004,264:162-172.
[10] WONG C H,BRYAN M C.Sugar arrays in microtiter plates[J]. Methods Enzymol,2003,362:218-225.
[11] 闻平,郭月芳.(1,3)-β-D-葡聚糖ELISA检测方法建立及初步临床应用[J].现代检验医学杂志,2003,18(5):1-2.
[12] KÖHLER G,MILSTEIN C.Continuous cultures of fused cells secreting antibody of predefined specificity[J]. Nature,1975,256:495-497.
[13] CARLOS A V,JULIANA C,MERCEDES S. Singleshot plasmid DNA intrasplenic immunization for the production of monoclonal antibodies persistent expression of DNA[J]. Journal of immunological methods, 2000,244:1-2.
[14] BRODEUR B R, TSANG P S.High yield monoclonal antibody production in ascites[J]. J Immunol Methods, 1986,86:239-241.
[15] STEWART F, CALLANDER A,GARWES D J.Comparison of ascites production for monoclonal antibodies in BALB/c and BALB/c-derived cross-bred mice[J]. J Immunol Methods,1989,119:269-275.
[16] BRODEUR B R, TSANG P,LAROSE.Parameters affecting ascites tumour formation in mice and monoclonal antibody production[J]. J Immunol Methods,1984,71:265-272.
[17] HOOGENRAAD N J, WRAIGHT C J. The effect of pristane on ascites tumor formation and monoclonal production[J]. Methods in Enzymol,1986,121:375-381.
[18] HOOGENRAAD N, HELMAN T,HOOGENRAAD J.The effect of pre-injection of mice with pristane on ascites tumour formation and monoclonal antibody production[J]. J Immunol Methods,1983,61:317-320.
[19] JACKSON L R,TRUDEL L J,FOX J G,et al.Monoclonal antibody production in murine ascites.II.Production characteristics[J].Lab Anim Sci,1999,49(1):81-86.
[20] GAGNON P.The quest for a generic IgG purification process[C]//Presentation given at the waterside conference.Bal Harbour,FL,2005.
[21] 孙光瑞,李小兵,王哲.制备分泌单克隆抗体杂交瘤细胞小鼠腹水的方法[M].北京:科学出版社,2001:953.
[22] 于翠,吴坚祥,周雪平.番茄花叶病毒单克隆抗体的制备及检测应用[J].微生物学报,2002,42(4):453-457.
[23] 龚鹏飞,王权,陈永军.孔雀石绿单克隆抗体的制备及其鉴定[J].中国兽医科学,2007,37(4):359-362.
[24] 陈丹,孙广瑞,柳增善.辛酸-硫酸铵联合沉淀法在单克隆抗体纯化中的应用[J].安徽农业科学,2007,35(26):8105-8108.
Preparation ofDendrobiumhuoshanensePolysaccharide Monoclonal Antibodies and Distribution in Tissues
WANG Chang-shun
(Hefei University of Technology, Hefei, Anhui 230009)
[Objective]To discuss the distribution of polysaccharides in mice after oral injection withDendrobiumhuoshanensepolysaccharide.[Method]Conjugating the polysaccharides to bovine serum albumin as an antigen, monoclonal antibodies were obtained and used as primary antibody to conduct immuno histochemistry experiments.[Result] It was confirmed that CDAP activation method can effectively couple polysaccharides and proteins, the obtained conjugates can induce the immune response of mice to produce the required monoclonal antibody. Distribution of polysaccharides in mouse tissues was obtained by using monoclonal antibody with high activity and specificity. [Conclusion] The method can provide scientific basis for distribution ofDendrobiumhuoshanensepolysaccharide in mice.
Dendrobiumhuoshanense; Polysaccharide; Monoclonal antibodies;Immuno histochemistry
国家自然科学基金(21006019)。
王长顺(1987-),男,吉林通化人,硕士研究生,研究方向:分子生物学。
2016-06-12
S 567.2
A
0517-6611(2016)21-100-04

