一种用于桑RAD-Seq高通量测序的基因组DNA提取方法
刘 玲, 柯皓天, 吕 银, 陈仁芳
(1.四川省丝绸科学研究院,四川成都 610031;2.四川省丝绸工程技术研究中心,四川成都 610031;3.西南大学生物技术学院,重庆 400716)
一种用于桑RAD-Seq高通量测序的基因组DNA提取方法
刘 玲1, 柯皓天1, 吕 银2, 陈仁芳3*
(1.四川省丝绸科学研究院,四川成都 610031;2.四川省丝绸工程技术研究中心,四川成都 610031;3.西南大学生物技术学院,重庆 400716)
[目的]筛选一种能够得到高质量桑树基因组DNA的方法。[方法]采用天根试剂盒法(Plant Genomic DNA Kit 离心柱型),并稍加改进,从11个桑种的新鲜嫩叶中提取DNA。[结果]该方法简单快速,不需要复杂仪器,且能有效地除去桑叶中的多糖、多酚、蛋白质等杂质,得到的DNA能够满足RAD-Seq高通量的测序要求。[结论]建立了一种用于桑RAD-Seq高通量测序的基因组DNA提取方法。关键词桑树;RAD-Seq;基因组DNA提取
高质量基因组DNA通常用于构建基因组文库、Southern杂交及PCR分离基因等。因此,选用合适的提取方法获取高质高量DNA非常重要[1]。RAD-Seq,即限制性酶切位点相关DNA的测序技术,是利用限制性内切酶对基因组进行酶切,产生一定大小的片段,构建测序文库,对酶切后产生的RAD片段进行高通量测序[2]。常用的植物基因组DNA提取方法有CTAB法[3]和SDS法[4],但利用这2种方法得到的桑DNA很难满足RAD-Seq测序的要求。桑RAD-Seq高通量测序对总DNA浓度的要求较高。桑树组织中含有较多的蛋白质、糖类、酚类等杂质,利用常用的提取方法很难得到高质量的DNA。笔者利用该方法能够得到较纯的桑树基因组DNA,满足RAD-Seq测序要求。
1 材料与方法
1.1试验材料供试材料为中国桑属11个种及变种,分别为白桑Morusalba,蒙桑M.mongolica,长穗桑M.wittiorum,鸡桑M.australis,奶桑M.macroura,细齿桑M.serrata,鬼桑M.mongolicavar.diabolica,川桑M.notabilis,黑桑M.nigra,华桑M.cathayana,滇桑M.yunnanensis。材料采自各原产地,采集时用带冰块的泡沫塑料盒盛装,尽快采回于-80 ℃冰箱保存备用。

1.3DNA质量检测
1.3.1琼脂糖凝胶电泳检测。取3 μL DNA溶液,加入2 μL 6×Loading buffer,用1%琼脂糖凝胶电泳进行检测,用DL 2 000 Maker做参照。150 V电泳20 min后,用EB染色,然后在紫外凝胶成像系统下观察并拍照。
1.3.2紫外分光光度计检测。取1 μL DNA样品,用Nanodrop分光光度计(ND-1000,Thermo Fisher Scientific,USA)检测DNA浓度和纯度(A260/A280)。
2 结果与分析
2.1DNA电泳检测结果琼脂糖凝胶电泳检测结果见图1。从图1可以看出,电泳条带明亮、清晰,无拖尾、弥散现象,说明该方法提取的桑树DNA无降解现象,基因组完整性好,浓度较高。

注:M.maker,1.白桑,2.蒙桑,3.长穗桑,4.鸡桑,5.奶桑,6.细齿桑,7.鬼桑,8.川桑,9.黑桑,10.华桑,11.滇桑。Note:M.maker, 1.M.alba, 2.M.mongolica, 3.M.wittiorum, 4.M.australis, 5.M.macroura, 6.M.serrata, 7.M.mongolica var.diabolica, 8.M.notabilis, 9.M.nigra, 10.M.cathayana, 11.M.yunnanensis.图1 DNA提取琼脂糖电泳图谱Fig.1 Genomic DNA detected by agarose gel electrophoresis
2.2DNA浓度和纯度A260/A280是检测DNA纯度的指标,A260/A280在1.8~2.0,说明DNA纯度较高;A260/A280大于2.0时,说明DNA样品中含有RNA;A260/A280小于1.8时,说明DNA样品中可能存在蛋白质污染。用Nanodrop分光光度计(ND-1000,Thermo Fisher Scientific,USA)检测提取的DNA浓度和纯度,结果见表1。由表1可知,A260/A280在1.80~1.90,浓度在92.5 ng/μL以上。说明所提取的DNA较纯,符合进一步分析要求。
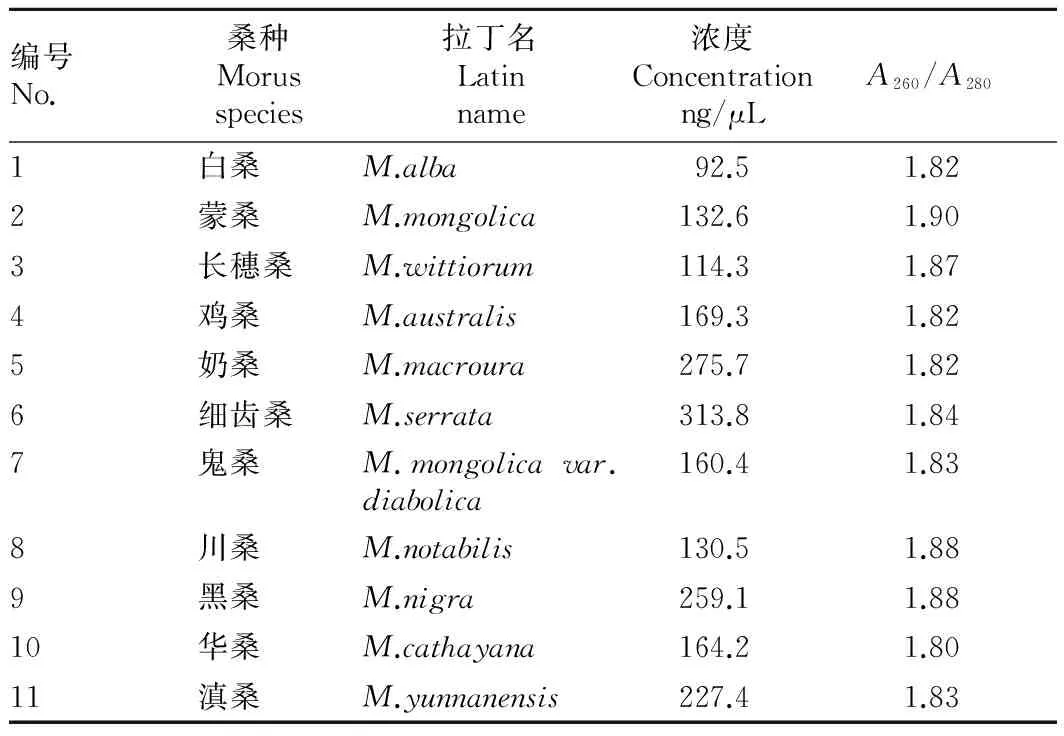
表1 桑种A260/A280
3 结论
该方法简单快速,不需要复杂仪器,且能有效地除去桑叶中的多糖、多酚、蛋白质等杂质,得到的DNA经华大基因检测能够满足RAD-Seq高通量测序要求。
[1] 吴艳艳, 代德艳, 蔡春梅.一种改良的大豆DNA提取方法[J].大豆科学, 2015, 34(1):112-115.
[2] 王洋坤, 胡艳, 张天真.RAD-seq技术在基因组研究中的现状及展望[J].遗传, 2014, 36(1):41-49.
[3] 蔡朝晖, 李萍, 董婷霞, 等.贝母的分子生物学鉴定方法的研究[J].药学学报,2000, 35(4):309-312.
[4] DOYLE J J, DOYLE J L. A rapid DNA isolation procedure for small quantities of fresh leaf tissue[J].Phytochemical bulletin, 1987, 19:11-15.
[5] 天根生长科技(北京)有限公司.天根试剂盒Plant Genomic DNA Kit植物基因组DNA提取试剂盒(离心柱型)使用说明书[Z].2016.
A High Throughput Sequencing DNA Extraction Method forMorusRAD-Seq
LIU Ling1, KE Hao-tian1, LU Yin2, CHEN Ren-fang3*
(1.Silk Research Institute of Sichuan Province, Chengdu, Sichuan 610031; 2.Sichuan Silk Engineering Research Center, Chengdu, Sichuan 610031; 3.Biotechnology School of Southwest University, Chongqing 400716)
[Objective] The aim was to screen out a method to obtain high quality DNA from mulberry genome.[Method] By using improved Plant Genomic DNA Kit centrifugal column method, DNA was extracted from 11 species of fresh mulberry leaves.[Result] The method is simple, rapid, and can effectively remove polysaccharides, polyphenols, protein and other impurities in the mulberry leaves, the DNA is able to meet the RAD-Seq high-throughput sequencing requirements.[Conclusion] A DNA extraction method for Morus RAD-Seq sequencing was established.
Mulberry; RAD-Seq; Genomic DNA extraction
刘玲(1989- ),女,山西大同人,硕士,从事桑树分子标记研究。*通讯作者,副研究员,博士,从事桑资源及分类研究。
2016-06-12
S 188
A
0517-6611(2016)21-136-02

