氮源对酿酒酵母GJ2008不同糖浓度甘蔗汁酒精分批发酵的影响
柯善恢,伍时华,张 健*,赵东玲,黄翠姬
(广西科技大学生物与化学工程学院,广西柳州545006)
氮源对酿酒酵母GJ2008不同糖浓度甘蔗汁酒精分批发酵的影响
柯善恢,伍时华,张健*,赵东玲,黄翠姬
(广西科技大学生物与化学工程学院,广西柳州545006)
研究了不同糖浓度下氮源对酿酒酵母GJ2008甘蔗汁酒精发酵的影响,旨在为高浓度甘蔗汁酒精发酵提供研究基础。将2 g/L尿素加入150 g/L、200 g/L、250 g/L、300 g/L和350 g/L总糖质量浓度甘蔗汁培养基中,以对应糖浓度未添加氮源组为对照组,通过分析细胞生长、糖代谢和乙醇生成来探究氮源如何影响甘蔗汁酒精发酵。结果表明:与未添加氮源相比,氮源加快了发酵速度,发酵周期最高缩短为18 h,糖消耗速率和乙醇生成速率最大分别提高了55%和96%;使酒精发酵更彻底,总糖含量最高减少了40.42 g/L;增加了目的产物,乙醇含量最高提升了28.4%。说明氮源有效地促进了甘蔗汁酒精发酵,加强了酵母的无氧呼吸途径。
氮源;酿酒酵母GJ2008;甘蔗汁酒精发酵;无氧呼吸途径
甘蔗富含蔗糖、葡萄糖和果糖,价格低廉,被认为是生产燃料乙醇最理想的糖质原料。乙醇作为生物能源,是最清洁的石油替代能源之一[1-3]。甘蔗汁酒精发酵最终酒精度偏低,高浓度甘蔗汁酒精发酵的发酵效率也不高,氮源可以有效促进高浓度甘蔗汁酒精发酵,但氮源如何影响甘蔗汁酒精发酵尚不清楚。氮源是构成菌体物质和一些代谢产物必需的营养元素,缺氮会使酒精发酵迟缓变慢[4],甚至导致酒精发酵途径的不完整。添加氮源几乎对发酵过程所有参数都会产生有利影响[5]。为了弄清氮源如何影响酒精发酵,国内外做了很多研究尤其是氮源对酵母生长的影响[6]。GUTIÉRREZ A等[7-8]发现在不同氮源下的酵母细胞生长(细胞数)与发酵活力并没有严格的相关性,但氮源可以提高最终发酵酒精度。BLOMQVIST J等[9]发现兼性厌氧酵母布鲁塞尔德克酵母(Dekkera bruxellensis)在厌氧条件下酒精发酵必须补充氮源。
本试验研究氮源对不同糖浓度甘蔗汁酒精发酵的影响,通过分析酵母细胞生长、糖代谢和乙醇生成,探讨添加氮源和不添加氮源对不同糖浓度甘蔗汁酒精发酵的影响,为高浓度甘蔗汁酒精发酵提高研究基础。
1 材料与方法
1.1材料与试剂
1.1.1菌株
酒精酵母(Saccharomyces cerevisiae)GJ2008:广西科技大学发酵工程研究所保藏。
1.1.2培养基
斜面活化培养基:酵母浸膏10 g/L,葡萄糖20 g/L,蛋白胨20 g/L,自然pH。
一级种子培养基:酵母浸膏10 g/L,葡萄糖20 g/L,蛋白胨20 g/L,自然pH。
二级种子培养基:酵母浸膏10 g/L,葡萄糖100 g/L,蛋白胨20 g/L,自然pH。
发酵培养基:将白糖加入至甘蔗汁中调节初始总糖质量浓度150 g/L、200 g/L、250 g/L、300 g/L、350 g/L,分为加氮源和不加氮源两组,调节pH 4.5,装液量为200 m L/500 m L锥形瓶中。
以上培养基均于115℃蒸汽灭菌20 m in。
1.1.3试剂
甘蔗汁:广西露塘糖厂;乙醇(色谱纯):天津市科密欧化学试剂有限公司;尿素(分析纯):广东台山粤侨试剂塑料有限公司;精制白糖:南京甘汁园糖业有限公司。
1.2仪器与设备
SGD-IV还原糖测定仪:山东省科学院生物研究所;GC7890Ⅱ气相色谱仪(配置火焰离子检测器(flame ionization detector,FID)检测器和T2100P色谱工作站):上海天美科学仪器有限公司;UPHW优普系列超纯水机:上海优普实业有限公司;HWY-2112全温度恒温调速摇床柜:上海智城分析仪器制造有限公司;1110M IKRO22R台式冷冻离心机:德国Hettich公司;DMB5Motic数码显微镜:麦克奥迪实业集团有限公司;XB.K.25血球计数板:北京科达有限公司。
1.3试验方法
1.3.1发酵方法
将32℃活化培养1~2 d斜面种子转接至一级种子培养基中,摇床120 r/min、32℃培养12 h后按10%(V/V)接种量转接至二级种子培养基中,牛皮纸透气膜封口,摇床120 r/min,32℃培养12 h后离心(4 000 r/min,10 min)弃上清,用无菌水将酵母泥振荡均匀制成10倍浓缩菌悬液,备用。以10%(V/V)接种量将二级种子分别接入200 g/L、250 g/L和300 g/L发酵培养基中,将过滤除菌的尿素以0、1 g/L、2 g/L、3 g/L、4 g/L量加入三种浓度培养基中,此为确定尿素添加量的预实验。确定尿素添加量后,将过滤除菌的尿素溶液加入至150 g/L、200 g/L、250 g/L、300 g/L、350 g/L发酵培养基中,以10%(V/V)接种量将二级种子接入培养基和与上述质量浓度相同未添加尿素的培养基中,未添加氮源的发酵培养基为对照组,装液量为200 m L/500 m L,发酵条件同上。每组2个平行,实验数据取平均值。
1.3.2分析方法
总糖的测定:使用还原糖测定仪测定。细胞数的出芽率的测定:采用血球板计数法。死亡存活率测定:美兰法[10]。乙醇浓度测定:采用气相色谱仪测定发酵过程中乙醇浓度,用面积外标法分析酒精浓度。气相色谱条件:氮气(N2)作为载气,柱温控制为80℃,气化室温度150℃,检测器温度150℃,总载气流速为92 m L/min,分流比为45∶1;发酵最终乙醇浓度用蒸馏法测定。
1.3.3数据处理
运用Origin 9.0软件对发酵数据处理并作图,运用Graph Pad Prism 5绘制和计算曲线下面积,数据处理按蒋凯[14]所述方法。
2 结果与分析
2.1氮源添加量的确定
因有机氮源成分复杂所以选尿素作为无机氮源,不同尿素添加量甘蔗汁酒精发酵最终乙醇浓度见表1。由表1可知,不同总糖质量浓度(200 g/L、250 g/L和300 g/L)甘蔗汁在不同尿素添加量条件下,酒精发酵最终乙醇含量不同,当尿素质量浓度为2 g/L时,最终乙醇含量最高,分别为88.2 g/L、116.8 g/L和137.3 g/L。因此,尿素添加量确定为2 g/L。
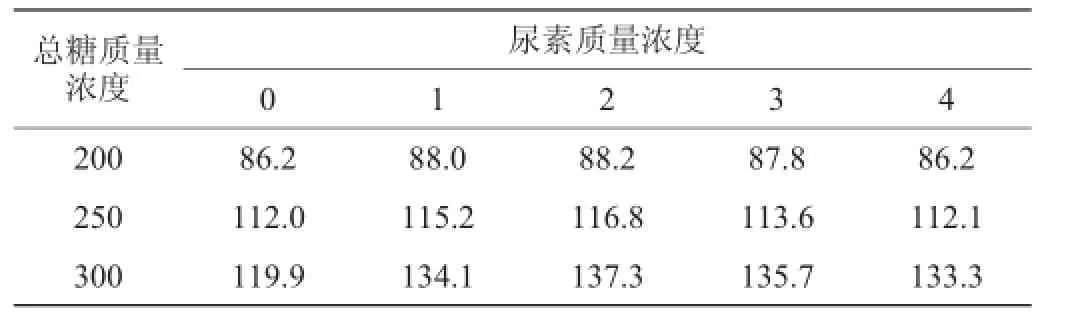
表1 氮源添加量与最终乙醇含量的关系Table 1 Relationship between n itrogen source addition and alcohol concentration g/L
2.2氮源对酵母菌细胞生长的影响
不同总糖质量浓度的甘蔗汁酒精发酵过程中氮源对酵母细胞生长、出芽率和死亡率的影响,如图1所示。由图1可知,相同糖浓度的甘蔗汁酒精发酵添加氮源与不添加氮源组(对照组)细胞数之间差距不大,250 g/L、300 g/L和350 g/L总糖质量浓度氮源组的细胞数在12 h后会略高于对照组,说明添加尿素在高浓度甘蔗汁酒精发酵时能一定程度增加细胞数。100 g/L和150 g/L总糖质量浓度时氮源组出芽率都明显高于其对照组,但随着总糖质量浓度的增高氮源组和对照组之间的出芽率趋于相同,说明添加尿素在低糖质量浓度时能增加细胞增长速率,高糖质量浓度时这种优势随总糖质量浓度增高而减弱。随着总糖质量浓度的升高,乙醇含量在增加(350 g/L总糖质量浓度除外),氮源组和对照组死亡率也明显在增加,由此推测酵母死亡率很可能与酒精生成即无氧呼吸途径有关。而对比250 g/L氮源组和对照组可知,氮源组与对照组最终乙醇含量相似,都属于较高乙醇含量,高乙醇含量也会影响酵母细胞生长,但氮源组的酵母细胞死亡率比对照组高出131.7%,而且氮源组与对照组最大的区别是氮源组的发酵速率比对照组快很多,乙醇产率高出58.0%,所以酒精发酵强度即无氧呼吸作用强度很可能也是造成酵母的死亡率增高的因素之一,即酵母的无氧呼吸作用越强酵母的死亡率就越高。同一总糖质量浓度氮源组与对照组比,氮源组死亡率高于对照组,尤其发酵最彻底的300 g/L总糖质量浓度,氮源组死亡率是对照组的3倍多。BELL S J等[11]指出氮源与酒精发酵即无氧呼吸途径密切相关,酿酒酵母缺氮会降低发酵性能和导致不完整的酒精发酵。VARONGSIRI K等[5]发现非酿酒酵母在缺氮情况下酒精发酵后期酵母能明显生长且保持高存活率(对比酿酒酵母)。氮源组比对照组的无氧呼吸更剧烈(乙醇产率更高),更彻底(残糖质量浓度更低),生成的乙醇更多(乙醇含量更高),可见氮源强化了酵母的无氧呼吸途径,又因为死亡率与无氧呼吸强度有关,最终尿素的添加增加了死亡率。
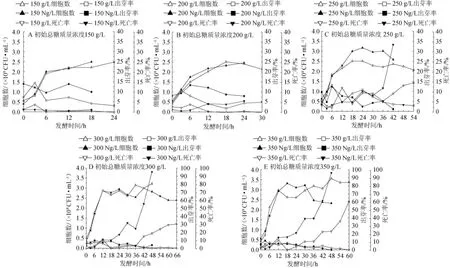
图1 甘蔗汁酒精发酵中氮源对酵母菌细胞生长的影响Fig.1 Effect of nitrogen source on yeasts cell growth in sugarcane juice alcoholic fermentation
2.3氮源对甘蔗汁酒精发酵糖代谢的影响
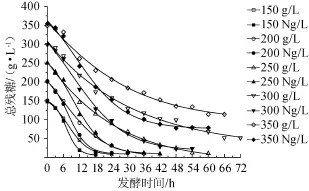
图2 甘蔗汁酒精发酵中氮源对残糖含量的影响Fig.2 Effect of nitrogen source on the residual sugar content in sugarcane juice alcoholic ferm entation
由图2可知,150~350 g/L总糖质量浓度氮源组都比对照组糖消耗快,其中150 g/L总糖质量浓度氮源组在18 h即达到总糖最低值而对照组达到最小值时为24h,故发酵周期缩短了6 h;其他糖浓度的氮源组发酵周期也都缩短6 h以上,说明氮源能够明显缩短甘蔗汁酒精发酵周期。总残糖曲线下面积(area under curve,AUC)可以整体的评价糖消耗的快慢[12],总残糖AUC越小说明糖消耗越快加快发酵过程[13-14],氮源组总残糖AUC都比对照组快(见表2),说明氮源加速了总糖的消耗,这与PRETORIUS I S等[4]的研究结果相似;MESSIAS M J等[15]也指出总糖质量浓度较高时,氮源的加入效果会更加明显。150~250 g/L总糖质量浓度的氮源组和对照组之间最终残糖基本相同,但300 g/L和350 g/L总糖质量浓度氮源组残糖分别比对照组小40.42 g/L和35.82g/L,说明氮源在高总糖质量浓度甘蔗汁酒精发酵时能显著提高糖的利用率。350 g/L超高糖质量浓度时,氮源组和对照组残总糖比300 g/L总糖质量浓度的高,乙醇含量比300 g/L总糖质量浓度的低,说明酵母发酵能力已受到高总糖质量浓度强烈地抑制。
由图3可知,无论总糖质量浓度高低,氮源组总糖消耗速率都高于对照组。发酵0~3 h,总糖消耗速率氮源组都比对照组大,其中150 g/L、200 g/L、250 g/L总糖消耗速率明显高于300 g/L和350 g/L,说明总糖质量浓度对酵母发酵的抑制作用在300 g/L时已开始表现出来,但无论糖质量浓度高低尿素的添加都促进了糖代谢。发酵3~6 h,总糖消耗速率都有所升高,氮源组仍高于对照组。前6 h氮源组虽高于对照组,但相差并不大,氮源组总糖消耗速率表现出巨大优势是在6 h后,6~12 h氮源组比对照组分别高出36%、43%、55%、55%和14%,12~18 h时,氮源组基本都比对照组高出30%左右,其中150 g/L总糖质量浓度的氮源组由于糖提前消耗完而低于对照组。发酵18 h后除了因糖消耗完发酵结束外,氮源组总糖消耗速率都高于对照组。说明氮源的加入使各发酵阶段糖消耗速率加快,主要作用阶段在6 h之后;GEMMA B等[16]指出加入氮源总会加快糖消耗速率,但对数期效果更为明显。
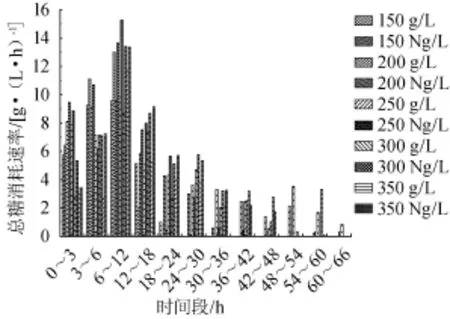
图3 甘蔗汁酒精发酵中氮源对总糖消耗速率的影响Fig.3 Effect of nitrogen source on total sugar consum ption rate in sugarcane juice alcoholic fermentation
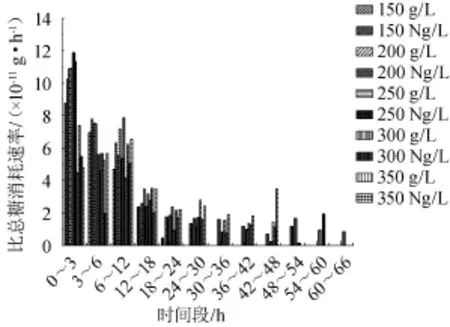
图4 甘蔗汁酒精发酵中氮源对比总糖消耗速率的影响Fig.4 Effect of nitrogen source on total sugar specific consum ption rates in sugarcane juice alcoholic ferm entation
比总糖消耗速率为总糖消耗速率与活细胞数之比,能够准确地表示单位活细胞与糖消耗速率之间的关系[14]。由图4可知,无论总糖质量浓度高低氮源组比总糖消耗速率基本都高于对照组,发酵0~3 h和3~6 h氮源组比总糖消耗速率基本高于对照组但不明显,与总糖消耗速率相似,说明0~6 h阶段氮源对单位活细胞的糖代谢能力提升有限,这是因为发酵初始阶段,发酵液溶氧充足使酵母细胞伴有有氧呼吸途径,而且甘蔗汁本身含有一定量氮,所含氮源对无氧途径的促进作用不明显,氮源组与对照组的差异化不明显。表现明显差异的是在6 h后,氮源组的比总糖消耗速率明显高于对照组,说明尿素的添加使单位活细胞的糖代谢能力提高,氮源组的总糖消耗速率总高于对照组本质原因是氮源大大增强活细胞的酒精发酵即无氧呼吸途径。
2.4氮源对甘蔗汁酒精发酵生成乙醇的影响
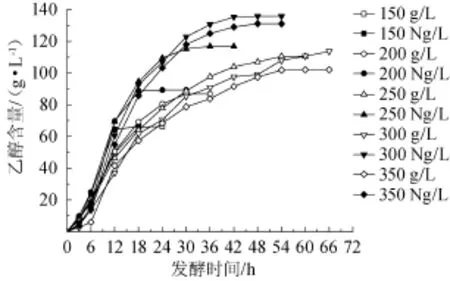
图5 甘蔗汁酒精发酵中氮源对乙醇含量的影响Fig.5 Effect of nitrogen source on alcohol contents in sugarcane juice alcoholic fermentation
由图5可知,150 g/L和200 g/L总糖质量浓度氮源组和对照组最终乙醇含量一样,但氮源组都比对照组提前到达最高乙醇含量,250~350 g/L总糖质量浓度氮源组不仅比对照组提前达到最高乙醇含量而且最终乙醇含量分别比对照组提升了6.3 g/L、22.1 g/L和29.0 g/L(见表2)。说明氮源不仅加快了乙醇的生成而且还提高了乙醇的产量,在高糖质量浓度表现得尤为明显。
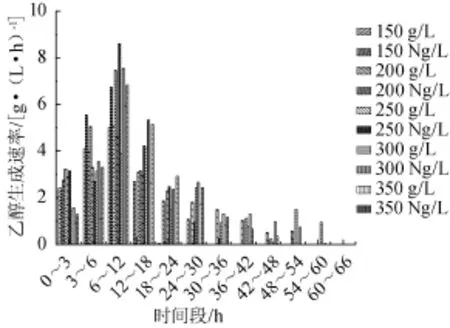
图6 甘蔗汁酒精发酵中氮源对乙醇生成速率的影响Fig.6 Effect of nitrogen source on alcohol producing rates in sugarcane juice alcoholic fermentation
由图6所示,发酵0~6 h氮源组乙醇生成速率基本都比对照组高,发酵6~12 h氮源组乙醇生成速率远大于对照组,分别高出对照组35%、47%、86%、94%和15%,这个时段也是各总糖质量浓度乙醇生成速率最大的阶段,发酵18 h后有些氮源组因发酵提前结束而使得乙醇生成速率低于对照组,其余氮源组都高于对照组,总体趋势与总糖消耗速率基本一致。说明氮源提高了乙醇的生成速率,在6 h后表现得尤为明显。
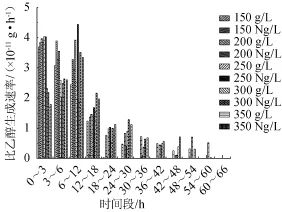
图7 甘蔗汁酒精发酵中氮源对比乙醇生成速率的影响Fig.7 Effect of nitrogen source on alcohol specific producing rates in sugarcane juice alcoholic ferm entation
比乙醇生成速率能够准确地表示单位活细胞与乙醇生成之间的关系[14]。由图7可知,发酵0~6 h氮源组稍高于对照组,由于这个阶段无氧呼吸途径并不剧烈,氮源对酵母活细胞酒精发酵促进作用有限。6~12 h氮源组远高于对照组,其中250 g/L氮源组的比乙醇生成速率最大4.44×10-11g/h,比对照组高42.9%,对照组单位活细胞的产乙醇生成速率远远低于氮源组。说明氮源的加入使单位活细胞的乙醇生成能力增强。
2.5氮源对甘蔗汁酒精发酵主要发酵参数的影响
不同总糖质量浓度甘蔗汁酒精发酵主要参数见表2。由表2可知,添加氮源几乎对发酵过程所有参数都产生了有利影响,这与VARONGSIRI K等[5]的研究结果一致。在总糖质量浓度不高(150 g/L和200 g/L)时,氮源组比对照组的发酵周期缩短6 h,乙醇产率分别高32.9%和28.7%,氮源加快了酒精发酵即无氧呼吸途径。250~350 g/L不仅缩短发酵周期和提高乙醇产率,还使乙醇含量分提高5.7%、19.5%和28.4%,总糖发酵效率分别提高了4.9%、14.4%和15.2%,也使残总糖降低,提高了糖的利用率。
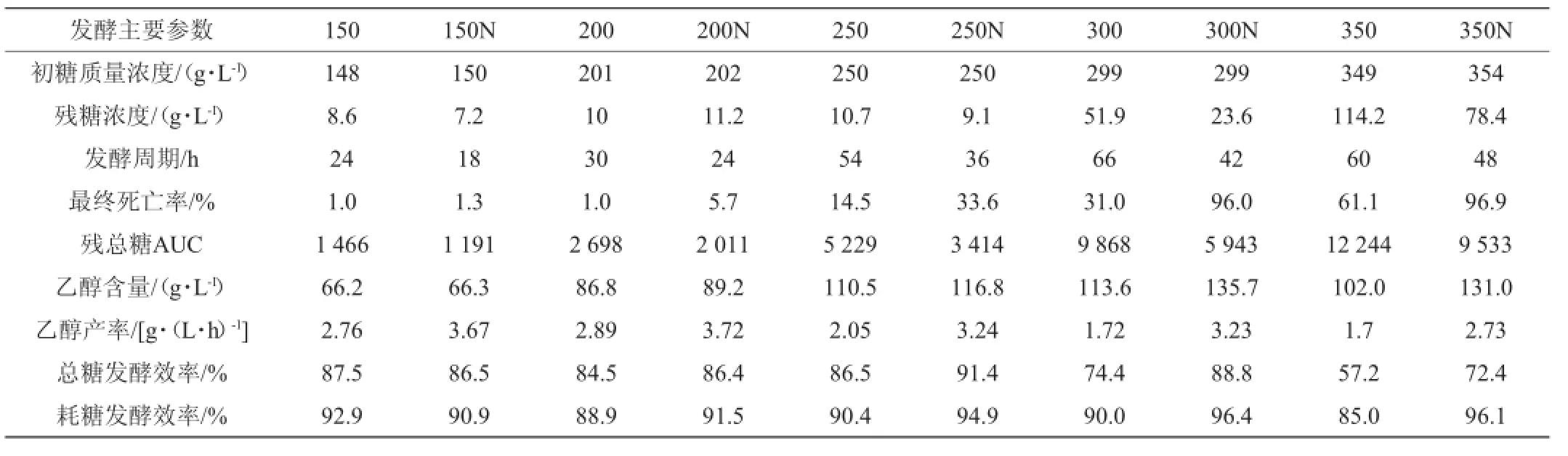
表2 不同糖浓度氮源组与对照组甘蔗汁酒精发酵主要参数Table 2 Major param eters of the n itrogen source groups and control group w ith different sugar concentration during thesugarcane juice alcoholic fermentation
3 结论
本实验研究了氮源对酒精酵母GJ2008不同总糖质量浓度甘蔗汁酒精发酵的细胞生长、糖代谢和乙醇生成的影响。结果表明:氮源加速了酒精酵母GJ2008的酒精发酵即无氧呼吸途径,糖消耗和乙醇生成都更快;氮源使酒精发酵更彻底,残糖更少;氮源使酵母产生了更多的目的产物,乙醇含量更高。总之,氮源的添加有效地促进了酒精发酵,同时氮源的加入增强了酵母发酵能力也加速了酵母菌的死亡速率。氮源是构成菌体的重要营养物质,是蛋白质合成不可缺少的元素,氮源对酒精发酵的促进可能与丙酮酸脱羧酶和乙醇脱氢酶有关,也可能与糖酵解途径一种或几种酶有关,具体原因需要进一步研究。本研究探索氮源对甘蔗汁酒精发酵过程的影响,发现氮源对甘蔗汁酒精发酵有明显促进作用,尤其在高总糖质量浓度表现得更明显,旨在为高浓度甘蔗汁酒精发酵和补料发酵提供研究基础。
[1]GAUDER M,GRAEFF-HÖNNINGER S,CLAUPEIN W.The impact of a grow ing bioethanol industry on food production in Brazil[J].Appl Energy,2011,88(3):672-679.
[2]BÖRJESSON P.Good or bad bioethanol from a greenhouse gas perspective-what determines this[J].App l Energy,2009,86(5):589-594.
[3]YAN J,LIN T.Biofuels in Asia[J].App l Energy,2009,86(11):S1-S10.
[4]PRETORIUS I S.Tailoring w ine yeast for the new millennium:novel approaches to the ancient art of winemaking[J].Yeast,2000,16(8):675-729.
[5]VARONGSIRI K,TIAGO V,YLVA A,et al.Influence of nitrogen sources on grow th and fermentation performance of different w ine yeast species during alcoholic fermentation[J].App l M icrobiol Biotechnol,2015,99(23):10191-10207.
[6]GODARD P,URRESTARAZU A,VISSERS S,et al.Effect of 21 different nitrogen sources on global gene expression in the yeast Saccharomyces cerevisiae[J].M ol Cell Biold,2007,27(8):3065-3086.
[7]GUTIÉRREZ A,CHIVA R,SANCHO M,et al.Nitrogen requirements ofcommercial w ine yeast strains during fermentation of a synthetic grape must[J].Food M icrobiol,2012,31(1):25-32.
[8]GUTIÉRREZ A,BELTRAN G,WARRINGER J,et al.Genetic basis of variations in nitrogen source utilization in four w ine commercial yeast strains[J].PloS One,2013,8(6):e67166.
[9]BLOMQVIST J,NOGUÉ VS,GORWA-GRAUSLUND M,et al.Physiological requirements for grow th and competitiveness of Dekkera bruxellensis under oxygen limited or anaerobic conditions[J].Yeast,2012,29(7):265-274.
[10]ALFENORE S,CAMELEYRE X,BENBADIS L,et al.Aeration strategy:a need for very high ethanol performance in Saccharomyces cerevisiae fed-batch process[J].App l M icrobiol Biotech,2004,63(5):537-542.
[11]BELL S J,HENSCHKE P A.Implications of nitrogen nutrition for grapes,fermentation and w ine[J].Aust J G rape W ine R,2008,11(3):242-295.
[12]LICCIOLI T,CHAMBERS P J,JIRANEK V.A novel methodology independent of fermentation rate for assessment of the fructophilic character of wine yeast strains[J].J Ind M icrobiol Biot,2011,38(7):833-843.
[13]武文强,伍时华,赵东玲,等.基于二次发酵糖代谢曲线下面积法对高浓度酒精发酵后期酵母活力的评估[J].食品与发酵工业,2015,41(3):53-57.
[14]蒋凯,伍时华,赵东玲,等.通气量对酿酒酵母GGSF16高浓度乙醇发酵的影响[J].食品与发酵工业,2015,41(5):35-40.
[15]MESSIAS M J,MARGARETH B,EDUARDO M C,et al.Sucrose fermentation by brazilian ethanol production yeasts in media containing structurally complex nitrogen sources[J].J I Brewing,2009,115(3):197-197.
[16]GEMMA B,ESTEVE-ZARZOSO B,NICOLAS R S,et al.Influence of the tim ing of nitrogen additions during synthetic grape must fermentations[J].Agr Food Chem,2005,53(4):996-1002.
Effect of nitrogen source on sugarcane juice batch alcoholic fermentation by Saccharomyces cerevisiae GJ2008 w ith different sugar concentrations
KE Shanhui,WU Shihua,ZHANG Jian*,ZHAO Dongling,HUANG Cuiji
(School of Biological and Chem ical Engineering,Guangxi University of Science and Technology,Liuzhou 545006,China)
In order to provide research basis for alcoholic fermentation of high sugarcane juice concentration,the effects of nitrogen on sugarcane juice alcoholic fermentation by Saccharomyces cerevisiae GJ2008 w ith different sugar concentrations were researched.2 g/L carbamide was added into the sugarcane juice mediums with sugar concentration of 150 g/L,200 g/L,250 g/L,300 g/L and 350 g/L.Using the corresponding sugar concentration groups without nitrogen source as control group,the effects of nitrogen source on sugarcane juice alcoholic fermentation were investigated by analyzina cell grow th,glycometabolism and the alcohol generation.The results showed that compared with control group w ithout nitrogen source,the nitrogen source could speed up the fermentation,and the fermentation period was shortened and the shortest period was 18 h.The sugar consumption rate and alcohol generation rate were increased by 55%and 96%,respectively,which made alcoholic fermentation more thoroughly,and the total sugar content was decreased by the highest for 40.42 g/L.The aimed products were increased,and the alcohol concentration increased by 28.4%.The study indicated that nitrogen source effectively promoted the sugarcane juice alcoholic fermentation and strengthened the anaerobic respiration of yeast.
nitrogen source;Saccharomyces cerevisiae GJ2008;sugarcane juice alcoholic fermentation;anaerobic respiration
Q815
0254-5071(2016)05-0031-06
10.11882/j.issn.0254-5071.2016.05.007
2016-03-05
广西科技攻关项目(桂科攻0782003-2);广西高校科学技术研究项目(YB2014202)
柯善恢(1989-),男,硕士研究生,研究方向为微生物代谢控制发酵。
张健(1964-),男,讲师,本科,研究方向为微生物发酵技术。

