N2在液态CO2中的溶解度分析
杨文超 李舒宏 冯义康 单贵苏 张小松
(1东南大学能源与环境学院, 南京210096)(2青岛海信日立空调系统有限公司, 青岛266510)
N2在液态CO2中的溶解度分析
杨文超1李舒宏1冯义康2单贵苏1张小松1
(1东南大学能源与环境学院, 南京210096)(2青岛海信日立空调系统有限公司, 青岛266510)
采用Henry常数法及PR,SRK状态方程法计算了N2在液态CO2中的溶解度.将溶解度计算结果与实验数据进行比较后得出:PR状态方程的计算精度最高,计算结果与实验数据的平均相对误差绝对值均小于9%;Henry常数法计算结果误差最大,计算结果与实验数据的平均相对误差绝对值均大于26%; N2的溶解度随温度降低或压力增大而逐渐增大.为进一步提高PR方程的计算精度,利用实验数据优化了N2与CO2之间的二元交互作用系数,并提出二元交互作用系数与温度、压力有关的关联式;将关联式运用于温度为220,240及250 K的N2溶解度计算中,计算结果与实验数据的相对误差绝对值均小于2%,当温度为220 K时,溶解度计算结果与实验数据的相对误差绝对值均小于0.7%,证明了所得关联式的准确性.
低温碳捕集;溶解度;二元交互作用系数;参数优化
二氧化碳捕集与封存技术是减少温室气体CO2排放并应对全球气候变化的重要措施,其中低温相变分离捕集CO2的方法以其无污染、获得的液态CO2产品纯度高、产品便于贮藏和输送等优点受到研究者关注[1-2].低温相变分离CO2是将传统燃烧或富氧燃烧后的混合气经多次压缩和冷却,使得CO2液化或凝华,达到从混合气中分离的目的,其中CO2的分离率及分离纯度是低温碳捕集系统设计及分析的关键.电厂烟气经脱硫脱硝等工艺后的主要组分为CO2和N2,而在低温碳捕集过程中N2在液态CO2中的溶解度分析是碳捕集系统设计的重要依据,若溶解度计算不准确,将导致系统的设备尺寸设计不合理、产品纯度不达标等问题.
低温下N2在液态CO2中的溶解度即为CO2与N2混合物气液相平衡时液态组分中N2的含量.目前常用的相平衡计算方法有状态方程法及Henry常数法[3-4],但状态方程是半经验公式,当实验数据不足时,组分间相互作用系数的可靠性降低,导致热力学参数计算结果与实际有较大的偏离[5-6].为解决这一问题,Thiery等[4]优化了SRK方程中的二元交互作用系数,提高了CO2-CH4-N2相平衡数据的计算精度.
二元交互作用系数kij是状态方程中的重要参数,反映了两分子之间的相互作用特性及非理想作用特性.文献[5,7]计算了PR方程中N2与CO2之间的二元交互作用系数kij,但将kij视为常数,应用时会产生较大误差,因而适用性受到限制.Graboski等[8]提出交互作用系数与温度、压力有关的设想;董军航等[9]指出,虽然二元交互作用系数kij可以与温度无关,但如果将kij视为温度的函数,则可以提高相平衡的计算精度;石玉美等[10-11]利用CH4-N2-O2三元气液相平衡的实验数据,计算得出SRK和PR方程中的二元交互作用系数kij,并提出kij与温度之间的关联式.目前关于CO2-N2之间二元交互作用系数的研究较少,直接应用会导致计算误差较大,从而影响碳捕集系统的设计和运行.
本文采用Henry常数法及PR,SRK状态方程法计算低温下N2在液态CO2中的溶解度,将计算结果与已有实验数据[7,12-13]进行对比,从而确定最优的计算方法并探究N2在液态CO2中的溶解规律;计算了CO2-N2之间的二元交互作用系数kij,并提出kij与温度、压力的关联式;最后通过与实验数据[12-13]对比,验证所得关联式的准确性.
1 CO2及N2物性分析
CO2的临界点为温度304.15 K,压力7.376 MPa;三相点为温度216.55 K,压力0.518 MPa;N2的临界点为温度126.15 K,压力3.394 MPa[14].图1为CO2及N2的压力-温度相图,由图可以看出,在温度126.15~216.55 K的区间内,CO2会变成固体干冰,而N2仍然为气体,因此在同一压力下CO2冷凝为液体时,N2仍为气态.
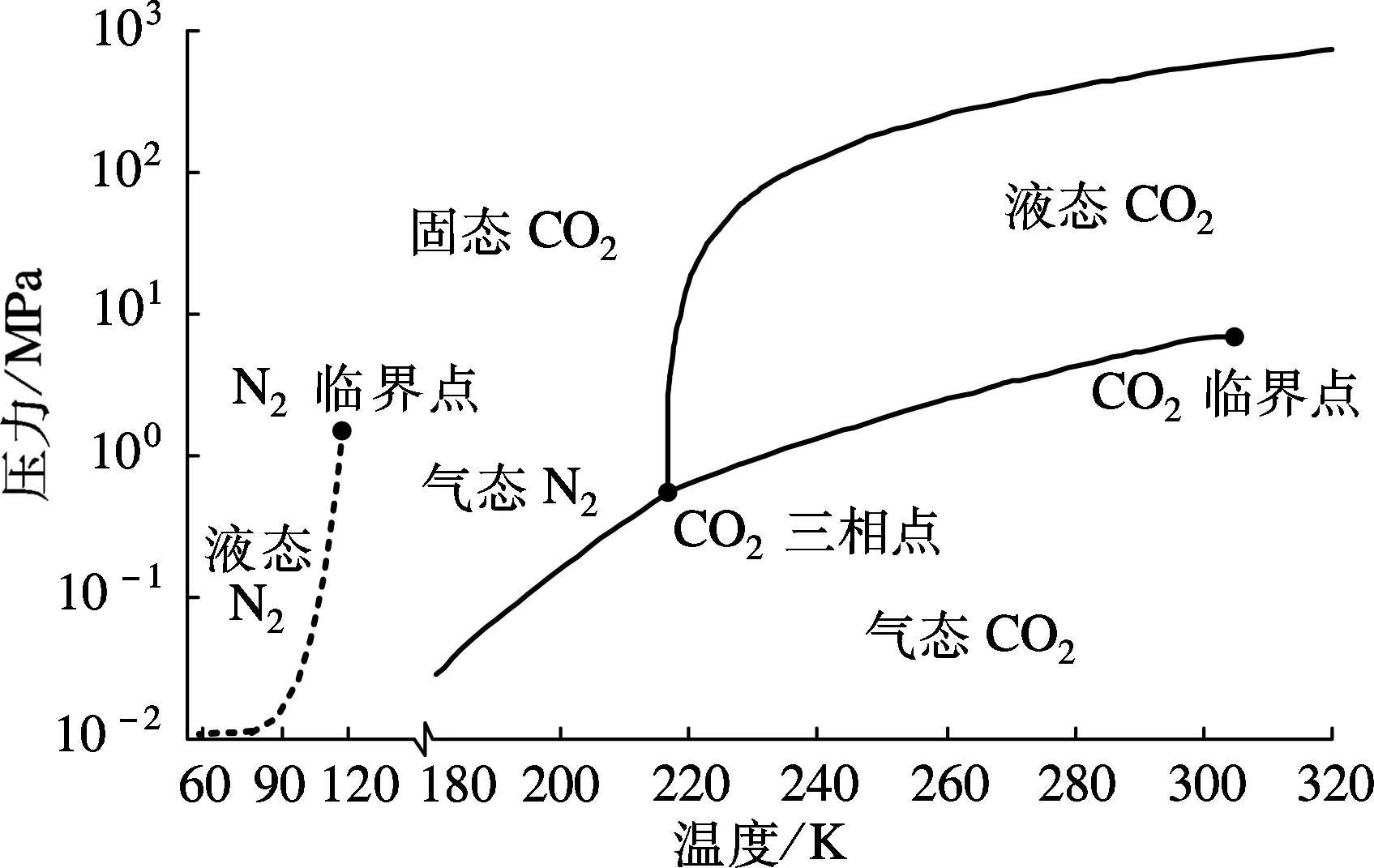
图1 CO2及N2的压力-温度图
2 溶解度计算分析
根据是否含有不凝组分,气体在液体中溶解时的相平衡可以分为汽液平衡(vapor-liquid equilibrium)和气液平衡(gas-liquid equilibrium).气液平衡是指常规条件下的气态组分与液态组分间的平衡关系,相平衡时至少有一种组分是非凝性的气体;而汽液平衡的各组分都是可凝性物质.由物性分析可知,N2与 CO2的相平衡为气液平衡.
本文选用Henry常数法及工程中常用的PR,SRK半经验半理论状态方程进行溶解度的分析计算,并与文献[7,12-13]中的实验数据进行比较.
2.1Henry常数法
Henry常数是衡量气体溶解度大小的一个重要指标,由Henry常数可以获得有关气体溶解度的信息.Henry常数法中,某一气体的溶解度与该气体的气相分压成正比,即
p=Hx
(1)
式中,p为气相分压;x为液相中气体的摩尔分数;H为Henry常数,以摩尔分数的形式表示.Henry常数只与温度有关,与压力无关.N2在液态CO2中的Henry常数表达式[3]为
H=178.21-0.479 98T
(2)
式中,T为系统温度.
2.2状态方程法
气体溶解度的计算以相平衡原理为基础,应用状态方程法可以较好地计算气液相平衡.当气体溶解达到平衡时,任一组分在气液两相中的温度、压力、逸度及化学势均相等[15],其中组分的逸度相等是判别达到相平衡的常规判据,即
fiL=fiG
(3)
式中,fiL为液相中i组分的逸度;fiG为气相i组分的逸度.
液相的逸度方程为
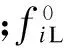
fi=yiφiGP=xiφiLP
(5)
式中,fi为i组分的逸度;yi为气相中i组分的摩尔含量;φiG为气相i组分的逸度系数;φiL为液相中i组分的逸度系数;P为系统压力.
本文运用工程中常用的PR[17]及SRK[18]状态方程并结合范德瓦尔(Vdw)混合规则,通过组分气液相逸度相等规则分析N2在液态CO2中的溶解度,PR和SRK状态方程及混合规则的具体形式见表1.表中,a为纯组分的引力项,b为纯组分的协体积项;v为组分摩尔比容;ω为组分的偏心因子;TC和PC分别为组分的临界温度及压力;R为通用气体常数;am和bm分别为混合物的引力项和协体积项;aij为i组分与j组分的交叉项;kij为i组分与j组分的二元交互作用系数,一般通过采用气液相平衡实验数据计算得到.

表1 状态方程及混合规则表达式
通常将状态方程改写成压缩因子z的形式,以便求解体积根及后续的计算,PR状态方程改写为
z3-(1-B)z2+(A-2B-3B2)z-
(A-B2-B3)=0
(6)
SRK状态方程改写为
z3-z2+(A-B-B2)z-AB=0
(7)
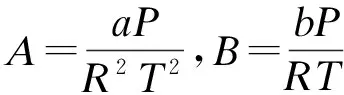
由PR及SRK状态方程分别导出的混合物中i组分的逸度系数[19]为
(8)
(9)
式中,φi,PR,φi,SRK分别为PR和SRK状态方程的逸度系数;z为压缩因子,且z=Pv/(RT).z可能有3个实根,分别为最大值zmax、中间值zmid及最小值zmin.当混合物为气体时,气相的压缩因子为zG=zmax;当混合物为液体时,液相的压缩因子为zL=zmin;当只有一个实根时,实根即为所需的压缩因子.
2.3计算结果分析
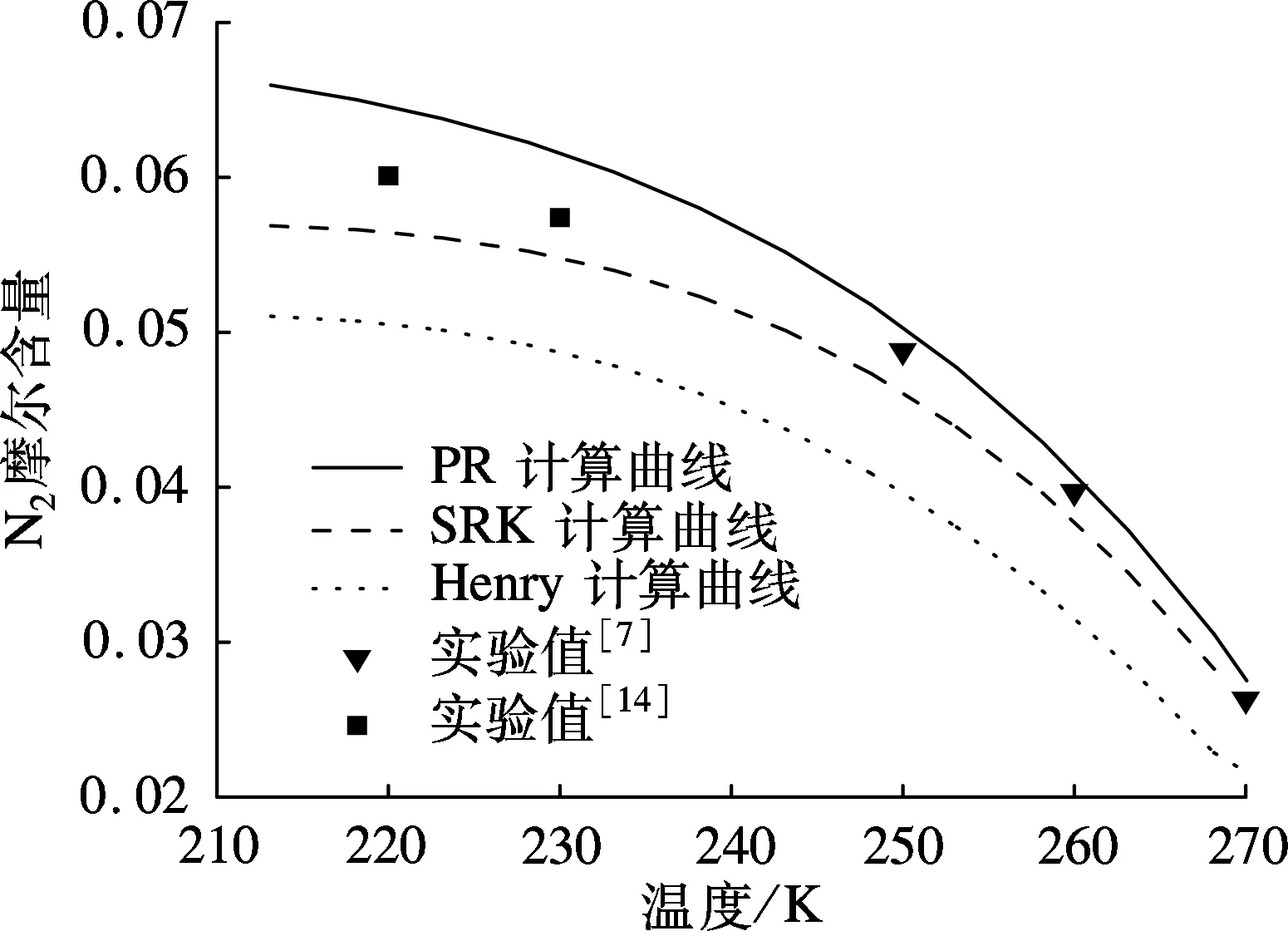
本文运用3种方法计算了压力为4.6,6.0 MPa及温度为220,240 K条件下N2在液态CO2中的溶解度,并将溶解度的计算结果与实验数据[7,12-13]进行对比,结果如图2和图3所示.根据常用的N2与CO2之间的二元交互作用系数kij,PR状态方程中的kij取定值-0.013[12],SRK状态方程中的kij取定值-0.014[5].
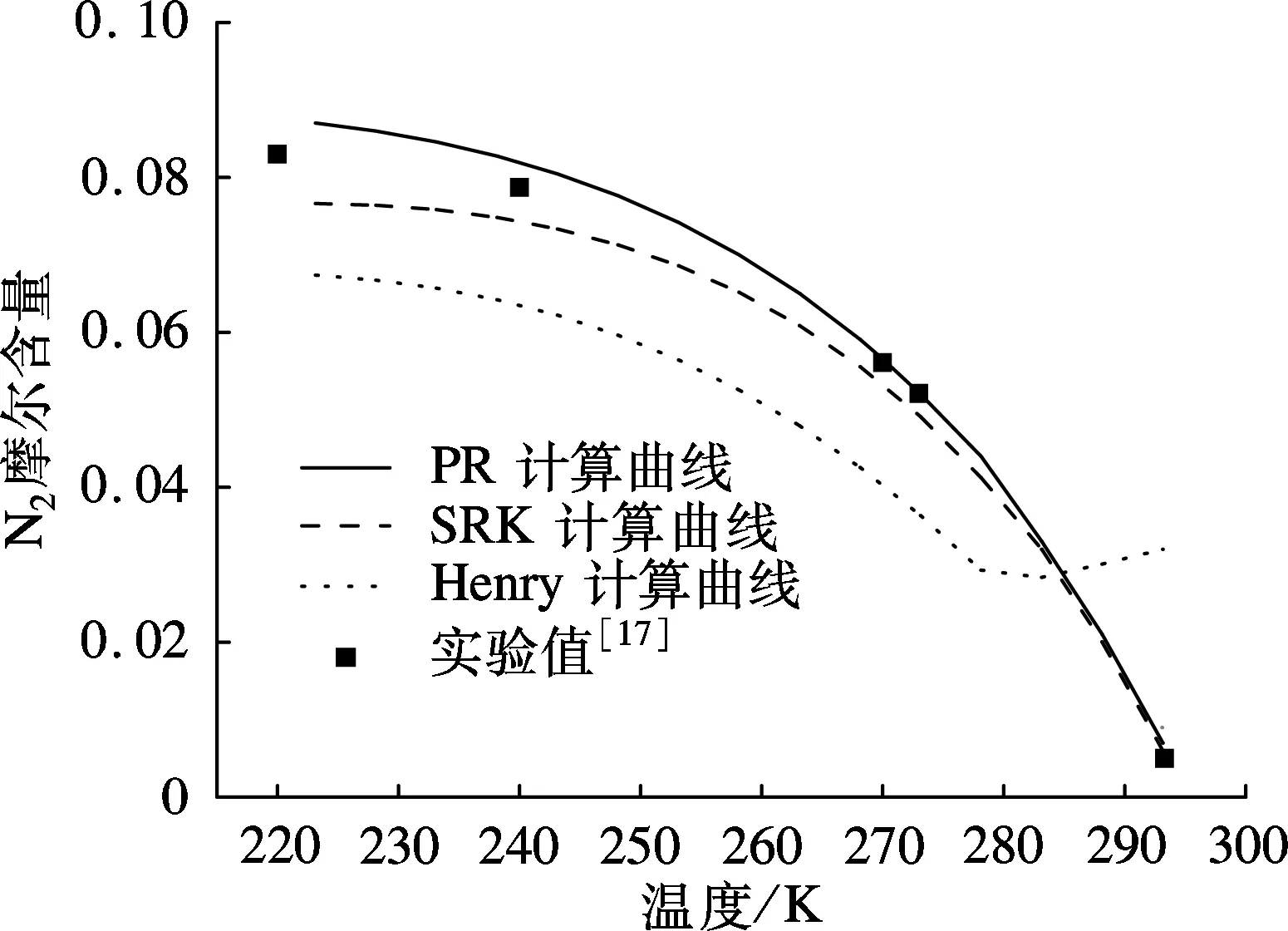
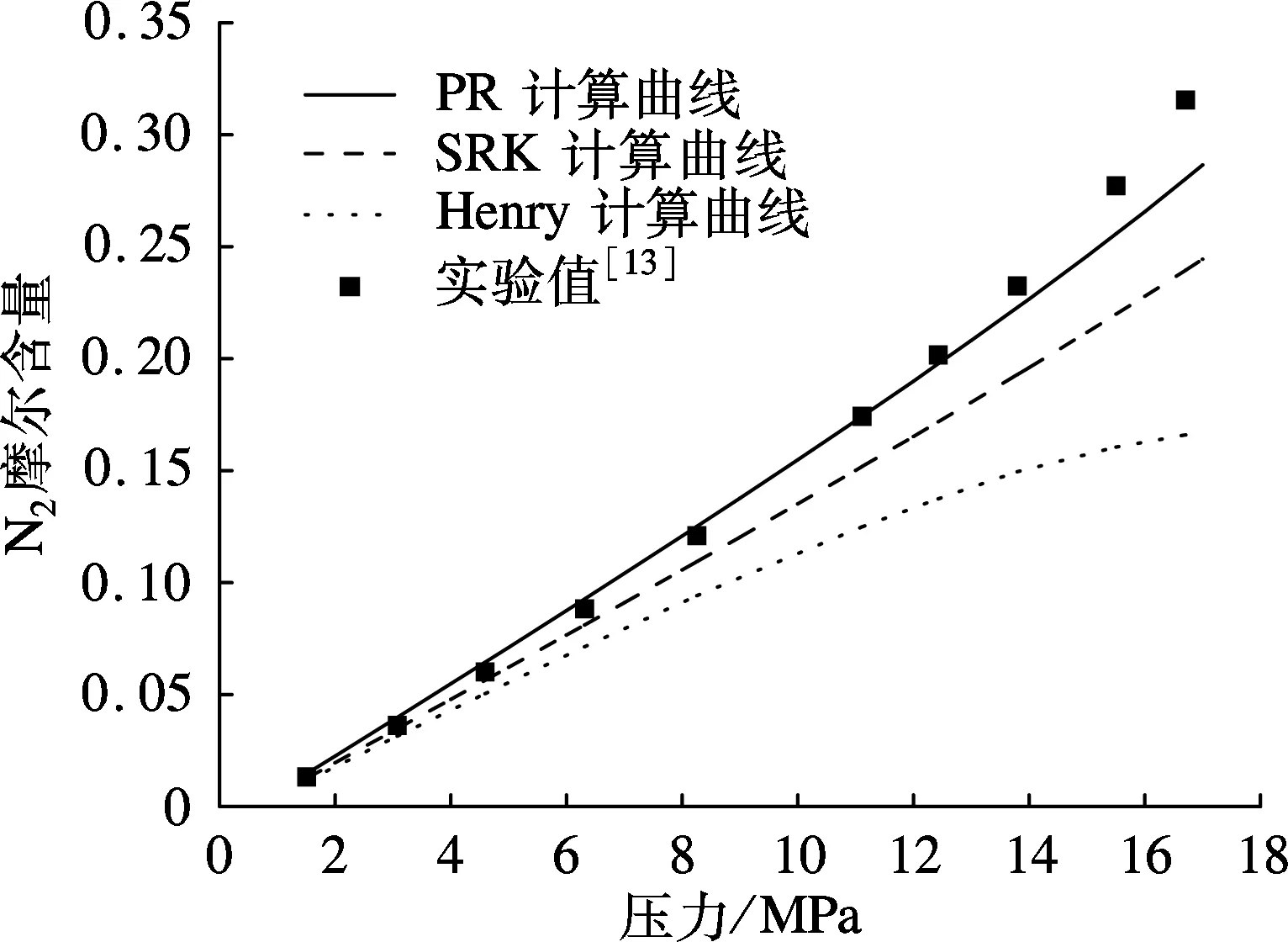
由图2可以看出:在相同压力条件下,随温度升高,N2在液态CO2中的溶解度逐渐减小.运用PR状态方程计算的溶解度大于实验溶解度,而由SRK状态方程及Henry常数法计算得到的溶解度小于实验数据.
由图3可以看出:在相同温度条件下,随着压力增大,N2在液态CO2中的溶解度逐渐增大.当温度为220 K时,N2溶解度随压力升高呈线性增长;当温度为240 K且压力低于14 MPa时,N2的溶解度随压力升高而增大的趋势较平缓,当压力高于14 MPa时,N2溶解度迅速增大.
(a) 4.6 MPa
(b) 6.0 MPa
(a) 220 K

(b) 240 K
运用PR方程计算的溶解度与实验数据较吻合,而采用Henry常数法计算的溶解度误差最大.利用3种方法计算的溶解度与实验溶解度数据的误差见表2.计算值与实验值的相对误差绝对值计算式为
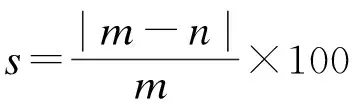
(10)
式中,m为溶解度实验值;n为溶解度计算值.
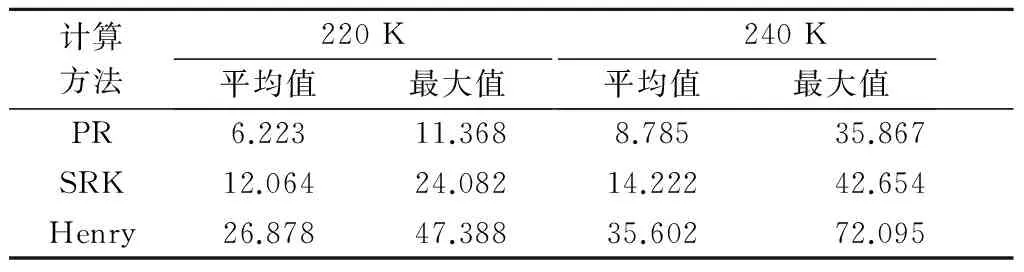
表2 溶解度计算值与实验值的相对误差绝对值 %
通过以上对比分析可知,运用PR方程计算的溶解度与实验数据误差最小,平均相对误差绝对值均小于9%;SRK方程的溶解度计算精度低于PR方程,平均相对误差绝对值均大于12%;Henry常数法计算结果误差最大,平均相对误差的绝对值均大于26%.
虽然PR方程计算的溶解度与实验数据误差最小,但随着压力增大,误差逐渐增大,当温度为240 K、压力为16.7 MPa时,相对误差绝对值达到35.867%.因此,为进一步提高PR方程的计算精度,本文优化了PR方程中CO2与N2之间的二元交互作用系数kij.
3 二元交互作用系数分析
由前文分析可知,利用PR状态方程在高压下计算的N2溶解度误差较大,其原因在于PR状态方程为立方型状态方程,是基于“平均分子场”的假设,即假设各相中每个分子周围的势能场相同,但这种假设在密度波动较大的高压范围并不适用.因此,高压区可以利用实验数据来计算方程中的二元交互作用系数[20],计算流程见图4.
本文选取了温度为220,240及250 K的实验数据[12-13],计算得到PR方程中的二元交互作用系数kij.根据kij的数值规律提出二元交互作用系数与温度、压力有关的关联式,即
kij=a-bT+cT2-dP+eP2-fP3
(11)
式中,a,b,c,d,e,f为系数,其取值见表3.
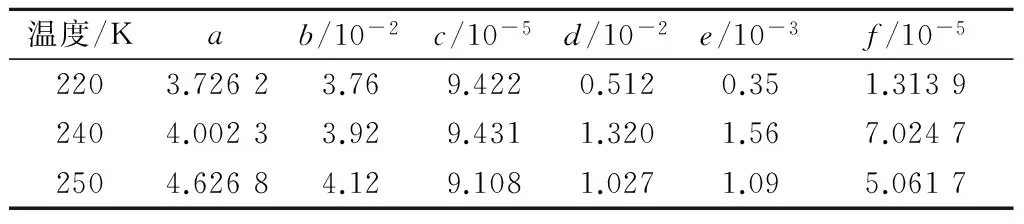
表3 关联式(11)中的系数
利用实验数据计算得到的二元交互作用系数及关联式曲线如图5所示.由图可以看出,二元交互作用系数随压力增大逐渐减小,且温度越高,二元交互作用系数越小;当压力超过10 MPa时,随压力升高,kij下降趋势明显,若将kij视为常数,则高压下的计算结果误差较大.
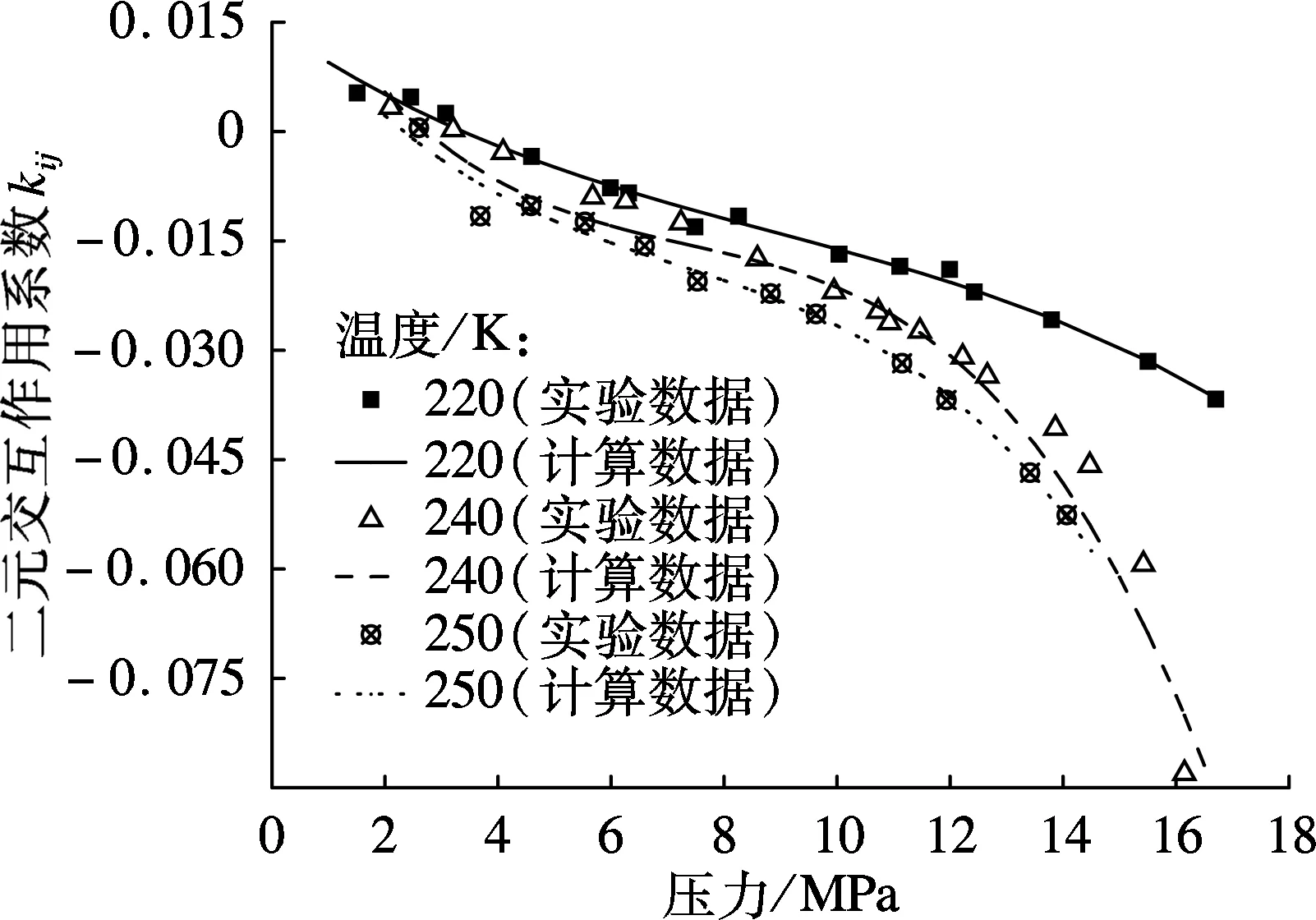
图5 二元交互作用系数比较
为验证所得关联式的准确性,将关联式计算所得的二元交互作用系数应用到PR方程中,计算不同压力、温度为220,240及250 K时,N2在液态CO2中的溶解度,并与实验数据[12-13]进行比较,分析结果见表4~表6.由表中的数据可以看出,220 K时的计算溶解度相对误差绝对值均小于0.7%;240 K时相对误差绝对值均小于1.5%;250 K时相对误差绝对值均小于2%.在高压状态下计算精度也满足实际应用需求,证明了所提出关联式的准确性,提高了PR方程的计算精度,从而可为碳捕集系统的流程及设备设计提供更加便捷准确的计算依据.
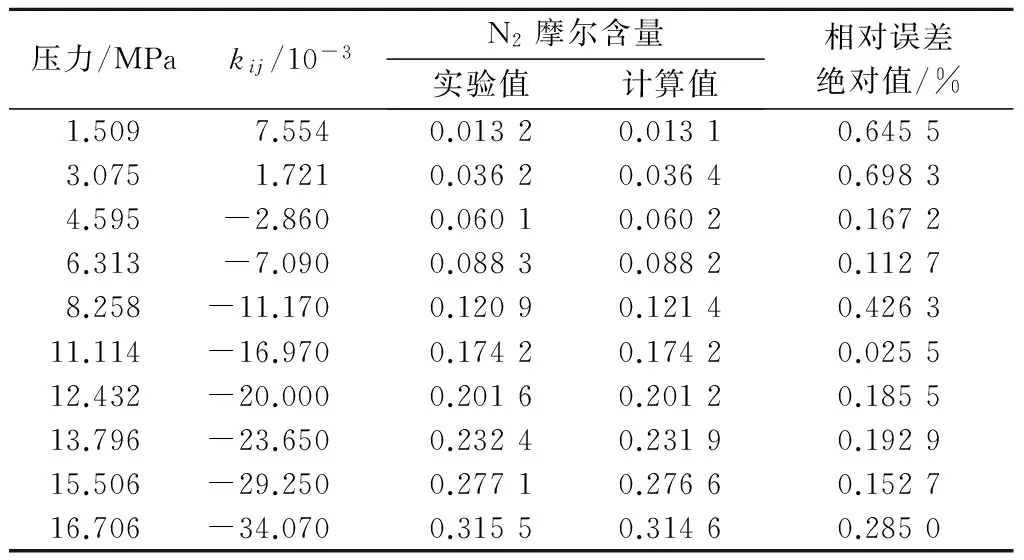
表4 220 K时N2溶解度实验值与计算值比较
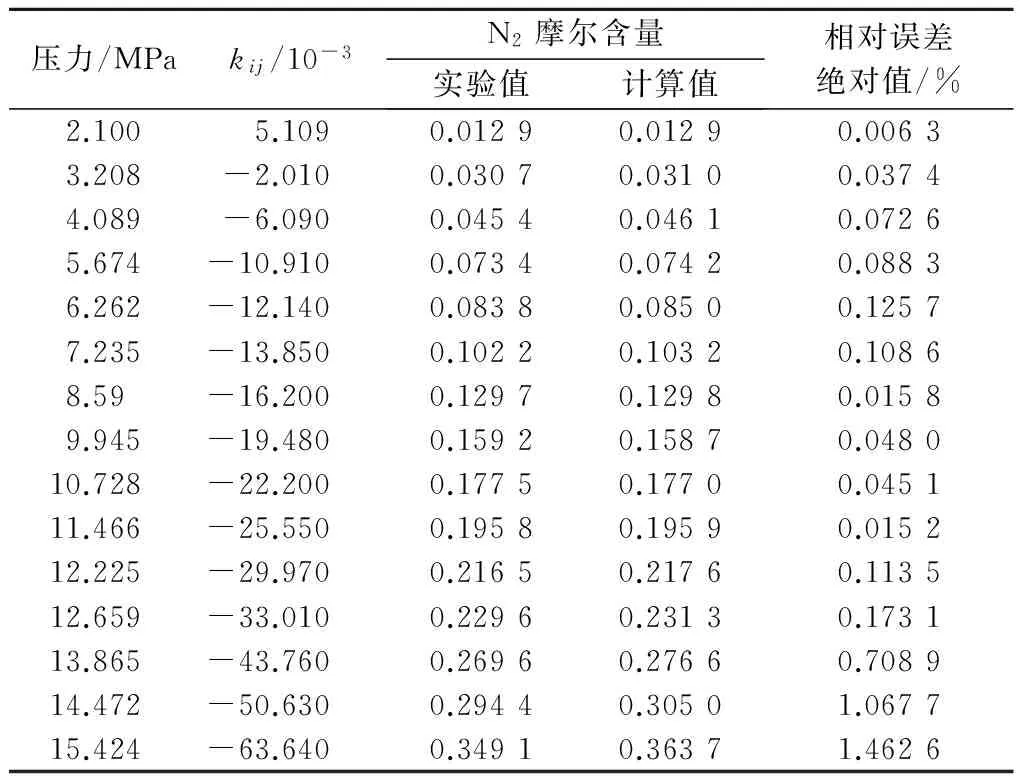
表5 240 K时N2溶解度实验值与计算值比较
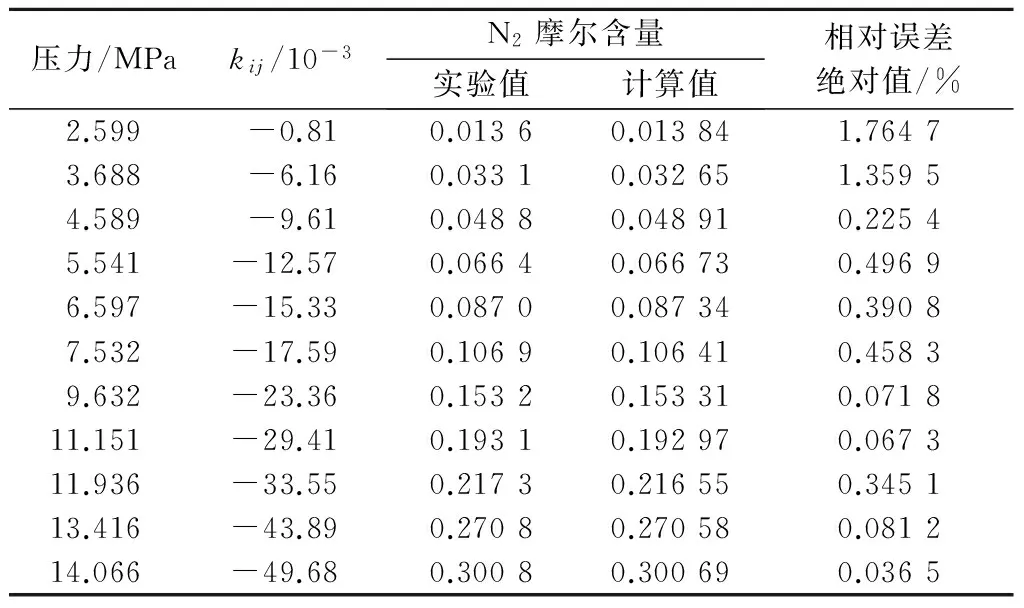
表6 250 K时N2溶解度实验值与计算值比较
4 结论
1) 低温下随温度升高N2在液态CO2中的溶解度逐渐减小,随着压力增大,N2在液态CO2中的溶解度逐渐增大.
2) 运用PR状态方程计算所得N2在液态CO2中的溶解度与实验数据吻合较好,计算精度高于SRK方程,Henry常数法计算结果误差最大.
3) 随着压力增大,利用PR状态方程计算溶解度的偏差逐渐增大,利用实验数据优化CO2与N2之间的二元交互作用系数可提高计算精度;本文提出二元交互作用系数与温度、压力的关联式,将溶解度计算结果与实验数据进行比较得出,220 K时溶解度相对误差绝对值均小于0.7%,240 K时相对误差绝对值均小于1.5%,250 K时相对误差绝对值均小于2%,证明了所得关联式的准确性,提高了PR方程的计算精度.
References)
[1]Theunissen T, Golombok M, Brouwers J J H, et al. Liquid CO2droplet extraction from gases [J].Energy, 2011, 36(5):2961-2967. DOI:10.1016/j.energy.2011.02.040.
[2]Zanganeh K E, Shafeen A. A novel process integration, optimization and design approach for large-scale implementation of oxy-fired coal power plants with CO2capture [J].InternationalJournalofGreenhouseGasControl, 2007, 1(7):47-54.
[3]Vrabec J, Kedia G K, Buchhauser U, et al. Thermodynamic models for vapor-liquid equilibria of nitrogen+oxygen+carbon dioxide at low temperatures [J].Cryogenics, 2009, 49(2):72-79.
[4]Thiery R, Vidal J, Dubessy J. Phase equilibria modelling applied to fluid inclusions: Liquid-vapor equilibria and calculation of the molar volume in the CO2-CH4-N2system [J].GeochimCosmochimActa, 1994, 58(3):1073-1082. DOI:10.1016/0016-7037(94)90573-8.
[5]Li H, Yan J. Evaluating cubic equations of state for calculation of vapor-liquid equilibrium of CO2and CO2-mixtures for CO2capture and storage processes [J].AppliedEnergy, 2009, 86(6):826-836. DOI:10.1016/j.apenergy.2008.05.018.
[6]李舒宏, 李献亮, 杨文超, 等. 基于不同状态方程模型的N2/O2/CO2相平衡特性分析[J]. 化工学报, 2014, 65(S2):25-32. DOI:10.3969/j.issn.0438-1157.2014.z2.004.
Li Shuhong,Li Xianliang,Yang Wenchao, et al. Phase equilibrium property analysis of N2/O2/CO2based on several state equation models [J].CIESCJorunal, 2014, 65(S2):25-32. DOI:10.3969/j.issn.0438-1157.2014.z2.004.(in Chinese)
[7]Touret J. An empirical phase diagram for a part of the N2-CO2system at low temperature[J].ChemicalGeology, 1982, 37(1):49-58. DOI:10.1016/0009-2541(82)90066-3.
[8]Graboski M S, Daubert T E. A modified soave equation of state for phase equilibrium calculations. 1.hydrocarbon systems[J].Industrial&EngineeringChemistryProcessDesignandDevelopment, 1978, 17(4):443-448. DOI:10.1021/i260068a009.
[9]董军航, 汪朝晖, 徐南平,等. 方型状态方程在高压相平衡中的研究及应用 [J]. 南京化工大学学报,1997, 19(1):86-93.
Dong Junhang, Wang Zhaohui, Xu Nanping, et al. Researches and applications of cubic equation of state for high pressure phase equilibria [J].JournalofNanjingUniversityofChemicalTechnology, 1997, 19(1):86-93. (in Chinese)
[10]石玉美,顾安忠,鲁雪生,等.甲烷-氮气气液相平衡试验研究[J].天然气工业, 2000,20(4):80-82. DOI:10.3321/j.issn:1000-0976.2000.04.023.Shi Yumei,Gu Anzhong,Lu Xuesheng,et al. A study of methane-nitrogen gas-liquid phase equilibrium test [J].NaturalGasIndustry, 2000,20(4):80-82. DOI:10.3321/j.issn:1000-0976.2000.04.023.(in Chinese)
[11]石玉美,顾安忠,汪荣顺,等.CH4-N2-CO2三元汽液相平衡试验研究[J].天然气工业,2002, 22(5):84-87. DOI:10.3321/j.issn:1000-0976.2002.05.024.
Shi Yumei,Gu Anzhong,Wang Rongshun,et al. An experiment on vapor-liquid equilibrium of CH4-N2-CO2[J].NaturalGasIndustry, 2002, 22(5):84-87. DOI:10.3321/j.issn:1000-0976.2002.05.024.(in Chinese)
[12]Brown T S, Sloan E D, Kidnay A J. Vapor-liquid equilibria for the ternary system N2+CO2+nC4H10at 250 and 270 K[J].InternationalJournalofThermophysics, 1994, 15(6):1211-1219. DOI:10.1007/bf01458829.
[13]Brown T S, Niesen V G, Sloan E D, et al. Vapor-liquid equilibria for the binary systems of nitrogen, carbon dioxide, and n-butane at temperatures from 220 to 344 K[J].FluidPhaseEquilibria, 1989, 53: 7-14. DOI:10.1016/0378-3812(89)80067-6.
[14]Mantovani M, Chiesa P, Valenti G, et al. Supercritical pressure-density-temperature measurements on CO2-N2,CO2-O2and CO2-Ar binary mixtures[J].JournalofSupercriticalFluids, 2012, 61(2):34-43. DOI:10.1016/j.supflu.2011.09.001.
[15]Xu N, Dong J, Wang Y, et al. High pressure vapor liquid equilibria at 293 K for systems containing nitrogen, methane and carbon dioxide[J].FluidPhaseEquilibria, 1992, 81:175-186. DOI:10.1016/0378-3812(92)85150-7.
[16]Ahmad M, Gernert J, Wilbers E. Effect of impurities in captured CO2on liquid-vapor equilibrium[J].FluidPhaseEquilibria, 2013, 363(4):149-155. DOI:10.1016/j.fluid.2013.11.009.
[17]Peng D Y, Robinson D B. A new two-constant equation of state [J].IndustrialandEngineeringChemistryFundamentals, 1976, 15(1): 59-64. DOI:10.1021/i160057a011.
[18]Soave G. Equilibrium constants from a modified Redlich-Kwong equation of state [J].ChemicalEngineeringScience, 1972, 27(6): 1197-1203. DOI:10.1016/0009-2509(72)80096-4.
[19]韦钦胜. 复杂体系化学平衡及相平衡计算方法的研究[D]. 青岛:中国海洋大学化学化工学院, 2007.
[20]Thiery R, Dubessy J. Improved modelling of vapour-liquid equilibria up to the critical region: Application to the CO2-CH4-N2system [J].FluidPhaseEquilibria, 1996, 121(1):111-123. DOI:10.1016/0378-3812(96)03029-4.
Analysis of solubility on N2in liquid CO2
Yang Wenchao1Li Shuhong1Feng Yikang2Shan Guisu1Zhang Xiaosong1
(1School of Energy and Environment, Southeast University, Nanjing 210096, China)(2Qingdao Hisense Hitachi Air-conditioning System Co. Ltd., Qingdao 266510, China)
The solubility of N2in liquid CO2is calculated by using the Henry constant, PR(Peng-Robinson) and SRK (Soave-Redlich-Kwong) equation methods. The comparison results between calculation results with experimental data show that PR equation has the highest precision,and the average absolute values of relative deviation of calculation results and experimental data are less than 9%. The deviation of calculation results by using the Henry constant method is the largest, the average absolute values of the relative deviation of calculation results and the experimental data are more than 26%. With the decrease of the temperature and the increase of pressure, the solubility of N2in liquid CO2increases. In order to further improve the accuracy of the PR equation, the binary interaction parameters between N2and CO2are optimized using experimental data. In addition, a correlation between the binary interaction parameters with the temperature and pressure is proposed. Applying the correlation to the solubility calculations of N2at 220, 240 and 250 K, the absolute values of the relative deviation of calculation results and the experimental data are less than 2%, and those are less than 0.7% at 220 K, proving the accuracy of the correlation.
cryogenic carbon capture;solubility;binary interaction parameters;parameter optimization
10.3969/j.issn.1001-0505.2016.04.017
2015-12-13.作者简介: 杨文超(1990—),男,硕士生;李舒宏(联系人),男,博士,教授,博士生导师,equart@seu.edu.cn.
江苏省“六大人才高峰”资助项目(2013-JNHB-014).
10.3969/j.issn.1001-0505.2016.04.017.
TK01
A
1001-0505(2016)04-0776-06
引用本文: 杨文超,李舒宏,冯义康,等.N2在液态CO2中的溶解度分析[J].东南大学学报(自然科学版),2016,46(4):776-781.

