龙眼TFL1基因的克隆与表达
林知宝, 樊正炎, 董妙霞, 魏丹枫, 曾黎辉
(福建农林大学园艺学院,福建 福州 350002)
龙眼TFL1基因的克隆与表达
林知宝, 樊正炎, 董妙霞, 魏丹枫, 曾黎辉
(福建农林大学园艺学院,福建 福州 350002)
以‘红核子’龙眼叶芽为材料,克隆了龙眼TFL1-1和TFL1-2基因的cDNA序列和基因组DNA序列,进行序列分析,并对这两个基因在花芽分化过程中的表达进行了研究.结果显示,龙眼TFL1-1基因cDNA开放阅读框共519 bp,编码173个氨基酸,TFL1-2基因cDNA开放阅读框共525 bp,编码175个氨基酸;两个基因DNA序列均含有4个外显子和3个内含子;序列分析和系统进化树分析表明,龙眼TFL1-1和TFL1-2都是TFL1同源基因,龙眼TFL1-1基因与柑橘、梨的TFL1基因亲缘关系较近;基因表达结果表明,龙眼TFL1-1和TFL1-2基因的功能都与抑制花芽分化有关.
龙眼;TFL1同源基因; 基因克隆; 基因表达
龙眼(DimocarpuslonganL.)属无患子科(Sapindaceae)龙眼属(Dimocarpus),是我国较重要而有特色的一种亚热带木本果树.龙眼果实营养价值高,常作为补品、鲜食、蜜饯等商品,但龙眼生产上长期存在着单产低,隔年结果和大小年等现象[1-2],花芽分化受外界环境的影响很大[3],如抽冬梢、“冲梢”等都会影响花芽分化,严重地阻碍着生产的发展.
基因TFL1、FT和MFT3个亚家族共同组成磷酸乙醇胺结合蛋白PEBP基因家族[4-5].研究表明,TFL1基因是开花抑制基因[6],过量表达TFL1基因导致拟南芥开花时间推迟,营养生长期延长[6-7].TFL1基因在多年生的高山南芥(Arabisalpina)中阻止幼年植株感受低温春化[8];在柑橘中调控童期性状[9];RNA干扰(RNAi)梨TFL1-1和TFL1-2基因表达后,转基因植株提早开花[10],都说明TFL1基因功能在多年生植物中与维持童期性状有关.同时,草莓TFL1基因通过光周期和温度途径抑制开花,保证草莓在不同季节中的正确开花时间[11];菊花TFL1基因在长日照条件下抑制开花[12];对一年中可连续开花的玫瑰和草莓的研究表明,其变异性状是由TFL1同源基因的变异引起的[13],说明TFL1基因还有调控植物响应正确的开花诱导环境,调控成花季节性的功能.此外,葡萄TFL1A基因还与花序多分支有关[14].
在本课题组前期进行的转录组测序中,获得了两个龙眼TFL1同源基因的拼接序列(Unigene 6475和Unigene 6027)[15].其中,Unigene 6475包含完整的编码区,命名为TFL1-1基因;Unigene 6027包含基因的部分编码区,命名为TFL1-2基因.本试验在此基础上对两个龙眼TFL1同源基因进行克隆和序列分析,并对其表达进行了初步研究,探索TFL1同源基因的功能,以期更深入地认知龙眼成花调控的分子机理,为生产上进行成花调控提供理论依据.
1 材料与方法
1.1材料
1.1.1植物材料基因克隆和定量PCR所用‘红核子’龙眼叶芽采自于福建农林大学拓荒广场旁.定量PCR材料为2014年9月20日、10月27日、11月29日和12月25日及2015年1月21日、2月23日和3月21日分别取样的‘红核子’结果母枝顶芽(图1).其中,2014年9~12月的顶芽外观没有明显变化,但芽在不断抽长,2015年1月可见侧芽比较饱满,2015年2月可见明显的“红点”.将这些芽分别装入到1.5 mL离心管中,在液氮中进行速冻,然后放在-80 ℃的冰箱中备用.
1.1.2试剂通用植物总RNA大量提取试剂盒、多功能DNA纯化回收试剂盒购自于北京百泰克生物技术有限公司;RACE试剂盒为Clontech公司的Super SMARTerTMRACE cDNA Amplification Kit;逆转录试剂盒购自于北京全式金生物科技有限公司;DNaseⅠ、RNase Inhibitor、Ex tag酶、dNTP、克隆载体pMD18-T、大肠杆菌DH5α感受态、DL2 000 Marker、DL15 000 Marker购自于TaKaRa生物工程(大连)有限公司.
1.2方法
1.2.1RNA提取和cDNA合成‘红核子’叶芽采用通用植物总RNA大量提取试剂盒提取.3′端RACE cDNA第一链的合成参照Super SMARTerTMRACE cDNA Amplification Kit试剂盒说明书进行,并以TAT为接头,以此为模板进行龙眼TFL1-2基因3′端的克隆.龙眼TFL1-1和TFL1-2基因cDNA的克隆,参照北京全式金生物科技有限公司的TransScript First-Strand cDNA Synthesis SuperMix 试剂盒说明书进行.用于定量PCR的cDNA的合成参照PrimeScript RT Reagent Kit试剂盒说明书进行.
1.2.2龙眼TFL1基因cDNA的克隆根据龙眼转录组测序结果设计龙眼TFL1-1基因cDNA序列特异引物(表1)扩增龙眼TFL1-1基因cDNA编码区全长序列.根据已知部分序列设计3′端RACE引物(表1),从‘红核子’中扩增龙眼TFL1-2基因3′端序列,并进一步获得cDNA编码区全长序列.龙眼TFL1-2基因3′端RACE PCR反应程序如下.第1轮扩增:94 ℃预变性3 min;94 ℃变性30 s,55 ℃退火45 s,72 ℃延伸90 s,35个循环;72 ℃再延伸7 min;第2轮扩增:94 ℃预变性3 min;94 ℃变性30 s,54 ℃退火45 s,72 ℃延伸90 s,35个循环;72 ℃再延伸7 min.全长 cDNA PCR扩增反应程序为:94 ℃预变性3 min;94 ℃变性30 s,58 ℃退火1 min,72 ℃延伸2 min,35个循环;72 ℃再延伸7 min.目的片段回收参照多功能DNA纯化回收试剂盒(离心柱型)说明书进行,回收后克隆于载体pMD18-T,测序委托上海博尚生物技术有限公司完成.电泳为1.0%琼脂糖凝胶电泳.

表1 用于基因克隆和定量PCR的引物1)
1)TAT:5′-CTGATCTAGAGGTACCGGATCCTTTTTTTTTTTTTTTTT-3′.
1.2.3DNA的提取和龙眼TFL1基因DNA序列的克隆龙眼基因组DNA的提取参照曾黎辉等[16]的方法.龙眼TFL1-1和TFL1-2基因DNA序列克隆的引物见表1.
1.2.4两个龙眼TFL1基因序列分析采用DNAMAN软件比对不同物种TFL1氨基酸序列.利用MEGA 5.0软件,采用Neigbber-Joining法进行系统发育分析,并进行1 000次自助法(Bootstrap)统计学检验.采用在线生物信息学网站ExPASy Protparam预测编码蛋白质的基本理化性质(http://www.expasy.ch/tools/protparam.html);采用NetPhos 2.0在线软件(http:www.cbs.dtu.dk/services/NetPhos/)对龙眼TFL1-1和TFL1-2蛋白磷酸化修饰进行预测;采用NCBI的保守区域(http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)对两个龙眼TFL1蛋白保守结构域进行预测;采用SingalP 3.0在线软件(http://www.cbs.dtu.dk/services/SignalP-3.0/)对两个龙眼TFL1蛋白进行信号肽预测;采用PSORT软件对蛋白进行亚细胞定位情况进行预测.
1.2.5实时荧光定量PCR分析以龙眼肌动蛋白基因(Actin)作为内参基因进行荧光定量PCR分析,TFL1-1、TFL1-2和Actin基因的引物序列及退火温度见表1.qPCR反应程序为:94 ℃预变性3 min;94℃变性5 s,退火15 s,72 ℃延伸30 s,40个循环.每个基因重复3次.每个荧光定量PCR结束时将获得相对应的循环数值,采用2-△△Ct法处理试验数据,得出不同样品间各基因的表达差异.用q检验法进行多重比较和显著性差异分析.
2 结果与分析
2.1龙眼TFL1基因cDNA的克隆
2.1.1龙眼TFL1-1基因cDNA的克隆PCR扩增龙眼TFL1-1基因cDNA编码区全长,得到约600 bp的条带(图 2A),测序后获得602 bp的序列(GenBank登录号:AGT41971.1),包含519 bp完整的开放阅读框(图3),共编码173个氨基酸.经与转录组序列比对后,两个序列完全一致.
2.1.2龙眼TFL1-2基因cDNA的克隆以3′端RACE cDNA第一链为模板,进行两轮巢式PCR,得到一条约450 bp的条带(图2B),测序后获得龙眼TFL1-2基因3′端399 bp的序列.将获得的序列与已知序列进行拼接,并设计上游引物和下游引物进行TFL1-2基因cDNA 全长的扩增,得到约800 bp的条带(图2C),测序后获得818 bp大小的序列(GenBank登录号:AIY68668.1),与拼接序列完全一致.TFL1-2基因开放阅读框共有525 bp(图3),编码175个氨基酸.
2.2龙眼TFL1基因组DNA序列的克隆
克隆龙眼TFL1-1和TFL1-2基因组DNA序列发现,TFL1-1基因编码区DNA序列全长1 222 bp,TFL1-2基因编码区DNA序列全长1 182 bp,两个基因都有4个外显子和3个内含子.外显子和内含子的长度如图4所示.
2.3龙眼TFL1基因序列
2.3.1龙眼TFL1氨基酸序列龙眼TFL1-1和TFL1-2氨基酸序列与柑橘Citrussinensis(GenBank登录号:AY344244.1)、白梨PyrusbretschneideriRehd(GenBank登录号:KF240776.1)、绿竹Bambusaoldhamii(GenBank登录号:HM641253.1)、苜蓿Medicagotruncatula(GenBank登录号:XM_003625760.1)、拟南芥Arabidopsisthaliana(GenBank登录号:U77674.1)和文心兰Oncidiumhybridum(GenBank登录号:KM233713.1)的TFL1氨基酸序列进行比对.结果(图5)表明,龙眼TFL1-1和TFL1-2氨基酸都拥有TFL1氨基酸同源序列的保守区域.Banfield et al[17]鉴定出金鱼草TFL1蛋白AmCEN配体结合所必需的6种氨基酸,在龙眼TFL1氨基酸中同样保守(图5).His88和Asp144是TFL1区别于FT的关键碱[18],龙眼TFL1-1和TFL1-2都含有TFL1这两个特有的氨基酸(图5).
2.3.2龙眼TFL1基因的聚类分析采用MEGA 5.05软件对多种植物TFL1和FT基因的系统进化树进行分析.结果(图6)显示:两个龙眼TFL1基因与其他物种TFL1基因聚为一类,与FT基因属于两个不同的亚族;龙眼TFL1-1基因与同属于木本植物的柑橘TFL1基因亲缘关系较近,而龙眼TFL1-2基因与菊花TFL1基因、葡萄TFL1C基因的亲缘关系较近,与其他植物的遗传距离相对较远.
2.4龙眼TFL1蛋白的生物信息学
2.4.1龙眼TFL1蛋白的基本理化性质为了比较两个龙眼TFL1蛋白的特点,运用ExPASy服务系统中的Prot Param工具对两个龙眼TFL1基因编码翻译得到的氨基酸序列进行基本理化性质分析,结果见表2.
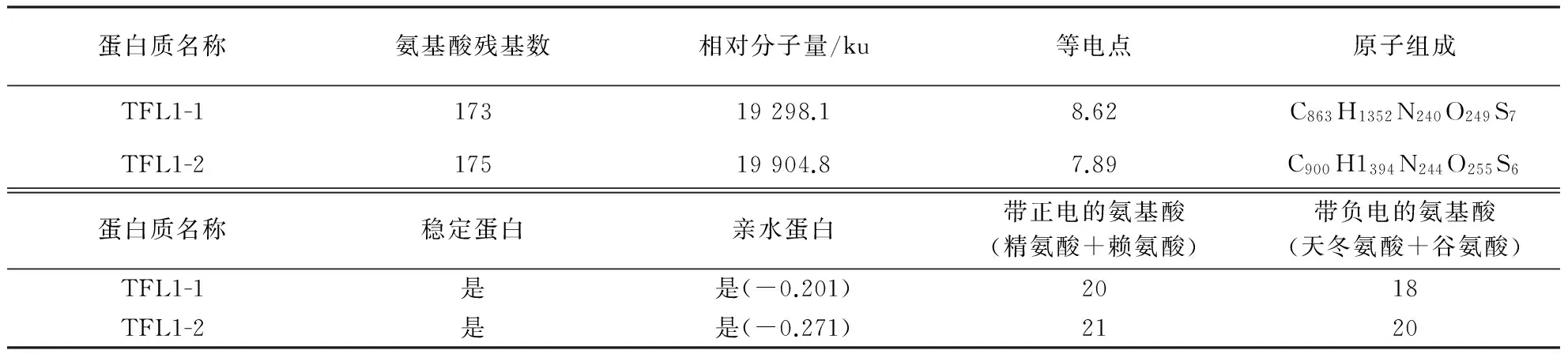
表2 龙眼TFL1蛋白的基本参数
两个龙眼TFL1基因所编码的蛋白均为碱性稳定蛋白,具有亲水特性,带负电的氨基酸(天冬氨酸+谷氨酸)数量均小于带正电的氨基酸(精氨酸+赖氨酸)数量.从氨基酸组成的数量来看,两个龙眼TFL1蛋白均由20种氨基酸组成;从氨基酸组成的含量来看,龙眼TFL1-1和TFL1-2蛋白均富含缬氨酸,含量分别为9.8%和12.0%.
2.4.2龙眼TFL1蛋白的信号肽预测及亚细胞定位分析信号肽是分泌蛋白N端一段含15~35个氨基酸的疏水性肽段,其功能是引导蛋白质多肽链穿过内质网膜进入腔内.信号肽预测结果表明,龙眼TLF1-1和TFL1-2蛋白均不是分泌蛋白,不存在信号肽.
植物蛋白质不同的亚细胞定位与其生物学功能密切相关.采用PSORT软件对两个龙眼TFL1蛋白进行亚细胞定位情况预测.结果(表3)显示:龙眼TLF1-1蛋白存在于细胞质、微体(过氧化物酶体)、溶酶体(内腔)和线粒体基质的空间;而TFL1-2蛋白不存在于细胞质中,定位在微体(过氧化物酶体)中的可能性较大,分值为0.685.
2.4.3龙眼TFL1蛋白的磷酸化位点预测蛋白质的磷酸化和去磷酸化在基因转录、植物发育等细胞信号转导过程中起重要的作用,具有调节转录因子的转录激活或改变蛋白质的功能以及结合DNA的能力[19-20].对龙眼TFL1-1和TFL1-2基因翻译后磷酸化修饰进行预测的结果显示:TFL1-1蛋白共有9个磷酸化位点;TFL1-2蛋白共有12个磷酸化位点(表4).

表3 龙眼TFL1蛋白的亚细胞定位

表4 龙眼TFL1基因编码蛋白的磷酸化位点预测
2.4.4龙眼TFL1蛋白保守结构域预测对两个龙眼TFL1蛋白保守结构域进行预测的结果表明,两个TFL1蛋白均含有一个PEBP家族区域,在TFL1-1蛋白中的位置为27~164,在TFL1-2蛋白中的位置为26~166.
2.5龙眼TFL1基因在花芽分化过程中的表达
荧光定量PCR分析龙眼TFL1-1和TFL1-2基因在‘红核子’花芽分化过程中的表达情况.结果(图7)显示:龙眼TFL1-1基因在9月份的叶芽中有较高的表达量,10月份表达量急剧下降,12月份表达量达到最低,翌年2月份表达量略有增加;而TFL1-2基因在9和10月份叶芽中的表达量都很高,11月份表达量显著下降,此后一直到翌年3月份表达量都较低.
3 讨论
本试验从‘红核子’龙眼中克隆了TFL1-1和TFL1-2基因cDNA序列和基因组DNA序列,两基因的氨基酸序列同源性达到73.14%,DNA序列都含有4个外显子和3个内含子.序列分析和系统进化树分析表明,这两个基因都是TFL1同源基因,但龙眼TFL1-1基因与柑橘、梨的TFL1同源基因的亲缘关系较近,而龙眼TFL1-2基因与菊花、葡萄的TFL1同源基因的相似度更高,而且两个龙眼TFL1蛋白在氨基酸的组成上存在差异,说明它们的功能可能存在差异.
与具有嫁接童期短且周年开花特性的‘四季蜜’龙眼比较,龙眼TFL1-1基因在普通龙眼嫁接新梢中的表达量略有升高,而TFL1-2基因的表达量下降[13],因此在童期调控方面,两个TFL1基因的功能可能不同.柑橘TFL1基因的功能与童期调控有关[9],龙眼TFL1-1基因与柑橘TFL1基因的亲缘关系较近,可能在龙眼童期调控中发挥作用.
‘红核子’龙眼在9月份果实成熟采收后,夏延秋梢(第2年的结果母枝)进一步生长充实,11和12月份进入花芽生理分化期,一般在1月中下旬开始形态分化[21-22].龙眼TFL1-1和TFL1-2基因在花芽分化过程中的表达显示,TFL1-1和TFL1-2基因在结果母枝进入花芽分化生理期时,表达量都显著下降,与菊花TFL1基因在顶芽中的组成型表达不同[12],但两个龙眼TFL1基因的功能可能与拟南芥、草莓和菊花等的TFL1基因相似,维持顶芽的未分化性和抑制开花[6-7,11-12],其表达量的降低与结果母枝顶芽进入花芽分化期密切相关.不同的是,龙眼TFL1-1基因的表达量在10月份就快速下降,而TFL1-2基因到11月份才显著下降,推测这两个基因可能在龙眼成花调控网络中处于不同的位置,它们的功能还有待于进一步研究.
[1] 刘星辉,吴少华.龙眼栽培新技术[M].福州:福建科学技术出版社,1999:128-132.
[2] 黄羌维.龙眼内源激素变化和花芽分化及大小年结果的关系[J].热带亚热带作物学报,1996,4(2):58-62.
[3] 廖文彬,彭明.龙眼花芽分化生物学调控研究进展[J].热带农业科学,2009,29(3):56-58.
[4] 孙洪波,贾贞,韩天富.PEBP家族基因在植物发育调控中的作用[J].植物生理学通讯,2009,45(8):739-747.
[5] 常丽丽,吴连城,库丽霞,等.植物Flowering Locus T/Terminal Flower1基因家族的研究进展[J].西北植物学报,2008,28(4):843-851.
[6] SHANNON S, MEEKS-WAGNER D R. Genetic interactions that regulate inflorescence development in arabidopsis [J]. The Plant Cell, 1993,5(6):639-655.
[7] RATCLIFFE O J, AMAYA I, VINCENT C A, et al. A common mechanism controls the life cycle and architecture of plants [J]. Development, 1998,125(9):1 609-1 615.
[8] WANG R, ALBANI M C, VINCENT C, et al. AaTFL1 confers an age-dependent response to vernalization in perennial arabis alpina [J]. The Plant Cell, 2011,23(4):1 307-1 321.
[9] PILLITTERI L J, LOVATT C J, WALLING L L. Isolation and characterization of a terminal flower homolog and its correlation with juvenility in citrus [J]. Plant Physiology, 2004,135(3):1 540-1 551.
[10] FREIMAN A, SHLIZERMAN L, GOLOBOVITCH S, et al. Development of a transgenic early xowering pear (PyruscommunisL.) genotype by RNAi silencing ofPcTFL1-1 andPcTFL1-2 [J]. Planta, 2012,235(6):1 239-1 251.
[11] RANTANEN M, KUROKURA T, JIANG P, et al. Strawberry homologue of terminal flower1 integrates photoperiod and temperature signals to inhibit flowering [J]. The Plant Journal, 2015,82(1):163-73.
[12] HIGUCHI Y, HISAMATSU T. CsTFL1, a constitutive local repressor of flowering, modulates floral initiation by antagonising florigen complex activity in chrysanthemum [J]. Plant Science, 2015,237:1-7.
[13] IWATA H, GASTON A, REMAY A, et al. TheTFL1 homologueKSNis a regulator of continuous flowering in rose and strawberry [J]. The Plant Journal, 2012,69(1):116-125.
[14] FERNANDEZ L, LE CUNFF L, TELLO J, et al. Haplotype diversity of VvTFL1a gene and association with cluster traits in grapevine (V.vinifera) [J]. BMC Plant Biol, 2014,14:209.
[15] JIA T, WEI D, MENG S, et al. Identification of regulatory genes implicated in continuous flowering of longan (DimocarpuslonganL.) [J]. PLoS ONE, 9(12):e114568.
[16] 曾黎辉,王庆莲,洪自同,等.龙眼LEAFY同源基因片段的克隆和表达[J].热带作物学报,2006,27(4):69-73.
[17] BANFIELD M J, BRADY R L. The structure of antirrhinum CENTRORA-DIALIS protein (CEN) suggests a role as a kinase regulator [J]. Journal of Molecular Biology, 2000,297(5):1 159-1 170.
[18] AHN J H, MILLER D, WINTER V J, et al. A divergent external loop confers antagonistic activity on floral regulatorsFTandTFL1 [J]. The EMBO Journal, 2006,25(3):605-614.
[19] 梁前进,王鹏程,白燕荣.蛋白质磷酸化修饰研究进展 [J].科技导报,2012,30(31):73-79.
[20] 姜铮,王芳,何湘,等.蛋白质磷酸化修饰的研究进展 [J].生物技术通讯,2009,20(2):233-237.
[21] 邱金淡,吴定尧,张海岚,等.石硖龙眼花芽分化的研究[J].华南农业大学学报(自然科学版),2001,22(1):27-30.
[22] 王长春,柯冠武.龙眼花芽形态分化的研究[J].福建省农科院学报,1992,7(1):55-58.
(责任编辑:施晓棠)
Cloning and expression analysis of longanTFL1 genes
LIN Zhibao, FAN Zhengyan, DONG Miaoxia, WEI Danfeng, ZENG Lihui
(College of Horticulture, Fujian Agriculture and Forestry University, Fuzhou, Fujian 350002, China)
To investigate genes that regulate flower bud differentiation, cDNA and genomic DNA sequences of longan terminal flower 1-1 (TFL1-1) and terminal flower 1-2 (TFL1-2) genes were cloned from longan cultivar ‘Honghezi’ , and followed by sequence and expression analysis via PCR. Results showed thatTFL1-1 gene had an open reading frame (ORFs) of 519 bp in length, which encoded 173 amino acid residues, andTFL1-2 gene had an ORF of 818 bp in length, which encoded 175 amino acid residues. And both sequences consisted of 4 exons and 3 introns. Sequence analysis and cluster analysis showed that two longanTFL1 proteins belonged toTFL1 homologs, andTFL1-1 had closer genetic relationship with citrusTFL1 and pearTFL1. To summarize, bothTFL1-1 andTFL1-2 inhibited flower bud differentiation.
longan;TFL1 homologs; gene cloning; gene expression
2015-06-24
2015-09-19
国家级大学生创新性实验计划项目(111ze3005).
林知宝(1993-),男.研究方向:果树遗传育种与分子生物学.Email:541265493@qq.com.通讯作者曾黎辉(1973-),女,教授,博士.研究方向:果树遗传育种与分子生物学.Email:lhzeng@hotmail.com.
S667.2; Q785
A
1671-5470(2016)03-0269-08
10.13323/j.cnki.j.fafu(nat.sci.).2016.03.006

