超高效液相色谱-串联质谱法同步检测食品中的2-甲基咪唑及4-甲基咪唑
庞美蓉,林 钦,戴 明,任小英,张 英*
(1.浙江大学 生物系统工程与食品科学学院,浙江省农产品加工技术研究重点实验室,浙江省食品加工技术与装备工程中心,浙江 杭州 310058;2.福建省产品质量检验研究院 国家加工食品质量监督检验中心,福建 福州 350002)
超高效液相色谱-串联质谱法同步检测食品中的2-甲基咪唑及4-甲基咪唑
庞美蓉1,林钦2,戴明2,任小英2,张英1*
(1.浙江大学生物系统工程与食品科学学院,浙江省农产品加工技术研究重点实验室,浙江省食品加工技术与装备工程中心,浙江杭州310058;2.福建省产品质量检验研究院国家加工食品质量监督检验中心,福建福州350002)
建立了超高效液相色谱-串联质谱(UPLC-MS/MS)同步检测食品中2-甲基咪唑(2-MEI)和4-甲基咪唑(4-MEI)的分析方法。大多数食品超声提取后可直接进样,基质极其复杂的样品(如酱油、咖啡、茶叶等)需经强阳离子交换柱(PCX)萃取净化,采用同位素内标法定量。在优化条件下,2-MEI和4-MEI的检出限分别可达 0.5 ng/g和1.4 ng/g,回收率分别为82.6%~98.1%和89.5%~108.1%,日内相对标准偏差(RSD)分别为1.3%~4.5%和1.0%~5.0%,日间RSD分别为2.0%~5.4%和1.9%~6.5%。采用该方法对市售90余种加工食品进行抽样检测,结果发现2-MEI仅在少量食品中存在且含量较低,而4-MEI在多种食品中存在,含量较高的食品包括老抽酱油(3 224.20~18 795.93 ng/g)、咖啡(0~5 554.35 ng/g)、曲奇(63.48~584.78 ng/g)、焦糖色素饼干(373.12~1 899.60 ng/g)、可乐(44.13~342.77 ng/g)、大麦茶(3 131.05~3 335.60 ng/g)等。该文还首次报道了不同品种茶叶(16~761.89 ng/g)中4-MEI的含量。
超高效液相色谱-串联质谱(UPLC-MS/MS);2-甲基咪唑(2-MEI);4-甲基咪唑(4-MEI);食品
食品的热加工过程中常伴随着美拉德反应,而对该反应伴生危害物的研究已成为当前食品安全领域的热点,热加工食品中的甲基咪唑主要包括2-甲基咪唑(2-Methylimidazole,2-MEI)和4-甲基咪唑(4-Methylimidazole,4-MEI)。美国国家毒理学计划(NTP)通过动物实验证明2-MEI和4-MEI具有致癌性,从而使得食品中的甲基咪唑及其对人类健康的影响得到了各国研究者的广泛关注。国际癌症机构(IARC)将二者列为“人类可能的致癌物(2B组)”[1]。2-MEI和4-MEI是氨(铵)法焦糖色素中主要的潜在危害物,欧盟规定加铵法生产的焦糖色素中4-MEI含量不能超过200 mg/kg,我国标准GB 8817-2001也明确规定氨(铵)法生产的焦糖色素中4-MEI不得超过200 mg/kg[2]。此外,甲基咪唑也存在于未添加焦糖色素的食品中(如咖啡、曲奇等)。
目前用于检测2-MEI和4-MEI的方法有液相色谱法(HPLC)[3-4]、气相色谱法(GC)[5-6]、气相色谱-质谱联用(GC-MS)[7-9]、液相色谱-串联质谱法[10-17]、二维色谱法(LC-LC)[18]、酶联免疫法(ELISA)[19]等。样品的前处理方法主要有离子对萃取[7-9]、固相萃取[10-13]、超临界流体萃取[14]、分散固相萃取(QuEChERS)[15]、阳离子交换吸附[20]等,也有研究报道采用直接进样的方法检测焦糖色素和饮料[16-17]。
由于采用液相色谱-二极管阵列检测器或紫外检测器时,其灵敏度无法满足痕量分析的需要;而GC-MS法的样品前处理较为繁琐且需衍生化;ELISA法易受杂质的干扰,产生假阳性。因此,本实验建立了一种快速、准确、适用性强的UPLC-MS/MS法检测不同食品中的2-MEI和4-MEI,结合色谱的分离能力和质谱的高鉴别能力,能够实现准确定性定量,选择性和灵敏度优势明显,简化了前处理步骤,提高了效率,降低了成本。文中通过对各类消费量较大的可能含有高含量甲基咪唑的食品进行检测,为人群甲基咪唑暴露水平及风险评估提供了参考。
1 实验部分
1.1仪器、材料与试剂
Waters Acquity超高效液相色谱仪、Waters Premier XE 三重四极杆串联质谱仪、20位固相萃取装置(美国Waters公司);CAPCELLPAK CR色谱柱(SCX∶C18=1∶4,2.0 mm×150 mm×5 μm,日本资生堂投资有限公司);十万分之一电子天平、万分之一电子天平(德国Sartorius公司);Cleanert PCX固相萃取柱(3 mL,60 mg,天津博纳艾杰尔科技有限公司);涡旋振荡器、0.2 μm PTFE滤膜(美国Thermo Scientific公司);DS8510DT超声波清洗机(上海生析超声仪器有限公司);食品粉碎机、氮气吹干仪均为实验室常用设备。
1-MEI、2-MEI标准品(99%,美国Sigma公司);4-MEI标准品(>98.5%,德国Dr.Ehrenstorfer GmbH);4-MEI-d5同位素内标(>99%,加拿大C/D/N ISO Topes公司);甲醇、乙腈、乙酸铵、甲酸(HPLC级,德国Merck公司);氨水、三氯乙酸(分析纯,国药集团化学试剂有限公司);实验用水为超纯水,由美国Millipore公司的Milli-Q型超纯水系统制备。
5%三氯乙酸(含20%甲醇):称取25 g三氯乙酸,加入400 mL水和100 mL甲醇,溶解混匀;10%乙腈(含0.2%甲酸):取50 mL乙腈和450 mL水混合,加入1.0 mL甲酸混匀。
各种代表性市售加工食品(调味品、饮料、咖啡、饼干等)均购自当地超市。
1.2实验方法
1.2.1标准溶液的配制分别准确称取适量的1-MEI,2-MEI,4-MEI和4-MEI-d5标准物质,用乙腈配成浓度约为1 mg/mL的标准储备液,-20 ℃保存。准确移取适量的标准储备液用乙腈稀释成约100 μg/mL的混合标准中间液和内标中间液。
1.2.2样品制备固体:准确称取粉碎混匀的样品3.0 g(精确至0.01 g)于25 mL具塞比色管中,加入25 μL内标中间液,再加入10 mL 5%三氯乙酸(含20%甲醇),涡旋振荡混匀,超声30 min,用水定容至 25 mL,混匀,4 500 r/min 离心3 min。
液体:准确称取样品5.0 g(精确至0.01 g)于25 mL具塞比色管中(碳酸饮料、啤酒先超声1 min脱气),加入25 μL内标中间液,再加入10 mL 5%三氯乙酸(含20%甲醇),涡旋振荡混匀,用水定容至25 mL,混匀,4 500 r/min 离心3 min。
咖啡、酱油、茶叶等基质复杂、离子抑制严重的样品需采用固相萃取进一步净化后检测,其他样品经上述处理后直接取上清液过0.2 μm PTFE滤膜,进行UPLC-MS/MS分析。
1.2.3固相萃取将PCX固相萃取柱依次用3 mL甲醇和3 mL 0.5%甲酸活化,准确移取2.0 mL上清样液加至活化后的固相萃取柱中,流速控制在1 mL/min,待样液流尽后,用3 mL水和3 mL甲醇依次淋洗,真空抽干,再用3 mL 5%氨水甲醇溶液洗脱,洗脱液于40 ℃氮吹至近干,用2 mL 10%乙腈(含0.2%甲酸)定容至2 mL,涡旋混匀后过0.2 μm PTFE滤膜,进行UPLC-MS/MS分析。
1.3UPLC-MS/MS检测条件
1.3.1液相色谱条件Waters Acquity超高效液相色谱仪;色谱柱:CAPCELLPAK CR色谱柱(SCX∶C18=1∶4,2.0 mm×150 mm,5 μm);流动相:A为20 mmol/L 乙酸铵(含0.006 7%甲酸),B为甲醇;梯度洗脱程序:0.0~0.5 min,70%~25%A;0.5~3.0 min,25%A;3.0~6.0 min,25%~70%A;6.0~8.0 min,70%A;流速:0.4 mL/min;柱温:35 ℃;进样量:10 μL。
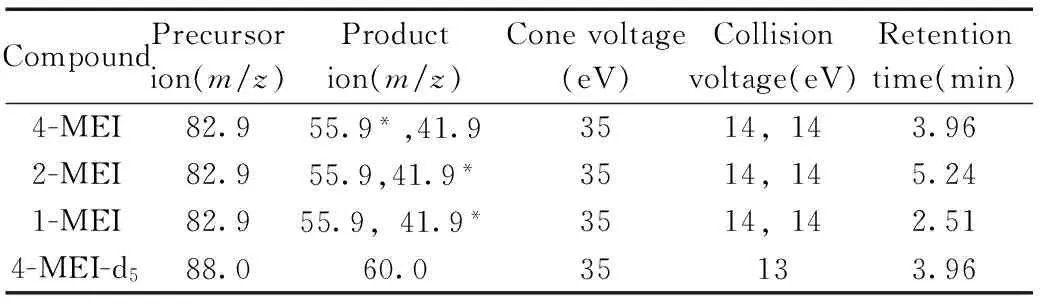
表1 1-MEI,2-MEI,4-MEI和4-MEI-d5的质谱分析条件Table 1 Optimized MS/MS parameters for 1-MEI,2-MEI, 4-MEI and 4-MEI-d5
*quantitative ion
1.3.2质谱条件Waters Premier XE 三重四极杆串联质谱仪;离子源:电喷雾正离子模式(ESI+);多反应监测(MRM);毛细管电压:3.5 kV;源温度:120 ℃;脱溶剂气温度:400 ℃;脱溶剂气流速:700 L/h;反吹气流速:50 L/h;碰撞室压力:2.7×10-3mbar;化合物的监测离子对(m/z)、锥孔电压、碰撞电压等质谱参数见表1。
2 结果与讨论
2.1前处理条件的选择
目前UPLC-MS/MS检测采用的前处理方法主要有固相萃取法、QuEChERS分散净化技术、超临界流体萃取等,上述方法净化后可以减少干扰,提高检测灵敏度,但增加了时间和成本。本方法简化了前处理步骤,对于曲奇、焦糖饼干、可乐、黑啤、食醋等样品,采用三氯乙酸沉淀蛋白,超声辅助提取,离心后取上清液直接进行UPLC-MS/MS分析,在优化条件下,杂质干扰小。但直接提取进样的方法并不适合所有食品,如酱油、咖啡、茶叶等,酱油(尤其是老抽)含有高浓度的盐和其他有机物,特别是氨基酸和低分子量肽等含氮成分;咖啡中含有多种不同的化合物,焙烤之后成分更加复杂;茶叶中含有大量的色素、油脂等。对于这些基质特别复杂的样品,提取后直接进样离子抑制比较严重,重复性差,因此需进一步净化。本方法采用强阳离子交换固相萃取净化方法,有效降低了离子抑制,获得了较好的净化效果。
2.2液相色谱条件的优化
首先尝试使用UPLC-PDA对样品进行检测,但食品体系基质复杂,2-MEI和4-MEI的含量低,即使采用固相萃取净化样品后,UPLC-PDA也不能满足分析需求。因此,改为使用UPLC-MS/MS。
1-MEI是2-MEI和4-MEI的同分异构体,虽然目前尚未发现食品中存在1-MEI,但为了排除其可能对2-MEI和4-MEI检测的干扰,本方法对1-MEI也同时检测。3种同分异构体具有相同的分子质量和离子碎片,需利用液相色谱进行分离,以准确定量。考察了Waters BEH-C18(1.7 μm,2.1 mm×100 mm),CAPCELL PAK ST(5 μm,2.0 mm×150 mm)和CAPCELL PAK CR(SCX∶C18=1∶4,2.0 mm×150 mm,5 μm)等不同色谱柱的分离情况。由于甲基咪唑的极性较大,出峰太快,采用Waters BEH-C18色谱柱时,3种异构体难以达到基线分离。而采用HILIC分离机理的CAPCELL PAK ST色谱柱时,1-MEI和4-MEI难以分离。同时,由于大量极性杂质共流出,采用这两种色谱柱检测未经固相萃取净化的样品时,会造成严重的离子抑制,大大降低检测灵敏度。CAPCELL PAK CR色谱柱由十八烷基(C18)和磺酸基(SCX)制成的混合填料填充而成,结合了C18引起的疏水性相互作用和磺酸基引起的强阳离子交换模式,在此色谱柱上3种甲基咪唑具有良好的保留并可实现完全分离,且峰形和灵敏度良好(如图1)。
考察了甲醇和乙腈作为流动相的有机相时化合物的响应情况,尽管两种有机相均能实现目标物的完全分离,但采用乙腈作为流动相时,对2-MEI产生了强烈的干扰。这可能是由于乙腈在ESI源电离下获取H+,形成[M+H]+,其m/z为42,与2-MEI的定量离子相同,造成基线太高,严重干扰了 2-MEI的检测。而采用甲醇则可避免这一问题,因此选择甲醇作为流动相。
另外考察了目标化合物在甲醇-乙酸铵流动相体系中的分离情况,结果表明,乙酸铵的浓度越大,出峰时间越快,峰形越尖锐,但浓度增大也会增强离子抑制且易污染离子源。在ESI+模式下,流动相中加入可提供H+的甲酸或乙酸等会提高目标化合物的离子化效率,提高待测物的响应值。对流动相酸度进行调整,发现酸度越大,色谱柱对甲基咪唑的保留越强,有利于与样品中杂质的分离,但会造成色谱峰峰形展宽,降低灵敏度。通过优化流动相中乙酸铵的浓度和甲酸的加入量,最后确定以20 mmol/L乙酸铵(含0.006 7%甲酸)作为A相,甲醇作为B相,采用梯度洗脱,以获得3种甲基咪唑的良好分离及高灵敏度。
2.3质谱条件的优化
分别取约10 μg/mL的1-MEI,2-MEI,4-MEI和4-MEI-d5标准溶液,由注射泵直接进样进行质谱条件优化。首先作一级质谱全扫描,在ESI+模式下,1-MEI,2-MEI,4-MEI的母离子均为m/z82.9,4-MEI-d5的母离子为m/z88.0;再对母离子进行二级质谱子离子扫描,碰撞气和碰撞电压的作用使化合物发生断裂或重排,产生二级特征碎片离子,甲基咪唑分别丢失1个-C2H3和1个-NC2H3,相应产生m/z56和m/z42的碎片离子,对于4-MEI,m/z83→56响应相对较强,2-MEI则是m/z83→42响应较强,以强度高的碎片离子为定量离子,2-MEI和4-MEI的定量离子分别选择m/z42和m/z56。优化后的质谱条件见表1。
2.4方法学验证
2.4.1线性与检出限由于1-MEI在质谱上的响应较差且在食品中均未检出,因此只对2-MEI和4-MEI进行方法学考察。采用同位素内标法定量以消除基质效应影响。用20%乙腈配制2-MEI和4-MEI的混合标准溶液,逐级稀释得到2-MEI浓度分别为5.3,10.6,42.2,84.4,105.5,126.6,168.8,211.0 ng/mL,4-MEI浓度分别为7.1,14.2,56.8,113.7,142.2,170.6,227.4,284.3 ng/mL的系列混合标准溶液,加入适量4-MEI-d5内标溶液使浓度均为88.9 ng/mL。在优化条件下进行测定,以定量离子峰面积和相应内标峰面积的比值(y)为纵坐标,标准溶液浓度(x,ng/g)为横坐标进行回归分析。得到2-MEI和4-MEI的标准曲线方程分别为y=2.875x+0.252和y=2.504x+1.895,相关系数(r2)均为0.999 5。 以信噪比(S/N)为3时相应的浓度确定方法检出限(LOD),S/N=10时相应的浓度确定方法定量下限(LOQ),得出2-MEI和4-MEI的LOD分别为0.5 ng/g和1.4 ng/g,LOQ分别为1.8 ng/g和4.6 ng/g。
2.4.2回收率与精密度选取酱油、咖啡、碳酸饮料、曲奇样品,按本方法进行10,50,100 ng/g 3个浓度水平的加标回收实验,每个浓度平行测定5份,计算回收率和日内相对标准偏差(RSD),依照本方法连续测定3 d,计算日间RSD,结果见表2。对于不同食品基质,2-MEI的回收率为82.6%~98.1%,日内RSD为1.3%~4.5%,日间RSD为2.0%~5.4%;4-MEI的回收率为89.5%~108.1%,日内RSD为1.0%~5.0%,日间RSD为1.9%~6.5%,说明方法的适用性良好。

表2 不同样品中2-MEI和4-MEI的加标回收率及相对标准偏差(RSD)Table 2 Spiked recoveries and RSDs of 2-MEI and 4-MEI in different samples
2.5实际样品检测
采用本方法检测了市售加工食品中2-MEI和4-MEI的含量,结果见表3。在食品中均未检测出1-MEI。总体上看,2-MEI的含量普遍较低甚至低于检出限。5种可乐中4-MEI的含量最高为342.77 ng/g。未添加焦糖色素的2种天然酿造酱油中4-MEI的含量极低,1种未检出,另一种仅为10.3 ng/g,4种老抽酱油中4-MEI的含量最高达到18 795.93 ng/g。5种陈醋中4-MEI的含量最高为10 242.0 ng/g。4种添加焦糖色素的饼干中4-MEI含量为373.12~1 899.60 ng/g,远高于不添加焦糖色素的饼干。
未添加焦糖色素的曲奇、咖啡和茶叶等食品中也存在甲基咪唑。在24种曲奇饼干中,4-MEI含量小于100 ng/g的有19种(其中2种未检出),含量在100~300 ng/g的4种,500 ng/g以上的1种。中式麻花在高温油炸的条件下也会产生4-MEI。生咖啡豆不含甲基咪唑,但焙烤后的咖啡豆和速溶咖啡中甲基咪唑含量较高,尤其是速溶黑咖啡,4-MEI含量最高达到5 554.35 ng/g,咖啡中2-MEI的含量也较高,为174.36~1 657.34 ng/g。本文还首次报道了不同品种茶叶中4-MEI的含量,其中红茶中最高含量达761.89 ng/g,大麦茶中4-MEI的含量超过3 000 ng/g。
表3市售各类加工食品中2-MEI和4-MEI的含量(n=3)
Table 3Contents of 2-MEI and 4-MEI in various processed foods(n=3)w/(ng·g-1)
(续表3)
* no detected
3 结 论
本文建立并优化了UPLC-MS/MS检测食品中2-MEI和4-MEI的方法,大多数食品超声提取后可以直接进样,节省了检测成本和时间,对基质极其复杂的样品(如酱油、咖啡、茶叶等)应采用固相萃取净化。该方法适用性广、快速简单、灵敏度高,能很好地应用于各类食品中2-MEI和4-MEI的检测。
[1]IARC Working Group on the Evaluation of Carcinogenic Risks to Humans,IARC Monogr.Eval.Carcinog.Risks Hum.http://monographs.iarc.fr/ENG/Monographs/vol101/mono101-015.pdf,in press.
[2]GB 8817-2001.Food Additive-Caramel(Sulfite Ammonia Caramel,Ammonia Caramel,Plain Caramel).National Standards of the People's Republic of China(食品添加剂焦糖色(亚硫酸铵法,氨法,普通法).中华人民共和国国家标准).
[3]Coffey J S,Nursten H E,Ames J M,Castle L.FoodChem.,1997,58(3):259-267.
[4]Licht B H,Shaw K,Smith C,Mendoza M,Orr J,Myers D V.FoodChem.Toxicol.,1992,30(5):375-382.
[5]Fuchs G,Sundell S.J.Agric.FoodChem.,1975,23(1):120-122.
[6]Guo X L,Chen M,Zhang S X,Hu J R.FoodSci.(郭小莉,陈敏,张世湘,胡锦蓉.食品科学),2005,26(2):169-171.
[7]Cunha C,Senra L,Fernandes J O,Cunha S C.FoodAnal.Methods,2014,7(7):1519-1525.
[8]Fernandes J O,Ferreira M A.J.Chromatogr.A,1997,786(2):299-308.
[9]Casal S,Fernandes J O,Oliveira M B P P,Ferreira M A.J.Chromatogr.A,2002,976(1/2):285-291.
[10]Klejdus B,Moravcová J,Lojková L,Vacek J,Kubáň V.J.Sep.Sci.,2006,29(3):378-384.
[11]Yamaguchi H,Masuda T.J.Agric.FoodChem.,2011,59(18):9770-9775.
[12]Séverine G,Vincent H,Hasna T,Joris V L.FoodAddit.Contam.A,2014,31(10):1652-1660.
[13]Liu Y,Ding T,Fei X Q,Lin H,Shen C Y,Wu B,Zhang R,Tan M R.J.Instrum.Anal.(刘芸,丁涛,费晓庆,林宏,沈崇钰,吴斌,张睿,谭梦茹.分析测试学报),2015,34(4):381-387.
[14]Lojková L,Klejdus B,Moravcová J,Kubán V.FoodAddit.Contam.,2006,23(10):963-973.
[15]Cai W H,Xian Y P,Luo H Y,Lai F R,Luo D H,Lu Y J,Li H,Guo X D.Mod.FoodSci.Technol.(蔡玮红,冼燕萍,罗海英,赖富饶,罗东辉,卢宇靖,李核,郭新东.现代食品科技),2014,30(2):249-254.
[16]Wang J Y,Schnute W C.J.Agric.FoodChem.,2012,60(4):917-921.
[17]Schlee C,Markova M,Schrank J,Laplagne F,Schneider R,Lachenmeier D W.J.Chromatogr.B,2013,927(15):223-226.
[18]Moretton C,Cretier G,Nigay H.J.Agric.FoodChem.,2011,59(8):3544-3550.
[19]Wu X,Yu S,Kang K.FoodChem.,2015,170:354-359.
[20]Müller L,Langseth W,Solheim E,Sivertsen T.J.Agric.FoodChem.,1998,(46):3172-3177.
Simultaneous Determination of 2-Methylimidazole and 4-Methylimidazole in Various Foods by Ultrahigh Performance Liquid Chromatography-Tandem Mass Spectrometry
PANG Mei-rong1,LIN Qin2,DAI Ming2,REN Xiao-ying2,ZHANG Ying1*
(1.Zhejiang R&D Center for Food Technology and Equipment,Zhejiang Key Laboratory for Agro-food Processing,College of Biosystems Engineering and Food Science,Zhejiang University,Hangzhou310058,China;2.China National Quality Supervision and Testing Center for Processed Food,Fujian Inspection and Research Institute for Product Quality,Fuzhou350002,China)
An ultrahigh performance liquid chromatography-tandem mass spectrometric(UPLC-MS/MS) method was developed for the simultaneous determination of 2-methylimidazole(2-MEI) and 4-methylimidazole(4-MEI) in various foods.Most of foods could be injected directly after ultrasonic extraction.Solid phase extraction was needed for extremely complex sample matrix(such as sauce,coffee and tea),and the target analytes were quantified by isotope internal standard.Under the optimized conditions,the limits of detection for 2-MEI and 4-MEI were up to 0.5 ng/g and 1.4 ng/g,respectively,the recoveries of the method ranged from 82.6%to 98.1%for 2-MEI and 89.5%to 108.1%for 4-MEI.The intraday RSDs of 2-MEI and 4-MEI were 1.3%-4.5%and 1.0%-5.0%,while their inter-day RSDs were 2.0%-5.4%and 1.9%-6.5%,respectively.The results indicated that the method was suitable for simultaneous determination of 2-MEI and 4-MEI in food matrices.This method was applied in more than 90 kinds of foods,in which 2-MEI was only observed in several samples and the contents were relatively low,whereas 4-MEI was detected in most of the tested foods,including dark soy sauce(3 224.20-18 795.93 ng/g),coffee(0-5 554.35 ng/g),cookie(63.48-584.78 ng/g),biscuit(containing caramel,373.12-1 899.60 ng/g),cola(44.13-342.77 ng/g) and barley tea(3 131.05-3 335.60 ng/g).This study also reported the contents of 4-MEI in different varieties of tea(16-761.89 ng/g) for the first time.
ultrahigh performance liquid chromatography-tandem mass spectrometry(UPLC-MS/MS);2-methylimidazole(2-MEI);4-methylimidazole(4-MEI);food
2016-01-19;
2016-03-15
国家“973”计划项目(2012CB720806);福建省科技厅民生科技专项(2013Y6003)
张英,教授,研究方向:天然产物与人类健康,Tel:0571-88982164,E-mail:yzhang@zju.edu.cn
10.3969/j.issn.1004-4957.2016.08.003
O657.63;F407.82
A
1004-4957(2016)08-0943-06

