PHLDA3在肝细胞癌中的表达及临床意义
高文斌,曹 超,李进军,刘 巍
(中南大学湘雅医院普通外科,长沙 410008)
PHLDA3在肝细胞癌中的表达及临床意义
高文斌,曹 超,李进军,刘 巍
(中南大学湘雅医院普通外科,长沙 410008)
目的:探讨PHLDA3在肝细胞癌中的表达及其对肝细胞癌生物学行为的影响。方法:通过实时荧光定量PCR和免疫组化检测肝细胞癌组织中PHLDA3 mRNA和蛋白的表达情况,分析PHLDA3的表达与肝细胞癌临床病理特征的关系。结果:肝细胞癌组织中PHLDA3 mRNA和蛋白的表达均明显低于邻近非瘤肝组织,PHLDA3的表达水平与肝细胞癌患者的AFP、结节数目、血管侵犯、TNM分期和BCLC分期紧密相关。结论:PHLDA3在肝细胞癌中低表达,与肝细胞癌的不良临床病理特征密切相关,可能是肝细胞癌侵袭转移的抑制因素。
PHLDA3基因;肝细胞癌;临床病理特征
肝细胞癌(hepatocellular carcinoma,HCC)是全球范围内的常见恶性肿瘤之一[1]。虽然医疗水平不断进步,但是由于HCC的高复发转移,患者的总体生存仍然很差。HCC的复发转移是一个多步骤多因素、复杂连续的动态过程[2]。研究表明,在HCC复发转移过程中与p53、PTEN等抑癌基因的失活或突变有重要关系[3]。最新的研究发现PHLDA3与p53存在密切联系,在管理细胞的增殖与凋亡方面发挥重要作用[4]。然而目前尚无报道PHLDA3是否在HCC的侵袭转移过程中发挥重要作用,本研究旨在对此进行初步探讨。
1 资料与方法
1.1 组织标本和临床资料 收集2012年1月~2013 年12月在中南大学湘雅医院行肝切除术的105例石蜡包埋HCC组织标本。其中25例病人肝切除后,立即在无菌条件下切取新鲜HCC组织和距离肿瘤边缘1 cm相应的邻近非瘤肝组织(Adjacent nontumorous liver tissue,ANLT)并置于液氮中保存。全部病人均经术后组织病理学检查确诊为HCC。收集所有病人临床资料,其中男性82例,女性23例,平均年龄47.9±9.2岁。
1.2 组织RNA提取和实时荧光定量PCR 研磨好的新鲜HCC组织及ANLT标本,使用Trizol裂解液裂解,提取出来后用无RNA酶水溶解,置于-80℃冰箱中保存。实时荧光定量PCR的引物,交由上海生工生物技术公司合成合成。PHLDA3的引物为:上游F-CCACATCTACTTCACGCTGGT,下游R-ATGGCCTGCTGGTTCTTG。产物的大小126bp。按照罗氏试剂盒说明书操作,在ABI7300实时PCR 反应系统中进行,具体的实验条件为:95℃预变性10 min,95℃变性15 sec,60 ℃退火60sec,72 ℃延伸30sec,共40个循环,72℃10 min。每个样本重复3个复孔,取平均值。使用管家基因GAPDH基因作为内参,检测结果采用目的基因与内参照的比值表示,分析PHLDA3 mRNA的相对表达量。
1.3 免疫组织化学 使用5 μm 厚切片常规脱蜡脱水,经柠檬酸抗原修复液抗原热修复,接着山羊血清封闭,然后依次滴加一抗4℃过夜,生物素化二抗常温孵育40min,DAB 液显色,苏木精复染后中性树脂封片,镜下阅片。结果分析依据Shimizu评分方法。按染色细胞数目的评分:无:0分,<1/3数目:1分,<2/3数目:2分,>2/3数目:3分。着色强度的评分:没有着色:0分,浅着色:1分,明显着色:2分。两者评分相加等于0分为(-),2分(±),3分(+),4分(++),5分(+++)。大于2分定为阳性表达。
1.4 统计学处理 采用SPSS 18.0统计学软件。计量资料以均数±标准差表示,采用独立样本t检验。分类变量通过χ2检验或Fisher 确切检验比较。P<0.05为说明差异有统计学意义。
2 结果
2.1 PHLDA3在HCC组织中mRNA和蛋白的表达情况 运用实时荧光定量PCR技术检查25对HCC组织及相匹配的ANLT中PHLDA3 mRNA的表达情况。将PHLDA3在ANLT中mRNA的表达量设为1,计算PHLDA3 mRNA在HCC组织中的相对表达量。结果显示,PHLDA3 mRNA在HCC组织中的表达量平均值为0.449±0.212,即ANLT中PHLDA3 mRNA的表达水平是HCC组织中的2.22倍,PHLDA3在HCC组织中mRNA的表达显著低于ANLT(P<0.05,图1)。采用免疫组织化学技术检测HCC组织及相匹配的ANLT中PHLDA3蛋白的表达情况。结果显示,PHLDA3蛋白主要表达于ANLT的胞浆和胞膜细胞,而HCC组织中的阳性细胞很少见(图2)。HCC组织中PHLDA3的阳性表达率为44.8%(47/105),ANLT中PHLDA3的阳性表达率为85.7%(90/105),两者相比差异有显著性(P<0.05,表1)。
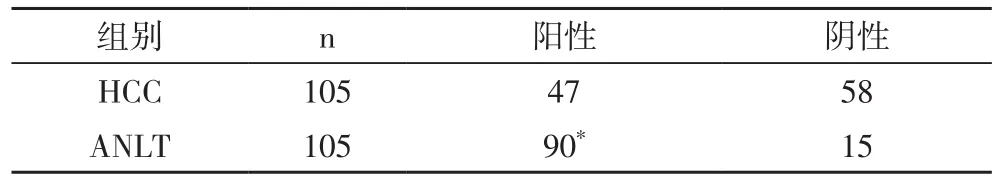
表1 PHLDA3蛋白在HCC组织和ANLT中的阳性表达率比较
2.2 HCC中PHLDA3的表达与其临床病理特征的关系 分析105例HCC组织中PHLDA3的表达水平与其临床病理特征的关系发现,PHLDA3的表达水平与HCC患者的AFP、结节数目、血管侵犯、TNM分期和BCLC分期紧密相关(P<0.05)。而与HCC患者的性别、年龄、乙肝表面抗原、肝硬化、肿瘤大小、肿瘤包膜、Child-Puhg分级和Edmondson-Steiner分级无明显相关性(表2)。
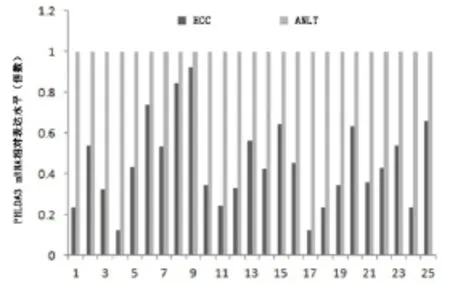
图1 PHLDA3在HCC组织和ANLT中mRNA的表达
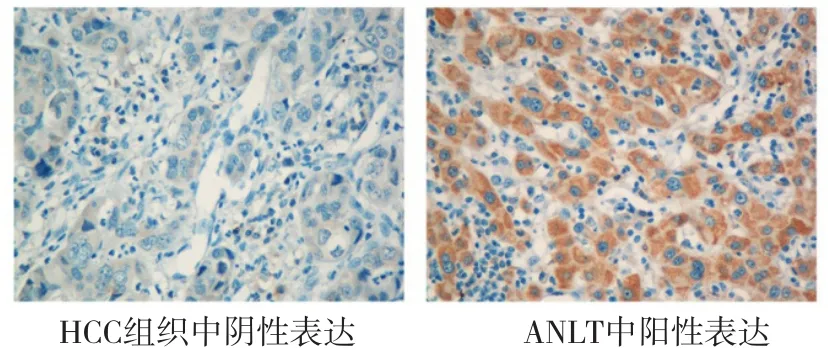
图2 PHLDA3蛋白在HCC组织和ANLT中的表达(免疫组化,400×)
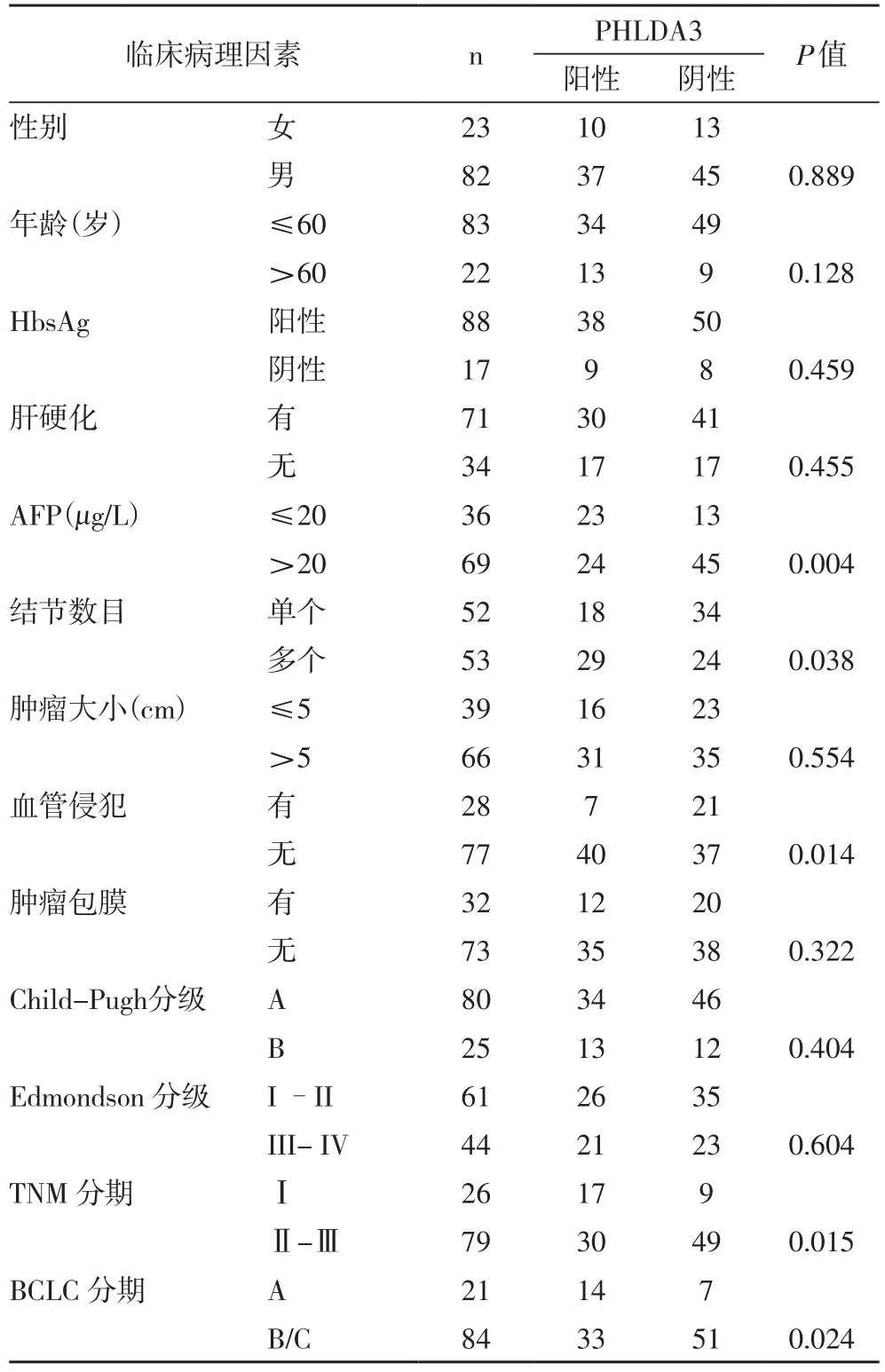
表2 肝细胞癌组织中PHLDA3的表达与其临床病例特征的关系
3 讨论
HCC严重威胁着我国人民的生命健康,研究和阐明HCC复发转移的机制,对治疗HCC患者和提高HCC患者的生存时间具有重要意义。目前关于抑癌基因和癌基因在HCC复发转移中的地位已被大家熟知,越来越多的抑癌基因和癌基因也被不断发现。PHLDA3基因是最新发现的一个与细胞增殖和凋亡有关的基因,已有报道发现PHLDA3是胰腺神经内分泌瘤进展中的一个重要的抑癌基因[5]。然而,有关PHLDA3在HCC中的研究未见报道。本文验证了PHLDA3 在HCC组织中mRNA和蛋白的表达情况,分析了HCC组织中PHLDA3的表达与其临床病理特征的关系,这对阐明HCC的复发转移潜在机制有重要提示意义。
结果显示,PHLDA3在mRNA和蛋白水平在HCC组织中均呈低表达而在ANLT中高表达,这提示PHLDA3可能是HCC的一个抑癌基因。Katarzyna等[6]的研究发现PHLDA3 是p53基因靶向的下游基因,能够通过阻断AKT信号通路诱导细胞凋亡。而肿瘤细胞在侵袭转移的过程中要能避免细胞凋亡才能成功[7],这可能是PHLDA3作为HCC抑制因子的潜在机制。本研究还发现,PHLDA3的表达水平与HCC患者的AFP、结节数目、血管侵犯、TNM分期和BCLC分期密切相关。AFP是目前HCC的最重要的肿瘤标志物,在HCC的诊断和监测中都发挥不可替代的作用[8]。肿瘤的结节数目、血管侵犯都已经有大量研究表明是HCC侵袭转移的重要标志[9,10]。TNM分期和BCLC分期是国际上HCC分期系统中认可度最高,以及运用最为广泛[11,12]。这些都提示着PHLDA3可能在HCC的增殖、侵袭转移能力中发挥着重要的抑制作用。
总之,本研究发现PHLDA3在HCC中低表达,且其mRNA表达水平和蛋白表达水平存在一致性。更重要的是发现PHLDA3的表达水平与肝细胞癌的不良临床病理特征密切相关,可能是肝细胞癌侵袭转移的抑制因素。本研究提示PHLDA3可能是HCC新的分子标志物,进一步研究PHLDA3在HCC侵袭转移中的作用机制,将为HCC的诊断治疗和判断预后提供重要帮助。
[1] Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012[J]. CA: A Cancer J Clin, 2015, 65(2): 87-108.
[2] Valastyan S, Weinberg RA. Tumor Metastasis: Molecular Insights and Evolving Paradigms[J]. Cell, 2011, 147(2): 275-292.
[3] Chow LM, Endersby R, Zhu X, et al. Cooperativity within and among Pten,p53, and Rb Pathways Induces High-Grade Astrocytoma in Adult Brain[J]. Cancer Cell, 2011, 19(3): 305-316.
[4] Kawase T, Ohki R, Shibata T, et al. PH domain-only protein PHLDA3 is a p53-regulated repressor of Akt[J]. Cell, 2009, 136(3): 535-550.
[5] Ohki R, Saito K, Chen Y, et al. PHLDA3 is a novel tumor suppressor of pancreatic neuroendocrine tumors[J]. Proc Natl Acad Sci, 2014, 111(23): E2404-E2413.
[6] Leszczynska KB, Foskolou IP, Abraham AG, et al. Hypoxia-induced p53 modulates both apoptosis and radiosensitivity via AKT[J]. J Clin Invest,2015, 125(6): 2385-2398.
[7] Su Z, Yang Z, Xu Y, et al. Apoptosis, autophagy, necroptosis, and cancer metastasis[J]. Mol Cancer, 2015, 14(1): 48.
[8] Ma WJ, Wang HY, Teng LS. Correlation analysis of preoperative serum alpha-fetoprotein(AFP)level and prognosis of hepatocellular carcinoma(HCC)after hepatectomy[J]. World J Surg Oncol, 2013, 11: 212.
[9] Arii S, Tanaka S, Mitsunori Y, et al. Surgical Strategies for Hepatocellular Carcinoma with Special Reference to Anatomical Hepatic Resection and Intraoperative Contrast-Enhanced Ultrasonography[J]. Oncology, 2010,78(1): 125-130.
[10] Roayaie S, Jibara G, Taouli B, et al. Resection of Hepatocellular Carcinoma with Macroscopic Vascular Invasion[J]. Ann Surg Oncol, 2013, 20(12): 3754-3760.
[11] Bruix J, Sherman M. Management of hepatocellular carcinoma: an update[J]. Hepatology, 2011, 53(3): 1020-1022.
[12] Kee KM, Wang JH, Lin CY, et al. Validation of the 7th edition TNM staging system for hepatocellular carcinoma: an analysis of 8, 828 patients in a single medical center[J]. Dig Dis Sci, 2013, 58(9): 2721-2728.
The clinical significance and the expression of PHLDA3 in hepatocellular carcinoma
Gao Wen-bin, Cao Chao, Li Jin-Jun, Liu Wei
(Department of Surgery, Xiangya Hospital of Central South University, Changsha 410008, China)
Objective To investigate the expression of PHLDA3 in hepatocellular carcinoma and the impacts on biological behavior of hepatocellular carcinoma. Methods The expression levels of PHLDA3 mRNA and protein in hepatocellular carcinoma were detected via real-time fluorescent quantitative PCR and Immunohistochemical methods. The relationship between expression levels of PHLDA3 and Clinicopathologic features of hepatocellular carcinoma were analyzed. Results The expression of PHLDA3 mRNA and protein in hepatocellular carcinoma tissues were both significantly lower than in the adjacent nontumor liver tissue. The expression level of PHLDA3 were closely related with the AFP, nodule number, vascular invasion, TNM staging and BCLC staging in the patients with hepatocellular carcinoma. Conclusion The expression of PHLDA3 in hepatocellular carcinoma was low, and were closely related with adverse clinical pathological features in hepatocellular carcinoma patients,PHLDA3 may be the inhibiting factor for the invasion and metastasis of hepatocellular carcinoma.
PHLDA3 gene; hepatocellular carcinoma; clinicopathologic features
R735.7
A
1673-016X(2016)04-0123-03
2016-03-21
高文斌,E-mail:gaowenbinxy@163.com

