金银花尺蠖蛹粗多糖体外抗氧化活性
向玉勇,章志坚,殷培峰,张元昶
(滁州学院 生物与食品工程学院,安徽 滁州 239000)
金银花尺蠖蛹粗多糖体外抗氧化活性
向玉勇,章志坚,殷培峰,张元昶
(滁州学院 生物与食品工程学院,安徽 滁州 239000)
为了解金银花尺蠖Heterolocha jinyinhuaphaga蛹粗多糖的抗氧化活性,采用热水浸提法提取了金银花尺蠖蛹粗多糖,并测定其体外抗氧化活性。结果表明:金银花尺蠖蛹粗多糖对二苯代苦味酰自由基(DPPH),羟基自由基(·OH)以及超氧阴离子自由基(O2-·)具有一定的清除作用,在其质量浓度为0.2 g·L-1时的清除率分别为39.32%,35.62%和26.75%。随着多糖质量浓度的增大,对自由基的清除率也逐渐增加,当质量浓度上升到1.2 g·L-1时,清除率分别为74.93%,61.59%和47.84%,分别增加了35.61%,25.97%和21.09%,差异达显著水平(P<0.05)。在0.2~1.2 g·L-1的质量浓度范围内,清除率与粗多糖质量浓度之间呈显著的线性关系。金银花尺蠖蛹粗多糖具有较强的体外抗氧化活性,具有开发为抗氧化剂的潜力。图4参20
昆虫学;金银花尺蠖;蛹粗多糖;自由基;抗氧化活性
生物体在有氧代谢过程中会不断地产生自由基。自由基的产生和清除在正常情况下是动态平衡的,对机体伤害小,如果自由基的产生量超过生物体的清除能力,生物体就会出现相应的疾病[1]。如人体内主要的活性氧自由基,即羟自由基(·OH)和超氧阴离子自由基(O2-·)可经过一系列反应生成其他氧自由基,累积过多就会损伤生物膜中的不饱和脂肪酸,引起脂质过氧化,从而导致机体衰老、心血管疾病及肿瘤的发生[2],严重危害人体健康。因此,寻找合适的抗氧化剂来清除活性氧自由基,使机体免受损伤就显得非常重要。多糖是由多个单糖分子失水、缩合而成的一类结构复杂的生物大分子,在动物、植物、微生物和海藻中普遍存在[3]。许多研究表明:多糖具有特殊的生物活性和药理特性,能够清除自由基,减少慢性疾病的发生,并且基本无毒副作用[4-7],在医药卫生和食品行业具有很好应用价值,受到了人们的广泛关注。因此,从生物体内筛选出具有很强抗氧化能力的多糖成分已成为当今的一个研究热点。近年来,许多学者从植物和真菌中提取了多糖,并进行了抗氧化研究。对动物,特别是昆虫源多糖的提取及抗氧化活性研究的报道也较多,如何钊等[8]研究了黄粉虫Tenebrio molitor多糖体外抗氧化活性,结果表明:黄粉虫多糖对二苯代苦味酰自由基(DPPH)清除率为50%时的质量浓度(IC50值)为0.65 g·L-1,在质量浓度为1.76 g·L-1时,对羟基自由基(·OH)的清除率达到99.3%,但在实验范围内,对超氧阴离子自由基(O2-·)的清除率均在50%以下,效果较不显著;武忠伟等[9]研究了冬虫夏草Cordyceps sinensis与富硒虫草多糖的抗氧化活性,认为冬虫夏草和富硒虫草多糖对羟基自由基(·OH),超氧阴离子自由基(O2-·)和 H2O2具有较好的清除作用,当 100 mg·L-1多糖溶液添加量分别高于 80,40,90 μL时,各组多糖对3种自由基的抑制率均高于50%;赵秋蓉等[10]对冬虫夏草多糖进行纯化和抗氧化活性研究,认为冬虫夏草多糖质量浓度为0.5 g·L-1时,对羟基自由基(·OH)的清除率已经达55.56%,当质量浓度为3.0 g·L-1时,清除率为65.74%,在质量浓度为0.5 g·L-1时,对超氧阴离子自由基(O2-·)的抑制率为20.99%,当质量浓度为1.0 g·L-1时,抑制率为25.62%。这些研究结果表明:昆虫种类不同以及多糖的提取方法不同,其多糖的抗氧化活性均存在一定差异。昆虫是自然界中种类最多、数量最大的类群,是地球上尚未被充分开发利用的巨大生物资源。中国昆虫种类繁多,占世界种类总量的10%[11],尚有很多种类未进行相关研究。因此,进行昆虫多糖的抗氧化活性研究对开发新药源具有非常重要的意义。金银花尺蠖Heterolocha jinyinhuaphaga属鳞翅目Lepidoptera尺蛾科Geometridae昆虫,别名拱腰虫,是近年来新发现的金银花Lonicera japonica主要食叶害虫之一,在河南、山东、安徽等地已有报道[12-15]。该虫常将金银花叶片咬成缺刻或孔洞,甚至将叶片全部吃光,造成金银花的大面积减产,给金银花生产带来严重损失。目前,国内对金银花尺蠖的生物学特性及防治方面已有一些研究[12-16],而有关其多糖抗氧化活性研究还未见报道。笔者已研究了金银花尺蠖的一些生物学特性,初步建立了实验室种群,现在前期研究的基础上提取金银花尺蠖蛹粗多糖,进行体外抗氧化活性研究,以期为从昆虫中开发天然抗氧化药物和功能食品提供科学参考,从而达到变害为宝的目的。
1 材料与方法
1.1试剂
石油醚(60~90℃),正丁醇,氯仿,体积分数为95%乙醇,丙酮,葡萄糖,无水乙醇,苯酚,浓硫酸,碳酸氢钠,三氯乙酸,三氯化铁,磷酸氢二钠,磷酸二氢钠,铁氰化钾,二苯代苦味酰自由基(DPPH),邻菲罗啉,硫酸亚铁,过氧化氢,二乙基三胺五乙酸(DTPA),三羟甲基胺基甲烷,盐酸,邻苯三酚,标准抗坏血酸(Vc),均为国产分析纯。
1.2主要仪器
人工气候箱(RXZ-288A型,宁波江南仪器制造厂),索氏提取器(郑州兴华玻璃仪器厂),旋转蒸发仪(RE-52AA型,上海亚荣生化仪器厂),循环水式多用真空泵(SHB-Ⅲ型,郑州长城科工贸有限公司),800B型台式离心机(上海市安亭科学仪器制造厂),高速万能粉碎机(FW80型,天津市泰斯特仪器有限公司),HH-6数显恒温水浴锅(江苏省金坛市荣华仪器制造厂),精密烘箱(20011243型,西班牙Selecta公司),85-2磁力加热搅拌器(江苏金坛红凯仪器厂),723C可见分光光度计(上海欣茂仪器有限公司)。
1.3试验方法
1.3.1供试昆虫的饲养从安徽省明光市三界镇野生金银花上采集金银花尺蠖幼虫,放入罐头瓶内,10 头·瓶-1,然后放在人工气候箱中用新鲜的金银花叶片饲养,每天更换叶片,直至化蛹。人工气候箱的光周期设置为光照期(L)∶暗期(D)=14∶10,相对湿度设置为(75±7)%,温度设置为(25±1)℃。
1.3.2金银花尺蠖蛹粗多糖的制备采用热水浸提法[2]。取金银花尺蠖蛹,经烘箱(45℃)干燥后粉碎,过40目筛。称取金银花尺蠖蛹粉末10.0 g,置于索氏提取器中,加入石油醚(沸点60~90℃)100.0 mL,70℃回流提取1 h脱脂,抽滤,浓缩回收溶剂,重复2次。将滤渣经45℃烘干后置于烧瓶中,加入10倍量的蒸馏水,在沸水浴中提取1 h,过滤,滤渣再用蒸馏水重复提取1次,将2次滤液合并。将滤液用旋转蒸发仪(60℃)缩浓至一定体积,Sevage法除蛋白[17],流动自来水透析24 h,再次浓缩,加入4倍体积的体积分数为95%乙醇,在4℃冰箱中过夜醇沉,离心10 min(4 000 r·min-1),沉淀用无水乙醇、丙酮各洗涤2次,低温干燥至恒量,即得金银花尺蠖蛹粗多糖。称取一定量的粗多糖,用重蒸馏水溶解,并配制成不同浓度的试样,待用。
1.3.3金银花尺蠖蛹粗多糖质量分数测定蛹粗多糖质量分数的测定采用苯酚-硫酸比色法[18]。葡萄糖标准曲线的测定:取分析纯葡萄糖于105℃烘箱中干燥至恒量,精密称取50.0 mg,置于100 mL容量瓶中,用蒸馏水定容,即配制成0.5 g·L-1的葡萄糖标准溶液。用移液管精密移取0,1.0,2.0,3.0,4.0,5.0,6.0 mL的葡萄糖标准溶液,分别置于50.0 mL容量瓶中,加蒸馏水定容,并摇匀。精确吸取上述溶液2.0 mL,置于具塞试管中,加质量分数为5%的苯酚1.0 mL,摇匀,快速滴加浓硫酸5 mL,摇匀,放置10 min,置沸水浴中加热20 min后取出冷却,以蒸馏水作空白对照,在490 nm处测定吸光度值。以葡萄糖质量浓度(mg·L-1)为横坐标,吸光度值D(490)为纵坐标,绘制葡萄糖标准曲线,并回归出标准曲线方程。样品中粗多糖质量分数测定:称取干燥至恒量的蛹粗多糖样品100.0 mg,置于100 mL容量瓶中,加水溶解,摇匀,定容。精确吸取该溶液4.0 mL至50 mL容量瓶中,加水稀释,摇匀,定容。按照葡萄糖标准曲线的测定方法测定吸光度值。实验重复3次,采用葡萄糖标准曲线线性回归方程算出样品中粗多糖的平均质量分数。
1.3.4金银花尺蠖蛹粗多糖总还原力测定参考李润丰等[6]的方法。取各质量浓度粗多糖样品液2.5 mL置于具塞试管中,然后加入0.2 mol·L-1磷酸盐缓冲液(pH 6.6)2.5 mL和质量分数为1%铁氰化钾溶液2.5 mL,盖上塞子充分摇匀,在50℃水浴锅中保温20 min,取出后快速冷却,加入质量分数为10%三氯乙酸2.5 mL,充分摇匀后离心10 min(4 000 r·min-1),取上清液2.5 mL,加入质量分数为0.1%三氯化铁0.5 mL和蒸馏水2.5 mL,充分摇匀后静止10 min,在700 nm处测定吸光度值D(700),将样品液换成蒸馏水进行参比测定实验,用同浓度的维生素C作阳性对照。
1.3.5金银花尺蠖蛹粗多糖清除二苯代苦味酰自由基(DPPH)试验参照赵爱云等[7]的方法,称取金银花尺蠖蛹粗多糖,用蒸馏水配制成0.2,0.4,0.6,0.8,1.0和1.2 g·L-1等6种质量浓度。称取20.0 mg 的DPPH置于500 mL容量瓶中,用无水乙醇溶解,并定容为0.1 mmol·L-1的溶液。精确量取2.0 mL DPPH溶液放入10 mL具塞试管中,分别加入2.0 mL各质量浓度的样品溶液,充分混匀并静置30 min,在517 nm处测定溶液吸光度值。实验重复3次,以蒸馏水作空白对照,以维生素C作阳性对照。按下面公式计算蛹粗多糖清除DPPH自由基的能力:DPPH自由基清除率(%)=[D0-(D2-D1)/D0]×100。其中:D0为2.0 mL DPPH溶液+2.0 mL蒸馏水的吸光度值;D1为2.0 mL乙醇+2.0 mL样品溶液的吸光度值;D2为2.0 mL DPPH溶液+2.0 mL粗多糖溶液的吸光度值。
1.3.6金银花尺蠖蛹粗多糖清除羟自由基(·OH)试验参照单斌等[2]的方法,设空白组、对照组和样品组。在各样品管中分别依次加入1.0 mL不同质量浓度(0.2,0.4,0.6,0.8,1.0,1.2 g·L-1)蛹粗多糖溶液,再依次分别加入0.4 mol·L-1PBS缓冲溶液(pH 7.4)1.0 mL,2.5 mmol·L-1邻菲罗啉溶液1.0 mL,2.5 mmol·L-1硫酸亚铁溶液1.0 mL,20.0 mmol·L-1过氧化氢溶液0.5 mL;空白组中把样品溶液换成1.0 mL蒸馏水;对照组中用1.5 mL蒸馏水代替过氧化氢溶液和样品溶液。各管摇匀,在37℃恒温水浴中准确反应1 h后,迅速在536 nm处测定吸光度值。以等质量浓度的维生素C为阳性对照,实验重复3次。根据下列公式计算粗多糖样品对羟自由基(·OH)的清除率[2]:羟自由基(·OH)清除率(%)=[(D2-D1)/(D0-D1)]×100。其中:D0,D1,D2分别为标准对照组吸光度值、空白组吸光度值和样品组吸光度值。
1.3.7金银花尺蠖蛹粗多糖清除超氧阴离子自由基(O2-·)试验采用邻苯三酚自氧化法[2],取3 mmol·L-1DTPA溶液2.0 mL和150 mmol·L-1Tris-HCl缓冲液2.0 mL(pH 8.2)放入10 mL具塞试管中,分别加入0.5 mL各质量浓度(0.2,0.4,0.6,0.8,1.0,1.2 g·L-1)待测粗多糖溶液,经25℃恒温水浴保温20 min后,立即加入经25℃预热的45 mmol·L-1邻苯三酚溶液0.1 mL,迅速摇匀,在3.5 min内,隔30 s在325 nm处测定1次溶液的吸光度值,计算吸光度值随时间的变化率。实验重复3次,以等质量浓度的维生素C为阳性对照,并与空白溶液比较。根据下列公式计算粗多糖样品对超氧阴离子自由基的清除率。超氧阴离子自由基清除率(%)=[(F0-Fx)/F0]×100。其中:F0为空白溶液吸光度值随时间的变化率;Fx为被测溶液吸光度值随时间的变化率。
2 数据统计
采用SPSS 11.5统计软件进行数据处理和统计学分析,采用Duncan氏新复极差法在P<0.05水平上进行差异显著性检验。
3 结果与分析
3.1葡萄糖标准曲线及粗多糖含量
将所测定各质量浓度标准葡萄糖溶液的吸光度值D(490)为纵坐标,对应的葡萄糖质量浓度C(mg· L-1)为横坐标绘制标准曲线,得出吸光度D(490)与葡萄糖标准品质量浓度 C关系的线性回归方程为D (490)=0.069 3C-0.050 9,相关系数R2为0.992 2,说明葡萄糖在2.5~15.0 mg·L-1范围内,其质量浓度与吸光度线性关系良好。此回归方程可以很好地拟合试验数据。按1.3.3方法步骤测得金银花尺蠖蛹中粗多糖质量分数(干质量)为34.6 g·kg-1。
3.2金银花尺蠖蛹粗多糖总还原力
在反应体系中,铁氰化钾与还原物质发生反应生成亚铁氰化钾,再与Fe3+反应生成普鲁士蓝,在700 nm处有特异性吸收,吸光度值越大,说明样品的还原能力就越强。一般情况下,物质的还原能力越强,其抗氧化活性就越强。图1显示:金银花尺蠖蛹粗多糖具有较强的还原能力,在2.0 g·L-1时的吸光度值为0.67,随质量浓度的增加吸光度值也在增加。当质量浓度上升到10.0 g·L-1时,吸光度值增加到1.72,差异达显著水平(P<0.05),说明还原力随粗多糖质量浓度的增加而增大,但各质量浓度下的还原力均低于维生素C,差异达显著水平(P<0.05)。在2.0~10.0 g·L-1的质量浓度范围内,多糖的总还原力(y)与质量浓度(x)之间呈显著的线性关系,拟合方程为y=0.133x+0.372,R2=0.994 0。
3.3金银花尺蠖蛹粗多糖对二苯代苦味酰自由基(DPPH)自由基的清除作用
由图2可知:金银花尺蠖蛹粗多糖对DPPH自由基具有较强的清除作用,在0.2 g·L-1时的清除率为39.32%,随着粗多糖质量浓度的增加,对DPPH自由基的清除率也逐渐增加。当质量浓度上升到1.2 g· L-1时,清除率已达到74.93%,增加了35.61%,差异达显著水平(P<0.05)。各质量浓度下的清除率均低于维生素C,差异达显著水平(P<0.05)。在0.2~1.2 g·L-1的质量浓度范围内,粗多糖对DPPH自由基的清除率(y)与质量浓度(x)之间呈显著的线性关系,拟合方程为y=35.381x+32.215,R2=0.999 8。
3.4金银花尺蠖蛹粗多糖对羟自由基(·OH)的清除作用

图1 蛹粗多糖的总还原力Figure 1 General reducing ability of pupae raw polysaccharide

图2 蛹粗多糖对DPPH的清除作用Figure 2 Clearing effects of pupae raw polysaccharide on DPPH
由图3可知:在体外,金银花尺蠖蛹粗多糖能明显地清除羟自由基(·OH),在0.2 g·L-1时,即显示较强清除能力,清除率达35.62%,其清除作用随着粗多糖质量浓度的升高而逐渐加强,当质量浓度上升到1.2 g·L-1时,清除率已达到61.59%,增加了25.97%,差异达显著水平(P<0.05),各质量浓度下的清除率均低于维生素C,差异达显著水平(P<0.05)。在0.2~1.2 g·L-1的质量浓度范围内,粗多糖对羟自由基(·OH)的清除率(y)与质量浓度(x)之间呈显著的线性关系,拟合方程为y=26.787x+29.907,R2=0.995 9。
3.5金银花尺蠖蛹粗多糖对超氧阴离子自由基(O2-·)的清除作用
由图4可知:金银花尺蠖蛹粗多糖在体外对超氧阴离子自由基(O2-·)具有一定的清除作用,具有直接清除超氧阴离子自由基的抗氧化活性。在0.2 g·L-1时,对超氧阴离子自由基(O2-·)的清除率为26.75%,随着多糖质量浓度的增加,对超氧阴离子自由基(O2-·)的清除率也逐渐增加,当质量浓度上升到1.2 g·L-1时,清除率达47.84%,增加了21.09%,差异达显著水平(P<0.05),各质量浓度下的清除率均低于维生素C,差异达显著水平(P<0.05)。在0.2~1.2 g·L-1的质量浓度范围内,粗多糖对超氧阴离子自由基(O2-·)的清除率(y)与质量浓度(x)之间呈显著的线性关系,拟合方程为y=21.037x+23.101,R2= 0.986 4。
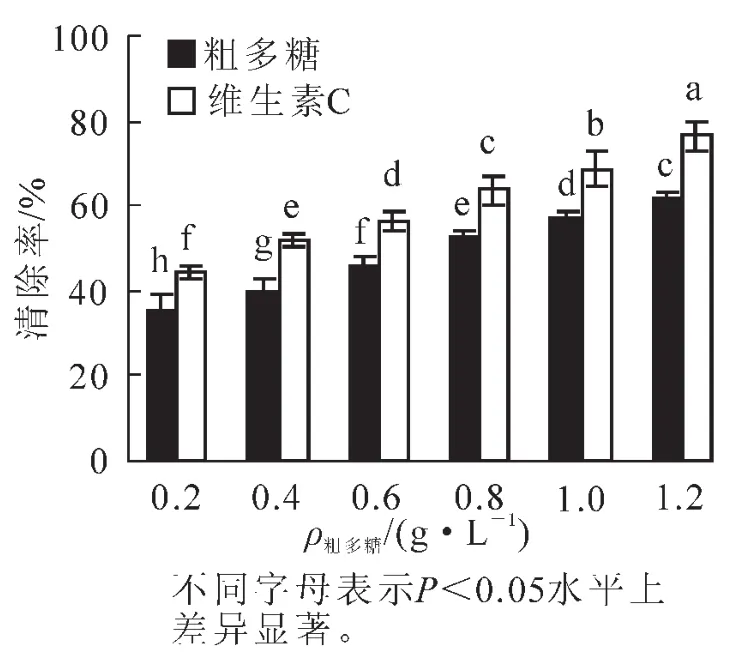
图3 蛹粗多糖对羟自由基(·OH)的清除作用Figure 3 Clearing effects of pupae raw polysaccharide on hydroxy radical

图4 蛹粗多糖对超氧阴离子自由基(O2-·)的清除作用Figure 4 Clearing effects of pupae raw polysaccharide on superoxide anion radical
4 讨论
昆虫体内多糖丰富,是开发多糖资源的良好材料。目前,有关昆虫多糖抗氧化活性研究已有较多的报道[8-10]。笔者在室内提取了金银花尺蠖蛹粗多糖,并测定了其体外抗氧化活性。结果表明:金银花尺蠖蛹粗多糖在体外均能明显地清除DPPH自由基、羟自由基(·OH)和超氧阴离子自由基(O2-·),并且清除作用随着多糖质量浓度的增加而不断增强,呈明显的线性关系。这表明金银花尺蠖蛹粗多糖具有较强的抗氧化作用,能够清除机体内产生的氧自由基,因而在抗氧化、防衰老方面具有一定的作用,是一种很有开发潜力的资源昆虫,在医学及人类保健事业上具有潜在的开发利用价值。
何钊等[8]的研究表明:在试验范围内,黄粉虫多糖对DPPH自由基、羟自由基(·OH)和超氧阴离子自由基(O2-·)的清除能力随质量浓度的增加而增强,存在一定的量效关系,但没有呈线形关系,当上升到一定质量浓度时,清除率趋于稳定。笔者的研究则表明:在试验范围内,金银花尺蠖蛹粗多糖对这3种自由基的清除作用与多糖质量浓度之间呈明显的线性关系。这说明金银花尺蠖蛹粗多糖对自由基的清除能力比较稳定,显示了持续的抗氧化效果。武忠伟等[9]和赵秋蓉等[10]的研究也显示:冬虫夏草对自由基具有一定的清除作用,但都没有做阳性对照试验。笔者的研究表明:金银花尺蠖蛹粗多糖对3种自由基的清除作用均低于维生素C,这与何钊等[8]的研究结果一致。作为一种酸性多羟化合物,维生素C是通过逐级供给电子来清除活性氧自由基的[19],可能由于金银花尺蠖蛹粗多糖供电子能力不及维生素C,所以对自由基的清除作用低于维生素C。
本试验只是研究金银花尺蠖蛹粗多糖的体外抗氧化活性,不能代表其体内清除自由基的实际情况,今后还需进行动物活体试验,以进一步明确其粗多糖抗氧化活性。本试验中金银花尺蠖蛹粗多糖对3种自由基的清除活性不同,这可能与多糖中不同组分所起的作用不同有关[20]。今后还需对金银花尺蠖蛹粗多糖的各组分进行分离纯化,研究其分子结构与生物活性之间的构效关系,探讨其抗氧化的药理作用,并且还需研究金银花尺蠖人工大量繁殖技术,为进一步开发利用提供科学依据。
[1]MARX J L.Oxygen free radicals linked to many diseases[J].Science,1987,235(4788):529-531.
[2]单斌,张卫国,赵强,等.苦瓜多糖抗氧化活性的研究[J].安徽农业科学,2009,37(1):182-183,229. SHAN Bin,ZHANG Weiguo,ZHAO Qiang,et al.Study on the antioxidant activity of polysaccharide from Momordica Charantia L.[J].J Anhui Agric Sci,2009,37(1):182-183,229.
[3]姚新生.天然药物化学[M].2版.北京:人民卫生出版社,2001:53-65.
[4]李尔春,丁红军,金晓辉.天然植物多糖的结构及活性研究进展[J].食品与药品,2007,9(4):51-53. LI Erchun,DING Hongjun,JIN Xiaohui.Research advance on structure and biological activities of natural plant polysaccharides[J].Food Drug,2007,9(4):51-53.
[5]林桂兰,许学书,连文思.食用菇多糖提取物体外抗氧化性能研究[J].华东理工大学学报:自然科学版,2006,32(3):278-281,317. LIN Guilan,XU Xueshu,LIAN Wensi.Antioxidant activity of edible mushroom polysaccharide extracts in vitro[J].J East China Univ Sci Technol Nat Sci Ed,2006,32(3):278-281,317.
[6]李润丰,刁华娟,彭友舜,等.板栗多糖的提取及抗氧化活性研究[J].食品研究与开发,2011,32(8):21-25. LI Runfeng,DIAO Huajuan,PENG Youshun,et al.Study on the antioxidant activity of polysaccharide from chestnut [J].Food Res Dev,2011,32(8):21-25.
[7]赵爱云,胡博路,杭瑚,等.部分植物抗氧化活性的初步研究[J].天然产物研究与开发,2000,12(3):42-44. ZHAO Aiyun,HU Bolu,HANG Hu,et al.The primary study on antioxidant activity of some plants[J].Nat Prod Res Dev,2000,12(3):42-44.
[8]何钊,冯颖,孙龙,等.黄粉虫多糖响应面法提取及抗氧化活性[J].食品与生物技术学报,2011,30(5):641 -647. HE Zhao,FENG Ying,SUN Long,et al.Optimization of extraction process by using response surface methodology and antioxidant activity of polysaccharide from yellow mealworm[J].J Food Sci Biotechnol,2011,30(5):641-647.
[9]武忠伟,许桂芳,曹蓬勃,等.虫草与富硒虫草多糖的体外抗氧化活性[J].食品科学,2011,32(9):76-78. WU Zhongwei,XU Guifang,CAO Pengbo,et al.Antioxidant activity of intracellular and extracellular polysaccharides from regular and Se-rich Cordyceps sinensis in vitro[J].Food Sci,2011,32(9):76-78.
[10]赵秋蓉,李建平,吴迪,等.冬虫夏草中多糖提取、纯化及抗氧化性能的研究[J].中国农学通报,2012,28 (15):238-242. ZHAO Qiurong,LI Jianping,WU Di,et al.Studies on the extraction,purification of the polysaccharides in Cordyceps sinensis and its autoxidation[J].Chin Agric Sci Bull,2012,28(15):238-242.
[11]彩万志,庞雄飞,花保祯,等.普通昆虫学[M].北京:中国农业大学出版社,2001∶8.
[12]张文冉,高殿滑,刘爱华.金银花尺蠖的发生与气象条件的关系[J].气象与环境科学,2007,30(4):60-62. ZHANG Wenran,GAO Dianhua,LIU Aihua.Relationships between honeysuckle geometrid occurrence and meteorological condition[J].Meterol Environ Sci,2007,30(4):60-62.
[13]王广军,张国彦,王江蓉.金银花尺蠖的发生规律与防治技术[J].中国植保导刊,2005,25(3):22-23. WANG Guangjun,ZHANG Guoyan,WANG Jiangrong.Occuring rules of Heterolocha jinyinhuaphaga and its control measures[J].Chin Plant Prot,2005,25(3):22-23.
[14]姜敏,邵明果,赵伯林.金银花尺蠖的生物学特性及防治技术[J].山东林业科技,2005(1):62-63. JIANG Min,SHAO Mingguo,ZHAO Bolin.Biology characteristic of Heterolocha jinyinhuaphaga and its control methods[J].J Shandong For Sci Technol,2005(1):62-63.
[15]向玉勇,刘克忠,殷培峰,等.安徽金银花尺蠖的生物学特性[J].滁州学院学报,2010,12(5):35-37. XIANG Yuyong,LIU Kezhong,YIN Peifeng,et al.The biological characteristics of honeysuckle geometrid in Anhui Province[J].J Chuzhou Univ,2010,12(5):35-37.
[16]倪云霞,刘新涛,刘玉霞,等.金银花尺蠖的药剂防治[J].河南农业科学,2006(12):78-79. NI Yunxia,LIU Xintao,LIU Yuxia,et al.Pesticide control to Heterolocha jinyinhuaphaga Chu[J].J Henan Agric Sci,2006(12):78-79.
[17]刘玲,安家彦,金凤燮.蛹虫草多糖除杂蛋白的方法[J].大连轻工业学院学报,2002,21(1):33-37. LIU Ling,AN Jiayan,JIN Fengxie.Method of protein removal in cordyceps polysaccharide[J].J Dalian Inst Ligh Industry,2002,21(1):33-37.
[18]王文平,郭祀远,李琳,等.苯酚-硫酸法测定野木瓜中多糖含量的研究[J].食品科学,2007,28(4):276-279. WANG Wenping,GUO Qiyuan,LI Lin,et al.Assay study on content of polysaccharides in Stanuntonia chinensis by phenol-sulfuric acid method[J].Food Sci,2007,28(4):276-279.
[19]谭榀新,叶涛,刘湘新,等.植物提取物抗氧化成分及机理研究进展[J].食品科学,2010,31(15):288-292. TAN Pinxin,YE Tao,LIU Xiangxin,et al.Research advances in antioxidant composition of botanical extracts and their action mechanisms[J].Food Sci,2010,31(15):288-292.
[20]孙玉军,陈彦,王松华,等.胡萝卜多糖体外抗氧化活性研究[J].热带作物学报,2011,32(3):403-406. SUN Yujun,CHEN Yan,WANG Songhua,et al.Study on antioxidant activity of polysaccharide from carrot(Daucus carota var.sativa)in vitro[J].Chin J Trop Crop,2011,32(3):403-406.
Antioxidant activity of raw polysaccharides from Heterolocha jinyinhuaphaga pupae in vitro
XIANG Yuyong,ZHANG Zhijian,YIN Peifeng,ZHANG Yuanchang
(School of Biology and Food Engineering,Chuzhou University,Chuzhou 239000,Anhui,China)
To understand the antioxidant activity of raw polysaccharides from the Heterolocha jinyinhuaphaga pupae,and provide scientific reference for development of natural antioxidant drugs and performance foods,raw polysaccharides from the pupae was extracted in the laboratory by the hot water extraction method.Then,its antioxidant activity was studied in vitro by spectrophotometric method.Its clearing rate on 2,2-diphenyl-1-picrylhydrazyl(DPPH),·OH and O2-.was tested with 3 replications,and vitamin C was used as control.Results showed that with a dosage of 0.2 g·L-1,the clearing rate of raw polysaccharide was 39.3%on DPPH,35.6%on·OH,and 26.8%on O2-.With a 1.2 g·L-1dosage,the clearing rate increased to 74.9%for DPPH,61.6%for·OH,and 47.8%for O2-.From 0.2 to 1.2 g·L-1,the clearing rate showed a linear connection to the dosages.Thus,the pupae polysaccharide of H.jinyinhuaphaga had a high antioxidant activity,which could potentially be exploited.[Ch,4 fig.20 ref.]
entomology;Heterolocha jinyinhuaphaga;raw polysaccharides of pupae;free radicals;antioxidant activity
S763.42;Q964
A
2095-0756(2016)05-0862-07
10.11833/j.issn.2095-0756.2016.05.019
2015-10-28;
2015-11-20
安徽高等学校自然科学研究项目(KJ2012B123);安徽省高等学校优秀青年人才基金资助项目(2009SQRZ147);国家级大学生创新创业训练计划项目(201210377006)
向玉勇,副教授,博士,从事资源昆虫学及害虫防治研究。E-mail:xyy10657@sohu.com
浙 江 农 林 大 学 学 报,2016,33(5):862-868
Journal of Zhejiang A&F University
——茶尺蠖和灰茶尺蠖的识别

