光周期对白腰朱顶雀脱支酶活性的影响
王有祥,徐兴军*,邵淑丽,李怀永,王维禹,张伟伟
光周期对白腰朱顶雀脱支酶活性的影响
王有祥1,徐兴军1*,邵淑丽1,李怀永2,王维禹1,张伟伟1
(1.齐齐哈尔大学生命科学与农林学院,黑龙江齐齐哈尔 161006;2. 齐齐哈尔市第一医院放疗科,黑龙江齐齐哈尔 161000)
将白腰朱顶雀()分为长光组(16 h光照,8 h黑暗)、短光组(8 h光照,16 h黑暗)和对照组(12 h光照,12 h黑暗)分别驯化4周,探寻光周期对白腰朱顶雀体质量、器官质量、基础代谢率、体脂质量分数和脱支酶活性等生理生化指标的影响,结果显示:1) 短光组白腰朱顶雀体质量随驯化时间的延长逐渐增加,驯化后比驯化前体质量增加了1.05 g,与对照组相比差异极显著(0.01);长光组白腰朱顶雀体质量增加幅度不明显,驯化1~3周后涨幅较大。2) 短光组白腰朱顶雀的基础代谢率在驯化2~4周的增加幅度最明显,增加量为0.38mL/(g·h),驯化第3周至第4周结束时,短光组白腰朱顶雀基础代谢率与长光组的差异极显著(0.01)。3) 短光组白腰朱顶雀肌肉中脱支酶活性与对照组、长光组间的差异极显著(0.01);长光组白腰朱顶雀肝脏中的脱支酶活性与对照组、短光组间的差异极显著(0.01)。4) 短光组白腰朱顶雀体脂质量分数较对照组高2.19%,长光组体脂质量分数较对照组低1.73%,短光组和长光组白腰朱顶雀体脂质量分数与对照组间的差异极显著(0.01),短光组与长光组间的差异极显著(0.01)。5) 长光组白腰朱顶雀的消化能比短光组、对照组分别高22.71、24.69 kJ/g,长光组的消化能与对照组、短光组间的差异极显著(<0.01)。6) 短光组和长光组白腰朱顶雀心脏、胃、肾脏、胰脏鲜质量与对照组间的差异无统计学意义(>0.05)。结果表明,光周期是影响白腰朱顶雀产热特征改变的主要环境因子之一,在短光照条件下,白腰朱顶雀通过增加体质量、提高代谢率、提高对食物的消化速率、提高肝脏和肌肉组织中脱支酶的活性来补偿能量消耗,以适应外界光周期的变化。
白腰朱顶雀;光周期;脱支酶活性;基础代谢率;体质量
为应对自然界中环境因素的季节性变化,动物通过适当的能量调节来应对恶劣环境。光周期是重要的环境因子之一,是许多动物体质量和能量代谢季节性调节的重要信号[1]。动物的昼夜节律及季节节律随光周期的季节性变化而变化。关于光周期对小型动物能量代谢及产热方面影响的研究较多,如在长光照刺激下,日本鹌鹑的体质量降低,摄入能、排泄能及同化能显著升高[2];光周期直接参与肾上腺皮质应激反应的调控[3];短光照使树麻雀的体质量增加并随消化道的形态学变化而变化,通过小肠和直肠显著增生来维持较长黑暗环境中正常的能量代谢[4];短光照和较长光照能使白头鹎的体质量和器官质量发生明显变化[5];短光照能提高布氏田鼠的产热能力[6],等等。糖原对动物获得生存所需要的能量具有重要意义[7]。糖原在分解过程中产生许多种酶,其中脱支酶是关键的酶之一[8–9]。
白腰朱顶雀()属于雀形目(Passeriformes)、雀科(Fringillidae),生活于溪边丛生柳林和沼泽化的多草疏林,食性比较杂,且随季节的变化而变化,春、夏季主要以食虫为主,秋、冬季主要以食草籽为主,常见于中国东北地区,是中国北方地区最常见的雀形目之一。国内关于鸟类的研究主要针对鸟类的代谢产热方面[10–14],如树麻雀肝脏的线粒体呼吸和肝脏、肌肉的细胞色素C氧化酶在夏季明显高于冬季[10]等。目前,对光周期影响白腰朱顶雀脱支酶活性的研究尚少见报道。笔者研究白腰朱顶雀在不同光周期驯化下体质量、基础代谢率和脱支酶活性的变化,以深入了解北方小型鸟类对自然环境的适应策略。
1 材料与方法
1.1材料
1.1.1试验动物
白腰朱顶雀捕自黑龙江省齐齐哈尔市扎龙国家自然保护区(124°37'E至123°47'E ,47°32'N 至46°52'N),于齐齐哈尔大学生命科学与农林学院动物学实验室饲养。白腰朱顶雀自由取食及饮水,适应饲养1周后按体质量随机分为长光组(16 h光照,8 h黑暗)、短光组(8 h光照,16 h黑暗)和对照组(12 h光照,12 h黑暗),每组各8只,组间体质量无明显差异。将各试验组白腰朱顶雀分别置于3个人工光照培养箱中驯化4周,驯化温度25 ℃。
1.1.2主要仪器与试剂
主要仪器:BS210型电子天平(Sartorius公司);TGL–16M台式高速冷冻离心机(HERMLE Z323K Germany);LS–C50L高压灭菌锅(浙江);Μ–6382E超低温冰箱(–86 ℃,Japan);C2000 IKA氧弹量热仪(Germany);封闭式流体压力呼吸仪(北京师范大学司南仪器厂);723N可见分光光度计(上海精密科学仪器有限公司);GZP–250A智能光照培养箱(南京红龙仪器设备厂);250D数显光照培养箱(江苏省金坛市荣华仪器制造有限公司)。
主要试剂:1%支链淀粉溶液;乙酸钠缓冲溶液(pH为6.0,0.5 mol/L);0.01 mol/L的稀碘液;氢氧化钾溶液;二氧化硅。
1.2测定指标及方法
1.2.1体质量及器官质量的测定
体质量和各器官组织鲜质量、干质量用电子天平测量,精确到0.01 g。驯化试验开始后分别测定3组白腰朱顶雀的体质量(下文称为“初始体质量”);驯化试验结束时测定3组白腰朱顶雀的体质量及主要器官质量。
1.2.2基础代谢率的测定
采用封闭式流体压力呼吸仪测定白腰朱顶雀的基础代谢率,水浴温度控制在25 ℃,呼吸室体积为3.6 L,用氢氧化钾溶液和二氧化硅来吸收呼吸室内的二氧化碳和水,每隔3 d测1次基础代谢率。测量前先将白腰朱顶雀禁食4 h,称取体质量,单只放入铁丝制成的代谢笼内,使其保持静止状态,然后将其放入呼吸室内适应30 min,待白腰朱顶雀呼吸稳定后开始测量,每隔5 min记录1次,连续测定1 h,选取比较稳定的2个连续的最低值计算基础代谢率,共测定1 h的耗氧量[7]。基础代谢率的测定在18:00—24:00和人工光照培养箱的无光照时段进行。
1.2.3脱支酶活性的测定
测定脱支酶活性的最适温度为50 ℃,最适pH为6.0,最适底物浓度为1%。于300 μL 1%支链淀粉溶液和100 μL的上清酶液中加入100 μL乙酸钠缓冲溶液(pH为6.0,0.5 mol/L),在50 ℃水浴中反应1 h,取出100 μL反应液,加入2.5 mL 0.01 mol/L的稀碘液后迅速放入分光光度计测定值(620 nm),以未反应的酶液和底物混合物作为空白对照。在最适条件下作用1 h,将每1 min生成的支链淀粉在620 nm处光密度值增加0.01的酶活定义为一个酶活单位[15]。
1.2.4摄入热量值的测定
用全收粪法[16]测定白腰朱顶雀在一定期间内食入饲料物质的质量与粪便中排出物质的质量。记录动物在某阶段的饲料采食量和全部排粪量,对饲料和粪便进行热量测定。摄入能=摄入干物质质量×食物热值;粪便能=粪便干质量×粪便热值;消化能=摄入能-粪便能。
1.2.5体脂质量分数的测定
体脂质量分数的测定采取索氏抽提法[17]。体脂质量分数=(胴体干质量-抽提后不含体脂的胴体干质量)/个体体质量。
1.3数据分析
用SPSS软件进行数据统计分析。体质量、器官质量、基础代谢率、体脂质量分数、脱支酶活性均采用一元方差检测组间差异;驯化因素对体质量、热量值、基础代谢率等的影响采用SPSS软件多重比较LSD进行分析。
2 结果与分析
2.1各处理白腰朱顶雀的体质量和体脂质量分数及器官质量
驯化开始时,3组白腰朱顶雀的体质量间无明显差异,随着驯化时间的延长,3组白腰朱顶雀体质量均呈上升趋势,驯化至第2周时长光组与短光组间的差异极显著(0.01);短光组白腰朱顶雀的体质量在驯化3~4周大幅度增加,在第4周驯化结束时比初始体质量增加1.69 g,与长光组、对照组间的差异极显著(0.01);长光组和对照组白腰朱顶雀在第4周驯化结束后体质量增加不明显,与初始体质量相比分别增加0.87、0.80 g(表1)。
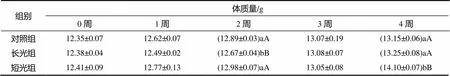
表1 各处理白腰朱顶雀的体质量
数据后字母表示组间差异分析结果(<0.05)。
短光组、长光组、对照组白腰朱顶雀的体脂质量分数分别为12.82%、8.90%、10.63%,短光组和长光组与对照组间的差异极显著(0.01),短光组与长光组间的差异极显著(0.01)。
由表2可见,短光组白腰朱顶雀心脏、肝脏、肾脏、脾脏的鲜质量总体均略高于长光组;短光组白腰朱顶雀的消化道鲜质量、干质量与长光组间的均存在显著性差异(0.05);长光组白腰朱顶雀肺干质量显著大于短光组的(0.05)。

表2 各处理白腰朱顶雀器官的鲜质量和干质量

组别 干质量/mg 心脏胃肺肾脏消化道肝脏胰脏脾脏肌肉 对照组77.29±2.48137.66±2.2556.03±1.4437.53±1.35(286.11±7.27)aA166.34±3.3129.86±0.8825.64±0.13(1285.38±8.07)aA 长光组74.38±1.60138.55±1.7758.36±0.9037.22±2.02(174.33±3.21)bB168.53±1.1530.31±2.3325.34±0.25(1195.52±3.97)aA 短光组75.19±2.48142.66±0.9045.54±1.3138.01±0.66(284.63±1.99)aA173.28±1.5629.13±0.9927.66±1.10(1401.23±9.76)bB
表中同列数据后的字母表示差异显著(0.05)或极显著(0.01)。
2.2各处理白腰朱顶雀的基础代谢率和消化能
在光周期驯化过程中,光周期的长短对基础代谢率有显著的影响,随着驯化时间的延长,短光组白腰朱顶雀的基础代谢率在驯化2~4周逐渐升高,在第4周驯化结束时达到最大值,与第1周相比升高0.60 mL/(g·h),与对照组间的差异显著(0.05);长光组白腰朱顶雀的基础代谢率升高幅度不明显,长光组驯化0~2周的基础代谢率大幅增加,在第4周驯化结束时达到最大值,与第1周相比增加0.35 mL/(g·h)(表3)。
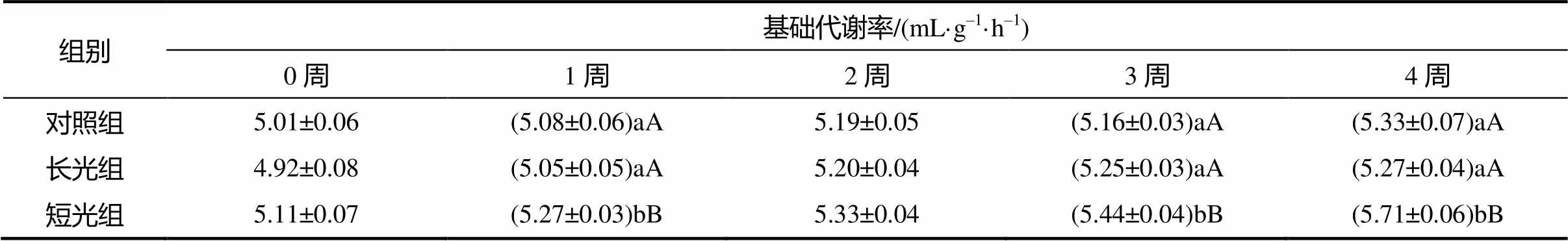
表3 各处理白腰朱顶雀的基础代谢率
表中同列数据后的字母表示差异显著(0.05)或极显著(0.01)。
短光组白腰朱顶雀的消化能随着驯化时间的延长而降低,而长光组白腰朱顶雀的消化能随着驯化时间的延长而升高。长光组、短光组、对照组白腰朱顶雀的消化能分别为76.06、53.35、51.37 kJ/g。长光组白腰朱顶雀的消化能与对照组、短光组间的差异极显著(0.01)。长光组白腰朱顶雀的消化能比短光组、对照组分别高22.71、24.69 kJ/g。
2.3各处理白腰朱顶雀的脱支酶活性
由表4可见,长光组白腰朱顶雀肌肉中脱支酶活性与对照组间的差异无统计学意义(0.05),短光组白腰朱顶雀肌肉中的脱支酶活性与长光组、对照组间的差异极显著(0.01);长光组白腰朱顶雀肝脏中的脱支酶活性与对照组间的差异无统计学意义(0.05),短光组白腰朱顶雀肝脏中脱支酶活性与长光组、对照组间的差异极显著(0.01)。

表4 各处理白腰朱顶雀的脱支酶活性
表中同列数据后的字母表示差异显著(0.05)或极显著(0.01)。
3 结论与讨论
光周期是影响鸟类能量代谢及产热能力的重要因素。体质量取决于能量收支平衡,其变化反映出动物随环境变化的适应性调节,对动物的生理、形态等都有重要影响[18–20]。短光组白腰朱顶雀的体质量驯化后较驯化前增加1.69 g,表明白腰朱顶雀通过增加体质量的方式使其体表面积比相对减少,自身的热传导降低,体热散失减少。随着体质量的增加,体脂质量分数和基础代谢率也相应提高[21–24],短光照条件下白腰朱顶雀摄入的能量不足以维持能量需求,只能通过储存大量的内源性脂肪为正常的基础代谢供能。代谢器官质量较小的改变会对基础代谢率产生较大的影响[25–27]。短光组白腰朱顶雀体质量比长光组的高,其心脏、消化道、肝脏、肾脏及脾脏的质量均高于长光组的,表明白腰朱顶雀的基础代谢率与肝脏、心脏等内部器官有一定的相关性。这与柳劲松等[28]的研究结论相一致。动物在环境压力影响下通过增加摄食量及消化速率、加大消化道容量或延长滞留时间来满足能量代谢需求[29–30]。消化速率增加,肝脏的代谢活动也会增强。本研究中短光组白腰朱顶雀的肝脏质量高于长光组的。这与张国凯等[12]关于白头鹎代谢率与器官质量在季节驯化中的可塑性变化研究结果相一致。光周期刺激能引起消化道发生增生反应,其质量的增加必然引起基础代谢率水平的提高[29]。短光组白腰朱顶雀的消化道鲜质量高于长光组的,但短光组白腰朱顶雀的消化能显著低于长光组的,表明消化道是食物消化吸收的主要场所,其质量和活性对维持能量平衡有重要作用。
鸟类的消化酶活力随季节的变化而变化,并直接影响动物对营养物质的吸收利用。短光组白腰朱顶雀肝脏和肌肉中的脱支酶活性比长光组的高,其原因可能是短光组白腰朱顶雀消化道鲜质量的增加提高了消化系统对营养物质的吸收,间接影响了脱支酶的活性,进而在食物中获得了较多能量。糖原作为能量的储存形式,在动物体内用以保持能量平衡,其分解主要是由磷酸化酶与脱支酶协同进行。脱支酶活性的高低与糖原含量与分解速率有关[31]。白腰朱顶雀肝脏中的脱支酶活性比肌肉中的高,其原因可能是肝糖原可直接分解供能,而肌糖原需要转化为肝糖原后才能分解供能。短光组白腰朱顶雀肝脏中的脱支酶活性比对照组、长光组的高,可能是随着驯化时间的延长,肝糖原不足以维持机体所需的能量,肌糖原经过机体内一系列反应再参与供能。这与徐兴军等[32]关于温度对麻雀肝糖原和肌糖原含量影响的研究结果一致。
总之,在季节性环境变化中,光周期是影响白腰朱顶雀产热特征改变的主要环境因子之一,其中短光照较长光照更能引起白腰朱顶雀能量代谢的变化。在短光照条件下,白腰朱顶雀通过提高肝脏和肌肉组织中脱支酶的活性和增加体质量、基础代谢率来应对短光照的影响,这些适应机制是北方小型鸟类应对短光照环境条件的生存策略之一。
参考文献:
[1] Bromage N,Porter M,Randall C.The environmental regulation of maturation in farmed finfish with special reference to the role of photoperiod and melatonin [J].Aquaculture,2001,197(1):63–98.DOI:10.1016/s0044–8486(01)00583–x.
[2] Boon P,Visser GH,Daan S.Effect of photoperiod on body weight gain,and daily energy intake and energy expenditure in Japanese quail (japonica)[J]. Physiol Behav,2000,70(3/4):249–260.DOI:10.1016/s0031–9384(00)00257–2.
[3] Pravosudov V V,Clayton N S.Effects of demanding foraging conditions on cache retrieval accuracy in food-caching mountain chickadees ()[J]. Proceedings of the Royal Society B:Biological Sciences,2001,268(1465):363–368.DOI:10.1098/rspb.2000.1401.
[4] 杨志宏,邵淑丽,柳劲松.树麻雀代谢率和器官重量在光周期驯化中的变化[J].四川动物,2009,28(4):513–516.
[5] 倪小英,林琳,周菲菲,等.光周期对白头鹎体重、器官重量和能量代谢的影响[J].生态学报,2011,31(6):1703–1713.
[6] 李庆芬,黄晨西.光周期和温度对布氏田鼠产热的影响[J].动物学报,1995,41(4):362–369.
[7] 徐兴军,邵淑丽,张伟伟,等.饥饿条件下麻雀体内糖原含量和基础代谢率的变化[J].江苏农业科学,2012,40(11):348–350.DOI:10.3969/j.issn.1002–1302. 2012.11.139.
[8] Narahara E,Makino Y,Omichi K.Glycogen debranching enzyme in bovine brain[J].J Biochem,2001,130(3):465–470.DOI:10.1093/oxfordjournals.jbchem.a003007.
[9] Duan X,Wu J.Advances in studying microbial GH13 starch debranching enzyme:a review[J].Acta microbiologica Sinica,2013,53(7):648–656.
[10] 柳劲松,李铭,邵淑丽.树麻雀肝脏和肌肉产热特征的季节性变化[J].动物学报,2008,54(5):777–784.
[11] Liknes E T,Scott S M,Swanson D L.Seasonal acclimatization in the American goldfinch revisited: to what extent do metabolic rates vary seasonally? [J].The Condor,2002,104(3):548.DOI:10.1650/0010– 5422(2002)104[0548: saitag] 2.0.co;2.
[12] 张国凯,方媛媛,姜雪华,等.白头鹎的代谢率与器官重量在季节驯化中的可塑性变化[J].动物学杂志,2008,43(4):13–19.DOI:10.3969/j.issn.0250–3263.2008. 04.003.
[13] 郑蔚虹,方媛媛,姜雪华,等.白头鹎肝脏和肌肉冬夏两季的代谢产热特征比较[J].动物学研究,2010,31(3):319–327.DOI:10.3724/SP.J.1141.2010.03319.
[14] Montgomery M K,Hulbert A J,Buttemer WA. Metabolic rate and membrane fatty acid composition in birds:a comparison between long-living parrots and short-living fowl[J].J Comp Physiol B,Biochem Syst Environ Physiol,2012,182(1):127–137.DOI:10.1007/s00360–011–0603–1.
[15] 王有祥,徐兴军,邵淑丽,等.温度驯化对白腰朱顶雀脱支酶活性的影响[J].东北林业大学学报,2015,43(9):107–110,120.DOI:10.3969/j.issn.1000–5382. 2015.09.022.
[16] 汪诗平,李永宏.放牧率和放牧时期对绵羊排粪量、采食量和干物质消化率关系的影响[J].动物营养学报,1997,9(1):47–54.
[17] Mansour I AL-Mansour.Seasonal variation in basal metabolic rate and body composition within individual sanderling bird calidris alba[J].Journal of Biological Sciences,2004(4):564–567.DOI:10.3923/jbs.2004.564.567.
[18] Haim A,Zisapel N.Daily rhythms of nonshivering thermogenesis in common spiny miceunder short and long photoperiods[J].Journal of Thermal Biology,1999,24(5):455–459.DOI:10.1016/s0306–4565(99)00055–8.
[19] Génin F,Perret M.Photoperiod-induced changes in energy balance in gray mouse lemurs[J].Physiol Behav,2000,71(3/4):315–321.DOI:10.1016/s0031–9384(00)00335–8.
[20] 赵志军,陈竞峰,王德华.光周期和高脂食物对布氏田鼠能量代谢和产热的影响[J].动物学报,2008,54(4):576–589.
[21] Cooper S J,Swanson D L.Seasonal acclimatization of thermoregulation in the black-capped chickadee[J]. The Condor,1994,96(3):638–646.DOI:10.2307/1369467.
[22] Rintamäkt P T,Stone J R,Lundberg A.Seasonal and diurnal body-mass fluctuations for two nonhoarding species of parus in sweden modeled using path analysis[J].Auk,2003,120(3):658.DOI:10.1642/0004–8038(2003)120[0658:sadbff]2.0.co;2.
[23] Mcnab B K,Kmcnab B.Ecological factors influence energetics in the Order Carnivora[J].Acta Zoologica Sinica,2005,51(4):535–545.
[24] Liu J S,Li M,Shao S L.Seasonal changes in thermogenic properties of liver and muscle in tree sparrows[J].Acta Entomologica Sinica,2008,51(11):1099–1128.
[25] Williams JB,Tieleman BI.Flexibility in basal metabolic rate and evaporative water loss among hoopoe larks exposed to different environmental temperatures[J]. J Exp Biol,2000,203(Pt 20):3153–3159.
[26] Zheng WH,Li M,Liu JS,et al.Seasonal acclimatization of metabolism in Eurasian tree sparrows ()[J].Comp Biochem Physiol,Part A Mol Integr Physiol,2008,151(4):519–525.DOI:10.1016/j.cbpa.2008.07.009.
[27] Liu J S,Sun R Y,Wang D H.Thermogenic properties in three rodent species from Northeastern China in summer[J].Journal of Thermal Biology,2006,31(1):172–176.DOI:10.1016/j.jtherbio.2005.11.005.
[28] 柳劲松,王德华,孙儒泳.东北地区黑线仓鼠的代谢产热特征及其体温调节[J].动物学报,2003,49(4):451–457.DOI:10.3969/j.issn.1674–5507.2003.04.005.
[29] Song Z.Maximum energy assimilation rate in brandt’s vole () from inner mongolia grassland[J]. Acta Theriologica Sinica,2001,21(4):271–278.
[30] Daan S,Masman D,Groenewold A.Avian basal metabolic rates:their association with body composition and energy expenditure in nature[J].Am J Physiol,1990,259(2 Pt 2):333–340.
[31] Shen JJ,Chen YT.Molecular characterization of glycogen storage disease type III[J].Curr Mol Med,2002,2(2):167–175.DOI:10.2174/1566524024605752.
[32] 徐兴军,王昌河,张伟伟,等.温度对麻雀肝糖原和肌糖原含量的影响[J].黑龙江畜牧兽医,2013(6):164–166.
Effects of photoperiod on debranching enzyme activity in redpolls
Wang Youxiang1,Xu Xingjun1*,Shao Shuli1,Li Huaiyong2,Wang Weiyu1,Zhang Weiwei1
(1.College of Life Sciences, Agriculture and Forestry, Qiqihar University, Qiqihar,Heilongjiang 161006, China; 2.Department of Radiation Oncology, First Hospital of Qiqihar, Qiqihar,Heilongjiang161000, China)
Four weeks’ domesticationwere selected to test the effects of photoperiod on their body weight, organ mass, basal metabolic rate, body fat mass fraction, debranching enzyme activity and other physiological and biochemical indicators. Three treatments were prepared, they were long light group (12 hours of light and 12 hours of dark), short light group (8 hours of light and 16 hours of dark) and the control group. The results showed that: 1) After domestication,body weight in short light group increased 1.05 g, body mass reached very significant level compared to the control group (0.01), while it did not get great increase in long light group before the1–3 weeks’ acclimatization; 2) Basal metabolic rate in short light group in 2–4 weeks got obvious increase with amount of 0.38 mL/(g·h), while after domestication at 3 weeks, basal metabolic rate in short light group reached very significant level compared to it in long light group (0.01), at the end of 4 weeks of acclimation, it reached very significant level in short light group compared with the long light group (0.01); 3) Debranching enzyme activity in muscle in the short light group reached significant level compared to them in the long light group and control group (0.01), as well as it in liver in the long light group compared to the short light group and control group (0.01); 4)Body fat mass fraction in short light group was higher 2.19% than that in control group, while it was lower 1.73% than that in control group in long light group; body fat mass fraction in short light and long group reached very significant level compared to the control group (0.01), it reached very significant level in the short light group compared to that in the long light group (0.01); 5)Digestible energy in long light group was respective higher 22.71 kJ/g and 24.69 kJ/g than them in short light group and control group, it reached very significant level in long light group compared with it in the short light and control group (0.01); 6)The fresh weight of heart, stomach, kidney and pancrea in short and long light group were not reached very significant level compared them with the control group (>0.05). Photoperiod was one of the main environmental factors affecting the change of thermogenesis at the condition of short light,could adapt itself to the change of photoperiod by improving body weight, basal metabolic rate, debranching enzyme activity in liver and muscle tissues to compensate the energy consumption from a series of physiological and biochemical reactions.
; photoperiod; debranching enzyme; basal metabolic rate; body weight
S865.3+4;Q959.7+39
A
1007-1032(2016)05-0518-06
2015–11–14
2016–04–20
黑龙江省教育厅科学技术研究项目(12541885)
王有祥(1990—),男,黑龙江虎林市人,硕士研究生,主要从事动物生理生态学研究,422645033@qq.com;*通信作者,徐兴军,教授,主要从事动物生理生态学研究,xxj0605@163.com
投稿网址:http://xb.ijournal.cn
责任编辑:王赛群
英文编辑:王库

