烘烤对核桃蛋白二级结构、表面疏水性及乳化性的影响
赵润泽,蒋 将,李进伟,刘元法
(江南大学食品学院,江苏无锡 214122)
烘烤对核桃蛋白二级结构、表面疏水性及乳化性的影响
赵润泽,蒋将,李进伟,刘元法*
(江南大学食品学院,江苏无锡 214122)
研究了烘烤增香过程对核桃蛋白的二级结构、表面疏水性以及乳化性的影响,采用扫描电镜、圆二色谱等仪器进行分析。结果表明,烘烤处理的蛋白微结构成片状,α-螺旋结构从42.7%降低至27.6%,β-转角从17.3%增加到25.3%,无规则卷曲从24.7%增加到32.7%,β折叠比例不变。界面张力从20.98减少为18.49,表面疏水性从316.14降低为297.55。使用turbiscan多重光散射仪对蛋白与三种植物油形成的乳化液进行分析,其中烘烤处理的蛋白与花生油形成乳化液稳定性指数为15.98,与大豆油形成的乳化液稳定性指数为14.53,与葵花籽油形成的乳化液稳定性指数为14.55,相比较于未处理蛋白形成的乳化液稳定性均显著下降。
核桃蛋白,烘烤,二级结构,表面疏水性,乳化稳定性
核桃(JuglansregiaL.)是一种营养丰富、具有经济开发潜力的坚果。核桃除了可直接食用外,还可加工成核桃油、核桃粉等产品。其中核桃仁蛋白质含量在13%~20%[1],其氨基酸种类高达18种,且谷氨酸含量最高。据报道,180 ℃烘烤20 min后的花生蛋白相比于未烘烤的花生蛋白的乳化稳定性有显著提高[2]。此外,大豆蛋白在90 ℃和100 ℃条件下热处理15 min后乳化性迅速升高,乳化稳定性有显著改善,100 ℃处理30 min乳化稳定性达到最大值[3]。工业上为核桃油增香多采用烘烤方法,温度在130 ℃左右,但国内对增香核桃油生产过程中的副产物核桃粕及其烘烤后性质的研究较少。
目前对乳化稳定性分析以观察分层高度和比较吸光值变化为主[4-5]。但是这两种方法检测精确度较低,不能采用定量方法来评价体系的稳定情况。利用近红外发射光谱的背散射光稳定性动力学参数(Stability Index)来研究乳化液的稳定性已经成为一种趋势[6]。
本文采取烘烤对核桃蛋白进行处理,对处理后的表面性状、二级结构、表面张力、表面疏水性进行测定,最后采用turbiscan稳定性分析仪分析核桃蛋白与不同脂肪酸组成的植物油形成的乳化液的性质,并对乳化液2 h内的变化情况做动态分析。研究核桃油加工后的核桃蛋白性质,旨在对核桃资源进行综合利用,提升核桃产品的附加值。
1 材料与方法
1.1材料与仪器
核桃(JuglansregiaL.)购于无锡农贸市场;大豆油、玉米油、花生油购于欧尚超市;乙醇、正己烷、氢氧化钠、盐酸等均为分析纯。
90-1恒温磁力搅拌器上海沪西分析仪器厂;HH-4数显恒温水浴锅常州金坛化学仪器厂;TGL-16B高速台式离心机上海安亭科学仪器厂;UV2100紫外可见分光光度计优尼科中国(上海)公司;PHS-3C pH计上海上海精密科学有限公司;OCA15EC接触角测量仪德国德菲仪器股份有限公司;Quanta-200扫描电子显微镜荷兰FEI公司;MOS-450圆二色光谱仪法国Bio-Logic比奥罗杰公司;turbiscan Lab多重光散射仪法国formulaction公司。
1.2实验方法
1.2.1原料制备
1.2.1.1核桃蛋白制备参照杜蕾蕾[7]等人方法,将去皮核桃仁烘干后粉碎,按照1∶5的料液比进行脱脂处理1 h,用滤纸过滤提取液,收集残渣,将残渣再次进行正己烷处理,直到滤液为无色为止。收集残渣放入通风橱挥干溶剂备用。
1.2.1.2烘烤核桃蛋白制备参照徐月华[8]等人方法,将核桃放入烘箱130 ℃烘烤30 min,然后取出。将核桃仁烘干后粉碎,按照1∶5的料液比进行脱脂处理1 h,用滤纸过滤提取液,收集残渣,将残渣再次进行正己烷处理,直到滤液为无色为止。收集残渣放入通风橱挥干溶剂备用。
1.2.2碱溶酸沉提取蛋白流程脱脂粉→加水溶解(料液比1∶60)调整pH为11→搅拌1 h→离心(10000 r/min,20 min,4 ℃)→上清液→调整pH为4.5→搅拌1 h→离心(10000 r/min,20 min,4 ℃)→沉淀→水洗至中性→冻干→得到纯度为94.8%的核桃蛋白和91.2%的烘烤核桃蛋白。
1.2.3扫描电镜观察参照张海华[9]等人方法,将处理过的核桃蛋白样品在干燥器保存15 d后,取少量样品过100 目筛,将筛过的样品用1%的OsO4固定1 h,以SCD-005离子溅射仪喷金,最后用扫描电子显微镜拍照。
1.2.4二级结构测定参照Sreerama[10]等人方法,样品溶于去离子水中,在25 ℃条件下磁力搅拌3 h,之后在4 ℃以10000×g离心45 min,上清液中蛋白浓度采用BCA试剂盒测定,最后将上清液蛋白浓度稀释至50 μg/mL。在25 ℃条件下,采用MOS-450圆二色光谱仪测定样品得到远紫外CD光谱(190~250 nm)。空白采用去离子水,用平均摩尔椭圆率[θ](deg cm2·dmol-1)表示。
1.2.5蛋白表面张力测定参照Azioune[11]等人方法,将蛋白质溶于水中,用pH7的磷酸缓冲盐溶液制成0.1%蛋白质溶液。在20 ℃的条件下,使用OCA15EC接触角测量仪以50 μL/s速度将蛋白质溶液注入大豆油中,在溶液液滴完整掉落时测定油水界面张力。
1.2.6蛋白表面疏水性测定参照Kato[12]等人的方法,配制2%的蛋白溶液,用0.01 mol/L的磷酸盐缓冲溶液(pH=7.4)将其分别稀释至0.5、0.25、0.1、0.05、0.02、0.005 mg/mL。取4 mL稀释液,加入50 μL的ANS溶液后,用荧光分光光度计在365 nm的激发波长和484 nm的发射波长下测定样品的荧光强度,以荧光强度对蛋白质浓度作图,外推至蛋白质浓度为0,曲线斜率即为蛋白质分子的表面疏水性指数。
1.2.7蛋白乳化稳定性
1.2.7.1乳化液的制备将质量百分比1%核桃蛋白溶液和10%植物油用高速剪切机在13500 r/min转速下剪切2 min,再将乳状液用高压均质机在40 MPa压力下均质两次
1.2.7.2乳化稳定性测量将乳液加至样品瓶中刻度线位置,放入turbiscan Lab多重光散射仪中,使用近红外光(λ=880 nm)从样品瓶底部开始扫描,经中部到顶部扫描一次。设置扫描间隔30 s,扫描时长2 h,温度30 ℃。得到不同时间乳化液背散射光强度曲线图,根据计算机软件计算稳定性指数(Stability Index)。稳定性指数(Stability Index)由turbiscan软件基于从样品瓶底部到顶部共41 mm高度,共2 h时间内背散射光数据变化自动计算,数值越低表明乳化液稳定性越好[13]。
1.2.8分析方法所有实验进行3次平行实验,利用SPSS Statistics 18.0软件对实验结果进行统计分析。采用Tukey’s检验进行显著性分析。
2 结果与讨论
2.1扫描电镜观察
通过扫描电镜(SEM)观察蛋白质的微观结构如图1所示。可以观察到烘烤工艺对核桃蛋白微结构的影响。未处理蛋白显示出比较稀松的结构,烘烤后蛋白呈现片状结构。当蛋白质经加热处理后,其高级结构会发生去折叠,为避免暴露出疏水基团,蛋白质分子间会发生疏水聚集引发表面结构出现变化[14]。有研究表明,蛋白质微结构不同,对物理化学结构和功能性会产生一定影响。其中稀松状结构蛋白体积密度相比于片状结构较小,有助于提高溶解性和乳化稳定性。

图1 扫描电镜观察图片Fig.1 SEM picture of walnut protein
2.2二级结构测定

表1 核桃蛋白CD光谱二级结构分析
注:不同组之间字母不相同者表示组间显著性差异,p<0.05;表2同。
核桃蛋白CD光谱二级结构分析如表1所示。通过软件分析得到,核桃蛋白主要以α-螺旋结构和无规则卷曲为主,分别占42.7%和24.7%。通过烘烤后,在制备过程中改变了核桃蛋白的二级结构,在一定程度上破坏了α-螺旋结构,使得无规则卷曲有所上升。可以推断烘烤处理后破坏了蛋白质分子的氢键,使得α-螺旋结构减少,β-转角和无规则卷曲结构大量增加,从而增大蛋白质分子的柔性,对乳化稳定性有明显影响。
2.3界面张力
核桃蛋白界面张力变化如表2所示。相比未处理蛋白,经过烘烤处理后蛋白质的界面张力有一定变化,根据研究结果表明,界面张力下降源于聚集体变化,高级结构展开使蛋白界面上亲水基团和疏水基团数量趋于平衡。通过改性,有助于形成较为稳定的乳化液。

表2 核桃蛋白表面疏水性和油水界面张力
2.4表面疏水性
蛋白质一般在分子内部形成疏水内核为非极性氨基酸侧链,在表面的亲水环境中分布的为极性氨基酸。表面疏水性比整体的疏水性而言影响着蛋白质分子间的相互作用,对蛋白质功能性有影响。表面疏水性如表2所示,烘烤处理蛋白质(297.55)表面疏水性相比要未处理蛋白(316.14)略有降低,可见在制备过程中疏水相互作用引起的亚基之间相互聚合,导致疏水性下降。可见烘烤处理在一定程度上降低了表面疏水性。一般情况下,表面疏水性降低不利于提高乳状液稳定性[15]。
2.5乳化稳定性
图2~图9为乳化稳定性变化分析结果。背散射光数据是从底部到液面顶部共41 mm扫描结果。两条曲线代表起始两个时间点对整个样品瓶共41 mm的背散射光数据。背散射光强下降,说明该位置乳化液油滴浓度下降,背散射光强上升,说明该位置乳化液油滴浓度上升,背散射光强不变,说明该位置乳化液油滴浓度保持不变。
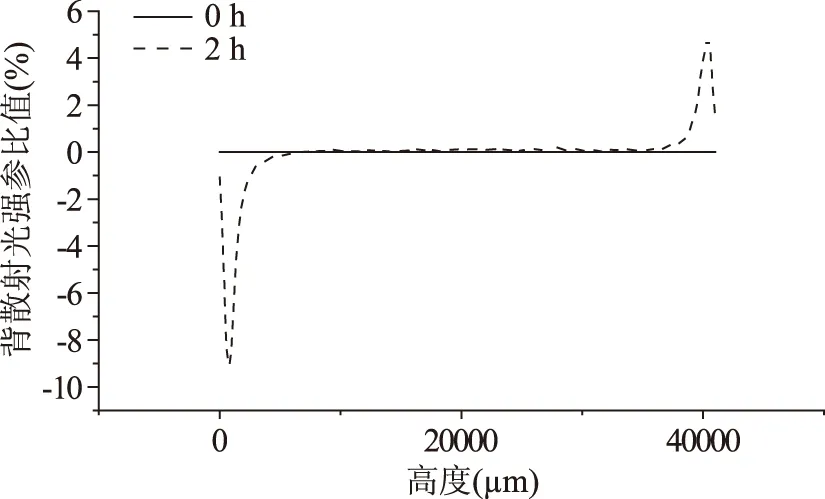
图2 未处理蛋白与花生油形成乳化液背散射光分析Fig.2 Back scattered light of untreatedwalnut protein with peanut oil emulsion

图3 未处理蛋白与大豆油形成乳化液背散射光分析Fig.3 Back scattered light of untreatedwalnut protein with soybean oil emulsion

图4 未处理蛋白与葵花籽油形成乳化液背散射光分析Fig.4 Back scattered light of untreatedwalnut protein with sunflower oil emulsion
由图2~图4可见,未处理蛋白与花生油、葵花籽油形成的乳化液在底部0~5 mm处有油滴浓度下降,在顶部35~41 mm处有油滴浓度上升,在中间油滴浓度保持相对稳定;未处理蛋白与大豆油形成的乳化液有剧烈分层现象,在位置24 mm左右有明显油滴浓度分界线,在24 mm以下油滴浓度下降剧烈,相比较于0 h时间点背散射光下降达到10%,在24 mm以上油滴浓度上升,相比较于0 h背散射光上升达到6%。
由图5~图7可见,烘烤蛋白与三种油形成的乳化液均有分层现象。其中烘烤蛋白与花生油、葵花籽油形成的乳化液,在20 mm附近有明显油滴浓度分界线,在20 mm以下,相比较于0 h时间点背散射光下降均超过30%;与大豆油形成乳化液在17 mm有油滴浓度分界线,但是背散射光下降最大值也达到30%。

图5 烘烤蛋白与花生油形成乳化液背散射光分析Fig.5 Back scattered light of heated walnut protein with peanut oil emulsion

图6 烘烤蛋白与大豆油形成乳化液背散射光分析Fig.6 Back scattered light of heated walnut protein with soybean oil emulsion
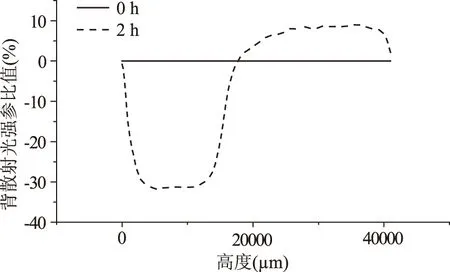
图7 烘烤蛋白与葵花籽油形成乳化液背散射光分析Fig.7 Back scattered light of heated walnut protein with sunflower oil emulsion
由图8和图9可见,未处理蛋白与三种植物油形成的乳化液均比烘烤处理蛋白与三种植物油形成的乳化液稳定,所有乳化液均随着时间变化稳定性逐渐降低。

图8 未处理蛋白与三种油形成乳化液稳定性分析Fig.8 The curves of emulsion stability of untreated walnut protein different oil
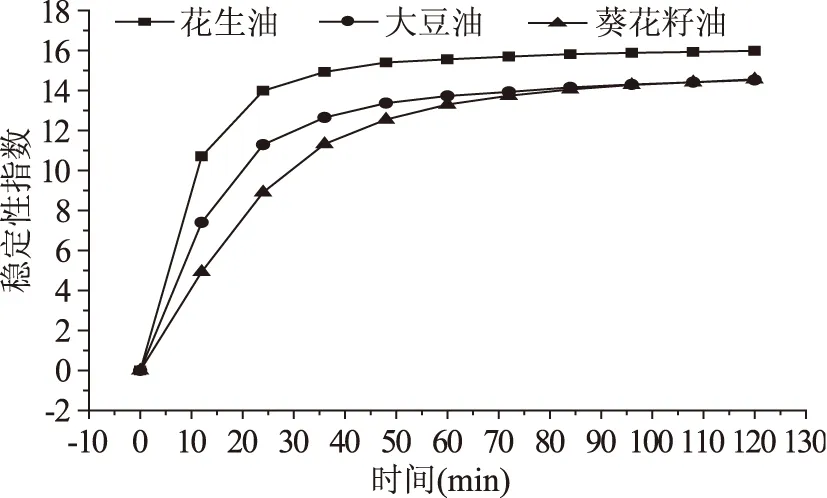
图9 烘烤蛋白与三种油形成乳化液稳定性分析Fig.9 The curves of emulsion stability of heated walnut protein different oil
未处理蛋白与三种植物油形成的乳化液中,与大豆油形成的乳化液在前30 min稳定性指数呈直线上升趋势,最终稳定性指数达到7.5,相比其他两种乳化液,与大豆油形成的乳化液最不稳定。烘烤蛋白与三种植物油形成的乳化液稳定性有很大下降,三种乳化液稳定性指数在40 min前迅速上升,在2 h时均超过13。背散射光强与稳定性指数呈正比例变化,背散射光强变化越大,稳定性指数越大,与文献报道一致[16]。烘烤处理的蛋白与花生油形成乳化液稳定性指数为15.98,与大豆油形成的乳化液测量终点稳定性指数为14.53,与葵花籽油形成的乳化液测量终点稳定性指数为14.55。
不同植物油对乳化液的稳定性有显著影响,有研究表明,植物油的种类对乳化液稳定性有显著影响[16]。可能是与不饱和脂肪酸的结构有关,不饱和脂肪酸不饱和程度越高,蛋白质氨基酸的疏水部分能够更好的与油滴表面结合形成稳定的界面膜[17]。实验选用的植物油脂肪酸组成如表3所示。未处理蛋白与葵花籽油、大豆油形成的乳化液相对稳定,大豆油乳化液最不稳定。烘烤处理蛋白与三种植物油形成的乳化液相比于未处理蛋白与三种植物油形成的乳化液不稳定程度增加,并且有明显的油滴浓度分界线。可能原因是烘烤后微结构成片状,亚基聚合,溶解性和乳化性下降,所以引起乳化液稳定性下降。

表3 植物油脂肪酸组成(%)
3 结论
烘烤对核桃蛋白的微结构有较大影响,烘烤核桃蛋白微结构呈现片状,二级结构中α-螺旋结构减少,β-转角和无规则卷曲结构大量增加,界面张力也有所下降,烘烤对核桃蛋白表面疏水性影响变化不明显。不同植物油对乳化液稳定性有显著影响,未处理蛋白与葵花籽油、花生油形成的乳化液相对稳定。烘烤处理蛋白与三种植物油稳定性均很差,没有明显差别。其中烘烤处理的蛋白与花生油形成乳化液稳定性指数为15.98,与大豆油形成的乳化液稳定性指数为14.53,与葵花籽油形成的乳化液稳定性指数为14.55。
[1]杜蕾蕾. 冷榨核桃制备核桃油和核桃蛋白的研究[D]. 武汉:武汉工业学院,2009.
[2]Jamdar S N,Rajalakshmi V,Pednekar M D,et al. Influence of degree of hydrolysis on functional properties,antioxidant activity and ACE inhibitory activity of peanut protein hydrolysate[J]. Food Chemistry,2010,121(1):178-184.
[3]郭凤仙,熊幼翎,何志勇,等. 热处理对大豆分离蛋白功能特性的影响[J]. 食品与机械,2009(6):9-11.
[4]毛晓英. 核桃蛋白质的结构表征及其制品的改性研究[D]. 无锡:江南大学,2012.
[5]Molina E,Papadopoulou A,Ledward D A. Emulsifying properties of high pressure treated soy protein isolate and 7S and 11S globulins[J]. Food Hydrocolloids,2001,15(3):263-269.

[7]杜蕾蕾,郭涛,万辉,等. 核桃蛋白的分离纯化及功能性质的研究[J]. 中国油脂,2009(5):21-24.
[8]徐月华,蒋将,孟宗,等. 烘烤条件对核桃油品质的影响[J]. 中国油脂,2014,39(7):9-12.
[9]张海华,朱科学,周惠明. 超声波对小麦面筋蛋白结构的影响[J]. 中国农业科学,2010,43(22):4687-4693.
[10]Sreerama N,Woody R W. Estimation of protein secondary structure from circular dichroism spectra:comparison of CONTIN,SELCON,and CDSSTR methods with an expanded reference set[J]. Analytical Biochemistry,2000,287(2):252-260.
[11]Azioune A,Chehimi M M,Miksa B,et al. Hydrophobic protein-polypyrrole interactions:The role of van der Waals and Lewis acid-base forces as determined by contact angle measurements[J]. Langmuir,2002,18(4):1150-1156.
[12]Kato A,Nakai S. Hydrophobicity determined by a fluorescence probe method and its correlation with surface properties of proteins[J]. Biochimica et Biophysica Acta(BBA)-Protein Structure,1980,624(1):13-20.
[13]张强,陈颖,付文静,等. TURBISCAN LAB 稳定性分析仪研究农药 WDG 悬浮液稳定性[J]. 光谱学与光谱分析,2008,28(4):843-846.
[14]王金梅. 大豆蛋白热聚集行为及界面,乳化性质研究[D].广州:华南理工大学,2012.
[15]Graham D E,Phillips M C. The conformation of proteins at the air-water interface and their role in stabilizing foams[J]. Foams,1976,12(32):237-255.
[17]朱波,蒋将,李进伟,等. 三种不同脂肪酸组成的油脂乳化液的理化性质研究[J]. 食品工业科技,2013,34(14):103-107.
Influence of roast processing on secondary structure,surface hydrophobicity and emulsifying properties of walnut protein
ZHAO Run-ze,JIANG Jiang,LI Jin-wei,LIU Yuan-fa*
(School of Science and Technology,Jiangnan University,Wuxi 214122,China)
The properties of roasted walnut proteins were investigated in this study. The micro-structure observed by SEM were turned from vesicular to flaky. The amount ofα-helix conformation of roasted protein was reduced from 42.7% to 27.6%,the amount ofβ-turn was increased from 17.3% to 25.3%,the amount of random coil was increased from 24.7% to 32.7%,the amount ofβ-pleated sheet was not changed. The interfacial tension was declined from 20.98 to 18.49,the surface hydrophobicity was declined from 316.14 to 297.55.Three kinds of vegetable oil and toasted protein were emulsified. The stability index of peanut oil was 15.98,the soybean oil was 14.53,the sunflower seed oil was 14.55.
walnut protein;roasted;secondary structure;surface hydrophobicity;emulsifying properties
2016-01-22
赵润泽(1989-),男,硕士研究生,研究方向:油脂与植物蛋白,E-mail:peter1989046@sina.com。
刘元法(1974-),男,博士,教授,研究方向:油脂营养与安全,E-mail:yfliu@jiangnan.edu.cn。
高油高蛋白油料水酶法制油(2013AA102103-1);粮食公益性行业科研专项(201313011-7-3)。
TS225.1
A
1002-0306(2016)16-0157-05
10.13386/j.issn1002-0306.2016.16.023

