溶藻弧菌胱硫醚-β-合成酶基因cbs的克隆、生物学信息分析及原核表达
陈树河,常云胜,刘晖晖,周 维,丁 燏
(广东海洋大学水产学院 // 广东省水产经济动物病原生物学及流行病学重点实验室,广东 湛江 524088)
溶藻弧菌胱硫醚-β-合成酶基因cbs的克隆、生物学信息分析及原核表达
陈树河,常云胜,刘晖晖,周 维,丁 燏
(广东海洋大学水产学院 // 广东省水产经济动物病原生物学及流行病学重点实验室,广东 湛江 524088)
提取溶藻弧菌(Vibrio alginolyticus)的总DNA,克隆溶藻弧菌胱硫醚-β-合成酶基因cbs,对其进行生物信息学分析。结果表明,所克隆溶藻弧菌cbs基因的开放阅读框为1 095 bp,编码364个氨基酸。氨基酸序列比对发现,溶藻弧菌的CBS蛋白与其他弧菌的CBS相似性极高,与副溶血弧菌(V.parahaemolyticus)CBS氨基酸序列相似性达98%;CBS蛋白质的二级结构为典型的“α+β”折叠模式,无跨膜结构及信号肽。构建cbs基因表达载体(pGEX-cbs)以表达重组蛋白,结果显示,cbs基因在大肠杆菌BL21中高效表达,可表达出分子质量约为66.4 ku的融合蛋白。对表达条件进行优化,发现在37℃、IPTG浓度0.6mmol/L的条件下诱导5 h后,CBS蛋白的表达量较多,该蛋白主要以包涵体形式存在。
溶藻弧菌;胱硫醚-β-合成酶;基因克隆;生物学信息分析;原核表达
溶藻弧菌(Vibrio alginolyticus)隶属于弧菌科弧菌属,可引起人类和水产养殖动物患病[1-2]。溶藻弧菌病的暴发对鱼、虾及贝类等水产养殖动物危害极大[3-5],给水产养殖业所造成的损失难以估量。目前,水产养殖上主要使用抗生素防治溶藻弧菌病。然而,抗生素的长期使用可增加耐药菌的出现频率,导致抗生素抑菌效果明显下降甚至消失[6]。在弧菌对抗抗生素的过程中,抗氧化系统发挥着重要的作用。研究发现,H2S作为信号分子,在植物抗环境胁迫[7]、动物促炎[8]等方面有独特功能,在细菌抗氧化过程中有重要作用[9]。Qabazard等[10]研究发现,H2S在上调秀丽隐杆线虫(Caenorhabditis elegans)抗氧化基因表达的同时,亦可能维持其呼吸链复合体Ⅱ的活性,从而调节其氧化系统以对抗农药的毒害,延长寿命。对细菌而言,内源性H2S亦可提高超氧物歧化酶(Superoxide dismutase,SOD)等抗氧化酶活力,从而提高其抗氧化能力,减轻抗生素的毒害[9]。
除植物外,在生物细胞中内源性H2S的生成有两支途径。一支是由胱硫醚-β-合成酶(cystathionine-β-synthase,CBS)和胱硫醚-γ-裂解酶(cystathionine-γ-lyase,CSE)直接以半胱氨酸等含硫氨基酸为底物生成 H2S,另一支则是半胱氨酸经半胱氨酸转氨酶转氨作用生成 3-巯基丙酮酸后,再由 3-巯基丙酮酸硫基转移酶(3-MST)进一步催化生成H2S。CBS、CSE和3-MST均为磷酸吡哆醛依赖酶,在动物体内的分布具有组织特异性[11-16],在细菌中也不同时存在[9]。CBS在微生物细胞中可参与含硫氨基酸的生理代谢[17]和H2S的生物合成,提高微生物抗环境胁迫能力。目前在溶藻弧菌中仅发现编码CBS蛋白的基因,推断该酶在弧菌抵抗抗生素过程中发挥着不可替代的作用。因此,分析溶藻弧菌的CBS蛋白,对进一步阐明H2S在溶藻弧菌抗氧化系统中的作用与地位有重要意义。
本研究克隆溶藻弧菌 cbs基因,并运用生物信息学方法对其所编码的蛋白进行序列分析和结构预测,同时构建cbs基因大肠杆菌BL21重组表达菌株,对CBS蛋白的表达条件进行优化,这将有助于了解弧菌的抗氧化机制,为水产病害的防治提供理论依据。
1 材料与方法
1.1 材料
1.1.1 菌株 溶藻弧菌(Vibrio alginolyticus HY9901)强毒株分离自湛江市海域的患病红笛鲷伤口处,经分子生物学鉴定后由广东省水产经济动物病原生物学及流行病学重点实验室(下称“本实验室”)保存[18],Escherichia coli DH5α和E.coli BL21购自全式金公司。
1.1.2 质粒 克隆质粒pMD18-T购自TaKaRa公司,表达质粒pGEX-6p-1由本实验室保存。
1.1.3 主要试剂 细菌基因组取试剂盒购自全式金公司,DNA凝胶回收纯化试剂盒购自Thermo公司,PCR引物由上海生工合成,T4连接酶、BamHI和XhoI购自TaKaRa公司。
1.2 方法
1.2.1 溶藻弧菌总DNA的提取 溶藻弧菌在TSA培养基于28℃的摇床中培养10 h,按照细菌基因组提取试剂盒说明书提取溶藻弧菌的总 DNA,于- 20℃条件下保存。
1.2.2 cbs基因的克隆 从GenBank中下载溶藻弧菌cbs基因序列(登录号WP_005389952.1),设计引物cbs(s)(5' -CGGGATCCATGTGTACTGACC ACAATTG-3')和cbs(a)(5' -CCGCTCGAGTTA AGCGTTAGTTGAGCCGC-3'),下划线部分分别为BamHI和XhoI酶切位点。以溶藻弧菌总DNA为模板扩增cbs基因,扩增程序:94℃ 4 min;94℃ 40 s,56℃ 40 s,72℃ 1.5 min,35循环;72℃ 10 min。扩增产物经10 mg/mL的琼脂糖凝胶电泳检测后,回收,于- 20℃条件下保存。
1.2.3 pMD18-cbs克隆载体的构建 连接成功后转化至E.coli DH5α感受态细胞中,将转化产物涂布于Amp+的LB琼脂平板,37℃条件下培养8 h。挑单菌落,接种于Amp+的LB液体培养基中,于摇床中以37℃、200 r/min条件培养0.5~1.0 h,经菌落PCR检测,将阳性菌送生工生物工程股份有限公司广州分公司测序。
1.2.4 pGEX-cbs表达载体的构建 经测序确认序列正确后,分别提取质粒pGEX-6p-1和pMD18-cbs,经BamHI和XhoI双酶切后用T4DNA连接酶将酶切的 pGEX-6p-1和目的片段重组,构建重组质粒pGEX-cbs,转化至E.coli BL21感受态细胞,参照1.2.3的步骤,将阳性菌送测。
1.2.5 pGEX-cbs重组质粒的诱导表达 将含有pGEX-cbs表达载体的大肠杆菌 BL21接种于Amp+的LB液体培养基中,在37℃的摇床200 r/min扩培至D(600 nm)值达0.4~0.6时加入IPTG,使其终浓度为1mmol/L,继续培养4 h。菌体预处理后全菌蛋白后经 SDS-PAGE分析。以含空载质粒pGEX-6p-1的 E.coli BL21作为空白组,同时从IPTG浓度、时间和温度3个方面优化胱硫醚-β-合成酶的表达条件。
1.2.5.1 最佳诱导浓度的确定 在其他培养条件一致的前提下,IPTG诱导浓度分别为0.1、0.2、0.4、0.6、0.8、1.0mmol/L,菌体预处理后进行SDS-PAGE分析。
1.2.5.2 最佳诱导时间的确定 在最佳诱导浓度条件下,其他培养条件保持一致,分别诱导1、2、3、4、5、6、7 h,菌体预处理后进行SDS-PAGE分析。
1.2.5.3 最佳诱导温度的确定 在最佳诱导浓度和诱导时间条件下,分别在 16、29、37℃下诱导培养,收集菌体后超声波破碎至菌液澄清,离心收集上清和沉淀采用SDS-PAGE进行分析。
2 结果与分析
2.1 cbs基因的克隆
PCR扩增后经琼脂糖凝胶电泳检测出约1 200 bp的条带(图1:A),连接pMD18-T克隆载体后转化至大肠杆菌DH5α感受态中,挑单菌落进行菌落PCR得到与其大小一致的条带(图1:B)。
2.2 CBS蛋白的生物信息学分析
2.2.1 CBS蛋白的理化性质 用 NCBⅠ上的 ORF Finder(http://www.ncbi.nlm.nih.Gov/gorf/gorf.html)分析cbs基因序列,发现该基因包含长度为1 095 bp的开放阅读框(ORF),可编码364个氨基酸(图2)。在ExPASy(http://web.expasy.Org/compute_pi/)网站上对溶藻弧菌HY9901的CBS蛋白进行分析,显示原子总数为5 629,理论分子质量为40.410 ku,蛋白质分子式为C1788H2787N491O548S15,理论等电点为 5.65,在大肠杆菌中表达的半衰期大于 10 h,脂肪指数(Aliphatic index)为81.76,亲水性平均值(GRAVY)为-0.304,不稳定指数 [instability index(ⅠⅠ) ]为39.63。此外,该蛋白中正(Arg+Lys)、负(Asp+Glu)电荷氨基酸残基数分别为37 和 45,使得整个蛋白分子对外呈酸性。
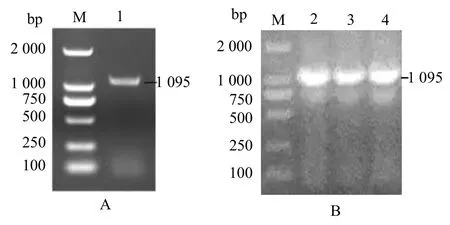
图1 cbs基因克隆及菌落PCR产物Fig.1 Cloning and identification PCR of cbs gene
2.2.2 与其他弧菌的CBS蛋白序列同源性分析通过 Blast(http://blast.ncbi.nlm.nih.Gov/Blast.cgi)对溶藻弧菌的 CBS蛋白序列与副溶血弧菌(V.parahaemolyticus)、哈维氏弧菌(V.harveyi)、创伤弧菌(V.vulnificus)、灿烂弧菌(V.splendidus)、霍乱弧菌(V.cholerae)等进行同源性对比,结果显示,其同源性分别为98%、94%、89%、83%、80%,表明 CBS蛋白在弧菌中高度保守(图 3)。运用MEGA 6.0软件将各弧菌及其他细菌的CBS蛋白氨基酸序列以NJ法构建的构建系统进化树,结果显示果溶藻弧菌 HY9901与副溶血弧菌(Vibrio parahaemolyticus)聚为一支,表明两种弧菌间的亲缘关系最为接近(图4)。

图3 藻弧菌CBS氨基酸序列与其他细菌的同源性比较Fig.3 Homology comparing of amino acid sequences of CBS protein among the bacteria
2.2.3 CBS蛋白的功能位点、亲疏水性、跨膜区和亚细胞定位预测 经 SoftBerry-Psite(http://linux1.softberry.com/berry.phtml?topic=psite&group=programs&subgroup=proloc)预测,CBS蛋白含有4个蛋白激酶C磷酸化位点、5个酪蛋白激酶II磷酸化位点和1个酪氨酸激酶磷酸化位点等10个磷酸化位点,此外还具有N-糖基化位点、酰胺化位点、内质网靶信号位点和Prenyl group binding site(CAAX box)各1个(图2)。由ProtScale(http://web.expasy.org/protscale/)预测的CBS蛋白亲疏水性结果(图5)可知,CBS蛋白质序列的第99个氨基酸分值最高达2.522,表明该处疏水性最强,第304个氨基酸分值最低达 - 2.411,表明该处亲水性最强。由图5可知,整个CBS蛋白序列的亲水氨基酸残基数目从整体上大于疏水氨基酸残基数目,且该蛋白的亲水区集中分布在第106~337位氨基酸间,表明CBS蛋白为可溶性蛋白,与ExPASy的亲水性预测一致。经 TMHMM Server 2.0(http://www.cbs.dtu.dk/services/TMHMM/)预测发现,该蛋白不存在跨膜区(图6)。利用SignalP 4.0 Server(http://www.cbs.dtu.dk/services/SignalP-4.0/)对CBS蛋白进行信号肽序列预测,发现剪切位置分值C、信号肽分值S和综合值Y均在0~0.2之间,大大低于0.5的阈值,说明其无明显的信号肽切割位点,表明该蛋白不属于分泌型蛋白(图 7)。用 PSORT II Prediction(http://psort.hgc.jp/form.html)对CBS蛋白进行亚细胞定位预测,结果显示,该蛋白仅分布于细菌细胞质中,可能性为38.1%,这与该蛋白不存在跨膜区和不属于分泌型蛋白的预测结果相互印证。
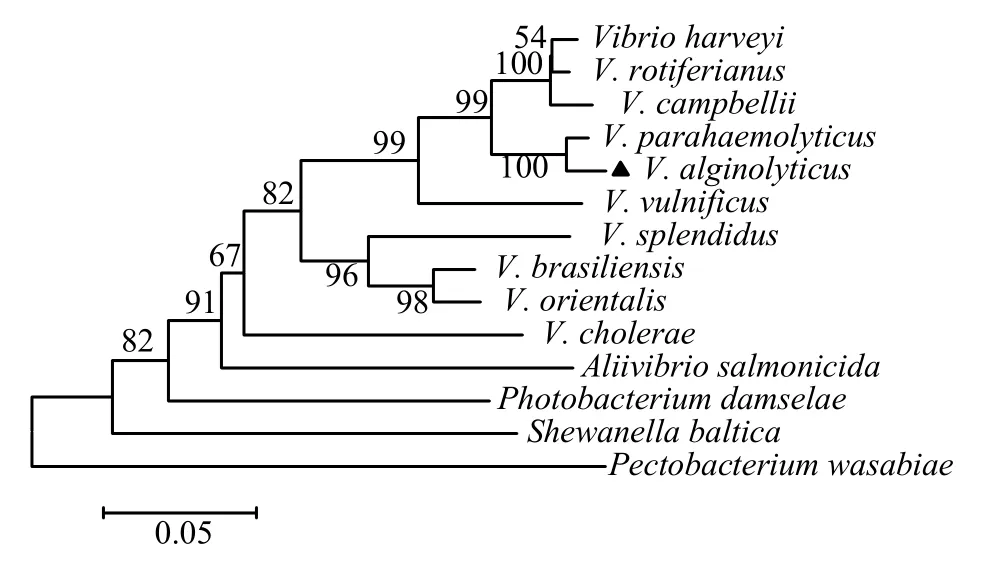
图4 邻接法构建的CBS氨基酸序列系统进化树Fig.4 Hylogenetic tree of amino acid sequence of CBS protein by neighbour-joining method
2.2.4 CBS蛋白质的功能域及高级结构的预测在NCBI保守结构域数据库CDD(http://www.ncbi.nlm.nih.gov/Structure/lexington/lexington.cgi)网站上分析该蛋白序列中的功能结构域(图8),结果均发现第23~336位存在Trp-synth-beta-II superfamily的保守结构域。经SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=/NPSA/npsa_sopma.html)预测,CBS蛋白中的二级结构中存在由140个氨基酸组成α螺旋(Alpha helix)、66个 氨 基 酸组成伸展片段(Extended strand)、40个氨基酸组成β转角(Beta turn)、118个氨基酸组成无规则卷曲(Random coil),分别占CBS蛋白序列的 38.46%、18.13%、10.99%、32.42%(图9)。以SWISS-MODEL网站(http://swissmodel.expasy.org/)对CBS蛋白进行同源建模后,得到 CBS三级结构。结果显示,CBS结构比较复杂,且与果蝇(Drosophila)的CBS蛋白A链有着极其相似的构型(图10)。
2.3 原核表达
cbs基因在IPTG诱导下,表达出约66.4 ku的融合蛋白,其中 pGEX-6p-1表达的标签蛋白约为26 ku,则CBS蛋白的分子质量为40.4 ku,与所预测的分子质量相一致。空白组未发现融合蛋白的条带,说明表达载体的构建及原核表达成功(图11)。
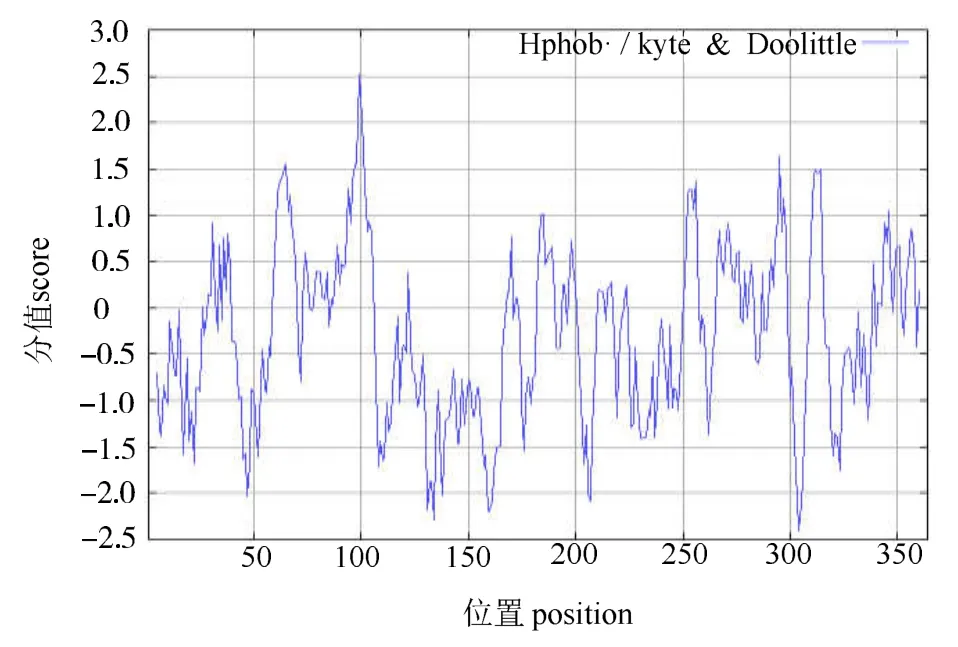
图5 CBS蛋白亲疏水性预测Fig.5 Predicted hydrophobicity of CBS protein
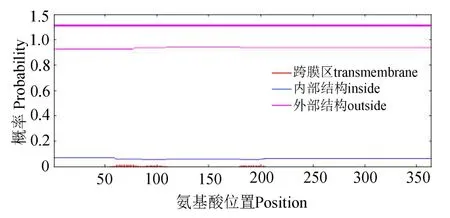
图6 溶藻弧菌CBS蛋白质跨膜结构预测Fig.6 TMHs prediction of CBS protein in Vibrio alginolyticus HY9901
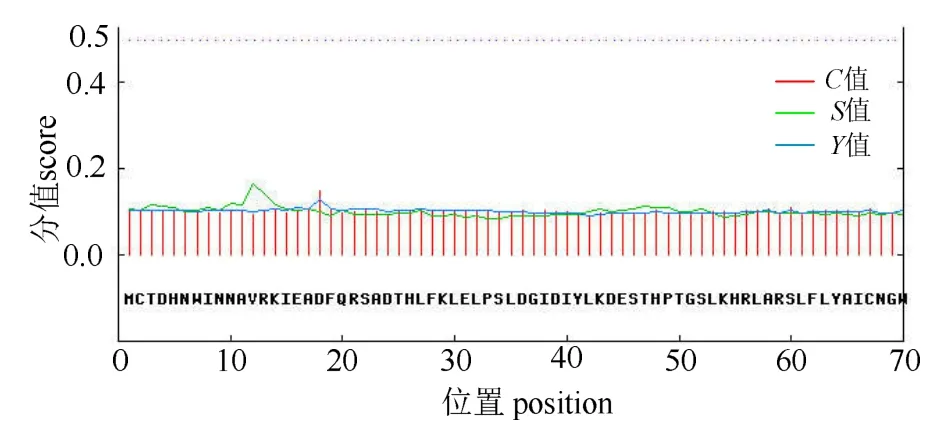
图7 溶藻弧菌CBS蛋白质的信号肽/序列预测Fig.7 TMHs prediction of CBS protein in V.alginolyticus
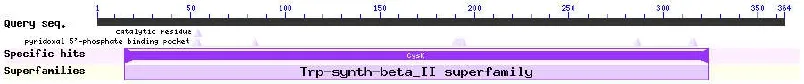
图8 预测的CBS蛋白保守结构域Fig.8 Conserved domain prediction of CBS protein
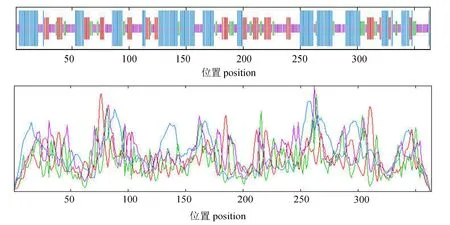
图9 溶藻弧菌CBS蛋白质对应的二级结构Fig.9 Secondary structure prediction domains of CBS protein in Vibrio alginolyticus HY9901
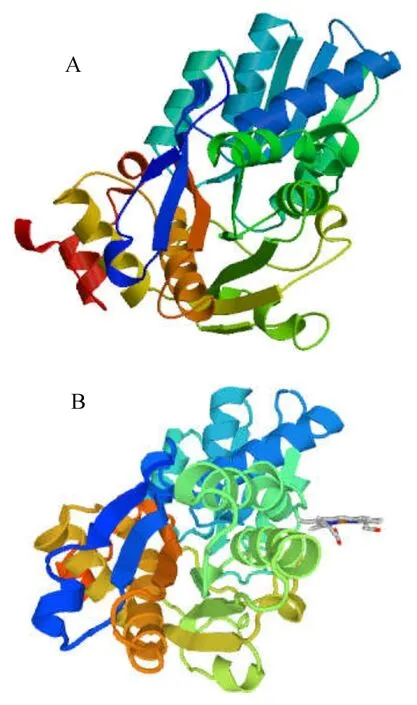
图10 溶藻弧菌(A)、果蝇(B) CBS的三级结构Fig.10 Three-dimensional structure of CBS in Vibrio alginolyticus(A) and Drosophila(B)
图12可知,IPTG浓度0~1.0mmol/L时,cbs表达量先增加后回落,0.6mmol/L时表达量最高(图12);在最佳诱导浓度条件下,诱导5 h后CBS的表达量达到最大(图 13);在最佳诱导浓度和诱导时间条件下,CBS的最适诱导温度为37℃(图14)。
在最佳的IPTG浓度、时间条件下诱导CBS表达,发现在 16、29、37℃诱导时沉淀和上清中均有融合蛋白条带,但在3个温度下上清液的融合蛋白条带均不明显,在 29、37℃条件下诱导时沉淀中有较明显蛋白条带,且 37℃条件下诱导时沉淀中蛋白条带最亮,说明CBS蛋白在这2个温度下表达时以包涵体形式存在于E.coli 中(图14)。
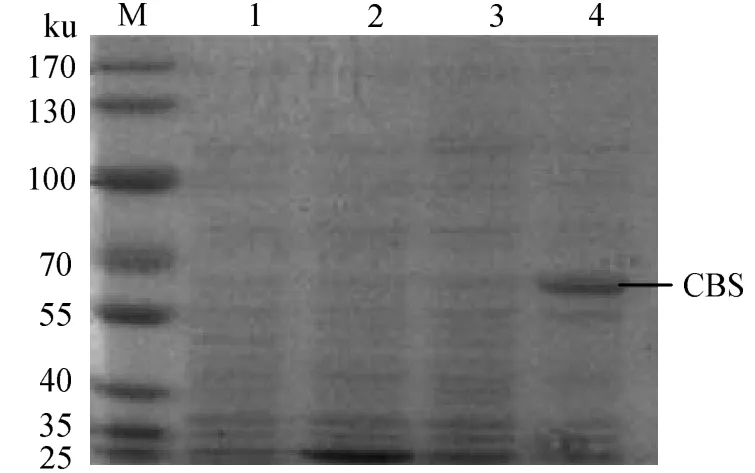
图11 CBS原核表达分析Fig.11 Analysis of CBS prokaryotic expression
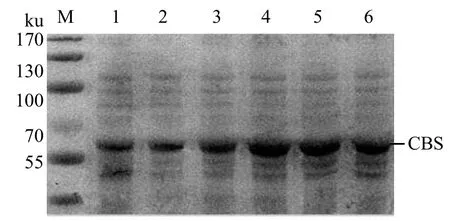
图12 IPTG诱导浓度的优化Fig.12 Optimization of induction concentration

图13 IPTG诱导时间的优化Fig.13 The optimization of induction time
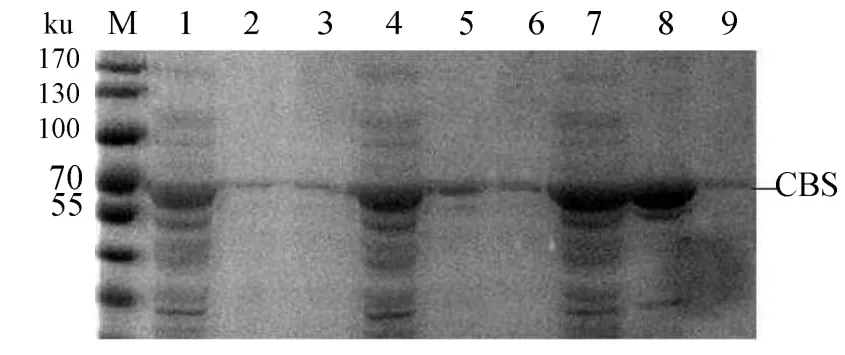
图14 IPTG诱导温度的优化以及沉淀和上清中蛋白含量的比较Fig.14 Optimization of induction temperature and comparison of protein concentration between the precipitation and the supernatant
3 讨论
3.1 溶藻弧菌CBS蛋白的生物信息学分析
CBS蛋白作为合成H2S的酶类,可催化信号分子的形成,在生物机体的硫代谢过程中扮演着重要的角色。本研究以NCBI 网站上所公布的cbs基因序列为模版设计特异性引物,扩增得1 095 bp的cbs基因序列,可编码含364个氨基酸的CBS蛋白。比对各弧菌CBS蛋白的氨基酸序列,发现CBS蛋白在弧菌中高度相似,说明该蛋白在弧菌进化历程中比较稳定,可能与弧菌适应环境有关。基于 CBS的氨基酸序列构建系统进化树表明,各弧菌聚为一大族,其中溶藻弧菌HY9901与副溶血弧菌(Vibrio parahaemolyticus)聚为同一亚族,表明它们之间亲缘关系较近,这与形态学和生化特征分类结果基本一致。根据氨基酸序列比对结果,推测CBS蛋白可能作为弧菌属的共同抗原,在弧菌致病过程中发挥着作用。
本研究发现,CBS蛋白含有4个蛋白激酶C磷酸化位点、5个酪蛋白激酶II磷酸化位点和1个酪氨酸激酶磷酸化位点等多个磷酸化位点,此外还具有N-糖基化位点、酰胺化位点、内质网靶信号位点和Prenyl group binding site(CAAX box) 各1个。磷酸化是生物最为常见的蛋白翻译后修饰[19-20],可提高蛋白作用的专一性的效率。虽然溶藻弧菌中缺乏对翻译后蛋白深加工的内质网和高尔基体,无法进行翻译后糖基化位或酰胺化等修饰,但其蛋白质的磷酸化修饰并不受此影响[21],这为CBS在合成内源性H2S的生理过程中提供精确的调控。在后续的研究中,可以通过构建磷酸化位点缺失的突变株来对CBS蛋白进行更为详尽的功能分析。进一步分析发现,该蛋白为可溶性蛋白,不存在跨膜区,亦无明显的信号肽切割位点,说明该蛋白仅在细胞周质中发挥生理作用,这与亚细胞定位预测结果相吻合,但目前并无直接证据表明CBS蛋白与溶藻弧菌的致病性无关。
本研究预测,CBS蛋白的二级结构含有由140个氨基酸组成的α螺旋(Alpha helix)和40个氨基酸组成的β转角(Beta turn),这符合“α+β”的折叠模式[22]。该二级结构进一步折叠成介于二级和三级结构的Trp-synth-beta-II superfamily(色氨酸合成酶β-II超家族)的保守结构域。色氨酸合成酶可以L-半胱氨酸和吲哚为原料合成L-色氨酸[23],这表明CBS蛋白可作为多功能酶在H2S生成量过高时通过消耗L-半胱氨酸含量以下调H2S的生物合成,从而防止细胞过度抗氧化。从CBS的三级结构可发现,该蛋白的三级结构与果蝇的CBS蛋白A链极为相似,说明其在微生物和动物的进化历程中极其保守,推测溶藻弧菌与果蝇的CBS蛋白可能来自相同的远古基因。
3.2 溶藻弧菌cbs 基因的原核表达
目的基因在大肠杆菌中的表达主要受诱导物浓度、诱导时间和诱导温度等因素影响。IPTG虽可诱导CBS蛋白的表达,但其本身有一定毒性[24],诱导物浓度过高反而抑制蛋白的表达,使目的蛋白的表达水平随诱导物浓度增加呈现先上升后下降的趋势,在诱导物浓度0.6mmol/L时CBS蛋白表达量最大。虽然IPTG可在菌体中稳定存在并持续诱导启动子的转录,但基因表达水平存在相应的阈值,到达这一阈值后,基因转录会受到负反馈调节[25]。随着表达蛋白的积累,蛋白的表达水平受到调控[26],诱导5 h后CBS蛋白表达量不再增加。对大肠杆菌而言,其最适生长温度接近37℃[27]。本研究中,在该温度下CBS蛋白表达量最大,且以包涵体形式存在。王利群等[28]研究表明,较低温度更利于大肠杆菌(DE3)增加目的蛋白的可溶性,可能与低温环境下可增加蛋白构象的准确性[29]、促使其疏水和亲水侧链基团正确排布有关,但本研究显示,较低温度下(16、29℃)上清液中目的蛋白含量并不显著增加,说明通过降低温度而增加可溶性蛋白的方法并不适用于所有大肠杆菌。因此,可通过在原核表达过程中使用融合标签[30]、目的蛋白与分子伴侣共表达[31]以及在培养基中加入山梨醇等稳定蛋白三维构象的物质[32]等方法提高可溶性蛋白产量,便于后续的回收和纯化。
4 小 结
本研究克隆出溶藻弧菌cbs基因。生物信息学分析显示,溶藻弧菌的 CBS 蛋白序列与各种细菌的相似性较高,其三级结构与果蝇的CBS蛋白A链相似性极高,表明CBS蛋白在生物的进化历程中极其保守。原核表达结果发现,在37℃、IPTG 浓度0.6mmol/L的条件下诱导5 h目的蛋白的表达量最高,主要以包涵体形式存在。在纯化蛋白时,应注意在溶解包涵体的过程中保持蛋白的生物活性。今后可利用纯化的 CBS蛋白开展相关的免疫抗原研究,以制备高效的弧菌疫苗。
[1]ARDIC N,OZYURT M.Case report:Otitis due to Vibrio alginolyticus[J].Mikrobiyoloji Bulteni,2003,38(1/2):145-148.
[2]LIU P C,LIN J Y,HSIAO P T,et al.Isolation and characterization of pathogenic Vibrio alginolyticus from diseased cobia Rachycentron canadum[J].Journal of Basic Microbiology,2004,44(1):23-28.
[3]陈强,鄢庆枇,马甡.溶藻弧菌致病性研究进展[J].海洋科学,2006,58(8):83-89.
[4]LEE K K,YU S R,CHEN F R,et al.Virulence of Vibrio alginolyticus isolated from diseased tiger prawn,Penaeus monodon[ J].Current Microbiology,1996,32(4):229-231.
[5]LIU P C,CHEN Y C,LEE K K.Pathogenicity of Vibrio alginolyticus isolated from diseased small abalone Haliotis diversicolor supertexta [J].Microbios,2000,104(408):71-77.
[6]OTTAVIANI D,BACCHIOCCHI I,MASINI L,et al.Antimicrobial susceptibility of potentially pathogenic halophilic vibrios isolated from seafood[J].International Journal of Antimicrobial Agents,2001,18(2):135-140.
[7]LI Z G,XIE L R,LI X J.Hydrogen sulfide acts as a downstream signal molecule in salicylic acid-induced heat tolerance in maize(Zea mays L.) seedlings[J].Journal of Plant Physiology,2015,177:121-127.
[8]ZHANG H L,ZHI L,MOOCHHALA S,et al.Hydrogen sulfide acts as an inflammatory mediator in cecal ligation and puncture-induced sepsis in mice by upregulating the production of cytokines and chemokines via NF-κB[J].American Journal of Physiology - Lung Cellular and Molecular Physiology,2007,292(4):L960-L971.
[9]SHATALIN K,SHATALINA E,MIRONOV A,et al.H2S:a universal defense against antibiotics in bacteria[J].Science,2011,334(6058):986-990.
[10]QABAZARD B,LI L,GRUBER J,et al.Hydrogen sulfide is an endogenous regulator of aging in Caenorhabditis elegans[J].Antioxidants & Redox Signaling,2014,20(16):2621-2630.
[11]ETO K,OGASAWARA M,UMEMURA K,et al.Hydrogen sulfide is produced in response to neuronal excitation [J].The Journal of Neuroscience,2002,22(9):3386-3391.
[12]SHIBUYA N,TANAKA M,YOSHIDA M,et al.3-Mercaptopyruvate sulfurtransferase produces hydrogen sulfide and bound sulfane sulfur in the brain[J].Antioxidants & Redox Signaling,2009,11(4):703-714.
[13]HOSOKI R,MATSUKI N,KIMURA H.The possible role of hydrogen sulfide as an endogenous smooth muscle relaxant in synergy with nitric oxide[J].Biochemical and Biophysical Research Communications,1997,237(3):527-531.
[14]ZHAO W M,ZHANG J,LU Y J,et al.The vasorelaxnt effect of H2S as a novel endogenous gaseous KATPchannel opener [J].The EMBO Journal,2001,20(21):6008-6016.
[15]ETO K,KIMURA H.The production of hydrogen sulfide is regulated by testosterone and S-adenosyl-L-methionine in mouse brain[J].Journal of Neurochemistry,2002,83(1):80-86.
[16]石琳,杜军保,卜定方,等.高肺血流量对肺血管结构及胱硫醚-γ-裂解酶基因表达的影响[J].北京大学学报(医学版),2003,35(6):566-570.
[17]LI D Y,JI X S,YU J,et al.PCR based cloning and sequence analysis of the Pichia pastoris cystathionine β synthase gene[J].Acta Biochimica Et Biophysica Sinica,2001,33(6):600-606.
[18]CAI S H,WU Z H,JIAN J C,et al.Cloning and expression of the gene encoding an extracellular alkaline serine protease from Vibrio alginolyticus strain HY9901,the causative agent of vibriosis in Lutjanus erythopterus(Bloch) [J].Journal of Fish Diseases,2007,30(8):493-500.
[19]KIM J H,LEE J,OH B,et al.Prediction of phosphorylation sites using SVMs[J].Bioinformatics,2004,20(17):3179-3184.
[20]TIAN M,CHEN X L,XIONG Q,et al.Phosphoproteomic analysis of protein phosphorylation networks in Tetrahymena thermophila,a model single-celled organism[J].Molecular & Cellular Proteomics,2014,13(2):503-519.
[21]HUNTER T.Signaling—2000 and beyond[J].Cell,2000,100(1):113-127.
[22]MURZIN A G,BRENNER S E,HUBBARD T,et al.SCOP:a structural classification of proteins database for the investigation of sequences and structures[J].Journal of Molecular Biology,1995,247(4):536-540.
[23]NEWTON W A,MORINO Y,SNELL E E.Properties of crystalline tryptophanase[J].Journal of Biological Chemistry,1965,240(3):1211-1218.
[24]ABBAS N,AHMAD A,SHAKOORI A R.Overexpression and purification of PreS region of hepatitis B virus antigenic surface protein adr subtype in Escherichia coli[J].BMB Reports,2007,40(6):1002-1008.
[25]邢欣荣,刘宇博,程智逵,等.组蛋白修饰酶对基因转录的调控[J].生理科学进展,2008,39(4):314-318.
[26]GALPERIN M Y.Diversity of structure and function of response regulator output domains[J].Current Opinion in Microbiology,2010,13(2):150-159.
[27]李向阳,邵卫华,刁恩杰,等.温度、pH、药物对大肠杆菌抑制作用的量热法研究[J].食品科学,2007,28(6):252-255.
[28]王利群,顾雅平,曹利民,等.截短人胱硫醚-β-合成酶的可溶性表达、纯化及活性鉴定[J].华中科技大学学报(医学版),2012,41(6):697-703.
[29]DONOVAN R S,ROBINSON C W,GLICK B R.Review:optimizing inducer and culture conditions for expression of foreign proteins under the control of the lac promoter[J].Journal of Industrial Microbiology,1996,16(3):145-154.
[30]GUO W H,CAO L,JIA Z J,et al.High level soluble production of functional ribonuclease inhibitor in Escherichia coli by fusing it to soluble partners[J].Protein Expression and Purification,2011,77(2):185-192.
[31]STEPHENS L L,SHONHAI A,BLATCH G L.Co-expression of the Plasmodium falciparum molecular chaperone,PfHsp70,improves the heterologous production of the antimalarial drug target GTP cyclohydrolase I,PfGCHI[J].Protein Expression and Purification,2011,77(2):159-165.
[32]李丹,姜新民,严拯宇.荧光光谱法研究山梨醇与牛血清白蛋白的相互作用[J].光谱学与光谱分析,2008(6):1312-1316.
(责任编辑:刘庆颖)
Cloning,Bioinformatics Analysis and Prokaryotic Expression of Cystathionine-β-Synthase Gene cbs from Vibrio alginolyticus
CHEN Shu-he,CHANG Yun-sheng,LIU Hui-hui,ZHOU Wei,DING Yu
(Fisheries College of Guangdong Ocean University // Guangdong Provincial Key Laboratory of Pathogenic Biology and Epidemilogy for Aquatic Economic Animals,Zhanjiang 524088,China)
The cystathionine-β-synthase gene cbs from Vibrio alginolyticus was cloned,and then the CBS protein was analyzed by bioinformatics method.The result shows that the open reading frame(ORF) of gene cbs is 1 095 bp and encodes 364 amino acids.The amino acid sequence alignment shows that there exists the higher homology of the CBS between V.alginolyticus and other Vibrios,with close relations to those of V.parahaemolyticus with about 98% homology.The secondary structure of CBS protein is a typical fold of “α + β” without signal peptide and transmembrane.A prokaryotic expression vector(pGEX-cbs) is constructed to express recombinant protein,and then the gene cbs is expressed highly in the recombinant E.coli BL21,with approximately 66.4 ku exogenous proteins in SDS-PAGE.The optimal induction conditions shows that it can achieve higher protein expressions when induced by 0.6mmol/L of IPTG at 37℃ for 5 h.
Vibrio alginolyticus; cystathionine-β-synthase; gene cloning; bioinformatics analysis;prokaryotic expression
Q75
A
1673-9159(2016)03-0020-09
10.3969/j.issn.1673-9159.2016.03.004
2015-01-08
广东省自然科学基金(2014A030313604);广东海洋大学“创新强校工程”项目[Q14196(2013050207)]
陈树河,男,硕士研究生,研究方向为海洋生物学。E-mail:cshgdou@163.com
丁 燏(1971-),男,博士,教授,研究方向为海洋微生物与水产病害,E-mail:dingy@gdou.edu.cn

