饲料中添加褐藻酸寡糖对大菱鲆肠道结构、消化酶活性及表观消化率的影响
潘金露,韩雨哲,霍圃宇,苏 鹏,姜志强
(大连海洋大学 农业部北方海水增养殖重点实验室,辽宁 大连 116023)
饲料中添加褐藻酸寡糖对大菱鲆肠道结构、消化酶活性及表观消化率的影响
潘金露,韩雨哲,霍圃宇,苏 鹏,姜志强
(大连海洋大学 农业部北方海水增养殖重点实验室,辽宁 大连 116023)
在基础饲料中添加质量分数0、0.02%、0.05%、0.20%、0.50%的褐藻酸寡糖,饲喂体质量(17.61±0.16)g的大菱鲆(Scophthalmus maximus L)70 d,研究褐藻酸寡糖对大菱鲆肠道结构、消化酶活性及表观消化率的影响。结果表明:1)褐藻酸寡糖处理组的肠道微绒毛长度与对照组差异无统计学意义(P>0.05),肠道皱襞高度与对照组差异无统计学意义(P>0.05),杯状细胞大于对照组(P < 0.05);2)饲料中添加褐藻酸寡糖对大菱鲆肠道内蛋白酶和淀粉酶活性影响无统计学意义(P>0.05),0.02%和0.05%褐藻酸寡糖实验组中的脂肪酶活性与对照组差异有统计学意义(P <0.05);3)褐藻酸寡糖对饲料干物质消化率、蛋白质消化率以及脂肪消化率影响无统计学意义(P>0.05)。在大菱鲆饲料中添加褐藻酸寡糖可增大肠道杯状细胞,促进肠道脂肪酶活性,但对肠绒毛长度,皱襞高度,淀粉酶、蛋白酶活性,表观消化率无影响。
大菱鲆;褐藻酸寡糖;肠道组织切片;消化酶活性;消化率
水产养殖中抗生素的使用会导致抗药性等问题的产生,因此,研究替代抗生素的饲料添加剂尤为重要[1]。褐藻酸寡糖(Alginate oligosaccharides,AOS)是一种酸性寡糖,由褐藻酸钠降解产生,在陆生动物中应用可以抗肿瘤[2]、保护神经[3]以及抑制病原菌感染[4]。在培养基中添加褐藻酸寡糖可抑制水产动物常见病原菌[5],在饲料中添加褐藻酸寡糖可提高海参的机体免疫力[6]。
大菱鲆(Scophthalmus maximus L.)是我国北方重要的养殖种类,具有肉质鲜美、经济价值高等优点,研究其饲料添加剂有重要意义。王鹏等[7]研究表明,在大菱鲆中的饲料中添加褐藻低聚糖,可显著提高大菱鲆血液中相关免疫酶活性,表明添加褐藻低聚糖可提高大菱鲆的非特异免疫。在大菱鲆饲料中添加糖萜素可以提高消化酶活性以及促进肠绒毛长度。本课题组的前期研究证明,褐藻酸寡糖对大菱鲆生长性能无促进作用,但可提高大菱鲆的非特异性免疫[8]。有关饲料功能性寡糖对大菱鲆消化能力影响的研究仅见郝甜甜等[9]、Hu等[10]报道的饲料糖萜素、水苏糖对大菱鲆消化酶活性、肠道结构影响,本研究探讨不同饲料褐藻酸寡糖水平对大菱鲆消化能力的影响,为褐藻酸寡糖在水产养殖中的应用提供理论依据。
1 材料与方法
1.1 实验设计与饲料
实验用 AOS由中国科学院大连化学物理研究所提供,聚合度2~10,其制备在大连中科格莱克生物科技有限公司生产基地的0.5 t反应釜中进行,底物海藻酸钠经褐藻酸裂解酶酶解,配料罐中加入去离子水,将海藻酸钠溶解在水中,搅拌升温至(45±2.0)℃。加入质量分数0.05%(对底物)的褐藻酸裂解酶制剂,搅拌,于45℃下恒温反应36~48 h。反应液经过滤后,浓缩成褐藻酸寡糖浓缩液(褐藻酸寡糖有效质量分数不少于60%)。在基础饲料中分别添加质量分数 0(对照组)、0.02%、0.05%、0.20%、0.50%的AOS,同时调整微晶纤维素质量分数使饲料总量平衡,配制出5种实验饲料。基础饲料配方见表1。饲料原料过孔径380 μm的筛,用搅拌机(新丰食品机械厂,B10G)搅拌,同时逐渐加入大豆油,混匀后加入400mL的水,搅拌混匀,用制粒机(东南干燥设备有限公司,XL-250)制成粒径1.8、2.0mm的饲料,于40℃烘箱中烘至水分10%,储存于- 20℃冰箱中备用。
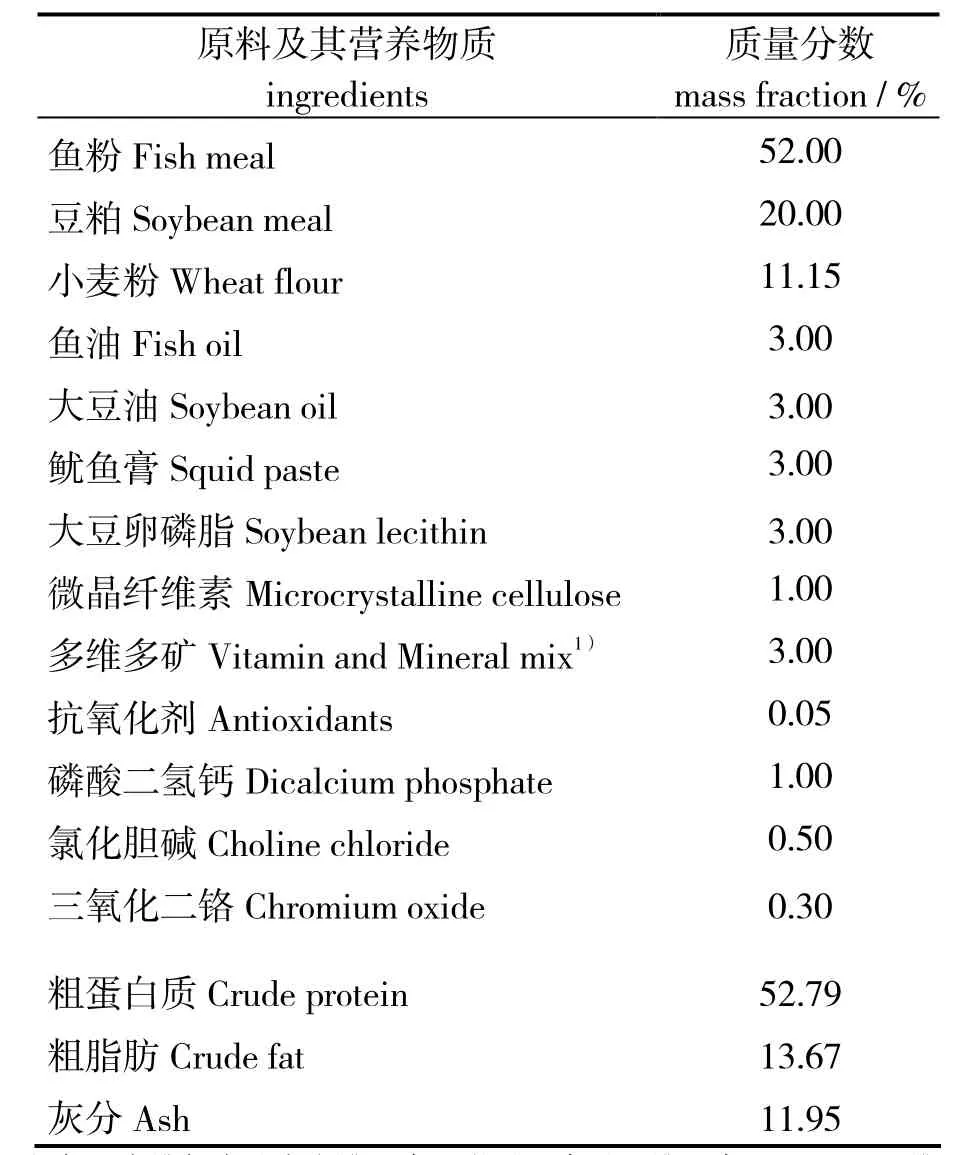
表1 基础饲料配方和营养物质(干物质基础)组成Table 1 Ⅰngredient and chemical composition of the basic diet( dry matter basis)
1.2 实验用鱼与饲养管理
实验大菱鲆幼鱼由大连天正实业有限公司提供,养殖实验在大连海洋大学农业部重点实验室进行。幼鱼于1 t水槽中驯养2周后开始实验。实验前停饲24 h。随机选择初始体质量(17.61±0.16)g的大菱鲆300尾,分为5组,每组3个重复组,每重复组20尾,分别于200 L方形蓝色聚乙烯水槽中饲养70 d。采取静水养殖,整个养殖过程连续充气。每天8:00和16:30饱食投喂,9:00和18:00换水40%~60%。实验期间,水温18~21℃,溶氧 >6 mg/L,pH 8.0~8.5,盐度31~34。
1.3 样品收集
采用指示剂法测定消化率,在每组实验饲料中添加质量分数0.3%的三氧化二铬,饲养1周后,每天7:00和16:00收集粪便,连续收集2周。粪便滤干水分后,放入40℃烘箱中烘干,储存于- 20℃冰箱中用于消化率测定。实验结束后停饲24 h,每水槽随机抽取大菱鲆5尾,于冰盘上剖取全肠,其中1尾鱼全肠用波恩氏液固定,用于肠道组织切片,4尾鱼肠道于- 80℃冰箱保存,用于消化酶测定。
1.4 测定与计算
1.4.1 消化酶的测定 取- 80℃保存的样品于4℃下解冻,称重,以10倍预冷的生理盐水匀浆,在4℃、12 000 r/min条件下离心 30 min,上清液即为 100 mg/mL的酶粗提取液。蛋白酶测定采用福林-酚法[11],在37℃下,每分钟水解酪素产生1 μg酪氨酸为一个酶活力单位。脂肪酶活性采用微乳液法[12],在40℃水浴条件下,每分钟水解脂肪产生1 μmol脂肪酸的酶量为一个国际单位。淀粉酶用AMS测试盒(南京建成生物工程研究所),采用碘-淀粉比色法测定,以组织中每毫克蛋白在 37℃与底物作用30 min,水解10 mg淀粉定义为1个酶活力单位。
1.4.2 消化率的测定 采用三氧化二铬指示剂法测定消化率。
测定日粮中养分消化率的计算公式如下:
饲料干物质消化率Dm= [1 - 饲料Cr2O3/ 粪便Cr2O3]×100%
营养物质消化率Dn= [1 -(粪便营养物质 / 饲料营养物质×饲料Cr2O3/ 粪便Cr2O3)]×100%
1.4.3 肠道组织结构 取固定在波恩氏液中的肠道中段,用石蜡包埋,HE染色,Olympus BX 51型显微镜观察,每张切片选取合适的视野拍照。用Photoshop CS4软件测量肠道微绒毛长度、皱襞高度以及杯状细胞的大小。
1.5 数据处理
采用 SPSS Statistics 19.0 软件对所得数据统计分析。对数据进行单因素方差分析(one-way ANOVA),若组间差异显著,用Tukey法进行多重比较,P < 0.05时,差异有统计学意义。
2 结 果
2.1 褐藻酸寡糖对大菱鲆幼鱼肠道组织结构的影响
图1可见,各组大菱鲆肠道组织结构完整。由表2可知,褐藻酸寡糖添加组中的肠道微绒毛长度以及肠道皱襞高度均与对照组差异无统计学意义(P > 0.05)。褐藻酸寡糖添加组的杯状细胞大于对照组(P < 0.05)。
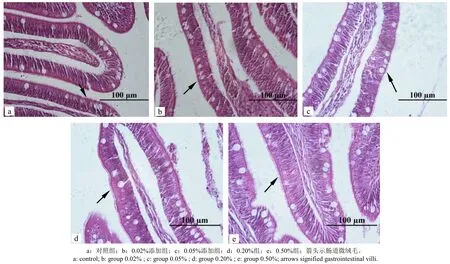
图1 各组大菱鲆肠道微绒毛Fig.1 Gastrointestinal villi structure of juvenile turbot
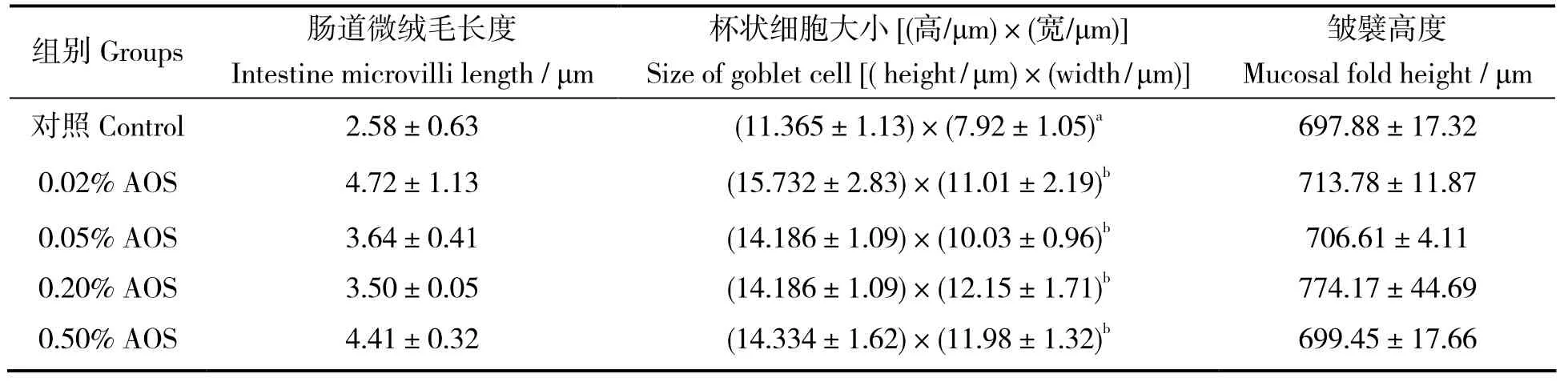
表2 添加不用浓度的褐藻酸寡糖对大菱鲆肠道组织结构的影响Table 2 Effects of AOS distal intestinal structures of turbot
2.2 褐藻酸寡糖对大菱鲆幼鱼肠道的消化酶活性的影响
添加褐藻酸寡糖实验组中的大菱鲆肠道内的蛋白酶和淀粉酶活性均高于对照组,但与对照组相差均无统计学意义(P > 0.05)。0.02%和0.05%褐藻酸寡糖实验组中的脂肪酶活性与对照组,有显著性差异(P < 0.05)。
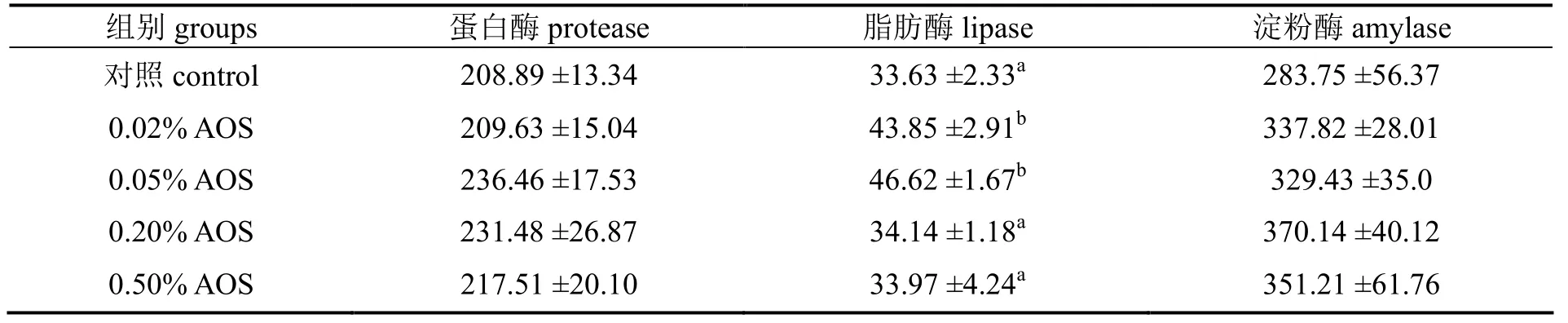
表3 饲料中添加不同浓度的褐藻酸寡糖对大菱鲆幼鱼肠道消化酶活性的影响Table 3 Effects of AOS on the activities of digestive enzymes in turbot intestinal tract U/g
2.3 褐藻酸寡糖对大菱鲆幼鱼饲料表观消化率的影响
由表4可知,各褐藻酸寡糖添加组中,干物质消化率、蛋白质消化率以及脂肪消化率与对照组差异均无统计学意义(P > 0.05)。
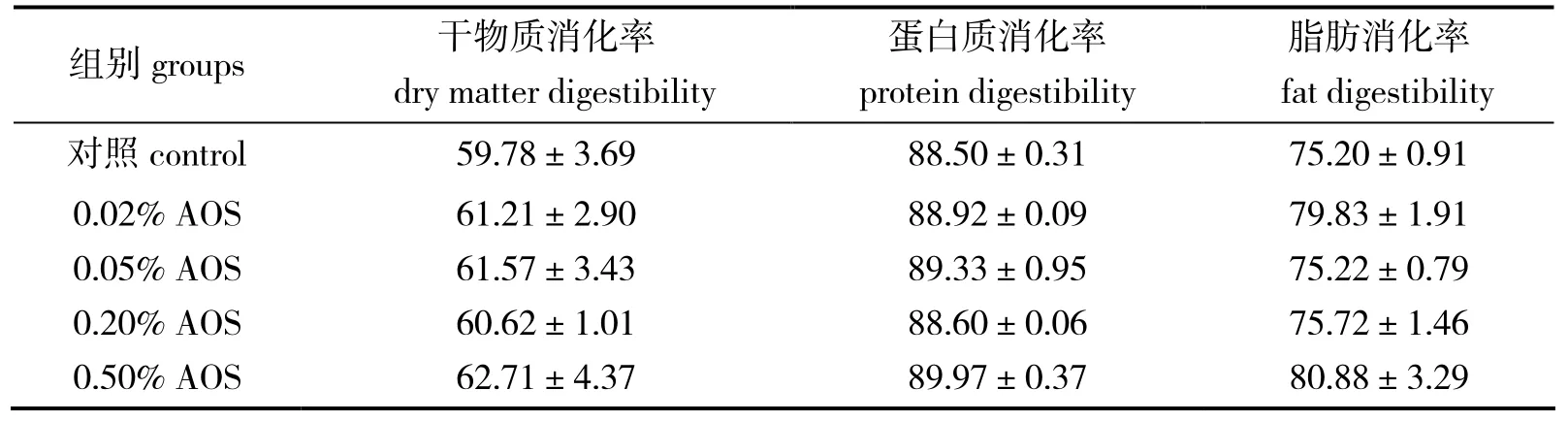
表4 饲料中添加不同浓度褐藻酸寡糖对大菱鲆表观消化率Table 4 Effects of dietary AOS levels on the apparent digestibility of turbot %
3 讨 论
3.1 褐藻酸寡糖对大菱鲆肠道组织结构的影响
微绒毛和皱襞是肠道吸收营养物质的重要部位,杯状细胞是分泌消化酶的重要场所[13]37-38,肠道中的皱襞高度、微绒毛长度和杯状细胞的大小决定肠道吸收营养物质的面积,进而决定其吸收营养物质的能力。有研究表明,在动物饲料中添加寡糖可刺激肠道微绒毛、皱襞的增长以及肠道皱壁上的杯状细胞变大[14-18],进而促进消化酶的分泌和对营养物质的吸收。Zhou等[17]报道,在饲料中分别添加质量分数0.10%的果寡糖和甘露寡糖可显著提高眼斑拟石首鱼(Sciaenops ocellatus)肠微绒毛的高度。Salze等[15]研究发现,在军曹鱼(Rachycentron canadum)饲料中添加甘露寡糖,可显著提高小肠微绒毛的高度。Dimitroglou 等[16]在虹鳟(Oncorhynchus mykiss)的研究中亦有类似结果。但 Pryor等[17]墨西哥湾鲟(Acipenser oxyrinchus desotoi)饲料中添加甘露寡糖时,肠道微绒毛的高度与对照组差异无统计学意义,本研究表明,饲料中添加寡糖对大菱鲆肠道微绒毛无明显的作用,与文献[17]结果类似,这是由于不同鱼种对寡糖的敏感度不同。肠道褶皱的杯状细胞大小可直接影响消化酶的分泌,本研究中,添加褐藻酸寡糖实验组的杯状细胞均大于对照组(P < 0.05),表明褐藻酸寡糖的添加可增大杯状细胞,促进消化酶的分泌。
3.2 褐藻酸寡糖对大菱鲆肠道消化酶活性的影响
消化酶是动物消化利用饲料的首要工具[19],其活性大小反映机体的消化生理特征,提高消化酶活性可促进机体对营养物质的吸收和利用[20]。Sang等[21]在蓝魔虾[Cherax destructor Clark(1936)]饲料中添加质量分数0.40%的甘露寡糖可显著提高蛋白酶的活性,肖明松等[22]在鲤(Cyprinus carpio)饲料中添加质量分数0.13%的果寡糖亦可提高消化酶活性。Liang等[23]在浅纹尖塘鳢(Oxyeleoris lineolatus)饲料中添加果寡糖显著提高肠道消化酶活性;相反,Maritza等[24]在眼斑拟石首鱼和杂交条纹鲈(Morone chrysops × M.saxatilis)饲料中分别添加复合寡糖和单独寡糖,对两种鱼肠道中的消化酶活性影响无统计学意义。本研究中,0.02%和0.05%褐藻酸寡糖添加组的肠道内脂肪酶活性高于对照组,这与杯状细胞增大结果相符;然而,在实验组中大菱鲆肠道蛋白酶和淀粉酶的活性与对照组差异无统计学意义,可能是由于肠道中的消化酶部分是来源于胰液和胃液[13]43,也可能与肠道内微生态环境有关[25]。
3.3 褐藻酸寡糖对大菱鲆饲料表观消化率的影响
鱼类对饲料原料消化能力影响的最直观反映就是干物质消化率高低,干物质消化率高低与饲料原料中的粗纤维、灰分含量以及原料中营养物质吸收程度有关。蛋白质和脂肪是水产动物的重要营养素,其消化率是衡量鱼类利用营养物质的重要指标[26]。有报道显示,饲料中添加单个或者混合寡糖,不仅可提高鱼类摄食量[27],亦可提高其对营养物质的消化吸收[28-30]。Yilmaz等[31]、Genc等[32]分别在虹鳟和杂交罗非鱼(Oreochromis niloticus × O.aureus)饲料中添加甘露寡糖,均可提高机体对饲料的消化率。本研究中,添加褐藻酸寡糖的实验组干物质消化率以及营养物质消化率差异无统计学意义(P >0.05),与蛋白酶、淀粉酶活性,以及肠道微绒毛高度等结果相呼应。
综上所述,饲料中添加褐藻酸寡糖可提高杯状细胞大小,增加脂肪酶活性,但不能提高蛋白酶、淀粉酶活性,以及营养物质表观消化率;因此,对大菱鲆消化能力的影响作用较为有限。
[1]刘爱君,冷向军,李小勤,等.甘露寡糖对奥尼罗非鱼(Oreochromis × O.aureus)生长、肠道结构和非特异性免疫的影响[J].浙江大学学报(农业与生命科学版),2009,35(3):329-336.
[2]王媛媛,郭文斌,宋存江,等.褐藻酸寡糖的生物活性与应用研究进展[J].食品与发酵工业,2010,36(10):122-126.
[3]董晓莉,耿美玉,管华诗,等.褐藻酸性寡糖对帕金森病大鼠纹状体、杏仁核多巴胺释放的影响[J].中国海洋药物,2003(5):9-12.
[4]YAN G L,GUO Y M,YUAN J M,et al.Sodium alginate oligosaccharides from brown algae inhibit salmonella enteritidis colonization in broiler chickens [J].Poultry Science,2011,90:1441-1448.
[5]陈丽,王淑军,刘泉,等.褐藻寡糖对 3种水产致病菌抗菌活性研究[J].淮海工学院学报(自然科学版),2009,18(1):90-92.
[6]江晓路,杜以帅,王鹏,等.褐藻寡糖对刺参体腔液和体壁免疫相关酶活性变化的影响[J].中国海洋大学学报,2009,39(6):1188-1192.
[7]王鹏,江晓路,江艳华,等.褐藻酸低聚糖对提高大菱鲆免疫机能的作用[J].海洋科学,2006,30(8):6-9.
[8]郝甜甜,张利民,李宝山,等.饲料中添加糖萜素对大菱鲆幼鱼体成分、消化酶活力、血脂及肠道组织结构的影响[J].上海海洋大学学报,2015,24(3):391-402.
[9]霍圃宇,潘金露,韩雨哲,等.褐藻酸寡糖对大菱鲆幼鱼生长性能、血液学指标及非特异性免疫影响[J].广东海洋大学学报,2015,35(4):10-16.
[10]HU H B,ZHANG YJ,MAI K S,et al.Effects of dietary stachyose on growth performance digestive enzyme activities and intestinal morphology of juvenile turbot( Scophthalmus maximus L) [J].Journal of OceanUniversity of China(Oceanic and Coastal Sea Research),2015,14(5):905-912.
[11]LOWRY O H,ROSEBROUGH N J,FARR A L,et al.Protein measurement with the folin phenol reagent[J].Biology Chemistry,1951,193:265-275.
[12]黄锡荣,张文娟,宁少芳,等.分光光度法测定微乳液中脂肪酶的酶活[J].化学通报,2001(10):659-661.
[13]林浩然.鱼类生理学[M].广州:广东高等教育出版社,2007.
[14]ZHOU Q C,ALEJANDRO B.Effects of dietary prebiotics on growth performance,immune response and intestinal morphology of red drum(Sciaenops ocellatus)[J].Aquaculture,2010,309:253-257.
[15]SALZE G,MCLEAN E,SCHWARZ M H,et al.Dietary mannan oligosaccharide enhances salinity tolerance and gut development of larval cobia [J].Aquaculture,2008,274:148-152.
[16]DIMITROGLOU A,DAVIES S,SWEETMAN J.The effect of dietary mannan oligosaccharides on the intestinal histology of rainbow trout(Oncorhynchus mykiss) [J].Comparative Biochemistry and Physiology,Part A:Molecular & Integrative Physiology,2008,150(3):349-361.
[17]PRYOR G S,ROYES J B,CHAPMAN F A,et al.Mannanoligosaccharides in fish nutrition:Effects of dietary supplementation on growth and gastrointestinal villi structure in gulf of Mexico sturgeon [J].North American Journal of Aquaculture,2003,65:106-111.
[18]DIMTROGLOU A,MERRIFIELD D L,MOATE R,et al.Dietary mannan oligosacchaide supplementation modulates intestinal microbial ecology and improves gut morphology of rainbow trout Oncorhynchus mykiss(Walbaum) [J].American society of animal science,2009,87:3226-3234.
[19]江永明,付天玺,张丽,等.微生物制剂对奥尼罗非鱼生长及消化酶活性的影响[J].水生生物学报,2011,35(6):998-1004.
[20]杨晴,杨锐,周歧存,等.褐藻糖胶对黄颡鱼幼鱼生长性能和消化酶活性的影响[J].动物营养学报,2014,26(7):1880-1887.
[21]SANG H M,FOTEDAR R,FILER K.Effects of dietary mannan oligosaccharide on the survival,growth,immunity and digestive enzyme activity of freshwater crayfish,Cherax destructor Clark(1936) [J].Aquaculture Nutrition,2011,17:629-635.
[22]肖明松,陈庆榆,鲍方印,等.果寡糖对鲤鱼生长性能及消化酶的影响[J].水利渔业,2005,25(6):29-31.
[23]LIANG R J,SHI S D,ZHANG B J.The effect of fructo-oligosaccharides on blood RBC count and digestive enzyme activities of oxyeleotris lineolatus [J].African Journal of Micobiology Research,2010,4(18):1909-1913.
[24]MARITZA A,CAMILO P,ALEJANDRO B,et al.The effects of prebiotics on the digestive enzymes and gut histomorphology of red drum(Sciaenops ocellatus) and hybrid striped bass(Morone chrysops × M.saxatilis) [J].British Journal of Nutrition,2013,109:623-629.
[25]MASLOWSKI K M,MACKAY C R.Diet,gut microbiota and immune responses [J].Nature Immunology,2010,12:5-9.
[26]明建华,叶金云,张易祥,等.2 龄青鱼对 7 种饲料原料中营养物质的表观消化率[J].动物营养学报,2014,26(1):161-169.
[27]MANSOURM R,AKRAMI R,GHOBADI S H,et al.Effect of dietary mannan oligosaccharide(MOS) on growth performance,survival,body composition,and some hematological parameters in giant sturgeon juvenile(Huso huso Linnaeus,1754) [J].Fish Physiol Biochem,2012,38:829-835.
[28]BURR G,HUME M,Neill W H,et al.Effects of prebiotics on nutrient digestibility of a soybean-meal-based diet by red drum Sciaenops ocellatus(Linnaeus) [J].Aquaculture Research,2008,39:1680-1686.
[29]YE J D,WAND K,LIF D,et al.Single or combined effects of fructo- and mannan oligosaccharide supplements and Bacillus clausii on the growth,feed utilization,body composition,digestive enzyme activity,innate immune response and lipid metabolism of Japanese flounder Paralichthys olivaceus [J].Aquaculture Nutrition,2011,17:902-911.
[30]蔡立胜,吴天星,潘晓东,等.肉毒碱和果寡糖对搸鱼幼鱼消化率影响的研究[J].饲料工业,2007,28(4):25-26.
[31]YILMAZ E,GENC M A,GENC E.Effects of Dietary mannan oligosaccharides on growth,body composition and intestine and liver histology of rainbow trout,Oncorhynchus mykiss [J].The Israeli Journal of Aquaculture-Bamidgeh,2007,59(3):182-188.
[32]GENC M A,YILMAZ E,GENC E,et al.Effects of dietary mannan oilosacchrides(MOS) on growth,body composition,and intestine and liver histology of the hybrid tilapla(Oreochromis niloticus × O.aureus) [J].The Israeli Journal of Aquaculture-Bamidgeh,2007,59(1):10-16.
(责任编辑:刘庆颖)
Effects of Dietary Alginate Oligosaccharide on Ⅰntestinal Morphology,Activities of Digestive Enzymes and Apparent Digestibility of Turbot(Scophthalmus maximus L)
PAN Jin-lu,HAN Yu-zhe,HUO Pu-yu,SU Peng,JIANG Zhi-qiang
(Dalian Ocean University,Key Laboratory of Mariculture and Stock Enhancement in North China's Sea,Ministry of Agriculture,Dalian 116023,China)
Turbot(Scophthalmus maximus L) with the initial body weight of 17.61±0.16 g were fed by a basal diet supplement with different level(mass fraction 0,0.02%,0.05%,0.20% and 0.50%,respectively) of alginate oligosaccharides(AOS) for 70 days,and the effects of AOS on activity of digestive enzyme,apparent digestibility and intestinal structure of turbot(Scophthalmus maximus L)were studied.The results showed that:1) Compared with control group,intestinal villi length and mucosal fold height of experimental group had not significant difference(P > 0.05),but the size of goblet cell of experimental group significantly increase(P < 0.05).2) Dietary AOS could no significantly enhance the activity of protease and amylase in turbot intestinal(P > 0.05),and dietary supplementation of 0.02%,0.05% significantly increased the activity of lipase(P < 0.05).3) Dietary supplementation of AOS had no significant effect on the digestibility of dry matter,crude protein and crude lipid(P > 0.05).It could be concluded that dietary supplementation of AOS can improve the sizeof goblet cell and the activity of lipase,but cannot improve the activity of protease and amylase,apparent digestibility,and intestinal villi length and mucosal fold height of turbot.
Scophthalmus maximus; alginate oligosaccharide; digestive enzyme activities; intestine tissue section; apparent digestibility
S963.73
A
1673-9159(2016)03-0039-06
10.3969/j.issn.1673-9159.2016.03.007
2015-11-17
国家海洋局公益性行业科研专项(201405003)
潘金露(1991-),女,硕士研究生,研究方向水产动物饲料添加剂。E-mail:1294386786@qq.com
姜志强(1960-),男,教授,研究方向为鱼类生物学、水产动物饲料学、水产集约化养殖。E-mail: zhqjiang@dlou.edu.cn。

