丝素蛋白吸附金属离子的性能及其机理的研究
孙越宜,唐科梦,杨明英,朱良均
(浙江大学应用生物资源研究所,浙江 杭州 310058)
丝素蛋白吸附金属离子的性能及其机理的研究
孙越宜,唐科梦,杨明英,朱良均*
(浙江大学应用生物资源研究所,浙江 杭州 310058)
丝素蛋白是蚕丝的主要组成部分,具有较好的吸湿性、透气性、吸附性等。而现今人类生活环境中存在较多的有害金属离子,因此拓展丝素蛋白吸附金属离子的用途具有重要的意义。本文在前期研究已证实丝素蛋白具有较好的吸附重金属离子能力的基础上,进一步测定分析了不同状态下的丝素蛋白(溶液状、凝胶状、粉末状)对金属离子(以锌为例)的吸附作用,探讨了丝素蛋白二级结构的变化,阐明了丝素蛋白吸附金属离子的机理。结果显示:丝素蛋白吸附锌离子时,氢元素与氧元素参与了其反应,而氮元素也可能参与了反应,丝素蛋白肽链上的-OH、-CO-NH-以及-NH2与Zn2+通过配位键形成了配合物;且丝素蛋白β-折叠增加而无规卷曲减少,丝素蛋白与Zn2+形成的配合物具有更稳定配位结构;同时pH对该配位反应过程也存在一定的影响。
丝素蛋白;金属离子;吸附机理;二级结构
1 引言
丝素蛋白(SF)是蚕丝的主要组成部分,具有较好的可加工性能、生物分解性能和生物相容性,是一种优良的生物材料。随着丝素蛋白研究领域的不断拓宽,丝素蛋白的功能特性被不断地发现和利用,如丝素蛋白的吸湿性、透气性、吸附性等[1,2]。而目前,随着社会经济的极大发展、工业化生产的普及等,在自然界和人类生活环境中,存在较多的有害金属离子,危及人类和动植物的健康[3]。研究表明,不同形态的丝素蛋白(SF,溶液状、凝胶状、粉末状)对重金属离子(铜、锌、铅)存在不同能力的吸附作用,且其吸附比率随着丝素蛋白浓度的增加而增大,对单一金属离子和混合离子具有同样效果[4]。
如能利用丝素蛋白的吸附性能,研制具有吸附金属离子功能的新型环保材料,不仅拓展丝素蛋白用途,提升蚕丝蛋白资源利用价值,而且对于改善生态环境等具有重要意义。因此,本研究从丝素蛋白的吸附性能入手,研究丝素蛋白对金属离子(以锌为例)的吸附性能,明确丝素蛋白吸附金属离子的机理。为进一步研制用于水或空气的净化等的丝素蛋白生物吸附材料建立理论基础。
2 材料与方法
2.1材料与设备
2.1.1材料
家蚕蚕茧茧层,无水碳酸钠(AR),99.9%溴化锂(AR),氯化锌(AR),浓盐酸(AR)。
2.1.2设备
电子分析天平(1702型,Sartorius GMBH Gottingen公司)、电磁炉(CH8660型,CAPLE公司)、恒温磁力搅拌器(78HW-3型,仪表电机公司)、空气恒温振荡器(SPH-2102C型,世平公司)、超声波细胞破碎仪(JY92-ⅡDN型,Scientz公司)、MD44透析带(8 ku-14 ku)、四环真空冷冻干燥机(LGJ-10C型,博医康公司)、数显电热鼓风干燥箱(GZX-9140MBE型,博迅公司)、傅立叶红外光谱仪(8400s型,Shimadzu公司)、圆二色谱仪(J-815型,Jasco公司)、X射线光电子衍射仪(250Xi型,Escalab公司)。
2.2方法
2.2.1脱胶丝素纤维的制备
取蚕茧茧层剪碎备用,每20 g蚕茧茧层配备两份10 g无水碳酸钠粉末。将两份碳酸钠粉末分别溶于2000 mL去离子水,取其中一份溶液煮沸后,加入20 g茧层,继续沸煮30 min,其间常用玻璃棒搅拌进行第1次脱胶,脱胶完成后倾去溶液,取出蚕丝用蒸馏水反复洗涤并拧干,获得一次脱胶丝。再取另一份碳酸钠溶液煮沸,以相同方法进行第2次脱胶,获得完全脱胶丝,即纯丝素纤维。将纯丝素纤维放入120℃烘箱中烘干备用。
2.2.2丝素蛋白溶液的制备
称取86.84 g溴化锂粉末,在磁力搅拌器不断搅拌的情况下缓慢溶解于约30 mL去离子水中。待溶液温度达到室温时,利用去离子水定容至100 mL,得100 mL 9 mol/L溴化锂溶液。
取纯丝素纤维,按0.1 g/ml的比例浸没于上述溴化锂溶液中,室温下置于摇床上振荡6 h,使丝素纤维溶解。然后用去离子水透析、浓缩后获得丝素蛋白溶液(RSF(aq))。取1 mL丝素蛋白溶液至小平皿内120℃烘箱中烘干、称重,计算丝素蛋白溶液浓度。
2.2.3丝素蛋白凝胶及粉末材料的制备
将2.2.2中制备得到的丝素蛋白溶液用25 kHz超声波处理(工作时间7 s,间隙时间3 s,超声约2 min)后凝胶化。然后将凝胶状丝素蛋白倒入平皿中于-4℃冰箱冷冻,再放入真空冷冻干燥机内干燥,研磨后获得丝素蛋白凝胶材料(RSF材料(g))。
另取2.2.2中丝素蛋白溶液分装倒入平皿中于-4℃冰箱冷冻,再放入真空冷冻干燥机内干燥,在红外灯下研磨后获得丝素蛋白粉末材料(RSF(s))。
2.3金属离子的吸附
2.3.1丝素蛋白溶液材料对锌离子的吸附
取36 mL11%的丝素蛋白溶液装入透析袋中,置于含13.63 g氯化锌的466 mL水溶液中,得氯化锌-丝素蛋白(aq)混合溶液。若混合溶液出现絮状沉淀即氢氧化锌,则逐滴添加盐酸直至絮状沉淀消失,此时的pH约为6。将上述混合溶液放于磁力搅拌器上室温条件下搅拌48 h,取透析袋中溶液进行圆二色谱(CD)分析,另取透析袋中溶液即Zn2+-RSF(aq)混合溶液,制成Zn2+-RSF(aq)混合膜进行X射线光电子能谱学(XPS)分析(测定O、N、C、Zn)。
以相同方法另制取两份氯化锌-丝素蛋白(aq)混合溶液,并分别用浓盐酸调节pH至4~5及2~3,以相同方法处理、分析样品。
另取丝素蛋白溶液进行圆二色谱分析,并制成丝素蛋白膜进行X射线光电子能谱学分析(测定O、N、C、Zn);同样取丝素蛋白溶液调节pH至2~3后进行圆二色谱分析。
2.3.2丝素蛋白凝胶材料对锌离子的吸附
取0.39 g丝素蛋白凝胶材料置于500 mL 0.2 mol/ L氯化锌溶液中得氯化锌-丝素蛋白(g)混合溶液。若混合溶液出现絮状沉淀即氢氧化锌,则逐滴添加盐酸直至絮状沉淀消失,此时的pH约为6。将上述混合溶液放于磁力搅拌器上室温条件下搅拌48 h后,将溶液抽滤,收集滤渣,冷冻干燥并研磨成粉,得Zn2+-RSF(g)样品。压片后进行傅立叶红外(FT-IR)分析(透射)及X射线光电子能谱学分析(测定O、N、C、Zn)。
以相同方法另制取两份氯化锌-丝素蛋白(g)混合溶液,并分别用浓盐酸调节pH至4~5及2~3,以相同方法处理、分析样品。
另取丝素蛋白凝胶材料压片后进行傅立叶红外分析(透射)及X射线光电子能谱学分析(测定O、N、C、Zn)。
2.3.3丝素蛋白粉末材料对锌离子的吸附
配制500 mL 0.2 mol/L氯化锌溶液,并取适量溶液溶解0.39 g丝素蛋白粉末材料,将溶解的丝素蛋白装入透析袋中后置于该氯化锌溶液中,得氯化锌-丝素蛋白(s)混合溶液。若混合溶液出现絮状沉淀即氢氧化锌,则逐滴添加盐酸直至絮状沉淀消失,此时的pH约为6。将上述混合溶液放于磁力搅拌器上室温条件下搅拌48 h,取透析袋内含物冷冻干燥并研磨成粉,得Zn2+-RSF(s)样品。压片后进行傅立叶红外分析(透射)及X射线光电子能谱学分析(测定O、N、C、Zn)。
以相同方法另制取两份氯化锌-丝素蛋白(s)混合溶液,并分别用浓盐酸调节pH至4~5及2~3,以相同方法处理、分析样品。
另取丝素蛋白粉末材料压片后进行傅立叶红外分析(透射)及X射线光电子能谱学分析(测定O、N、C、Zn)。
3 结果与分析
3.1圆二色谱测定分析[5~7]
根据丝素蛋白圆二色图谱分析[8],各液态实验样品中各类二级结构的比例如表1所示。由表1可知,丝素蛋白溶液与锌离子反应后,β折叠增多,β转角消失,而无规卷曲减少;同样,酸性条件也有助于其他二级结构向β折叠转变;其中,2.2.2中制备的丝素蛋白溶液为弱碱性,因此其二级结构与其他实验组存在较大差异。但有文献指出[5],pH为2时,丝素蛋白分子链可能被破坏,此时圆二色谱的分析结果并不能准确表示其二级结构,这一点还有待考证。

表1 各液态样品CD图谱分析结果(各类二级结构比例)Table 1 CD map analysis results of each liquid sample(proportion of various secondary structure)
3.2傅立叶红外测定分析
各固态样品傅立叶红外光谱透射图谱的特征峰值如表2、表3所示,其中酰胺Ⅰ带的1700 cm-1、1625~1640 cm-1,酰胺Ⅱ带的1515~1525 cm-1,酰胺Ⅲ带的1265 cm-1、1235 cm-1,和酰胺Ⅴ带的700 cm-1代表β-折叠;而酰胺Ⅰ带的1650~1660 cm-1,酰胺Ⅱ带的1535~1545 cm-1,酰胺Ⅲ带的1235 cm-1,和酰胺Ⅴ带的669 cm-1代表无规则卷曲[9,10]。因此,通过观察、分析各样品图谱中酰胺Ⅰ带和酰胺Ⅱ带的峰值,可以直观地比较丝素蛋白材料分别在凝胶状态下与粉末状态下,以及在添加Zn2+后在不同pH条件下二级结构的差异。
此外,通过比较各样品红外谱图中指纹区(1400~600 cm-1)与官能团区(3700~1500 cm-1)各键与各官能团的特征峰,也可以分析推断参与丝素蛋白与锌离子反应的基团[11]。
表2为凝胶状丝素蛋白材料及其与锌离子在不同pH条件下反应的傅立叶红外光谱(透射)分析结果。由此可见,与纯凝胶状丝素蛋白相比,加入锌离子后,酰胺Ⅱ带中代表无规卷曲的特征峰消失,说明蛋白二级结构中无规卷曲比例减小,这一点与丝素蛋白溶液相符。其次,pH=2~3时酰胺Ⅲ带的特征峰消失,这可能与pH为2时,丝素蛋白分子链可能被破坏有关[5]。
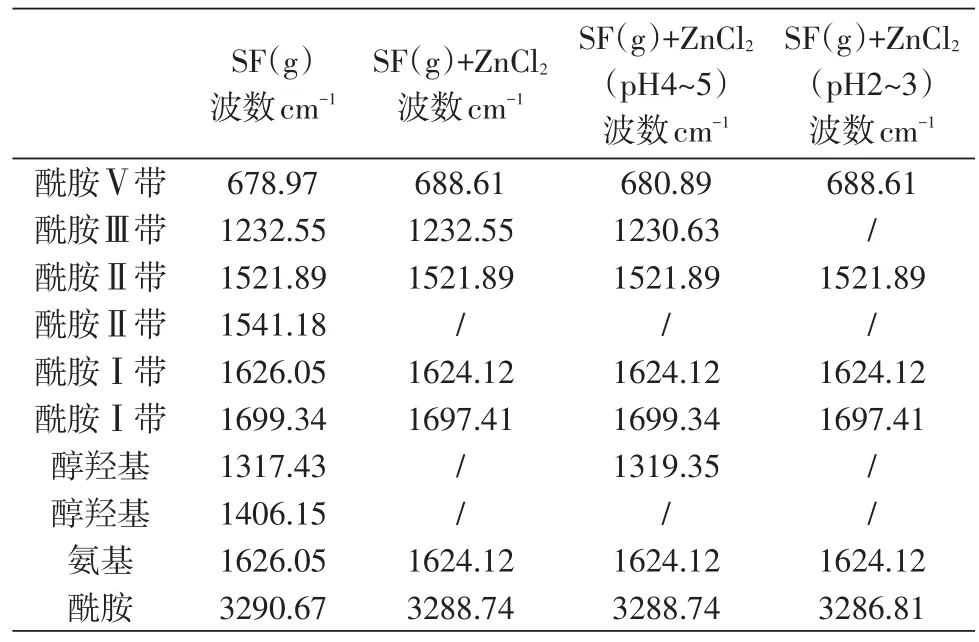
表2 凝胶状丝素蛋白材料组FT-IR光谱特征峰Table 2 FT-IR spectral characteristic peak of gel silk fibroin material group
凝胶状丝素蛋白材料在与氯化锌溶液混合后,表示醇羟基面内弯曲振动(δOH)的1410~1260 cm-1波段内,多个特征峰偏移或者消失,说明醇羟基参与丝素蛋白与锌离子的反应;表示胺基面内弯曲振动(δNH)的1650~1590 cm-1波段内,特征峰由1626.05 cm-1偏移至1624.12 cm-1,说明氨基参与反应;表示酰胺氨氮氢键伸缩振动(νNH)的3500~3100 cm-1波段内,特征峰由3290.67 cm-1分别偏移至3288.74 cm-1、3288.74 cm-1、3286.81 cm-1,说明酰胺基参与反应[11]。
表3为粉末状丝素蛋白材料实验组的傅立叶红外光谱(透射)分析结果。

表3 粉末状丝素蛋白材料组FT-IR光谱特征峰Table 3 FT-IR spectral characteristic peak of powder silk fibroin material group
由于pH为6时,粉末状丝素蛋白材料与氯化锌溶液反应后形成一种金黄色半透明状晶体,且质地坚硬而极易吸湿,故该实验组样品未能制成傅立叶红外光谱分析(透射)用压片,因此该实验组傅立叶红外光谱分析(透射)结果缺失。
根据其他三个实验组的傅立叶红外光谱分析(透射)结果,锌离子的加入使得粉末状丝素蛋白材料酰胺Ⅱ带处无规则卷曲的特征峰消失,而出现β-折叠的特征峰;与凝胶状丝素蛋白材料相似,在pH为2~3时,包括酰胺Ⅴ带在内的多处特征峰消失,这说明在该pH条件下丝素蛋白结构被破坏。
粉末状丝素蛋白材料在与氯化锌溶液混合后,表示醇羟基面内弯曲振动(δOH)的1410~1260 cm-1波段内,1386.86 cm-1处的波峰分别偏移至1384.94 cm-1和1383.01 cm-1,说明醇羟基参与丝素蛋白与锌离子的反应;表示胺基面内弯曲振动(δNH)的1650~1590 cm-1波段内,1637.62 cm-1处的波峰偏移至1635.69 cm-1,而1618.33 cm-1处的波峰消失,而1647.26 cm-1处出现新的波峰,说明氨基参与反应;表示酰胺氨氮氢键伸缩振动(νNH)的3500~3100 cm-1波段内,多个波峰出现明显迁移,说明酰胺基参与反应[11]。
在粉末状丝素蛋白材料实验组中,相比于凝胶状丝素蛋白材料实验组,特征峰迁移更明显,且受pH影响更大,这可能与凝胶状丝素蛋白材料不溶于水而粉末状丝素蛋白材料可溶于水有关,因此粉末状丝素蛋白材料结构及分子更易被改变。
3.3X射线光电子能谱测定分析[12-14]
3.3.1丝素蛋白溶液与锌的XPS测定分析
丝素蛋白溶液及其与锌离子在不同pH下反应的X射线光电子能谱分析结果如表4所示。
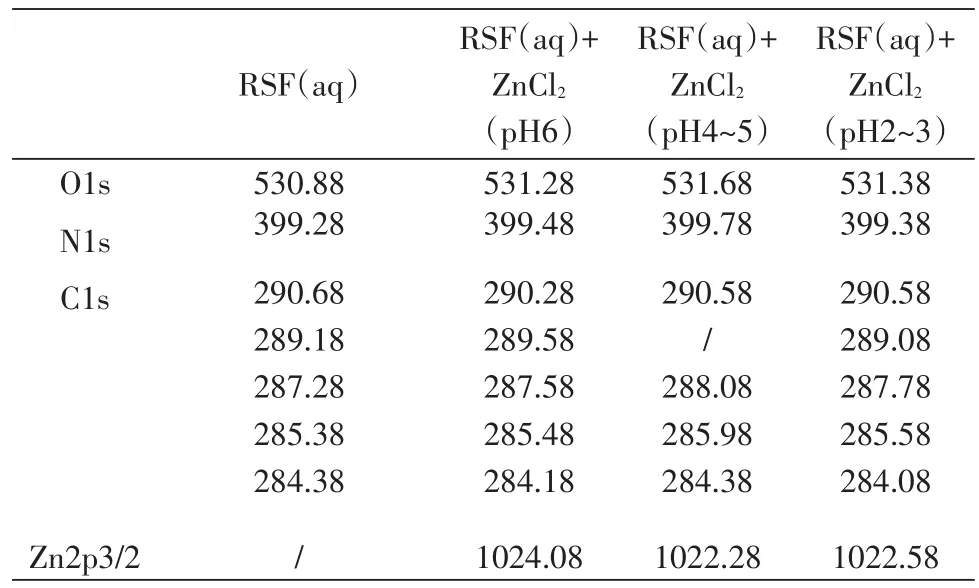
表4 RSF(aq)与Zn2+在不同pH条件下反应各原子的结合能(单位:eV)Table 4 Binding energy of each atom in the reaction between RSF(aq)and Zn2+with different pH
丝素蛋白与锌离子反应后,氧元素结合能明显增加,其电子层密度增加,说明氧元素参与了丝素蛋白溶液与锌离子的反应;而氮元素的结合能基本不变,但有文献[15]提到,N→Zn2+配键中有较大成分的d电子反馈,导致氮元素结合能变化不大,因此氮元素也可能参与反应;碳元素的结合能虽然保持不变但各结合能比例明显改变,即各峰面积比明显变化,主要是醇比例的增减,同样说明了氧元素参与了丝素蛋白溶液与锌离子的反应。
此外,当pH低于5时,锌元素的结合能明显减少,电子云密度降低,说明锌元素与丝素蛋白溶液发生配合,也因此推测氢离子参与丝素蛋白与锌离子的反应。
由此可以推测,在丝素蛋白溶液中,丝素蛋白主要通过氢元素、氧元素与锌离子反应,氮元素可能参与反应。
3.3.2凝胶状丝素蛋白与锌的XPS测定分析
凝胶状丝素蛋白及其与锌离子在不同pH下反应的X射线光电子能谱分析结果如表5所示。
根据表5的分析结果,基本与3.2.1中丝素蛋白溶液实验组一致,但氧元素的结合能有所降低;此外,凝胶状丝素蛋白材料实验组中锌元素结合能在不同pH下也未发生变化,这可能与凝胶状丝素蛋白材料不溶于水,结构受溶液pH影响较小有关,这一推测也与傅立叶红外光谱测定结果一致。
因此,凝胶状丝素蛋白材料与锌离子在水溶液中发生反应时,主要有氢元素、氧元素的参与,氮元素可能参与反应,这一结论验证了傅立叶红外光谱的分析结果。
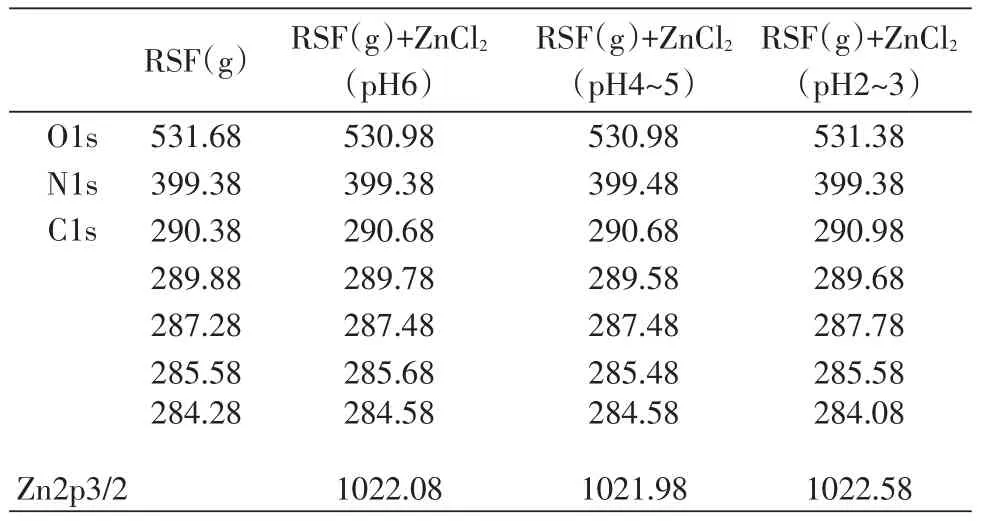
表5 RSF(g)材料与Zn2+在不同pH条件下的原子结合能(单位:eV)Table 5 Binding energy of each atom in the reaction between RSF(g)and Zn2+with different pH
3.3.3粉末状丝素蛋白与锌的XPS测定结果
粉末状丝素蛋白与锌离子在不同pH下反应的X射线光电子能谱分析结果如表6所示。

表6 粉末状丝素蛋白材料与Zn2+在不同pH条件下的原子结合能(单位:eV)Table 6 Binding energy of each atom in the reaction between powder silk fibroin material and Zn2+with different pH
粉末状丝素蛋白实验组的X射线光电子能谱分析结果中,锌元素情况与3.2.2中凝胶状丝素蛋白材料相似,其余元素与3.2.1中丝素溶液实验组相似。
因此,可以合理地推测粉末状丝素蛋白与锌离子反应时,同样有氢元素、氧元素的参与,氮元素可能参与反应。
3.4丝素蛋白与锌离子的配位反应
根据前述傅立叶红外光谱和X射线光电子能谱的共同分析结果可知,丝素蛋白与锌离子反应时,丝素蛋白肽链上的-OH、-CO-NH-及-NH2与Zn2+通过配位结合形成了配合物,推测其配位方式如图1所示。
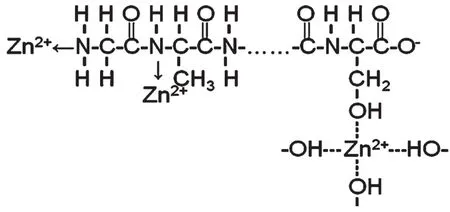
图1 SF与Zn2+可能的配合方式Figure 1 Possible coordination type between SF and Zn2+
4 结论
4.1丝素蛋白与锌离子反应的二级结构变化
根据3.1中丝素蛋白溶液、凝胶状丝素蛋白及粉末状丝素蛋白与锌离子反应二级结构的变化可知,丝素蛋白与锌离子反应后β-折叠增加,无规则卷曲减少,且酸性条件有助于β-折叠结构的形成。说明丝素蛋白与Zn2+结合形成的配合物具有更稳定配位结构。
同时pH对配合反应过程也存在一定的影响,且受影响程度的顺序为:丝素蛋白溶液材料>粉末状丝素蛋白材料>凝胶状丝素蛋白材料。丝素蛋白与锌离子反应时,其二级结构随pH梯度变化的改变还需要一系列严格控制pH梯度的实验来探究。
4.2丝素蛋白与锌离子的配位反应
根据傅立叶红外光谱和X射线光电子能谱的共同分析结果可知,丝素蛋白与锌离子反应时,丝素蛋白肽链上的-OH、-CO-NH-及-NH2与Zn2+通过配位结合形成了配合物。
同时pH对配合反应过程也存在一定的影响,且受影响程度的顺序为:丝素蛋白溶液材料>粉末状丝素蛋白材料>凝胶状丝素蛋白材料。
[1] 朱良均,胡国梁,姚菊明,等.丝素蛋白在胶凝时的分子结构、结晶性的探讨[J].蚕业科学,1998,24(4):226~230.
[2] 侯爱芹,史雅琪,谢孔良.丝素蛋白的提取及其在纺织上的应用进展[J].针织工业,2009,4(4):63~67.
[3] 陶俊逸,邵骏骅,张海萍,等.蚕丝蛋白制备方法的研究[J].蚕桑通报,2012,43(3):18~21.
[4] 孙越宜,俞纪维,支金丝,等.丝素蛋白对重金属离子吸附性能的研究[J].蚕桑通报,2015,46(1):37~40.
[5] 杨宇红,邵正中,陈新.光谱法研究pH值对再生桑蚕丝素蛋白在水溶液中结构的影响[J].化学学报,2006,64(16):1730~1736.
[6] Greenfield N.Applications of circular dichroism in protein and petide analysis.Trends in Analytical Chemistry,1999,18(4):236~244.
[7] Iizuka E,Yang J T.Optical rotator dispersion and circular dichroism of the beta-form of silk fibroin in solution. Proceedings of the National Academy of Sciences,1966,55(5):1175~1182.
[8] 宗小红,邵正中.铜离子和pH对再生丝素蛋白二级结构的影响[D].复旦大学.2004
[9] 周凤娟,许时婴,王璋,等.可溶性丝素蛋白的结构研究[J].丝绸,2003(8):23~25,45.
[10]谢孟峡,刘媛.红外光谱酰胺Ⅲ带用于蛋白质二级结构的测定研究[J].高等学校化学学报,2003,24(2):226~231.
[11]Robert M.Silverstein,Francis X.Webster,David Kiemle. Spectrometric Identification of Organic Compounds[M]. New York:Wiley,1998:88~90,101.
[12]Li Zhou,Xin Chen,Weilin Dai,Zhengzhong Shao.X-ray Photoelectron Spectroscopic and Raman Analysis of Silk Fibroin-Cu(II)Films.Wiley Inter Science,2006,20472. 144~151.
[13]陈军,张鎏,康慧敏,等.ZnO/HZSM-5丙烷芳构化催化剂中锌的形态表征[J].催化学报.2001,22(3):229~232.
[14]魏青,李丽,高胜利,等.锌盐与二甲氧基嘧啶配合物的光谱研究[J].光谱学与光谱分析,2003,23(2):300~302.
[15]高胜利,侯育冬,冀棉,等.锌盐与α-氨基酸配合物的XPS的研究.光谱学与光谱分析,2001,21(1):81~83.
[16]冀克俭,张银生.碳纤维表面的XPS表征[J].合成纤维工业,1994,17(1):43~47.
Study of the Adsorption and the Mechanism of Metal Ions by Fibroin
SUN Yue-yi,TANG Ke-meng,YANG Ming-ying,ZHU Liang-jun*
(Institute of Applied Bioresources,Zhejiang University,Hangzhou 310058,China)
Silk fibroin is the main component of the silk,with excellent properties like moisture absorption,air permeability and adsorption.Harmful metal ions in environment have an adverse influence on human life.Thus,it is of great importance that expanding the applications of silk fibroin into environment protection by taking advantage of its excellent properties.As my previous work indicated,silk fibroin has abilities to adsorb heavy metal ions such as copper,zinc,and lead.This study explored the adsorption mechanism of zinc ions onto RSF in different states(aqueous solution,gel,powder),and analyzed the conformational changes of RSF.It turned out:oxygen and hydrogen in RSF reacted with zinc ions,while nitrogen might be involved in the reaction,which means the-OH,-CO-NH-and-NH2of RSF coordinate with Zn2+;the content of β-sheet in RSF was increased while the random coil decreased during the reaction,which makes the RSF become more stable;pH was related to the reaction as well.
silk fibroin;metal ions;adsorption mechanism;secondary structure
S888.3
A
0258-4069[2016]01-026-06
现代农业产业技术体系专项(CARS-22)
孙越宜(1993-),女,浙江杭州人,本科生,从事蚕丝蛋白生物资源高分子材料研究。E-mail:303489670@qq.com
朱良均,男,教授,博士生导师。E-mail:ljzhu@zju.edu.cn

