体外诱导人脐带间充质干细胞定向分化为肝细胞的研究
薛改 韩华 陈泽纱 吴红海 刘建芳 侯艳宁
·论著·
体外诱导人脐带间充质干细胞定向分化为肝细胞的研究
薛改韩华陈泽纱吴红海刘建芳侯艳宁
目的对肝组织匀浆上清液(LHS)体外诱导人脐带间充质干细胞(hUCMSC)定向分化为肝细胞的功能特性进行检测。方法选取第3代hUCMSC,采用LHS作为诱导培养基,实验分为对照组和LHS处理诱导组,每组有3、5、7 d 三个时间点;诱导后对细胞进行AFP、CK18、TPH2、CYP3A4、Alb、HGF的免疫荧光细胞化学染色;并测定诱导前后CYP3A酶活性、Alb、HGF和尿素的分泌量。结果LHS诱导3 d后细胞表达肝特异性蛋白AFP、CK18、TPH2、CYP3A4、Alb和HGF;对照组hUCMSC不同时间点CYP3A酶特异性代谢底物咪达唑仑的代谢量为0.026~0.030 ng/mg,LHS诱导3、5和7 d后细胞代谢量分别为(30.14±1.19)、(50.20±6.24)和(120.85±15.52) ng/mg,与对照组相比显著升高(P<0.01);对照组细胞3、5和7 d HGF的分泌量分别为(0.24±0.14)、(0.42±0.20)和(0.18±0.15) ng/mg,LHS诱导后细胞HGF的分泌量分别为(4.06±1.35)、(3.35±0.17)和(3.83±0.42) ng/mg,与对照组相比显著升高(P<0.01);LHS诱导后各组细胞尿素分泌量增加14倍以上,与对照组相比显著升高(P<0.01);对照组3、5和7 d Alb的分泌量分别为(22.66±2.99)、(16.99±2.90)和(15.37±1.86) μg/mg,诱导3、5和7 d后Alb的分泌量分别为(36.40±3.53)、(46.66±2.50)和(54.82±4.28) μg/mg,与对照组相比显著升高(P<0.05或P<0.01)。结论在体外经LHS诱导后,hUCMSC能够分化为具有成熟肝细胞功能的肝细胞。
人脐带间充质干细胞;诱导分化;肝组织匀浆上清液;肝细胞
近年来,脐带来源的间充质干细胞(umbilical cord mesenchymal stem cells,UCMSC)以其显著的优点引起越来越多研究者的重视[1-2]。UCMSC可经体外诱导分化为各种组织细胞,如神经细胞,骨细胞,脂肪细胞,心肌细胞等[3]。研究发现,有关肝细胞发育的转录因子和肝祖细胞标志物在UCMSC中高表达,说明UCMSC在向肝细胞诱导方面更具有优势[4]。体内实验表明,UCMSC在治疗肝脏疾病的同时在体内可定向分化为肝样细胞[5],然而其机制还不十分清楚。体外研究显示,UCMSC体外诱导可定向分化为肝样细胞[6-8]。研究者们多采用各种细胞因子如:肝细胞生长因子(hepatocyte growth factor,HGF)、成纤维细胞生长因子(fibroblast growth factor,FGF)、表皮生长因子(epidermal growth factor,EGF )和致瘤素M(oncostatin M,OSM)等来进行诱导。诱导后细胞的鉴定指标一般为肝细胞特异性标志物或功能蛋白,如AFP、CK18、CK19、Alb、TDO等。Campard等[9]对所诱导的UCMSC进行了肝细胞功能鉴定,包括CYP3A4活性、糖元储备、葡萄糖-6-磷酸酶活性、尿素的检测等。以往的研究普遍存在诱导时间长、诱导转化率低等缺点,探寻一种体外诱导时间短,诱导率高且诱导后具备成熟肝细胞功能的诱导方式成为研究者关注的焦点。
本实验室已成功分离培养人脐带间充质干细胞(human umbilical cord mesenchymal stem cells,hUCMSC),经流式细胞术检测免疫表型符合MSC的免疫表型特征,且具有向成骨细胞和脂肪细胞分化的潜能。前期研究表明,肝组织匀浆上清液(liver homogenate supernatants,LHS)能够诱导hUCMSC定向分化为具有肝细胞特异标志物和功能蛋白的肝样细胞,为进一步探讨诱导的细胞是否具有肝细胞功能,本研究选取能代表肝细胞功能的CYP3A酶、白蛋白、尿素及人肝细胞生长因子等作为评价指标,考察诱导后的细胞功能,以期为临床应用干细胞治疗终末期肝病提供理论和实验依据。
资料和方法
一、主要试剂和仪器
DMEM/F12培养基和胎牛血清购于美国Hyclone 公司;0.25%胰蛋白酶/EDTA消化液购于德国Sigma 公司;HuHGF ELISA试剂盒和HuAlb ELISA试剂盒均购于上海BlueGene公司;BUN检测试剂盒购于南京建成生物工程研究所;HP-1100液相色谱质谱联用系统(美国Agilent公司);VersaMax连续波长多功能酶标仪(美国Molecular Devices公司)。
二、实验动物
健康成年SD大鼠,雄性,体质量(250±20)g,购于河北省实验动物中心(清洁Ⅱ级,合格证号:1305066)。动物饲养环境为清洁级,实验过程对动物的处置符合动物伦理学要求。肝匀浆上清液制备方法参考文献[10]。
脐带来源:取自白求恩国际和平医院妇产科剖腹产足月健康胎儿,约20 cm,经伦理委员会批准,产妇及家属知情同意。hUMSCs的分离培养、表型及分化潜能鉴定:具体方法参照文献[11]。
三、实验分组
取第3代hUMSC,以1.2×105个/孔的细胞密度接种于6孔板中,待细胞长至80%汇合,吸弃培养液,加入诱导培养基。实验组分为①对照3 d组;②对照5 d组;③对照7 d组;④诱导3 d组;⑤诱导5 d组;⑥诱导7 d组。对照组正常培养,诱导组加入LHS,于不同时间点进行处理,收集细胞及细胞上清液。
四、免疫细胞化学法检测诱导后肝细胞相关蛋白的表达
诱导3 d后将诱导液取出,细胞用4%多聚甲醛固定30 min,检测前用含0.3%Tritonx-100 PBS漂洗3次,每次5 min,含5%山羊血清 PBS封闭1 h,一抗AFP(1∶200)、CK18(1∶100)、CYP3A4(1∶100)HGF(1∶50)和Alb(1∶400))4℃过夜,PBS漂洗3次,每次5 min,二抗37℃孵育1 h,复染核后PBS漂洗3次,每次5 min,封片。
五、CYP3A酶活性的测定
(一)细胞处理选用咪达唑仑作为CYP3A酶的作用底物,具有CYP3A酶活性的细胞可代谢咪达唑仑,咪达唑仑浓度的减少代表CYP3A酶活性的变化。于诱导不同时间点(3、5、7 d)取出细胞上清液(-20℃冻存备用),加入含有CYP3A的相应底物咪达唑仑(200 ng/mL)的无血清培养基2 mL,放入培养箱中孵育2 h,反应终止后将细胞培养液吸出,离心取上清液。
(二)CYP3A酶底物咪达唑仑的测定方法采用HPLC-MS法测定细胞培养液中咪达唑仑的浓度。标准曲线浓度:500 ng/mL,200 ng/mL,100 ng/mL,50 ng/mL,20 ng/mL,10 ng/mL,内标为安定,浓度为100 ng/mL。
六、上清液中HGF、Alb和尿素含量的测定
采用ELISA法检测细胞HGF和Alb分泌水平;采用比色法检测BUN水平,即代表细胞分泌尿素水平,严格按照说明书操作。
七、统计学分析
应用SPSS 13.0统计软件,采用单因素方差分析(One-Way ANOVA)对数据进行统计分析。P<0.05为差异有统计学意义。
结 果
一、诱导后细胞的肝细胞特异性蛋白免疫荧光组化染色
诱导后细胞免疫荧光组化染色结果显示:诱导后的细胞形态由长梭形变为多边形或不规则形,肝细胞表面标志蛋白AFP、CK18高表达,肝细胞特异功能蛋白Alb、CYP3A4、TPH2、HGF均有表达,而未诱导的干细胞形态仍为长梭形,肝细胞特异性蛋白表达阴性。结果见图1。
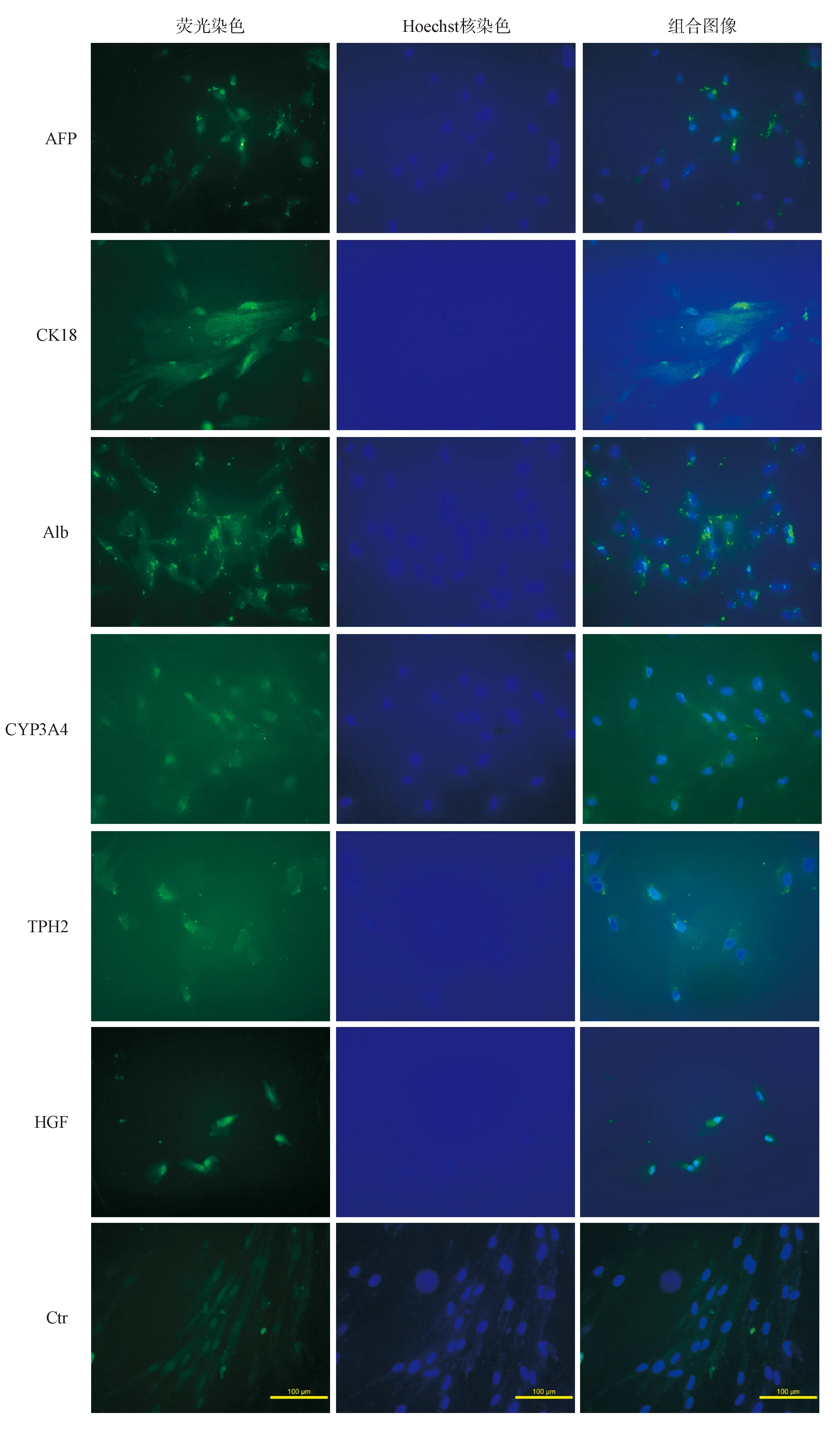
注:AFP为甲胎蛋白;CK18为角蛋白18;Alb为白蛋白;CYP3A4为细胞色素P-3A4酶;TPH2为色氨酸 2,3-加双氧酶;HGF为肝细胞生长因子;Ctr为对照
二、诱导后细胞CYP3A酶活性的变化
咪达唑仑的代谢量代表了细胞CYP3A的酶活性,对照组干细胞几乎无代谢咪达唑仑的能力,不同时间点的代谢量为0.026~0.030 ng/mg;3、5和7 d诱导组代谢量分别为(30.14±1.19)、(50.20±6.24)和(120.85±15.52) ng/mg。与对照组相比,诱导组咪达唑仑的代谢量显著增加,且代谢量随诱导时间的增长而增加(P<0.01),说明诱导后细胞具有CYP3A酶的活性,而且酶活性随诱导时间的增加而增强。
三、诱导后细胞分泌HGF水平的变化
对照组干细胞有分泌少量HGF的能力,3、5和7 d组HGF的分泌量分别为(0.24±0.14)、(0.42±0.20)和(0.18±0.15) ng/mg,诱导3、5和7 d HGF的分泌量分别为(4.06±1.35)、(3.35±0.17)和(3.83±0.42) ng/mg,与每个时间点的对照组相比,诱导组分泌的HGF均显著增高(P<0.01)。
四、LHS对hUCMSC分泌尿素水平的影响
对照组干细胞几乎无分泌尿素的能力,分泌量最高为1.80 μmol/mg,诱导后细胞分泌量增加14倍以上,诱导3、5和7 d尿素的分泌量分别为(20.59±2.61)、(26.64±5.79)和(28.55±4.80) μmol/mg,与每个时间点的对照组相比,诱导组分泌的尿素均显著增高(P<0.01)。
五、LHS对hUCMSC分泌Alb水平的影响
对照组干细胞有分泌Alb的能力, 3、5和7 d组Alb的分泌量分别为(22.66±2.99)、(16.99±2.90)和(15.37±1.86) μg/mg,诱导3、5和7 d Alb的分泌量分别为(36.40±3.53)、(46.66±2.50)和(54.82±4.28) μg/mg,与每个时间点的对照组相比,诱导组分泌的Alb均显著增高(P<0.05或P<0.01)。
讨 论
研究表明,干细胞所处的组织微环境可对其增殖和分化进行调控,使其分化为其他类型的功能细胞,干细胞移植后可迁移至受损组织器官并改善受损组织器官的功能。将hUCMSC移植到CCl4所致的慢性肝硬化模型小鼠体内,发现干细胞可分化为具有肝细胞特征和部分功能的肝样细胞,改善肝损伤的情况,替代部分肝脏功能[12,13]。临床研究发现,肝硬化患者移植hUCMSC后,Alb水平升高,总胆红素水平降低,腹水等症状减轻,但其作用机制仍不清楚[14-16]。有研究者在体外条件下采用组织提取物模拟组织微环境对干细胞进行诱导,研究在特定的组织微环境中干细胞能否向该组织细胞定向分化及调控其分化的关键因素。2005年Choi等[17]在体外条件下采用大鼠胰腺组织提取物诱导骨髓间充质干细胞,诱导后细胞能够分泌胰岛素、胰高血糖素、胰多肽、生长抑素等。Wang等[11]采用大鼠脑组织匀浆上清液诱导hUCMSC,分化后的细胞具有神经细胞形态,表达神经元特异性标志物NSE和神经胶质细胞特异性标志物GFAP。研究结果表明,体外条件下组织提取液能够诱导干细胞向该组织细胞定向分化。
目前,国内外学者应用各种细胞因子于干细胞向肝细胞定向分化的研究中[18-20],对诱导后的细胞除进行标志物的鉴定外,检测诱导分化的细胞是否具有成熟肝细胞的功能,因为MSC是否具有功能替代作用是决定其能否应用于肝脏再生的关键。目前,主要从Alb分泌、尿素产生、氨代谢和糖原储存等方面进行功能检测。大多数代谢和解毒酶类直至肝脏发生的最终阶段才具备其功能,因此可通过测定细胞色素P450酶系的活力来对细胞代谢功能进行检测。本实验室前期研究表明,LHS可诱导hUCMSC定向分化为具有AFP、CK18及TPH2表达的肝样细胞,并在蛋白和RNA水平得到验证。本研究在前期实验的基础上,进一步验证了分化后细胞的成熟肝细胞功能。CYP450酶系是一组由许多同工酶组成的大家族,其中重要的同工酶有CYP1A2、CYP2A6、CYP2C9、CYP2C19、CYP2D6、CYP2E1、CYP3A4,参与人体内约90%以上药物的代谢[21]。其中CYP3A4含量最高(29%),代谢底物种类最多,因此,CYP3A酶的活力改变是评价细胞代谢功能的一个重要指标。研究发现,对照组干细胞几乎无酶代谢功能,与对照组相比,酶底物的代谢量显著增加,且随诱导时间增长而增加,说明诱导后的细胞已具备了肝细胞酶的代谢功能,是成熟肝细胞的表现之一。尿素的产生和白蛋白的分泌亦是检测肝细胞功能的有效手段。LHS诱导3 d,细胞即有大量尿素分泌,尿素氮的水平达到对照组的14.78倍,诱导7 d,尿素氮的水平为对照组的66.26倍。LHS诱导后,细胞的Alb分泌量亦显著升高,进一步说明采用LHS诱导hUCMSC可使其定向分化为具有分泌功能的成熟肝细胞。
干细胞的诱导可能是多种因子共同作用的结果,研究者多选取不同细胞因子的组合和诱导时间来进行实验。研究发现,HGF、FGF、EGF和OSM等均对干细胞的分化有明显的调节作用,LHS体外诱导hUCMSC后,HFG水平明显增高[22]。HFG是肝细胞生长增殖的一个关键因子,可由肝细胞分泌,并促进肝细胞的生长增殖,其水平的增高可能是其发挥肝脏修复的一个因素。
本研究进一步验证了LHS可体外诱导hUCMSC定向分化为具备成熟肝细胞功能的细胞,且诱导效率高,所需时间短。研究结果表明,肝组织匀浆上清液能够模拟肝脏组织微环境诱导hUCMSC定向分化为有功能的肝细胞,表达肝细胞特异性蛋白AFP、CK18、TPH2,并且分泌Alb、尿素和HGF,具备CYP3A酶的活性,具有成熟肝细胞的功能。总之,肝组织匀浆上清液体外诱导法是一种有效的诱导hUCMSC定向分化为肝细胞的方法,并为干细胞的肝脏修复机制提供了数据。
[1]Secco M,Zucconi E,Vieira NM,et al. Multipotent stem cells from umbilical cord: cord is richer than blood. Stem Cells,2008,26:146-150.
[2]Han YF,Tao R,Sun TJ,et al. Optimization of human umbilical cord mesenchymal stem cell isolation and culture methods. Cytotechnology,2013,65:819-827.
[3]Lin GL,Hankenson KD. Integration of BMP, Wnt, and Notch signaling pathways in osteoblast differentiation. J Cell Biochem,2011,112:3491-3501.
[4]BuylK,De Kock J,Najar M,et al. Characterization of hepatic markers in human Wharton’s Jelly-derived mesenchymal stem cells. Toxicol In Vitro,2014, 28:113-119.
[5]Yan YM,Xu WR,Qian H,et al. Mesenchymal stem cells from human umbilical cords ameliorate mouse hepatic injury in vivo. Liver Int,2009,29:356-365.
[6]陈军,刘玉侠,姜文华,等. 体外诱导人脐带间充质干细胞向肝样细胞的分化.中国组织工程研究与临床康复,2010,14:9257-9261.
[7]任红英,赵钦军,邢文,等. 脐带间充质干细胞体外分化为有功能的低免疫原性肝细胞样细胞. 中国医学科学院学报,2010,32:190-194.
[8]Zhu ZY,Yan JQ,Han T. Long-term in vitro culture and hepatocytic differentiation of human umbilical cord-derived mesenchymal stem cells. Journal of Clinical Rehabilitative Tissue Engineering Research,2009,13:9792-9796.
[9]Campard D,Lysy PA,Najimi M,et al. Native umbilical cord matrix stem cells express hepatic markers and differentiate into hepatocyte-like cells. Gastroenterology, 2008,134:833-848.
[10]马欣,薛改,刘建芳,等. 肝匀浆上清液诱导人脐带间充质干细胞分化为肝样细胞. 中国组织工程研究,2013,17:7877-7884.
[11]Wang XY,Wu HH,Xue G,et al. Progesterone promotes neuronal differentiation of human umbilical cord mesenchymal stem cells in culture conditions that mimic the brain microenvironment. Neural Regen Res,2012,7:1925-1930.
[12]Ren H,Zhao Q,Cheng T,et al. No contribution of umbilical cord mesenchymal stromal cells to capillarization and venularization of hepatic sinusoids accompanied by hepatic differentiation in carbon tetrachloride-induced mouse liver fibrosis. Cytotherapy,2010,12:371-383.
[13]Yan Y,Xu W,Qian H,et al. Mesenchymal stem cells from human umbilical cords ameliorate mouse hepatic injuryin vivo. Liver International,2009,29:356-365.
[14]Zhang Z,Lin H,Shi M,et al. Human umbilical cord mesenchymal stem cells improve liver function and ascites in decompensated liver cirrhosis patients. J Gastroenterol Hepatol,2012,27:112-120.
[15]林沪,张郑,施明,等. 人脐带间充质干细胞治疗失代偿性肝硬化患者的初步研究. 肝脏,2010,17:79-82.
[16]于宏,王更银,孙殿兴,等. 脐带间充质干细胞经肝动脉灌注治疗失代偿期肝硬化患者. 肝脏,2011,16:185-190.
[17]Choi KS,Shin JS,Lee JJ,et al. In vitro trans-differentiation of rat mesenchymal cells into insulin-producing cells by rat pancreatic extract. Biochem Biophys Res Commun,2005,330:1299-1305.
[18]严永敏,李里明,李婷芬,等. 人脐带间充质干细胞体外诱导分化为肝细胞样细胞及ERK1/2 通路活化研究. 临床检验杂志,2012,30:591-598.
[19]潘兴南,魏开鹏. 肝细胞生长因子的浓度和诱导时间人骨髓间充质干细胞向肝细胞分化的影响. 肝脏,2013,18:382 -385.
[20]Campard D,Lysy PA,Najimi M,et al. Native umbilical cord matrix stem cell express hepatic markers and differentiate into heatocyte-like cells. Gastroenterology,2008,134:833-848.
[21]Purnapatre K,Khattar SK,Saini KS. Cytochrome P450s in the development of target-based anticancer drugs. Cancer Lett,2008,259:1-15.
[22]王忠琼,李昌平,杜光红,等. 多种细胞因子诱导骨髓间充质干细胞向肝细胞的分化. 中国组织工程研究与临床康复,2008,12:4035-4038.
(本文编辑:钱燕)
Differentiation of human umbilical cord mesenchymal stem cells into functional hepatocyte induced by liver homogenate supernatants in vitro
XUEGai,HANHua,CHENZe-sha,WUHong-hai,LIUJian-fang,HOUYan-ning.
DeparmentofPharmacology,BethuneInternationalPeaceHospital,Shijiazhuang050082,ChinaCorrespondingauthor:HouYan-ning,Email:biph2011@163.com
ObjectiveTo investigate functional characteristics of hepatocytes that differentiating from human umbilical cord mesenchymal stem cells (hUCMSCs) induced by liver homogenate supernatants (LHS). MethodsThe 3rd Passage of hUCMSCs were selected and divided into control group and LHS group. At three time points (3d, 5d, 7d) after being induced, the immunofluorescence-cytochemistry staining of alpha-fetoprotein (AFP), cytokeratin 18 (CK18), tryptophan hydroxylase 2 (TPH2), cytochrome P450 3A4 (CYP3A4), albumin (Alb) and hepatocyte growth factor (HGF) were performed, and the CYP3A enzyme activity and levels of HGF, Alb and BUN were detected. ResultsThe cells had expressed liver specific protein at the third day after LHS inducing, including AFP, CK18, TPH2, CYP3A4, Alb and HGF. In LHS group, the metabolism yield of midazolam, the specific metabolic substrates of enzyme CYP3A was increased significantly than that in control group (30.14±1.19, 50.20±6.24 and 120.85±15.52 ng/mg versus 0.026 to 0.030 ng/mg,P<0.01). Compared with control group, the secretion levels of HGF and Alb in LHS group were increased significantly at 3 time points. Additionally, the urea production of cells in LHS induction group increased 14 times more than that in control group (P<0.01). ConclusionThe study has demonstrated that hUCMSCs could differentiate into hepatocytes with mature functions in vitro after LHS induction.
Human umbilical cord mesenchymal stem cells; Inducting and differentiation; Liver homogenate supernatants; Hepatocyte
河北省卫生厅青年科技课题(20150122);军队“十二五”重点课题(BWS11J002)
050082石家庄白求恩国际和平医院药剂科(薛改,吴红海,刘建芳);河北省人民医院妇产科(韩华);河北省儿童医院药剂科(陈泽纱);河北医科大学研究生学院(侯艳宁)
侯艳宁,Email: biph2011@163.com
2016-03-21)