烟草硝酸盐转运蛋白基因 NtNRT2.4的克隆及表达分析
黄化刚,申燕,王卫峰,连文力,陈雪,翟欣,喻奇伟,杨振智,贾宏昉
1 河南农业大学烟草学院,烟草行业栽培重点实验室,郑州市文化路95号 450002;2 贵州省烟草公司毕节市公司,毕节 55107;3 中国烟草总公司广西壮族自治区公司,南宁 530022
生物技术
烟草硝酸盐转运蛋白基因NtNRT2.4的克隆及表达分析
黄化刚1,2,申燕2,王卫峰3,连文力1,陈雪2,翟欣2,喻奇伟2,杨振智2,贾宏昉1
1 河南农业大学烟草学院,烟草行业栽培重点实验室,郑州市文化路95号 450002;2 贵州省烟草公司毕节市公司,毕节 55107;3 中国烟草总公司广西壮族自治区公司,南宁 530022
植物NRT2基因家族(高亲和硝酸盐转运蛋白基因)在植物吸收和转运硝酸盐过程中发挥重要作用。本研究根据NRT2基因家族的保守序列设计兼并引物,扩增出一条821bp序列,以此序列为信息探针,通过电子克隆和RT-PCR的方法从烟草中克隆获得一个包含1593bp开放阅读框、编码530个氨基酸的cDNA序列,命名为NtNRT2.4。生物信息学分析表明,该基因编码的蛋白质具有NRT家族的共有结构特征,与烟草已发现的三个本家族基因同源性达到77.54%,与拟南芥NRT2家族基因同源性达到81.63%,其启动子中包含多个与硝酸盐、光照及根系特异表达相关的元件;组织特异表达分析结果显示,烟草NtNRT2.4基因的组织表达差异较大,在根部的表达量较高,在叶片和茎部的表达量低;不同氮素形态、光照和蔗糖处理下的基因表达分析结果表明,硝态氮、光照和蔗糖处理诱导NtNRT2.4表达,而铵态氮抑制其表达。
烟草;NtNRT2.4;克隆;表达分析
在烟叶生产过程中,氮素的用量与烟叶的产量和品质形成密不可分[1]。烟草是喜硝态氮作物,对土壤中硝态氮的吸收主要是通过硝酸盐转运蛋白来完成的[2]。到目前为止,在高等植物中已发现两种硝酸盐转运系统[3-4]:高亲和运输系统(high-affinity transport system, HATS)和低亲和运输系统(low-affinity transport system, LATS)。其中HATS的吸收动力学特征符合Michaelis-Mente方程,具有可饱和性,Km值较低,主要负责外在硝态氮浓度低于1 mmol/L时硝态氮的吸收;而LATS的吸收动力学或者Km值较高,呈线型不饱和特征,主要负责外在硝态氮浓度高于1 mmol/L时硝态氮的吸收。由于高亲和硝酸盐运输系统在低硝态氮条件下发挥作用,且部分家族成员受低硝态氮诱导表达,对该系统的研究将有助于提高作物的氮素利用率,已成为国内外学者重点研究热点。
高亲和硝酸盐转运蛋白是由硝酸盐转运蛋白NRT2家族基因编码的,属于MFS (major facilitator superfamily) 超家族成员,主要由12个跨膜结构域构成。第一个高亲和硝酸盐转运蛋白基因crnA是从曲霉菌中克隆出来,随后在衣藻中发现高亲和硝酸盐转运蛋白基因。植物NRT2基因最早是从大麦中分离(HvNRT2.1和HvNRT2.2),近年来又从水稻、拟南芥、玉米和烟草等高等植物中克隆到硝酸盐高亲和转运相关基因(NRT2)[5-12]。对植物NRT2家族成员的表达分析发现该家族基因不仅受NO3-调控,还受到pH、光照和糖等因素的影响[11]。对拟南芥的研究结果证实AtNRT2.1基因的mRNA表达与硝酸盐的吸收速率成正比,白天高晚上低,表明光照对一些NRT2家族基因起调节作用;同时在遮光下供应蔗糖可以提高AtNRT2.1基因转录水平[13]。目前已从烟草中克隆出高亲和硝酸盐转运蛋白基因NRT2家族成员有3个(预测可能有5~8个),均与硝酸盐吸收密切相关,但对于该家族成员是否受光和蔗糖调控还未见报道[13-14]。
本研究根据烟草、拟南芥和水稻等物种NRT2基因序列,采用同源序列克隆法获得烟草NRT2基因家族新成员NtNRT2.4,对其进行了生物信息学分析和硝态氮、铵态氮、光照和糖的应答机制的研究,为利用NRT2基因改良烟草的氮素吸收和调控能力提供理论依据。
1 材料与方法
1.1 供试材料
本研究以普通烟草品种K326为试材,烟草植株培养在16h/8h (光/暗)周期的培养箱中,光强为300μmol. m-2·s-1,温度设置为25°C/21°C (光/暗),相对湿度设置为60%。待培养至3-4片真叶后,选取大小一致的幼苗移至沙培育苗盘中,营养液培养至五叶期,营养液的配方及浓度为:2mM KNO3,1 mM NH4NO3,1 mM NaH2PO4,0.5 mM Ca(NO3)2,0.25 mM CaCl2,0.5 mM MgSO4,20µM Fe-EDTA,9µM MnCl2,46µM H3BO3,8µM ZnSO4,3µM CuSO4,0.03 µM (NH4)2MoO4,pH调至6.0左右。氮素形态试验设置正常供氮处理(1 mmol/L NO3-和1 mmol/L NH4+)、缺氮处理(无氮素)、单一铵态氮NH4+(2 mmol/L NH4+)和单一硝态氮NO3-(2 mmol/L NO3-)共4个处理,处理时间为7d,第个处理设置10棵烟株。处理后收集烟株的根、茎和叶片,迅速置于液氮中,于-80℃冰箱冻存,用于基因表达分析。光照应答机制试验是在硝态氮处理(2 mmol/L NO3-)条件下取一个光周期内(16h光照/8h黑暗)的样品,第隔4h取一次,共取6次(首次取样为早6:00,光照开始),研究光暗交替条件下该基因的表达规律,无对照;以光暗交替试验为对照,在光照应答机制研究的基础上设置黑暗时间点添加外源糖试验,研究外源糖处理对该基因表达的影响;光照和蔗糖试验样品均只取根系,迅速置于液氮中,于-80℃冰箱冻存,用于基因表达分析。
1.2 NtNRT2.4基因及启动子的克隆
参考GenBank收录的烟草、拟南芥和水稻等物种NRT2基因序列,采用Primer 5.0 软件设计烟草兼并引物(表1-NRT2兼并引物),选取兼并引物在普通烟草K326中扩增的片段序列(821bp)作为信息探针,应用 Sol genomics network和NCBI网站的Blast程序搜索烟草EST序列数据库。利用DNAstar软件中的Seqman程序将搜索到的EST序列与种子序列进行拼接、比对和组装,以组装的重叠群(contig)序列作为信息探针在烟草EST数据库中进行检索和拼接,获得烟草NRT2基因及启动子的电子延伸序列。在获得NRT2.4基因和启动子拼接序列的基础上,分别设计扩增NRT2.4全长基因及启动子的引物(表1),以缺氮处理的烟草根部位cDNA为模板进行PCR扩增,扩增条件为:94℃ 5 min ;94℃ 30 s ,58℃30s,72℃ 2min ,35 个循环,72℃ 5 min。将扩增目的片段连接在中间载体pMD19-T上,送Invitrogen生物公司测序验证。
1.3 序列分析方法
利用DNAStar软件的ORF fi nder进行基因序列ORF区的查找和蛋白翻译;利用DNAMAN进行拟南芥和烟草的NRT2家族核苷酸和氨基酸序列比对;利用NetPhos 2.0 Serve(http://www.cbs.dtu.dk/services/NetPhos/)软件对NtNRT2.4的氨基酸序列进行磷酸化位点的预测;利用SMART程序和ScanProsite (au.expasy.org/prosite)网站预测蛋白特性;利用TMPRED软件(http://ch.embnet.org/cgi-bin/TMPRED)进行跨膜预测;利用PLANTCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)在线工具对启动子序列元件进行分析。
1.4 NtNRT2.4基因表达分析
采用Trizol法提取烟草根、茎和叶三个部位的总RNA,样品通过随机引物法反转录合成cDNA。应用Primer Premier 5.0软件设计烟草NRT2.4基因的扩增引物(表1-RT-NRT2.4)。以烟草组成型表达基因L25作为内参。按照Invitrogen公司的RealMasterMix(SYBR Green)试剂盒说明书进行实时定量RTPCR,实时定量的实验数据采用2-ΔΔCt算法[12]进行分析,假设目的基因在胁迫处理下的表达量是对照(正常培养)的N倍,N = 2-ΔΔCt,ΔΔCt = Treat(Ct样品 - CtL25)- CK(Ct样品 - CtL25)。
2 结果与分析
2.1 烟草NtNRT2.4基因的克隆与序列分析
通过设计NRT2基因家族的兼并引物,以缺氮处理2周的普通烟草(K326)根系cDNA为模板,扩增出一条821bp的未知序列,测序后在NCBI数据库进行BLAST比对,发现该基因为一个未报道的烟草NRT2家族基因(结果未显示)。以此序列为信息探针,在NCBI烟草EST数据库中搜索到20条高度同源序列,电子拼接后获得一条长度为2010 bp的烟草NRT2基因序列。根据序列信息设计跨起始密码子和终止密码子的引物(表1-NRT2.4 full length),RTPCR扩增该基因全长测序,结果表明该序列与电子拼接结果一致。全长1593bp(图1),编码530个氨基酸。


图1 烟草NtNRT2.4基因的全长cDNA序列Fig. 1 Full length cDNA sequences of NtNRT2.4 in tobacco
Blast序列比对分析发现,克隆基因与已知同科植物NtNRT2基因编码的氨基酸序列高度同源(图2),与烟草已发现的三个本家族基因同源性达到77.54%,其中与NtNRT2.1基因的同源性为69.13%,与NtNRT2.2基因的同源性为69.90%,与NtNRT2.3基因的同源性为54.62%。进一步把该基因与拟南芥家族基因(AtNRT2.1-2.4)进行比对,发现与拟南芥NRT2家族同源性高达81.63%。结果表明该cDNA序列为烟草NRT2家族基因新成员,将该基因命名为NtNRT2.4。

图2 烟草和拟南芥NtNRT2家族的氨基酸序列比对Fig. 2 Alignment of the predicted amino acid sequences of NtNRT2 in tobacco and Arabidopsis
2.2 NtNRT2.4编码的蛋白质生物学信息分析
2.2.1 NtNRT 2.4 基因序列分析
为预测NtNRT2.4基因的基本功能,本研究通过ExPASy ProtParam(http://web.expasy.org/protparam/)在线工具分析NtNRT2.4蛋白的氨基酸序列,结果表明该基因编码530个氨基酸残基,理论等电点为9.34,分子量57.974kD,化学式为C4992H8371N1609O2116S333,包括26个酸性氨基酸(Asp +Glu)残基,39个碱性氨基酸(Arg + Lys)残基。进一步分析其不稳定指数(Ⅱ),发现NtNRT2.4基因编码的蛋白质不稳定性指数(Ⅱ)为33.08,属于比较稳定的蛋白,符合硝酸盐转运蛋白NRT2家族的蛋白特征。
蛋白质的磷酸化与去磷酸化过程在细胞的信号识别与转导、生物的代谢调控过程中起重要作用,为验证NtNRT2.4所编码蛋白能否通过磷酸化和去磷酸化起作用,利用NetPhos 2.0 Serve(http://www.cbs.dtu.dk/services/NetPhos/)软件对NtNRT2.4的氨基酸序列进行磷酸化位点的预测。发现NtNRT2.4氨基酸序列有9个丝氨酸,7个苏氨酸和3个酪氨酸,推测在这些位点可能发生磷酸化。
2.2.2 NtNRT2.4的跨膜结构域分析
通过TMHMM(http://genome.cbs.dtu.dk/services/TMHMM- 2.0)软件分析NtNRT2.4的跨膜结构,分析结果如图3所示,NtNRT2.4包括6个N端的跨膜区以及6个C端的跨膜区;氨基酸N末端朝向细胞内,C末端朝向细胞外,12个疏水的跨膜区域由一个带电荷的亲水区分隔成2组,第组各6个,在第六个和第七个跨膜区之间有一个中央亲水环分隔开。结果表明NtNRT2.4是膜整合蛋白,该蛋白的主要结构是α-螺旋,具有NRT2家族的共有结构特征。
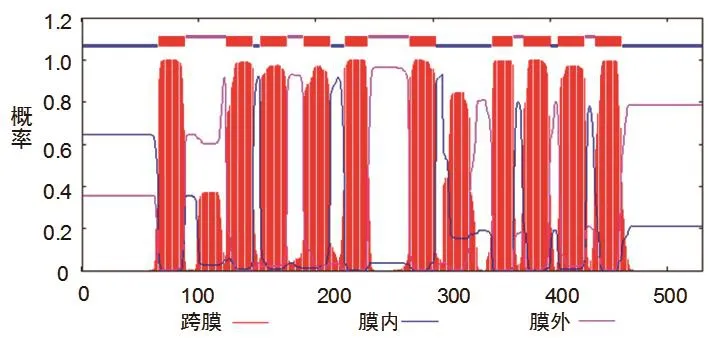
图3 NtNRT2.4蛋白跨膜结构域分析Fig. 3 Transmembrane (TM) topology models of NtNRT2.4
2.2.3 NtNRT2.4同源性分析与功能预测
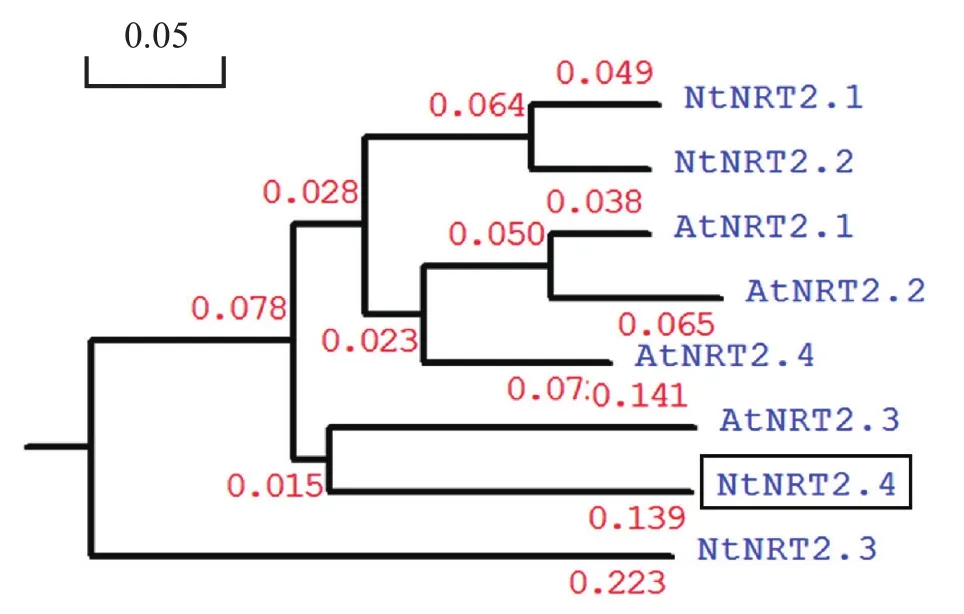
图4 NtNRT2.4的同源性分析Fig. 4 Phylogenetic analysis of tobacco NtNRT2.4 and other plant NRT2 homologs
利用ClustalX和DNAMAN等聚类比较软件,将NtNRT2.4基因序列植物中已知拟南芥和烟草的NRT2家族基因进行序列比对和进化树分析,研究NtNRT2.4基因与其余家族成员的关系以及潜在功能。结果如图4所示,与烟草NtNRT2.4同源关系最近的为双子叶植物拟南芥AtNRT2.3。前人研究结果表明AtNRT2.3主要在根中表达且受硝酸盐调控,负责硝酸盐的吸收,我们推测NtNRT2.4基因具有与拟南芥AtNRT2.3基因相似的功能。
2.3 NtNRT2.4 启动子的克隆及分析


图 5 烟草硝酸盐转运蛋白NtNRT2.4基因启动子克隆及分析Fig. 5 Cloning and analysis of NtNRT2.4 promoter from tobacco
以烟草NtNRT2.4基因全长序列为探针,利用Sol genomics network网站进行BLAST搜索,在ATG上游发现一段长1000bp的启动子序列。设计引物(表1-NRT2.4 Pro)扩增该目的片段,测序发现该片段与Sol genomics network网站上传序列一致。进一步利用PLANTCARE程序对NtNRT2.4基因启动子序列进行motif分析,除发现启动子所必须的TATABOX和CAAT-BOX外,在NtNRT2.4启动子中有很多与组织特异表达相关的顺式作用元件,例如Root motif box (ATATT),还有可能与硝酸盐调控有关的A(C/G)TCA,氮信号相关的GATABOX (GATA)和DOFCOREZM (AAAG),与光照相关的3-AF、BOX-I等(图5)。这些顺式调控元件可以作为研究基因启动子表达和调控机制的研究依据。
2.4 NtNRT2.4的表达特性
2.4.1 不同氮素形态下 NtNRT2.4的组织表达特性分析
本研究利用半定量和定量PCR方法进一步分析了烟草NtNRT2.4基因的组织表达特性,结果表明:NtNRT2.4基因在烟草的根、茎和叶均有表达,但组织间的表达差异较大,NtNRT2.4基因在烟草根部的表达量最高,是叶片和茎部的表达量的4-5倍;半定量RT-PCR结果显示茎和叶基本检测不到表达量(图6);对不同氮素形态的研究表明该基因受硝态氮调控增强表达,比正常供氮条件下提高40%-60%,且在缺氮条件下该基因表达量最高,达到正常供氮条件下的2倍。相反的,该基因受铵态氮影响降低表达,其中根部表达量仅有正常供氮条件下的60%。
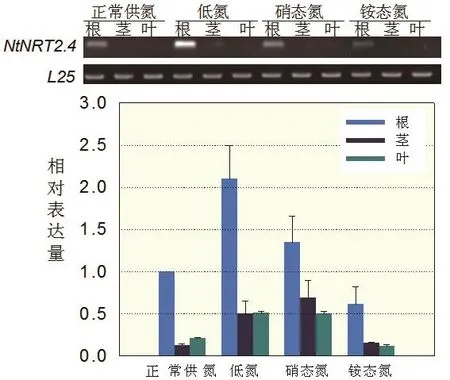
图6 不同氮素形态下NtNRT2.4的组织表达分析Fig. 6 Expression patterns of NtNRT2.4 in tobacco
2.4.2 光和蔗糖对NtNRT2.4的表达特性影响分析

图7 烟草根系NtNRT2.4受光照和蔗糖调控表达模式Fig. 7 Response of NtNRT2.4 expression to diurnal light/dark changes and to changes of sucrose in roots of tobacco
半定量和实时定量RCR结果均表明,烟草NtNRT2.4基因不仅受氮素形态的调控,而且受光照和蔗糖的调控(图7)。为了研究光源对烟草NtNRT2.4基因表达的影响,选取四片真叶完全展开的烟草幼苗转移到含2 mmol/L NO3-的营养液中生长3天,培养箱中提供的光源时间为06:00 am-22:00 pm,光照强度为300 µmol·m-2s-1,第4天开始在不同的时间点采取烟草根系样品提取RNA。图7A的结果表示,NtNRT2.4的表达水平随着白天、黑夜而变化,该基因的表达水平在提供光源4h (10:00 am)后达到一个峰值,而基因在关闭光源的时候 (22:00 pm),表达水平出现第二个峰值,但总体水平显著低于10:00 am时基因的表达水平。
本研究进一步分析了外源C源对烟草根系NtNRT2.4表达的影响,同样选取四片真叶完全展开的烟草幼苗转移到含2 mmol/L NO3-的营养液中生长3天,第3天关闭光源的时候,在营养液里加入3%的蔗糖,然后分别在4h和8h后采取烟草根系样品提取RNA。图7B的结果表明加入蔗糖后,NtNRT2.4转录水平比22:00pm时间点提高了3-4倍,而在不加蔗糖的情况下02:00am 和06:00am时间点的基因表达量远远低于22:00pm时间点(图7A)。
3 结论与讨论
植物NRT2基因家族(高亲和硝酸盐转运蛋白基因)在植物吸收和转运硝酸盐过程中发挥重要作用。本研究通过NRT2基因家族的保守序列设计兼并引物,从普通烟草(K326)中克隆出一个新的烟草硝酸盐转运蛋白基因(命名为NtNRT2.4),该基因编码的蛋白质具有NRT家族的共有结构特征,与烟草已发现的3个本家族基因同源性达到77.54%,与拟南芥NRT2家族基因同源性达到81.63%;进一步分析烟草NtNRT2.4基因的表达特征发现该基因主要在根部表达,负责硝酸盐的吸收,且受硝态氮、光照和蔗糖处理诱导增强表达,而受铵态氮影响抑制表达。
随着植物基因组测序工作的推进以及分子生物学技术不断的发展,已经在很多种植物中发现和克隆到多个高亲和硝酸盐转运蛋白基因,它们在结构上有着重要的相似性[5]。通过氨基酸比对和蛋白功能域预测,本研究发现NtNRT2.4基因编码的蛋白质与已经报道的拟南芥和烟草等高等植物硝酸盐转运蛋白结构上具有高度的同源性,功能结构域高度保守,具有典型的高亲和转运蛋白家族成员特征,属于高亲和NO3-转运蛋白(NRT2)。进一步通过系统进化树分析,该基因与拟南芥中的AtNRT2.3基因的关系最近,可能主要负责硝酸盐的吸收,这与本研究的基因组织表达特征相一致。
拟南芥和水稻根部的NRT2.4基因均能够受硝酸盐调控增加表达量[13,15-16]。半定量PCR结果表明烟草NtNRT2.4基因在烟草根部的表达量最高,在叶片和茎部基本检测不到表达(图6)。实时荧光定量PCR技术检测NtNRT2.4在根、茎、叶中均有表达,但在根中NtNRT2.4的表达量大约是茎和叶中的4-5倍。半定量和定量PCR结果均表明该基因主要在根部表达,这与本研究发现该基因启动子中包含大量Root motif box (ATATT)相一致(图5)。进一步的研究需要通过NtNRT2.4基因的转基因功能验证实来完成。
已有报道表示在很多植物中NO3-吸收是受昼夜节律调控[17]。植物本身的生物钟调控着NO3-转动蛋白的表达以及对NO3-的吸收。拟南芥中的研究结果表明,AtNRT2.1和AtNRT1.1基因在根系的转录水平受到光和昼夜节律变化的调控,而且在遮光并加入蔗糖后,这两个基因的表达丰度都迅速提高。本研究对启动子的分析结果表明NtNRT2.4基因中包含大量的光调控元件(图5)。进一步的基因表达特性分析显示,NtNRT2.4受光照处理诱导,这与我们的启动子分析结果相一致;虽然NtNRT2.4受蔗糖处理诱导,但是在启动子中并未发现已知的蔗糖调控元件,这表明该启动子中可能有许多潜在的未发现的蔗糖诱导调控元件。
迄今为止,NO3-不仅是一种重要的氮素营养物质,更是做为一个重要的信号物质受到科研工作者的高度重视[18]。然而,高等植物中的硝酸盐转运蛋白功能,尤其是调控因子还没有真正得到明确。本研究对烟草高亲和硝酸盐转运蛋白家族NtNRT2.4基因的克隆和表达分析为了解烟草硝酸盐转运蛋白的功能和调控提供了一定的研究基础,为进一步通过分子改良进行氮素营养调控提供了理论依据。
[1] 史宏志,韩锦峰. 烤烟碳氮代谢几个问题的探讨[J]. 烟草科技,1998(2):34-36.
[2] Wang YY, Hsu PK, Tsay YF. Uptake, allocation and signaling of nitrate [J]. Trends in plant science, 2012, 17 (8): 458-467.
[3] Forde BG. Nitrate transporters in plants: structure, function and regulation [J]. Biochimica biophysica acta, 2000, 1465(12):219-235.
[4] Williams LE, Miller AJ. Transporters responsible for the uptake and partitioning of nitrogenous solutes [J]. Annu Rev Plant Physiol Plant Mol Biol, 2001, 52(1): 659-688.
[5] Campble WH. Nitrate reductase structure, function and regulation: bridging the gap between biochemistry and physiology [J]. Annual Review of Plant Physiology, 1999,50(1):277-303.
[6] Trueman LJ,Richardson A,Forde B G. Molecular cloning of higher plant homologues of the high-affinity nitrate transporters ofChlamydomonas reinhardtii and Aspergillus nidulans[J]. Gene, 1996, 175(1-2): 223 - 231.
[7] Vidmar JJ, Zhuo D, Siddiqi MY, et al. Isolation and characterization of HvNRT2.3 and HvNRT2.4,cDNAs encoding high-affinity nitrate transporters from roots of barley[J]. Plant Physiology, 2000, 122(3): 783 - 792 .
[8] Quesada A, Krapp A, Trueman LJ, et al. PCR-identification of aNicotiana plumbaginifoliacDNA homologous to the high-affinity nitrate transporters of the crnA family [J]. Plant Molecular Biology, 1997, 34(2):265 - 274.
[9] Amarasinghe BH,De Bruxelles GL,Braddon M,et al.Regulation of GmNRT2 expression and nitrate transport activity in roots of soybean (Glycine max) [J]. Planta,1998,206(1):44- 52.
[10] Quaggiotti S, Ruperti B, Borsa P, et al. Expression of a putative high-affinity NO3-transporter and of an H+-ATPase in relation to whole plant nitrate transport physiology in two maize genotypes di ff erently responsive to low nitrogen availability[J].Journal of Experiment Botany,2003,54: 1023- 1031.
[11] 赵学强,李玉京,刘建中,等. 小麦NO3-转运蛋白基因TaNRT2.3的克隆和表达分析[J]. 植物学报,2004,46(3):347 - 354 .
[12] 张洪映,贾宏昉,张松涛,等. 烟草非生物胁迫应答基因NtSnRK2.1的克隆与表达分析[J].中国烟草学报,2014, 20(4):94-99
[13] Orsel M, Krapp A, Daniel-Vedele F. Analysis of the NRT2 nitrate transporter family in Arabidopsis. Structure and gene expression [J]. Plant Physiology,2002(2): 886 - 896.
[14] 许金,谢小东,冯爽,等. 烟草硝酸盐转运蛋白基因的克隆及表达分析[J]. 烟草科技, 2013,7:68-71
[15] Cai CH, Wang JY, Zhu YG, et al.Gene structure and expression of high-af fi nity nitrate transport system in rice roots [J]. Journal of Integrative Plant Biology, 2008, 50(2):443-451.
[16] Yan M, Fan XR, Feng HM, et al. Rice OsNAR2.1 interacts with OsNRT2.1, OsNRT2.2 and OsNRT2.3a nitrate transporters to provide uptake over high and low concentration ranges [J]. Plant Cell and Environment, 2011, 34(8):1360-1372.
[17] Lejay L, Tillard P, Lepetit M, et al. Molecular and functional regulation of two NO3-uptake systems by N and C status of Arabidopsis plants [J]. Plant Journal, 1999, 18(5): 509-519.
[18] Konishi M, Yanagisawa S. Identi fi cation of a nitrate-responsive cis-element in the Arabidopsis NIR1 promoter defines the presence of multiple cis-regulatory elements for nitrogen response [J]. Plant Journal, 2010, 63(2): 269-282.
Cloning and characterization ofNtNRT2.4 gene fromNicotiana tabacumL.
HUANG Huagang1,2, SHEN Yan2, WANG Weifeng3, LIAN Wenli1, CHEN Xue2, ZHAI Xin2, YU Qiwei2, YANG Zhenzhi2, JIA Hongfang1
1 Key laboratory of Tobacco Cultivation, College of Tobacco Science, Henan Agricultural University, Zhengzhou 450002, China;2 Guizhou Bijie Municipal Tobacco Company, Bijie 551700, Guizhou, China;3 Guangxi Zhuang Autonomous Region Tobacco Company, Nanning 530022, China
NRT2gene plays a critical role in nitrate absorption and transport in plants. 821bp sequence ofNRT2gene was screened from cDNA library. Based on the sequence,NtNRT2.4 was isolated from tobacco (Nicotiana tabacumL.) by in silico cloning and RT-PCR.NtNRT2.4 includes an open reading frame (ORF) of 1593 bp and encode 530 deduced amino acid residues (AAR). Phylogenetic analysis suggested thatNtNRT2.4 was high homologous to its paralogous genes from tobacco (77.54%) and orthologous genes fromArabidopsis(81.63%), which were also induced by nitrate stresses. Promoter analysis suggestedNtNRT2.4 had large amount of motif involved in N and light metabolism. Reverse transcription-polymerase chain reaction (RT-PCR) and quantitative real-time PCR (qRT-PCR) were used to determine expression patterns ofNtNRT2.4 in tobacco. Results revealed thatNtNRT2.4 expressed more in tobacco roots and less in leaves and stems. Expression patterns under light and sugar responses suggested thatNtNRT2.4 was involved in response to light and sugar treatment, with signi fi cant di ff erent responsive pro fi les.
Nicotiana tabacum;NtNRT2.4; cloning; expression analysis
黄化刚,申燕,王卫峰,等. 烟草硝酸盐转运蛋白基因NtNRT2.4的克隆及表达分析[J]. 中国烟草学报,2016,22(1)
贵州省烟草公司毕节市公司科技攻关项目(毕节合 2014-59) ;河南省高等学校重点科研项目(15A210029)
黄化刚(1982—),博士,在读博士后,高级农艺师,从事烟草植物营养方面研究,E-mail: huanghg82@gmail.com
贾宏昉(1982—),博士,讲师,从事烟草生物技术研究,E-mail: jiahongfang@126.com
2015-
: HUANG Huagang, SHEN Yan, WANG Weifeng, et al. Cloning and characterization ofNtNRT2.4 gene fromNicotiana tabacumL. [J]. Acta Tabacaria Sinica, 2016,22(1)

