液相色谱串联质谱法快速测定猪肉中克伦特罗残留量
张 艳,陈 国,吕 燕,吴银良*
(宁波市农业科学研究院,浙江 宁波 315040)
液相色谱串联质谱法快速测定猪肉中克伦特罗残留量
张 艳,陈 国,吕 燕,吴银良*
(宁波市农业科学研究院,浙江 宁波 315040)
建立快速测定猪肉中克伦特罗残留量的液相色谱串联质谱分析方法。猪肉样品在碱化的条件下用乙酸乙酯提取,提取后用甲酸溶液进行反萃取,萃取液经正已烷脱脂后直接进行液相色谱串联质谱(liquid chromatography with tandem mass spectrometry,LC-MS/MS)分析。采用Acquity BEH C18色谱柱分离,用0.1%甲酸溶液-甲醇作为流动相进行梯度洗脱,电喷雾正离子(ESI+)模式电离,多反应监测(multiple reaction monitoring,MRM)模式检测,同位素稀释内标法定量。克伦特罗在0.05~10.0 μg/L范围内建立的曲线相关系数大于0.999;方法检测限为0.10 μg/kg,定量限为0.25 μg/kg。克伦特罗在猪肉中的添加量为0.25、0.50、0.75 μg/kg时,平均回收率在95.9%~101.5%之间,批内相对标准偏差(relative standard deviation,RSD)在3.3%~4.6%之间,批间RSD在4.1%~5.1%之间。该方法能满足猪肉中克伦特罗残留量快速分析的要求。
克伦特罗;快速测定;液相色谱串联质谱法;残留量
DOI∶10.15922/j.cnki.rlyj.2016.10.006
引文格式:
张艳, 陈国, 吕燕, 等. 液相色谱串联质谱法快速测定猪肉中克伦特罗残留量[J]. 肉类研究, 2016, 30(10): 30-34. DOI:10.15922/j.cnki.rlyj.2016.10.006. http://rlyj.cbpt.cnki.net
ZHANG Yan, CHEN Guo, LÜ Yan, et al. Fast determination of residual clenbuterol in pork by liquid chromatography with tandem mass spectrometry[J]. Meat Research, 2016, 30(10): 30-34. (in Chinese with English abstract) DOI:10.15922/j.cnki. rlyj.2016.10.006. http://rlyj.cbpt.cnki.net
克伦特罗属于β2-受体激动剂类药物,该类药物的主要效应为支气管和肠壁平滑肌松弛,所以在医用和兽医临床上主要用于治疗支气管炎。在畜牧生产中,当克伦特罗添加在饲料中使用时可导致动物体内的脂肪分解代谢增强,提高酮体瘦肉率、增加体质量和提高饲料转化率,致使我国在上世纪未生猪生产中大量使用克伦特罗。但是由于克伦特罗容易在动物组织,特别是肝脏和肺脏中形成残留,导致人畜中毒。因此,有必要对快速测定动物组织中克伦特罗残留量的分析方法加强研究。
自本世纪初以来,科学家们对于包括克伦特罗在内的β2-受体激动剂类药物在生物样品中的残留分析方法进行了大量的研究,建立了许多残留分析方法,主要有酶联免疫吸附法[1-3]、液相色谱法[4-7]、气相色谱-质谱法[8-11]和液相色谱串联质谱法[12-19]等;然而已建立的绝大部分液相色谱串联质谱(liquid chromatography with tandem mass spectrometry,LC-MS/MS)方法由于要同时测定多种β2-受体激动剂类药物,在前处理步骤中不仅包括了费时的酶解步骤,而且通常采用固相萃取方法进行样品净化,这最终导致这些方法无法满足克伦特罗单个药物的快速分析需求。本实验考虑到克伦特罗在体内主要以原形代谢为主[20],轭合物的比例不超过5%,同时克伦特罗易溶于酸性溶液的特点,建立了快速提取和净化的前处理步骤,该方法的建立能充分满足动物性食品安全实际监管中单一快速确证克伦特罗的需要。
1 材料与方法
1.1 材料与试剂
空白猪肉样品 宁波市江东区欧尚超市。
盐酸克伦特罗(99%) 中国药品生物制品检定所;盐酸克伦特罗-D9(100 μg/L) 德国Dr. Ehrenstorfer公司;乙腈(色谱纯) 美国Thermo-Fisher公司;甲酸(色谱纯) 美国天地有限公司;甲醇(色谱纯)美国默克公司;其他试剂均为分析纯试剂。
1.2 仪器与设备
配有电喷雾离子源液相色谱串联质谱联用仪美国Waters公司;Ultra-Tyrrax T25型匀质器 德国IKA公司;SIGMA3K15离心机 北京博励行有限公司;Milli-Q超纯水仪 美国Millipore公司。
1.3 方法
1.3.1 标准溶液的配制
1.3.1.1 标准储备液(100 μg/mL)
准确称取适量盐酸克伦特罗标准品(含克伦特罗10.0 mg)于100 mL容量瓶中,用适量甲醇溶解后,再用甲醇定容至刻度,储备液含克伦特罗质量浓度为100 μg/mL。
1.3.1.2 标准工作液
克伦特罗标准工作液(0.05、0.125、0.25、0.5、2.5、10 μg/L)采用储备液用流动相稀释的方式配制,现配现用。
1.3.2 样品前处理
称取5.0 g样品于带盖的聚四氟乙烯离心管中,依次加入3 mL质量浓度为10 g/100 mL的碳酸钠溶液和20 mL乙酸乙酯,然后旋涡混合30 s后高速均质1 min,再以5 000 r/min速度离心2 min,吸取有机层于另一离心管中加入5 mL体积分数为2.0%的甲酸溶液进行反萃取,旋涡混合30 s,5 000 r/min离心2 min后吸取2 mL下层甲酸溶液于10 mL聚四氟乙烯离心管中,加入2 mL正已烷,旋涡混合30 s,静置1 min后吸取下层水溶液过0.22 μm滤膜后进行仪器分析。
1.3.3 仪器条件
色谱柱:Acquity BEH C18色谱柱(100 mm× 2.1 mm,1.7 μm);流动相:A相:0.1%甲酸溶液,B相:甲醇;梯度洗脱条件:B相在0.5 min内保持10%,在2.5 min内线性增加到90%,再保持0.5 min,然后在0.1 min内降至10%,保持0.9 min,整个梯度洗脱用时4.5 min;流速0.30 mL/min;进样量10 μL。
电喷雾(electron spray ionization,ESI)离子源正离子模式电离;多反应监测(multiple reaction monitoring,MRM)模式监测;毛细管电压:2.5 kV;萃取锥孔电压:20 V;离子源温度:150 ℃;脱溶剂气温度:500 ℃;RF透镜电压:0.5 V;脱溶剂气流速:1 000 L/h;锥孔气流速:50 L/h;倍增器电压:650 V;二级碰撞气:氩气;克伦特罗监测离子对分别为277.16>131.87和277.16>202.96;克伦特罗-D9监测离子对286.29>132.78。
2 结果与分析
2.1 仪器条件的建立
克伦特罗分子结构中含有一个氨基基团,易形成较为稳定的[M+H]+准分子离子,因此目前所建立的LC-MS/MS分析方法均采用ESI+模式。本研究利用仪器配备的IntelliStart软件,采用“T”三通方式,进行了克伦特罗及其内标物的定性定量离子对等质谱分析参数的研究和优化,所获得的最佳质谱条件详见1.3.3节。
利用LC分析克伦特罗时,采用乙腈为有机相时,同样色谱条件下出峰时间明显快于甲醇为有机相时;当分别采用0.1%甲酸溶液-乙腈和0.1%甲酸溶液-甲醇进行梯度洗脱分析克伦特罗时,前一种溶液作为流动相时克伦特罗的响应小于后一种溶液作为流动相时克伦特罗的响应,但灵敏度差异较小,而本研究考虑到0.1%甲酸溶液-甲醇作为流动相时的响应较高,采用0.1%甲酸溶液-甲醇作为流动相对克伦特罗进行分析。利用上述色谱和质谱条件获得的标准溶液图谱详见图1a,克伦特罗保留时间为2.93 min左右。
2.2 前处理条件的研究
本研究中的提取净化的步骤主要参照农业行业标准NY/T 468—2006《动物组织中盐酸克伦特罗的测定 气相色谱/质谱法》,但首先考虑到方法快速,一定要尽量精简前处理过程,于是结合本研究中的定量方法为同位素内标稀释定量的特点,将原标准中2 次乙酸乙酯提取改为1 次乙酸乙酯提取,改动后虽然绝对回收率从原来约85%左右降为现约65%,但大大简化了步骤;其次本研究将原标准中盐酸溶液反萃取改变为甲酸溶液反萃取,并对甲酸溶液中甲酸体积分数对反萃取回收率的影响进行了实验,实验发现当甲酸体积分数分别为0.5%、1.0%、2.0%、5.0%时,反萃取回收率分别为85.5%、92.8%、95.2%、95.6%,因此本研究将甲酸溶液中的甲酸体积分数设为2.0%;最后考虑到本研究中的仪器方法为LC-MS/MS法,直接将反萃取的甲酸溶液进样,然而发现克伦特罗出峰出现分叉,详见图2,根据前处理过程所用的试剂和步骤,很可能是由于甲酸溶液中带有的乙酸乙酯造成的,于是为去掉残余的乙酸乙酯,增加了一步正已烷去脂步骤,结果发现克伦特罗出峰较好,且克伦特罗出峰处无杂峰干扰,如图1b、c所示。
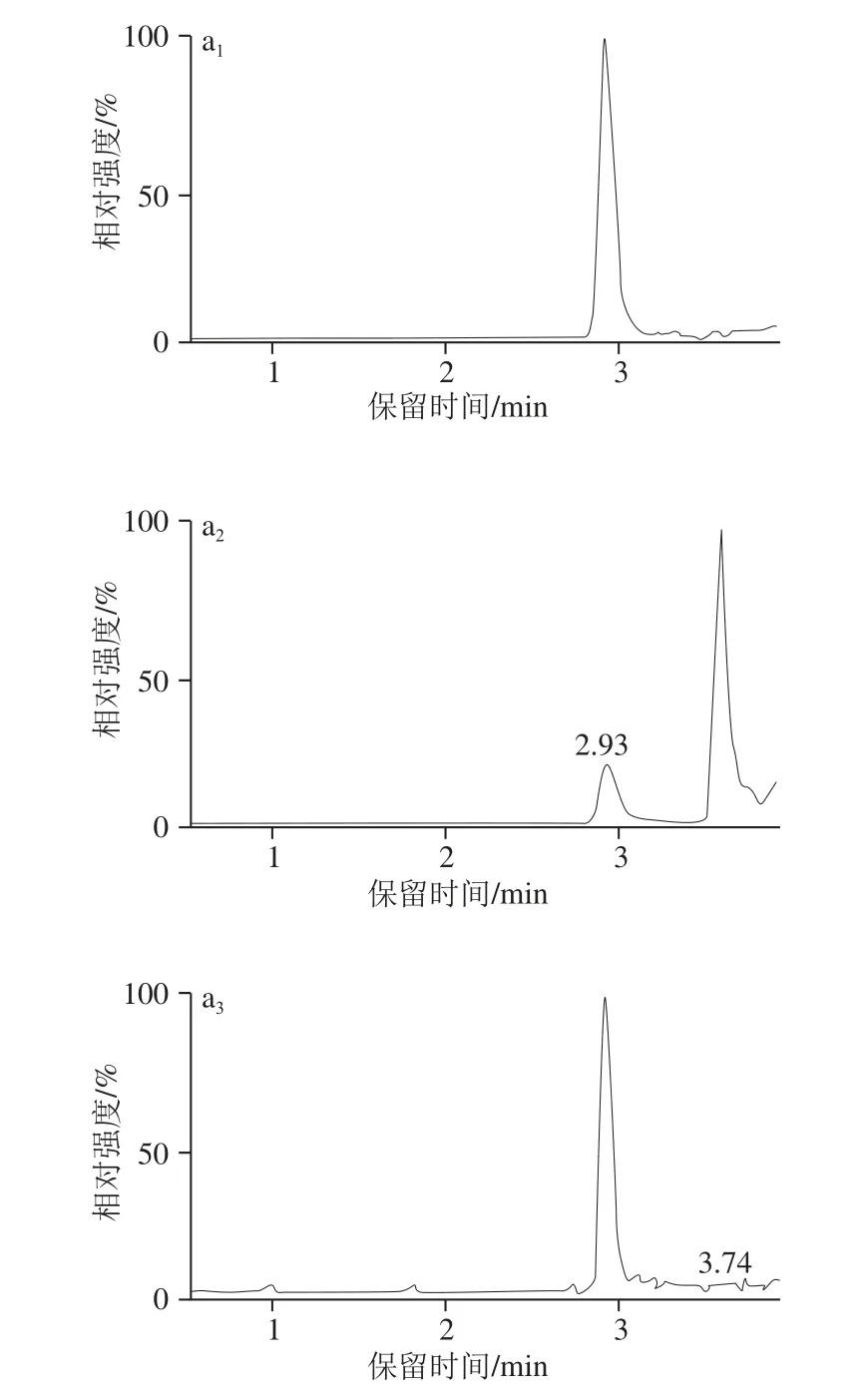
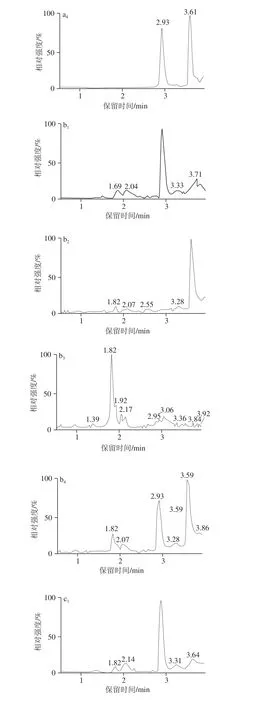
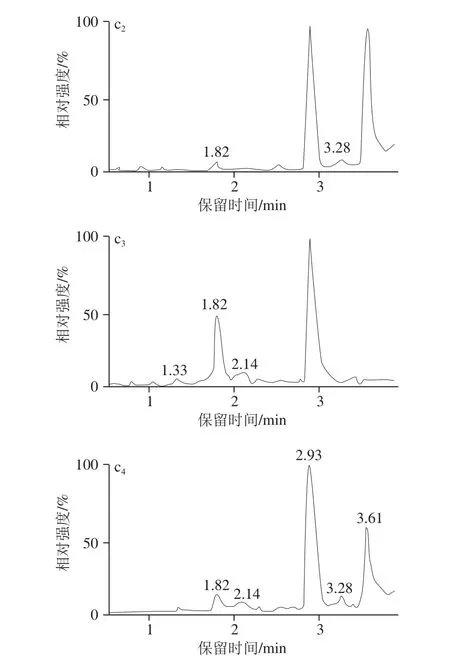
图1 0.12255 μgg/L克伦特罗标准溶液(aa11~~44)、空白样品(bb11~~44)和添加样品(00..5500 μgg//kkgg(cc11~~44)MRRMM色谱图Fig. 1 MRM chromatograms of clenbuterol standard solution (0.125 μg/L) (a1-4), blank (b1-4) and fortified sample (0.50 μg/kg) (c1-4)
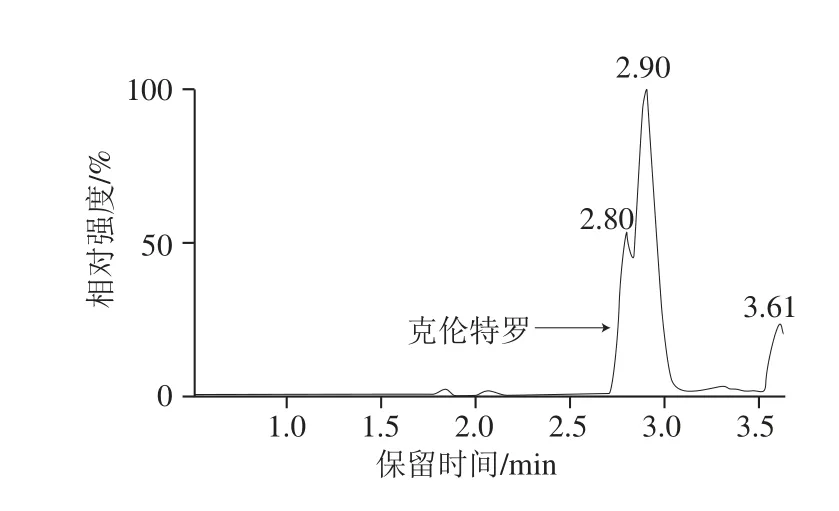
图2 猪肉添加样品总离子色谱图Fig. 2 Total ion chromatogram of fortified pork sample
2.3 线性实验
采用流动相稀释的方式配制标准工作溶液后,每个质量浓度标准工作溶液进样3 次,然后对克伦特罗在0.05~10 μg/L质量浓度范围内根据待测物定量离子对(277.16>131.87)与内标离子对峰面积比值对质量浓度作图,得到的标准曲线方程为y=1.956 4x+0.010 5,相关系数为0.999 8,大于0.999,说明本研究建立的仪器分析条件适用于克伦特罗残留量的分析。
2.4 回收率、精密度和检出限
采取称取空白猪肉样品加入标准工作溶液的方式配制添加样品,添加量分别为0.25、0.50、0.75 μg/kg,配制后按照1.3.2节进行前处理操作,每个添加水平重复3 次,每个添加量每次进行5 个添加样品的定量分析,获得的结果见表1。
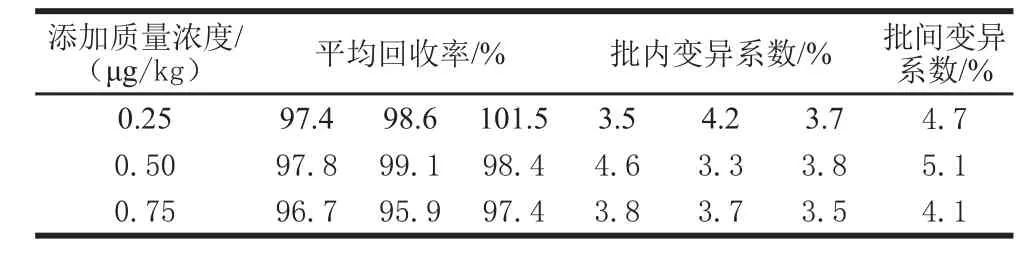
表1 猪肉添加样品中克伦特罗的平均回收率和变异系数Table 1 Mean recoveries (MR) and variation coefficients (CV) of clenbuterol in blank pork sample
由表1可知,本方法的平均添加回收率在95.9%~101.5%之间。批内相对标准偏差和批间相对标准偏差分别为3.3%~4.6 %和4.1%~5.1%,相对标准偏差均小于10%,可见方法能满足现行兽药残留分析的要求。然后根据研究中响应最低的0.50 μg/kg添加样品进行检出限和定量限的研究,克伦特罗的检出限和定量限分别为0.10 μg/kg和0.25 μg/kg。
2.5 方法应用
在2015年12月抽取了宁波市江东区3 个大型超市所售的20 个猪肉样品,利用本方法进行克伦特罗的快速确证,经研究发现20 个样品均不存在克伦特罗。
3 结 论
通过研究建立了快速测定猪肉中克伦特罗的LC-MS/MS方法,单个样品从称样到分析完成整个过程需要约12 min。在碱性条件下猪肉样品中的克伦特罗利用乙酸乙酯提取,然后经甲酸溶液反萃取,再通过正已烷快速脱脂,净化后获得的样品可以直接利用色谱柱进行分离,LC-MS/MS法测定。方法定量限达0.25 μg/kg,相对标准偏差均小于10%,因此利用该方法可满足动物性食品实际监控中快速确证克伦特罗的需要。
[1] SHELVER W L, SMITH D J. Enzyme-linked immunosorbent assay development for the beta-adrenergic agonist zilpaterol[J]. Journal of Agricultural and Food Chemistry, 2004, 52(8)∶ 2159-2166. DOI∶10.1021/jf049919i.
[2] SHELVER W L, SMITH D J. Development of an immunoassay for the beta-adrenergic agonist ractopamine[J]. Journal of Immunoassay,2000, 21(1)∶ 1-23. DOI∶10.1080/01971520009349496.
[3] HE L, PU C, YANG H, et al. Development of a polyclonal indirect ELISA with sub-ng g-1 sensitivity for the analysis of clenbuterol in milk, animal feed, and liver samples and a small survey of residues in retail animal products[J]. Food Additives and Contaminants, Part A,2009, 26(8)∶ 1153-1161. DOI∶10.1080/02652030902906142.
[4] RASHID B A, KWASOWSKI P, STEVENSON D. Solid phase extraction of clenbuterol from plasma using immunoaffi nity followed by HPLC[J]. Journal of Pharmaceutical and Biomedical Analysis,1999, 21∶ 635-639. DOI∶10.1016/S0731-7085(99)00165-X.
[5] LAWRENCE J F, MENARD C. Determination of clenbuterol in beef liver and muscle tissue using immunoaffi nity chromatograhic cleanup and liquid chromatography with ultraviolet absorbance detection[J]. Journal of Chromatography B, 1997, 696∶ 291-297. DOI∶10.1016/ S0378-4347(97)00240-5.
[6] ARESTA A, PALMISANO C F, ZABONIN C G. Determination of clenbuterol in human urine and serum by solid-phase microectraction coupled to liquid chromatography[J]. Journal of Pharmaceutical and Biomedical Analysis, 2008, 47∶ 641-645. DOI∶10.1016/ j.jpba.2008.02.001.
[7] POSYNIAK A, ZMUDZKI J, NIEDZIELSKA J. Screening procedures for clenbuterol residue determination in bovine urine and liver matrices using enzyme-linked immunosorbent assay and liquid chromatography[J]. Analytica Chimica Acta, 2003, 483∶ 61-67. DOI∶10.1016/S0003-2670(02)01021-8.
[8] ZHU Y H, LIU X Y, JIANG X F. Identification of ractopamine glucuronides and determination of bioactive ractopamine residues and its metabolites in food animal urine by ELISA, LC-MS/MS and GCMS[J]. Food Additives and Contaminants, Part A, 2014, 31(1)∶ 29-38. DOI∶10.1080/19440049.2013.855327.
[9] DI C D, MORRA V, PAZZI M, et al. Simultaneous determination of beta2-agonists in human urine by fast-gas chromatography/ mass spectrometry∶ method validation and clinical application[J]. Biochemical Chromatography. 2010, 24(4)∶ 358-366. DOI∶10.1002/ bmc.1300.
[10] LEHNER A F, HUGHES C G, HARKINS J D, et al. Detection and confirmation of ractopamine and its metabolites in horse urine after Paylean administration[J]. Journal of Analytical Toxicology, 2004,28(4)∶ 226-238. DOI∶10.1093/jat/28.4.226.
[11] 吴银良, 李晓薇, 刘素英, 等. 气相色谱-质谱法测定肝脏组织中盐酸克伦特罗和盐酸莱克多巴胺[J]. 分析化学, 2006, 34(8): 1083-1086. DOI:10.3321/j.issn:0253-3820.2006.08.007.
[12] DUVIVIER W F, van BEEK T A, MEIJER T, et al. Ultratrace LCMS/MS analysis of segmented calf hair for retrospective assessment of time of clenbuterol administration in Agriforensics[J]. Journal of Agricultural and Food Chemistry, 2015, 63(2)∶ 493-499. DOI∶10.1021/ jf5056437.
[13] CAO B, HE G, YANG H, et al. Development of a highly sensitive and specific enzyme-linked immunosorbent assay (ELISA) for the detection of phenylethanolamine A in tissue and feed samples and confirmed by liquid chromatography tandem mass spectrometry (LC-MS/MS)[J]. Talanta, 2013, 115∶ 624-630. DOI∶10.1016/ j.talanta.2013.06.026.
[14] CHO Y J, CHAE Y S, KIM J Y, et al. Improvement of an simultaneous determination for clenbuterol and ractopamine in livestock products using LC-MS/MS[J]. Korean Journal of Food Science and Technology,2013, 45(1)∶ 25-33. DOI∶10.9721/KJFST.2013.45.1.25.
[15] WANG L, ZENG Z, WANG X, et al. Multiresidue analysis of nine β-agonists in animal muscles by LC-MS/MS based on a new polymer cartridge for sample cleanup[J]. Journal of Separation Science, 36(11)∶1843-1852. DOI∶10.1002/jssc.201201088.
[16] LOPEZ-SERNA R, KASPRZYK-HORDEM B, PETROVI M, et al. Multi-residue enantiomeric analysis of pharmaceuticals and their active metabolites in the Guadalquivir River basin (South Spain) by chiral liquid chromatography coupled with tandem mass spectrometry[J]. Analytical and Bioanalytical Chemistry, 2013, 405(18)∶ 5859-5873. DOI∶10.1007/s00216-013-6900-7.
[17] WANG L, HE L, WANG Z, et al. Selection of a representative matrix for the multiresidue analysis of nine β-agonists in animal tissues and urine with LC-MS/MS[J]. The Analyst, 2013, 138(16)∶ 4579-4584. DOI∶10.1039/c3an36806h.
[18] LU J, HE G, WANG X, et al. An improved LC-MS-MS method for the determination of clenbuterol in human urine[J]. Lc Gc North America,2013, 31(3)∶ 240-247.
[19] 陈国, 刘勇军, 吕燕, 等. 液相色谱串联质谱法测定猪肉中克伦特罗手性对映体残留量[J]. 肉类研究, 2015, 29(5): 22-26. DOI:10.7506/ rlyj1001-8123-201505006.
[20] HOOIJERINK H, SCHILT R, HAASNOOT W, et al. Determination of clenbuterol in urine of calves by high-performance liquid chromatography with in series ultraviolet and electrochemical detection[J]. Journal of Pharmaceutical and Biomedical Analysis,1991, 9(6): 485-492. DOI:10.1016/0731-7085(91)80250-D.
Fast Determination of Residual Clenbuterol in Pork by Liquid Chromatography with Tandem Mass Spectrometry
ZHANG Yan, CHEN Guo, LÜ Yan, WU Yinliang1,*
(The Ningbo Academy of Agricultural Sciences, Ningbo 315040, China)
A method was developed for determining residual clenbuterol in pork by liquid chromatography with tandem mass spectrometry. Five grams of pork samples were extracted with ethyl acetate under basic condition. Then, clenbuterol was extracted from the extract using formic acid solution. After defatting with hexane, the extract was directly used for determination of clenbuter by liquid chromatography with tandem mass spectrometry (LC-MS-MS) on an Acquity BEH C18column with a mixture of 0.1% formic acid solution and methanol as the mobile phase under gradient elution conditions. The mass spectrometer was operated in multiple reaction monitoring (MRM) mode using positive electrospray ionization. The analyte was quantifi ed with the isotope dilution and internal standard methods. Good linearity was obtained for clenbuterol in the concentration range of 0.05-10.0 μg/L with correlation coeffi cient more than 0.999. The recoveries of pork samples were 95.9%-101.5% at fortifi ed levels of 0.25-0.75 μg/kg. The proposed method exhibited a limit of detection of 0.10 μg/kg and a limit of quantitation of 0.25 μg/kg for clenbuterol. The relative standard deviations of intra-assay and inter-assay precision were between 3.3% and 4.6%, and between 4.1% and 5.1%, respectively. The method is demonstrated to be suitable for the fast determination of clenbuterol in pork.
clenbuterol; fast determination; liquid chromatography with tandem mass spectrometry (LC-MS-MS); residue
TS251.7
A
1001-8123(2016)10-0030-05
2016-04-28
宁波市重大科技攻关项目(2013C11003)
张艳(1978—),女,工程师,硕士,研究方向为农产品中农兽药残留分析。 E-mail:zhangsky001@tom.com
吴银良(1975—),男,教授级高级工程师,博士,研究方向为农产品中农兽药残留分析。E-mail:wupaddyfield@sina.com

