荧光标记pH敏感胶束的制备及其药物控释
郝伟举 张俊琪 尚亚卓 徐首红,* 刘洪来
(1华东理工大学化学系,化学工程国家重点实验室,上海200237;2复旦大学基础医学院病原生物学系,上海200032)
荧光标记pH敏感胶束的制备及其药物控释
郝伟举1张俊琪2尚亚卓1徐首红1,*刘洪来1
(1华东理工大学化学系,化学工程国家重点实验室,上海200237;2复旦大学基础医学院病原生物学系,上海200032)
利用原子转移自由基聚合方法(ATRP)合成了pH敏感的两亲性嵌段共聚物mPEG-b-PDPAn(聚合度n=100-200)及荧光修饰的嵌段聚合物异硫氰酸荧光素-聚乙二醇-聚N,N-二异丙胺基甲基丙烯酸乙酯(FITCPEG45-PDPA100)。采用溶剂挥发的方法制备胶束,此胶束呈现均一的球形分布,平均粒径180-240 nm(0.3 mg·mL-1)。以阿霉素(DOX)为模拟药物,其胶束载药量约11%(w,质量分数)左右,外环境pH对载药胶束的粒径和体外释放行为有显著影响。在弱酸环境下,胶束核质子化发生膨胀甚至解体,在2-3 h内药物可释放80%左右。体外毒性试验表明,空白胶束与人类肝癌细胞(Huh7)有良好的生物相容性。同时,与此细胞共同孵育5 h的荧光聚合物胶束体现了较好的转染效果。因此,这类荧光标记胶束可能会为实时跟踪化疗药物的输送或分布打开新的视角。
pH敏感聚合物;自组装胶束;靶向运输;可控释药
1引言
嵌段聚合物胶束是由两亲性聚合物在水溶液中自组装形成,内核为疏水区,通过疏水作用力可包载疏水性药物,外围的亲水性嵌段可增加药物在体内的稳定性,延长药物的血液循环时间1。聚合物胶束由于具有适宜的粒径,稳定的物理化学性质,在高通透性及滞留效应(EPR)的作用下可被动靶向到肿瘤部位以减少抗肿瘤药对正常细胞的不良反应2。由于传统载药体系存在着诸多缺点,例如被细胞吞噬摄入后,药物释放缓慢难以在较短的时间内达到有效浓度等。因而,近年来具有特殊功能响应型聚合物应运而生,如温度3、pH4、超声5及酶敏感6材料。这些特殊功能的嵌段聚合物构成的载药体系,受到相应的环境刺激,实现定点定时的药物释放。研究发现人体正常血液循环及组织的pH约为7.47,而肿瘤区域由于其代谢旺盛,处在缺氧环境中,有过多的乳酸代谢物产生,使肿瘤组织微环境呈弱酸性(pH 6.5)8,此外,细胞内涵体的基质环境pH值约为5.5-6.09,当内涵体逐渐变成溶酶体的过程中,其pH值更低,约为4.5-5.010,介于这些组织或生理环境在pH上的差异,具有pH敏感的释药体系以特有的性质占据着优势11。
本文以此为出发点,合成了具有荧光示踪12及pH敏感双重功能的嵌段聚合物FITC-PEG45-PDPAn、mPEG45-PDPAn,聚合物通过自组装形成胶束,其疏水内核可以包载疏水性药物,并随着人体微环境pH的变化完成药物定向释放,实验中用人类肝癌细胞(Huh7细胞)作为细胞株,研究了胶束本身的药理毒性和胶束荧光跟踪效果13。
2 实验部分
2.1实验试剂及设备
甲基丙烯酸二异丙胺基乙酯(DPA,98%,Sigma-Aldrich公司),聚乙二醇单甲醚2000(mPEG45,95%,Sigma-Aldrich公司),异硫氰酸荧光素的聚乙二醇(FITC-PEG45,90%,西安瑞禧生物科技有限公司),2-溴代异丁酰溴(98%,Sigma-Aldrich公司);N,N,N-N,N″-五甲基二亚乙基三胺(PMDETA,99%,TCI公司);CuBr(AR,经冰醋酸、乙醇洗涤三次,90%,干燥后待用,上海莲花有限公司);芘(99%,Sigma-Aldrich公司),盐酸型阿霉素(DOX·HCl,98%,J&KCHEMICA公司);四氢呋喃(THF,99.5%,AR,上海泰坦有限公司);甲醇(99.5%,AR,上海泰坦有限公司);二氯甲烷(99.5%,AR,使用前经氢化钙处理,上海泰坦有限公司);中性三氧化二铝(200-300目,上海莲花有限公司)。人类肝癌细胞株(Huh7细胞,美国菌种保藏ATCC),细胞毒性试剂盒(CCK-8,上海碧云天有限公司)、无血清培养基、10%牛胎儿血清培养基均购置于上海生物科技有限公司。
动态光散射(DLS,Zem4228,马尔文,日本岛津公司,日本),紫外-可见分光光度计(UV-2450,日本岛津公司,日本);荧光分光光度计(F-4500,日本岛津公司,日本);凝胶渗透色谱仪(GPC,PL-GPC50,费尔伯恩精密公司,中国);透射电子显微镜(TEM-1400,日本);核磁共振(1H NMR,Bruker-400MH,德国)测定;倒置显微镜及荧光显微镜(EVOS.AMG,美国);微孔板分光光度计(ELX800 Biotek,美国)。
2.2大分子引发剂mPEG-Br及FITC-PEG-Br的合成
向干燥的单口烧瓶中加入聚乙二醇单甲醚(mPEG45,2 g,1 mmol),用25 mL干燥的甲苯溶解,加入三乙胺(TEA,200 μL,1.44 mmol),在冰盐浴的环境下缓慢滴加2-溴异丁酰溴(185 μL,1.5 mmol),反应体系持续剧烈搅拌,室温环境氮气保护反应24 h。反应结束后旋蒸,在冷乙醚中沉淀,真空干燥,得到淡黄色固体。产物质量1.82 g,有1H NMR确定其转化率为93%。该产物为CH3OPEG45-Br,具有荧光的FITC-PEG45-OH以同样的方法制备出大分子引发剂FITC-PEG45-Br。
2.3聚合物mPEG45-PDPAn及FITC-PEG45-PDPAn的制备
通过ATRP聚合的方法接枝聚合物14,15,以制备mPEG45-PDPA100为例,其物质摩尔量为n,n(DPA):n(mPEG45-Br):n(CuBr):n(PMDETA)= 100:1:1:1.1,取引发剂mPEG45-Br 0.5 g放入Schlenk装置,通氮气排氧,在氮气的保护下,取单体DPA 6 mL;干燥四氢呋喃12 mL,取PMDETA 50 μL注入Schlenk装置,经三次液氮冷冻-抽真空-溶解,在冷冻条件下加入催化剂CuBr 0.0326 g,在40°C的环境下反应12 h。反应结束后,将反应液加入四氢呋喃稀释,终止反应,过中性Al2O3的分离柱除去CuBr催化剂。旋蒸THF并在冷冻甲醇(除杂质及未反应的单体)中沉降。得到粘稠的聚合物,进一步干燥,得到白色固体,通过1H NMR (400 Hz,CCl3D)及GPC(THF为流出液)检测其纯度。
2.4嵌段聚合物的物化性质表征
嵌段聚合物的pH敏感性及荧光性能主要通过DLS、UV-2450及荧光光度计来进行表征。配置嵌段聚合物浓度为0.1 mg·mL-1的酸性溶液(pH 3.0左右),逐滴滴加氢氧化钠(1 mol·L-1)溶液,通过DLS检测其溶液体系的粒径及电位变化,同时通过UV-2450表征溶液的透过率随pH的变化。临界胶束浓度16(CMC)是聚合物形成胶束的重要参数,本实验通过配置1×10-6mol·L-1的芘溶液作为荧光探针,通过荧光在372与383 nm的强度比值与聚合物溶液的浓度对数,来测出嵌段聚合物的CMC。
2.5制备聚合物胶束
本实验主要通过溶剂挥发的方法制备聚合物胶束17。方法如下:(1)空白胶束的制备。配置6 mg·mL-1的聚合物THF溶液5 mL作为母液,取其100 μL,逐滴加入2 mL的pH 7.4的磷酸缓冲液(PBS,1 mmol·L-1),搅拌12 h至THF挥发完全;(2)对于载药的聚合物胶束的制备,使用相同的方法称取DOX·HCl 10 mg溶于100 μL的THF母液,加入50 μLTEA使亲水性DOX·HCl变为疏水性的DOX,逐滴加入2 mL的pH 7.4的PBS(1 mmol· L-1)缓冲液,使用3500 g·mol-1的透析袋除去为被包裹的DOX。聚合物胶束的粒径及带电量通过DLS表征,通过检测0.3 mg·mL-1的上述浓度溶液,其形貌通过TEM表征,铜网作为负载体,磷钨酸(1%,质量分数)作为负染液。
2.6胶束的载药及释药研究
胶束的载药量(DLC)及包封率(DEE)通过UV-2450在485 nm处的吸收峰进行检测18,其DLC和DEE通过以下公式可以计算:

其中m1为包载药物的质量(mg);m2为总胶束质量(mg);m3为总药质量(mg);
胶束的释药性能主要考察不同pH环境下DOX累积释放速率,分别考察其12 h聚合物胶束在pH 3.0、pH 5.0、pH 7.4、pH 9.2累积释药量。其中累积释放效率(η)为:

其中A1为累积紫外吸收强度,A2为胶束包载的总DOX的强度。
2.7聚合物胶束的毒性试验
采用Cell Counting Kit(CCK-8)法进行细胞毒性实验19,接种Huh7细胞于96孔板中(1×104/孔),于37°C,5%(φ,体积分数)CO2的培养箱中培养,24 h后分别加入无血清的聚合物胶束,其胶束的浓度为0、10、50、100和200 μg·mL-1。孵育24 h后,用PBS缓冲液冲洗细胞3次,每孔滴加10 μL的CCK-8检测液,于37°C孵育30 min后,通过微孔板分光光度计测量吸光值。
2.8荧光聚合物胶束的细胞转染试验
采用类似培养细胞的方法20,接种Huh7细胞于24孔板(2×104/孔),培养24 h后,分别加入具有荧光功能的混合聚合物mPEG45-PDPA100与FITCPEG45-PDPA100(摩尔比为1:1)胶束(0,100和200 μg·mL-1)与Huh7细胞进行孵育,5 h后吸除荧光的聚合物胶束,通过荧光显微镜观察转染情况。
3 结果与讨论
3.1聚合物的合成及表征
实验中嵌段聚合物的制备见示意图1所示,有mPEG45-OH及FITC-PEG45-OH与二溴异丁酰溴进行酯化合成出大分子引发剂,进而与单体DPA进行ATRP聚合,合成出不同链长的嵌段聚合物mPEG45-PDPAn及具有荧光标记的嵌段聚合物FITCPEG45-PDPA100。
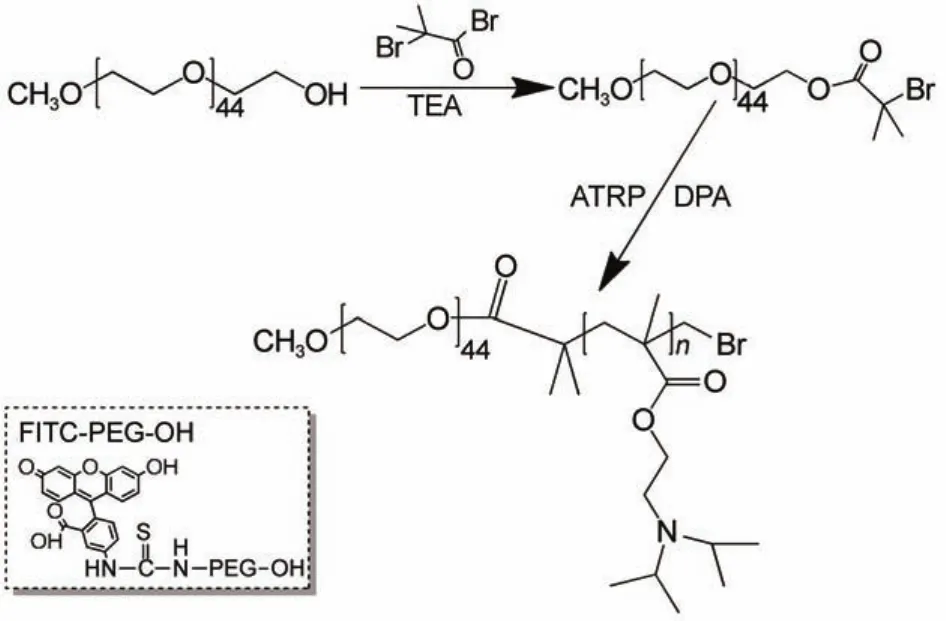
示意图1 嵌段聚合物的合成流程图Scheme 1 Synthesis route of polymer
合成的嵌段聚合物的分子结构用1H NMR进行表征,结果如图1所示,(a)为聚合物mPEG45-Br,mPEG45-PDPA100及FITC-PEG45-Br,FITC-PEG45-PDPA100的1H NMR谱图。图1(a)(1,2)中1.8位移处(e)为PEG-Br链段中丙交酯的甲基(―CH3),3.66位移处是PEG嵌段上的CH2―CH2O―基团;图1a(2)中1.12处(k)为聚合物PDPA链段中氨基处的4个(―CH3),常被看作PDPA的特征峰。图1a(3,4)为标记了荧光物质的FITC-PEG45-Br及嵌段聚合物FITC-PEG45-PDPAn的1H NMR谱图,与上面两个谱图相比,在3.66位移处有FITC-PEG45上的―CH2―基团,同时在化学位移5.35处,有荧光物质FITC的特征峰,通过核磁图谱的结果可以确定所设计的嵌段聚合物已经得到。
嵌段聚合物的相对分子量通过GPC进行测量,结果如图1(b)所示:相对分子量越大,则GPC检测出的流出时间就越短21,单峰型则证明嵌段聚合物中没有杂质。由图可知,随着PDPA嵌段的增加,分子量相应地增大,而荧光基团的分子量相对于聚合物的分子量几乎可以忽略。通过GPC数据分析,得到三个聚合物的分子量依次为21567 g· mol-1(mPEG45-PDPA100),27742 g·mol-1(mPEG45-PDPA150)和37236 g·mol-1(mPEG45-PDPA200),其PDI(多分散指数,Polydispersity Index)值分别为1.19、1.22和1.22,表明分子量有较窄的分布,FITC-PEG45-PDPA100嵌段聚合物的GPC分子量为23060 g·mol-1,其PDI为1.56。嵌段聚合物的pH敏感点则通过聚合物在不同pH环境下的粒径变化来检测,如图1(c)所示,在强酸性环境下即pH 3.0左右,各嵌段聚合物都较好地溶解在水溶液中,随着pH值上升,在pH 6.0-7.0之间,由于PDPA嵌段逐步脱质子化,由亲水性转变为疏水性,使得聚合物呈现两亲性而发生自组装形成胶束颗粒,如图1(c)在pH 6.0-7.0之间,各聚合物粒径发生突增,证明嵌段聚合物有较好的pH敏感性,pH敏感点随着PDPA嵌段的聚合度的增加略有上升,从图上判断大约从pH 6.0变为pH 6.7。
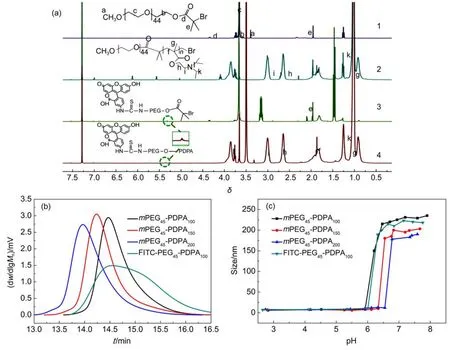
图1 (a)聚合物(1)PEG-Br、(2)PEG-PDPA、(3)FITC-PEG-Br、(4)FITC-PEG-PDPA的核磁共振图谱;(b)嵌段聚合物的GPC流出图;(c)嵌段聚合物在不同pH环境下的尺寸变化Fig.1 (a)1H nuclear magnetic resonance(1H NMR)spectra of the polymers(1)PEG-Br,(2)PEG-PDPA, (3)FITC-PEG-Br,and(4)FITC-PEG-PDPA;(b)the gel permeation chromatography(GPC)data of polymers; (c)size changes of the block polymers at different pH values
3.2胶束的形成及物性表征
通过溶剂挥发的方法制备出粒径均一、结构稳定的胶束,其物性如表1所示。由CMC的测定(图S1(Supporting Information),表1)可确定聚合物自组装形成所需最低浓度,PDPA嵌段越长,其CMC越小,符合两亲性嵌段聚合物的理论性质22。同时还发现,在相同浓度下(pH 7.4),PDPA嵌段越长所形成的胶束粒径反而越小,这可能是因为较长的PDPA疏水作用更强,自组装形成的胶束由于疏水作用收缩得更小。DLS结果显示(表1),颗粒的粒径在180-240 nm(0.3 mg·mL-1)左右,聚合物的浓度上升,颗粒的尺寸略有增加,其PDI值极小表明通过溶剂挥发的方法可以获得尺寸均一的胶束,zeta电位结果显示,胶束在pH 7.4时,均带有少量负电荷,由于各个嵌段聚合的pH敏感点不同,各自所带电量略有不同(表1)。mPEG45-PDPA200的电位接近中性,但是由于伸展在胶束外侧的PEG具有极强的亲水性,胶束并没有沉淀的倾向,在一定浓度胶束的条件下可以稳定存在5-7天。
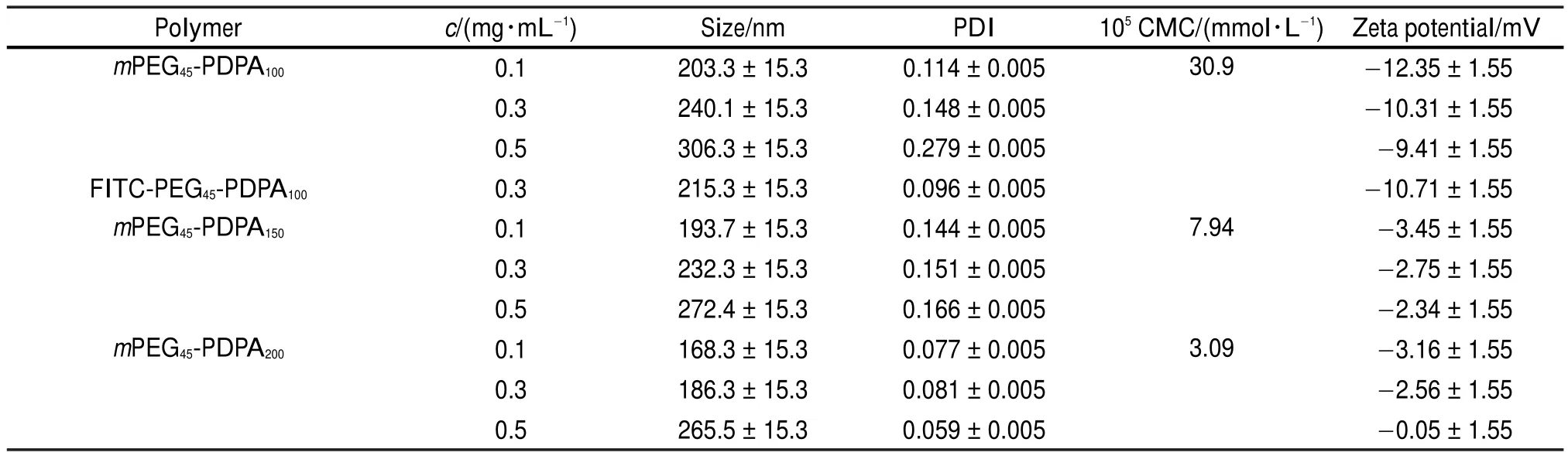
表1 聚合物自组装形成的胶束的物化性质(pH 7.4)Table1 Properties of micelles composed of copolymers by self-assembly(pH 7.4)
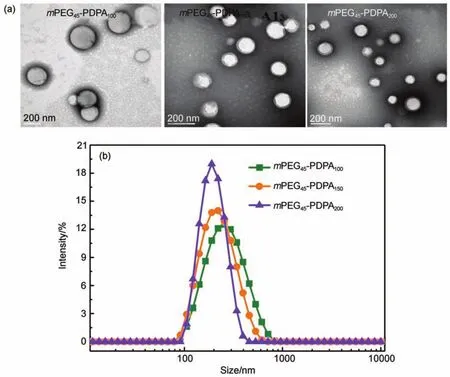
图2 (a)嵌段聚合物胶束的TEM图;(b)胶束的粒径Fig.2 (a)TEM images of polymer micelles;(b)particle sizes of micelles
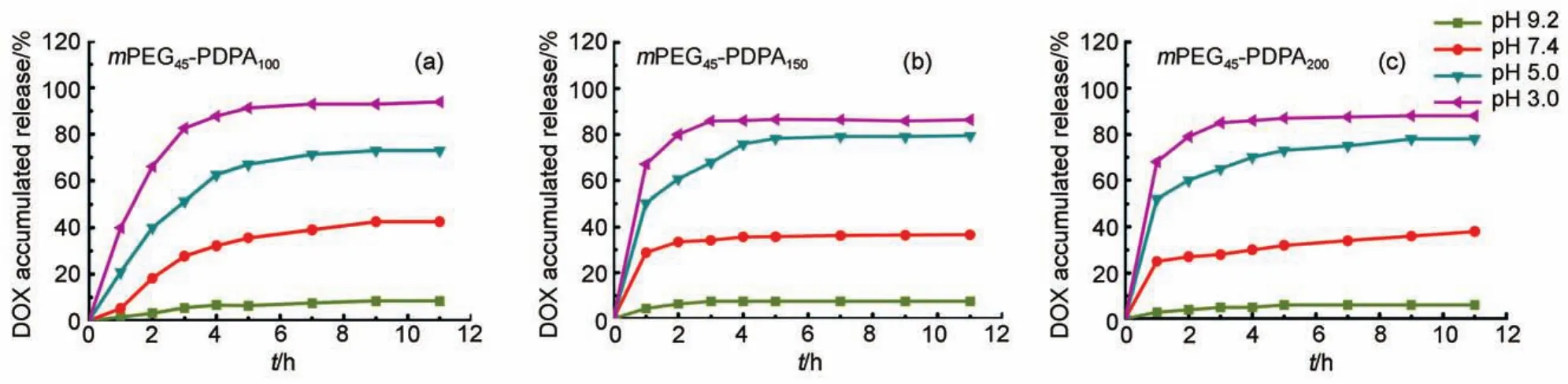
图3 嵌段聚合物胶束在不同pH值下的释药动力学Fig.3 Drug release dynamic of micelles at different pH values
对聚合物浓度为0.3 mg·mL-1形成的胶束进行了TEM形貌表征,由图2(a)可见,嵌段聚合物胶束呈现出均一的球形,粒径分布也比较均匀。mPEG45-PDPA100的胶束的平均粒径约为200 nm,mPEG45-PDPA150及mPEG45-PDPA200胶束的平均粒径则分别约为180、150 nm左右,和DLS结果相比略小一点(图2(b)),这和样品干燥处理过程有关。
3.3胶束的药物包裹及释放
均一的胶束为药物运载提供一个优良的基础23,我们进一步运用聚合物胶束进行疏水性药物DOX的包载和运输24,并研究不同的pH环境下(pH 3.0,5.0,7.4,9.2)的释放动力学。通过疏水作用力进行药物包裹,胶束的载药量可以达到11%(w,质量分数),包封率为70%(w,质量分数)左右。图3是各个聚合物形成的胶束的累计释药量曲线,从图中可以看出,包载药物的各个胶束在相同pH环境中几乎有着相同的释药趋势,即在碱性环境(pH 9.2)下,药物可以稳定地被包载在颗粒中,总释药率低于5%,而环境变为中性、酸性后,药物释放量增加,均在2-4 h后基本达到平衡。图3(a)中,胶束(mPEG45-PDPA100)的pH敏感点在三者中最低,约为pH 6.0,当pH从7.4降为5.0时,比起pH敏感点较高的颗粒(mPEG45-PDPA150和mPEG45-PDPA200)其质子化速度较慢,到达质子化平衡需更多时间,导致其释药在4 h后才达到平衡,而图3(b)和3(c)的胶束的释药仅需2 h就达到平衡。实验结果证明胶束在弱酸性环境下,由于聚合物中PDPA嵌段的质子化,胶束核逐渐膨胀,促进核中药物释放。在强酸性环境pH 3.0中,各个胶束核PDPA嵌段均迅速地几乎完全地被质子化,胶束核迅速膨胀变疏松,尤其是PDPA嵌段聚合度最短的mPEG45-PDPA100,胶束接近于解体,使得其包裹的药物几乎完全释放,而较长PDPA嵌段的胶束由于之前的自组装缠绕更紧密,很难完全释放。可见PDPA嵌段的尺寸可以调节胶束释药速率和累计释放量。
为了验证胶束中药物的释放机理25,在pH 7.4的环境中制备胶束,而后使体系的pH降低至pH 5.0。通过1HNMR进行表征,在酸环境下,聚合物PDPA发生质子化,胶束的核逐步溶胀,由图4可知,在pH 3.0的条件下的1HNMR图谱中,1 h后其化学位移为1.2处,出现PDPA嵌段上被质子化了的氢的峰,两亲性的嵌段聚合物由于变为亲水性而无法自组装为胶束而接近解体(DLS测到粒径只有几个纳米),而在弱酸环境下即pH 5.0,其胶束质子化水平受到H离子浓度的影响,在3 h后,在化学位移1.2处才出现PDPA嵌段上氢的微弱峰,表明质子化平衡后也只有少量的-PDPA被质子化,因而,聚合物胶束逐步膨胀变得疏松,大量的药物被泄露。
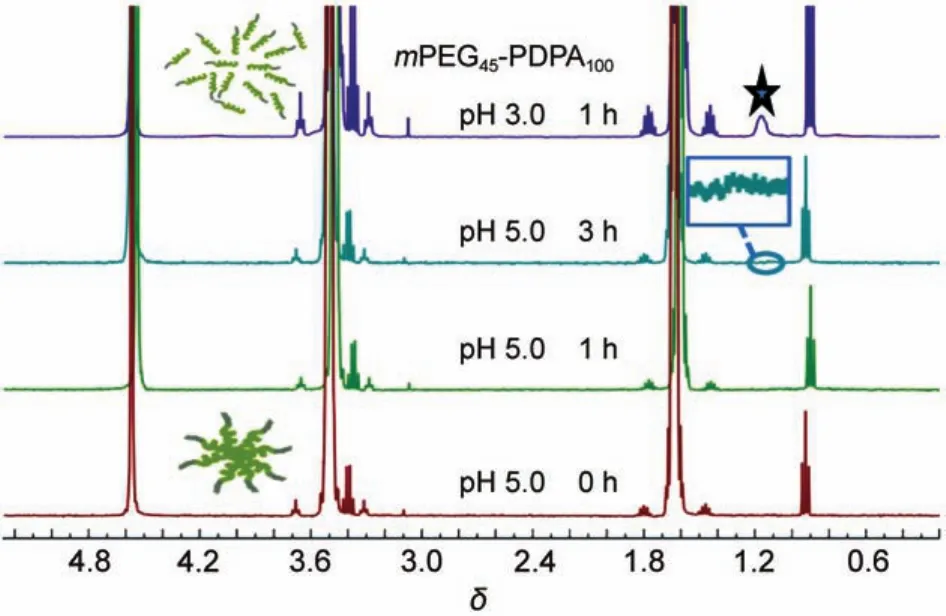
图4 mPEG45-PDPA100形成的胶束在弱酸性环境中随时间变化的1H NMR谱图(0.3 mg·mL-1)Fig.4 1H NMR spectral evolution with time of the micelles composed of mPEG45-PDPA10under acidic condition(0.3 mg·mL-1)
3.4胶束的生物相容性及细胞转染
嵌段聚合物胶束能否作为优良的药物载体,其最基本的条件则是需要有良好的生物相容性,以Huh7细胞作为实验的细胞株,在培养状态良好的Huh7细胞中,分别加入不同浓度的胶束,孵育过夜,24 h后洗除,加入新鲜的培养基,以CCK-8作为指示剂26。如图5所示,胶束与细胞孵育24 h后,即使在较大浓度下(250 μg·mL-1),细胞仍具有良好的生物活性,细胞存活率均在95%以上,因而,该嵌段聚合物胶束具有良好的生物相溶性,可以应用于体内分子运载的材料。同时进一步考察荧光标记的嵌段聚合物形成的胶束能否作为的荧光示踪载体运载药物至细胞内部,由于PEG具有较好的细胞通透性27,以混合的嵌段聚合物mPEG45-PDPA100及FITC-PEG45-PDPA100(摩尔比为1:1)作为示例,分别考察不同浓度的胶束转染Huh7的效果,由图6可以看出,在细胞内部出现了绿色荧光,表明这种荧光标记胶束可以很好地转染至细胞。
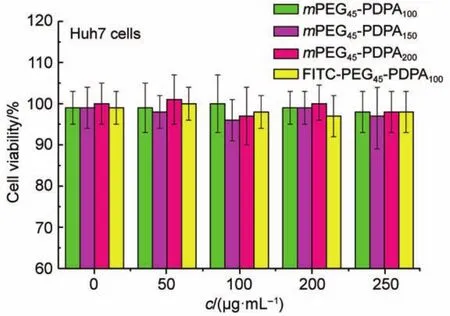
图5 不同浓度(c)胶束的Huh7细胞毒性试验Fig.5 Cell viability of Huh7 cells cultured with different concentrations(c)of micelles
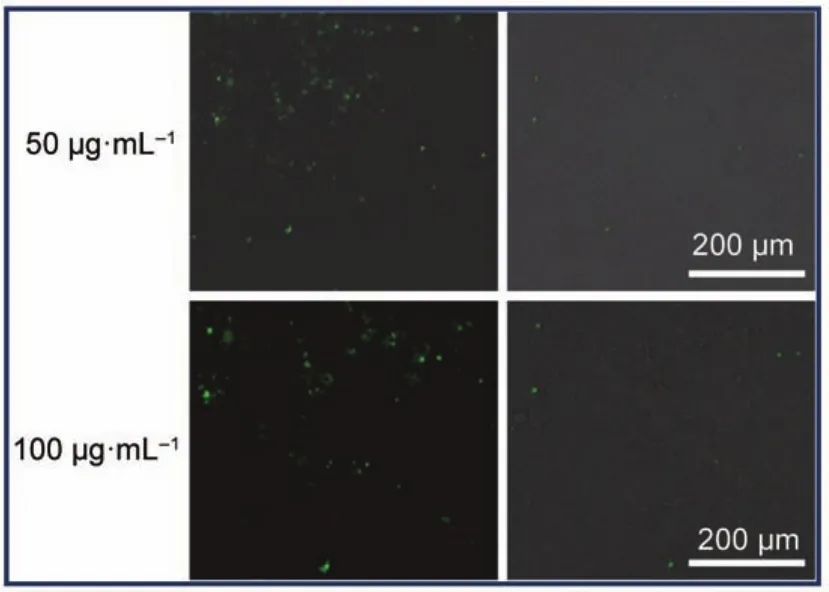
图6 mPEG45-PDPA100与荧光物FITC-PEG45-PDPA100(摩尔比,1:1)混合后的细胞转染图Fig.6 Transfection of the micelles composed of polymers mPEG45-PDPA100and FITC-PEG45-PDPA100(mole ratio,1:1)
4 结论
制备了一种荧光标记的pH敏感的二嵌段聚合物mPEG45-PDPAn及FITC-PEG45-PDPA100,通过自组装可以形成粒径均一的胶束,作为药物载体,在弱酸环境下,嵌段聚合物疏水链-PDPA质子化,胶束核发生膨胀,包载的药物释放;进一步实验表明,这种嵌段聚合物胶束有着良好的生物相容性,同时可以作为荧光标记药物载体进行细胞转染,具有较好的转染效果。因而,利用这种具有pH敏感及荧光效果的嵌段聚合物所制备的胶束,可以作为药物送达、示踪及实现细胞内药物释放的载体。
Supporting Information:available free of charge via the internet at http://www.whxb.pku.edu.cn.
References
(1) Lee,S.M.;Nguyen,S.T.Macromolecules 2013,46(23),9169. doi:10.1021/ma401529w
(2) Maeda,H.;Nakamura,H.;Fang,J.Adv.Drug Deliv.Rev.2013, 65(1),71.doi:10.1016/j.addr.2012.10.002
(3) Tan,R.;She,Z.;Wang,M.;Fang,Z.;Liu,Y.;Feng,Q. Carbohydr.Polym.2012,87(2),1515.doi:10.1016/j. carbpol.2011.09.048
(4)Wu,X.;Wang,Z.;Zhu,D.;Zong,S.;Yang,L.;Zhong,Y.;Cui, Y.ACS Appl.Mater.Interfaces 2013,5(21),10895. doi:10.1021/am403092m
(5) Paris,J.L.;Cabañas,M.V.;Manzano,M.;Vallet-Regí,M.ACS Nano 2015,9(11),11023.doi:10.1021/acsnano.5b04378
(6) Hill,E.H.;Zhang,Y.;Evans,D.G.;Whitten,D.G.ACS Appl. Mater.Interfaces 2015,7(9),5550.doi:10.1021/ acsami.5b00185
(7) Lay,C.L.;Tan,H.R.;Lu,X.;Liu,Y.Chemistry(Easton)2011, 17(8),2504.doi:10.1002/chem.201001403
(8)Kim,K.;Kim,J.H.;Park,H.;Kim,Y.S.;Park,K.;Nam,H.; Lee,S.;Park,J.H.;Park,R.W.;Kim,I.S.;Choi,K.;Kim,S. Y.;Kwon,I.C.J.Control.Release 2010,146(2),219. doi:10.1016/j.jconrel.2010.04.004
(9)Choe,U.J.;Rodriguez,A.R.;Lee,B.S.;Knowles,S.M.;Wu, A.M.;Deming,T.J.;Kamei,D.T.Biomacromolecules 2013,14 (5),1458.doi:10.1021/bm400124z
(10) Dai,Y.;Ma,P.A.;Cheng,Z.;Kang,X.;Zhang,X.;Hou,Z.;Li,C.;Yang,D.;Zhai,X.;Lin,J.ACS Nano 2012,6(4),3327. doi:10.1021/nn300303q
(11) Qian,J.;Sullivan,B.P.;Berkland,C.Biomacromolecules 2015, 16(8),2340.doi:10.1021/acs.biomac.5b00560
(12) Evans,C.M.;Henderson,K.J.;Saathoff,J.D.;Shull,K.R.; Torkelson,J.M.Macromolecules 2013,46(10),4131. doi:10.1021/ma400686j
(13) Jia,X.;Zhao,X.;Tian,K.;Zhou,T.;Li,J.;Zhang,R.;Liu,P. Biomacromolecules 2015.doi:10.1021/acs.biomac.5b01070
(14) Pearson,R.T.;Warren,N.J.;Lewis,A.L.;Armes,S.P.; Battaglia,G.Macromolecules 2013,46(4),1400.doi:10.1021/ ma302228m
(15) Ciftci,M.A.T.;Tasdelen,M.A.;Li,W.W.;Matyjaszewski,K.; Yagci,Y.Macromolecules 2013,46,9537.doi:10.1021/ ma402058a
(16) Keyes-Baig,C.;Duhamel,J.;Wettig,S.Langmuir 2011,27(7), 3361.doi:10.1021/la104820w
(17) Petros,R.A.;DeSimone,J.M.Nat.Rev.Drug Discov.2010,9 (8),615.doi:10.1038/nrd2591
(18) Guo,X.;Li,D.;Yang,G.;Shi,C.;Tang,Z.;Wang,J.;Zhou,S. ACS Appl.Mater.Interfaces 2014,6(11),8549.doi:10.1021/ am501422r
(19) Sankaranarayanan,J.;Mahmoud,E.A.;Kim,G.;Morachis,J. M.;Almutairi,A.ACS Nano 2010,4,5930.doi:10.1021/ nn100968e
(20)Yu,H.J.;Zou,Y.L.;Wang,Y.G.;Huang,X.N.;Huang, G.;Sumer,B.D.;Boothman,D.A.;Gao,J.M.ACS Nano 2011, 5,9246.doi:10.1021/nn203503h
(21) Han,X.;Zhang,X.;Zhu,H.;Yin,Q.;Liu,H.;Hu,Y.Langmuir 2013,29(4),1024.doi:10.1021/la3036874
(22) Orelma,H.;Teerinen,T.;Johansson,L.S.;Holappa,S.;Laine, J.Biomacromolecules 2012,13(4),1051.doi:10.1021/ bm201771m
(23)Wang,J.;Tian,S.;Petros,R.A.;Napier,M.E.;DeSimone,J.M. J.Am.Chem.Soc.2010,132(32),11306.doi:10.1021/ ja1043177
(24) Li,H.;Cui,Y.;Sui,J.;Bian,S.;Sun,Y.;Liang,J.;Fan,Y.; Zhang,X.ACS Appl.Mater.Interfaces 2015,7(29),15855. doi:10.1021/acsami.5b03150
(25) Hao,W.;Han,X.;Shang,Y.;Xu,S.;Liu,H.Colloids Surf.BBiointerfaces 2015,136,809.doi:10.1016/j. colsurfb.2015.10.033
(26) Liu,Q.;Chen,S.;Chen,J.;Du,J.Macromolecules 2015,48(3), 739.doi:10.1021/ma502255s
(27) Logie,J.;Owen,S.C.;McLaughlin,C.K.;Shoichet,M.S. Chem.Mater.2014,26(9),2847.doi:10.1021/cm500448x
Preparation of Fluorescently Labeled pH-Sensitive Micelles for Controlled Drug Release
HAO Wei-Ju1ZHANG Jun-Qi2SHANG Ya-Zhuo1XU Shou-Hong1,*LIU Hong-Lai1
(1State Key Laboratory of Chemical Engineering,Department of Chemistry,East China University of Science and Technology, Shanghai 200237,P.R.China;2Department of Medical Microbiology and Parasitology,School of Basic Medical Sciences, Fudan University,Shanghai 200032,P.R.China)
In this paper,novel pH-sensitive amphiphilic diblock copolymers[mPEG-b-PDPAn(n=100-200, polymerization degree;PEG is polyethylene glycol and PDPA is polydiphenylamine)]with and without a fluorescent group(fluorescein isothiocyanate,FITC)were synthesized by atom transfer radical polymerization (ATRP).The copolymers were used to prepare micelles by solvent evaporation to act as drug carriers.The micelles were spherical with a uniform diameter of 180-240 nm(0.3 mg·mL-1).The model drug doxorubicin (DOX)could be encapsulated into the micelles with a high loading efficiencyof about 11%(w,mass fraction). The micelles were stable at pH 7.4 and became looser upon the protonation of the PDPAblock in a weakly acidic environment.The release of DOX accelerated when the micelles were exposed to weakly acidic conditions,and the amount released reached 80%after 2-3 h.Cell toxicity assays of the micelles were carried out using human cancer cells(Huh7),and the micelles showed good cytocompatibility.The micelles labeled with FITC displayed high cell transfection efficiency.As a result,micelles labeled with fluorescent groups may open up new perspectives for real-time tracking of drug delivery and/or distribution during chemotherapy.
pH-sensitive copolymer;Self-assembly micelle;Targeting delivery;Controlled release
April 25,2016;Revised:June 27,2016;Published online:June 29,2016.
.Email:xushouhong@ecust.edu.cn;Tel:+86-21-64251942.
O648
10.3866/PKU.WHXB201606296
The project was supported by the National Natural Science Foundation of China(21276074)and Fundamental Research Funds for the Centre Universities of China.
国家自然科学基金(21276074)和基本科研业务费专项基金资助项目©Editorial office ofActa Physico-Chimica Sinica

