P005091的合成
余 平,袁明辉,牛丽君,张国刚,3
(1.河北科技大学化学与制药工程学院,河北石家庄 050018;2.威海市食品药品检验检测中心,山东威海 264200;3.河北省药物化工工程技术研究中心,河北石家庄 050018)
P005091的合成
余 平1,袁明辉2,牛丽君1,张国刚1,3
(1.河北科技大学化学与制药工程学院,河北石家庄 050018;2.威海市食品药品检验检测中心,山东威海 264200;3.河北省药物化工工程技术研究中心,河北石家庄 050018)
为改进抗肿瘤药物P005091(1-(5-((2,3-二氯苯基)硫基)-4-硝基-2-噻酚基)-乙酮)的合成方法,以2-氯噻吩为起始原料,乙酰氯为酰化试剂,三氯化铝为催化剂,在2-氯噻吩的5位引入乙酰基,得到2-乙酰基-5-氯噻吩(化合物2),收率为91%;再以浓硫酸为溶剂,以混酸为硝化试剂,与化合物2发生硝化反应得到5-乙酰基-2-氯-3-硝基噻酚(化合物3),收率为64%;再将化合物3与2,3-二氯苯硫酚在N,N-二甲基甲酰胺溶液中及碳酸钾的作用下发生硫醚化反应得到目标产物P005091,收率为76%。目标化合物的结构经熔点(mp)、核磁共振氢谱(1H-NMR)、核磁共振碳谱(13C-NMR)和质谱(MS)确证,总收率为44%。该合成路线成本低廉,操作简单,与原文献方法相比,避免使用毒性较大的试剂,反应条件更为温和,在保证产品纯度的前提下,收率有了一定的提高。
有机合成化学;泛素特异性蛋白酶;噻吩;抗肿瘤;合成;Friedel-Crafts酰基化反应
泛素-蛋白酶体系统的失控与肿瘤的发生有着密不可分的关系[1-2],目前以其为靶点的抗肿瘤药物的研究引起了人们的广泛关注[3]。泛素特异性蛋白酶7(USP7)是泛素-蛋白酶体系统中的一种关键性酶,参与细胞内肿瘤抑制、DNA修复及免疫应答等过程中诸多重要蛋白的活性调控[4-5]。研究表明,USP7与前列腺癌[6]、结肠癌[7]、肺癌[8]及多发性骨髓瘤[9]的发生和转移密切相关[10-11]。泛素特异性蛋白酶47(USP47)是与USP7高度相似的一个去泛素化酶,去除USP47基因可以降低肿瘤细胞的增殖能力,增强化疗药物的细胞毒活性[12-13]。P005091(1-(5-((2,3-二氯苯基)硫基)-4-硝基-2-噻吩基)-乙酮)是美国Progenra公司研发的具有选择性USP7和USP47的双效抑制剂[14-15]。P005091可以诱导对传统治疗或硼替佐米耐药的多发性骨髓瘤发生细胞凋亡,亦可与来那度胺或地塞米松联用发挥协同作用[7]。
目前中国没有P005091合成方法的相关报道,国外报道的文献是以2-乙酰基-5-氯噻酚(化合物2)为起始原料,采用发烟硝酸为硝化试剂兼溶剂,进行硝化反应得到中间体5-乙酰基-2-氯-3-硝基噻酚(化合物3),化合物3再与2,3-二氯苯硫酚在无水甲醇中甲醇钠的作用下发生硫醚化反应得到P005091[16]。
本文以相关文献方法为基础,以2-氯噻酚(化合物1)为起始原料,采用乙酰氯为酰化试剂、三氯化铝为催化剂,在2-氯噻吩的5位引入乙酰基,得到化合物2。再以浓硫酸为溶剂、混酸为硝化试剂对化合物2进行硝化得到化合物3。将化合物3与2,3-二氯苯硫酚在N,N-二甲基甲酰胺溶液中及碳酸钾的作用下发生硫醚化反应得到P005091。合成路线如图1所示。化合物2和化合物3经1H-NMR和MS进行表征,P005091的结构经1H-NMR,13C-NMR和MS进行表征。
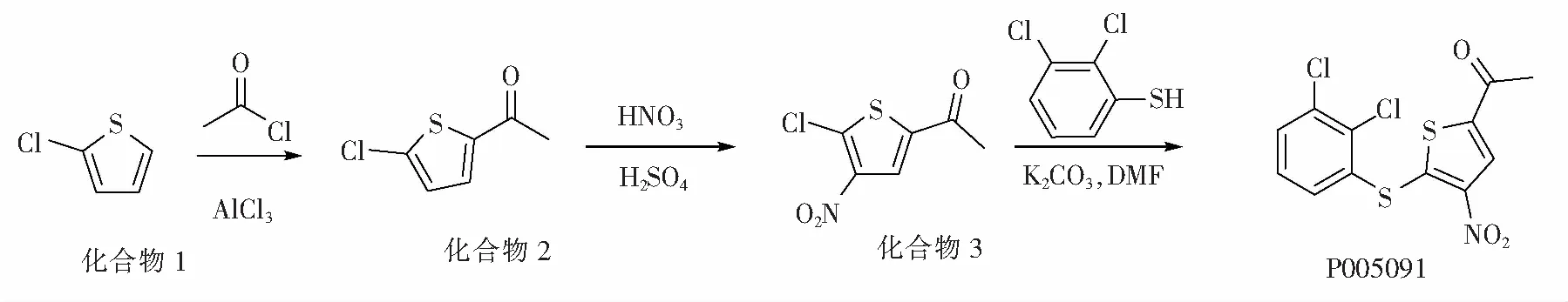
图1 合成路线Fig.1 Synthetic route
1 实验部分
1.1 主要仪器与试剂
1H-NMR测定采用AVANCE Ⅲ 500 MHz核磁共振谱仪(瑞士Bruker公司提供);MS测定采用Agilent 1100 MSD液相色谱质谱联用仪(美国Agilent公司提供);含量测定采用Agilent 1100 液相色谱仪(美国Agilent公司提供);熔点测定采用X-4型显微熔点测定仪(北京泰克仪器有限公司提供)。
本实验所用2-氯噻吩和2,3-二氯苯硫酚由成都西亚试剂有限公司提供,其余原料均由天津科密欧化学试剂有限公司提供,纯度为AR级。
1.2 合成步骤
1.2.1 2-乙酰基-5-氯噻酚(化合物2)的合成
将无水三氯化铝13.3 g(0.1 mol)加入到冷却至0 ℃的50 mL二氯甲烷中,将反应液温度保持在0~5 ℃,缓慢滴加乙酰氯7.9 g(0.1 mol),约20 min后滴加完毕,继续搅拌15 min。保持温度在0~5 ℃滴加2-氯噻吩11.9 g(0.1 mol)和二氯甲烷15 mL的混合溶液,滴加时间约30 min,反应液呈红棕色,继续反应1 h,反应完毕。将反应液倾入至100 g冰水和25 mL浓盐酸的混合液中,搅拌10 min后,将有机层用水(2 × 50 mL)洗涤,再经无水硫酸钠干燥、过滤、蒸干溶剂,得到淡紫色油状产物,放入冰箱于4 ℃静置过夜,得到化合物2浅紫色晶体14.6 g,收率为91%。其熔点为43~45 ℃(文献值[17]为45~46 ℃);ESI-MS (m/z): 160[M+H]+;1H-NMR (500 MHz, CDCl3-d),δ:2.50 (3H,s),6.95 (1H,d,J=4.0),7.47 (1H,d,J=4.0)。
1.2.2 5-乙酰基-2-氯-3-硝基噻酚(化合物3)的合成
将11.1g(0.07mol)化合物2加入到冷却至0 ℃的15mL浓硫酸(体积分数为98%)中,反应液保持0~8 ℃。缓慢滴加由浓硝酸(体积分数为65%)7.5g与浓硫酸(体积分数为98%)7.0g所配制的混酸,滴加约20min,反应液呈红棕色。继续反应15min,将反应液倾入冰水中,搅拌得到黄色固体。再经抽滤,将滤饼在40 ℃下干燥过夜,得到13.6g浅黄色固体。用无水乙醇重结晶,得到浅棕色针状固体9.3g,收率为64%。其熔点为81~84 ℃(文献值[18]为85~87 ℃);ESI-MS(m/z):206[M+H]+;1H-NMR(500MHz,CDCl3-d),δ:2.58 (3H,s),8.07(1H,s)。
1.2.3P005091的合成
室温下,依次将4.1g(0.02mol)化合物3及2,3-二氯苯硫酚3.6g(0.02mol)、无水碳酸钾2.7g(0.02mol)加入到20.0mL的N,N-二甲基甲酰胺溶液中,室温反应过夜。反应完毕,将反应液倾入100.0mL水中,静置2h后抽滤。将滤饼在40 ℃下干燥过夜,得到砖红色固体6.7g。用乙腈重结晶,得到淡黄色固体5.3g,收率为76%。其熔点为178~180 ℃;纯度为98.3%(HPLC归一化法:色谱柱为C18柱(4.6mm×150mm,5m),流动相为乙腈/水(二者体积比为40∶60),检测波长为230nm,流速为1.0mL/min,柱温为25 ℃);ESI-MS(m/z)∶349[M+H]+;1H-NMR(500MHz,CDCl3-d),δ:2.50 (3H,s),7.38 (1H,t,J=7.5),7.70 (2H,m),8.09 (1H,s);13C-NMR(125MHz,CDCl3-d),25.6,127.8,128.9,130.9,134.2,135.5,138.1,139.1,141.0,157.0,189.2。
2 结果与讨论
2.1 化合物2的合成
已有文献中P005091收率较高的方法均以2-氯噻吩为起始原料,乙酰氯为酰化试剂,三氟甲磺酸锌或三氟甲磺酸镱[19]为催化剂,在硝基甲烷中进行反应,收率为87%~92%。本研究是以二氯甲烷为溶剂,先加入无水三氯化铝和乙酰氯,然后滴加2-氯噻吩得到中间体化合物2。与原方法相比,改进后的方法无需加入昂贵的催化剂及较危险的硝基甲烷,具有操作简便、成本低廉、无需进一步纯化等优点,且收率与文献方法相当。
2.2 化合物3的合成
文献[7]采用发烟硝酸为硝化试剂兼溶剂,在冰甲醇浴(-5 ℃)下分批加入化合物2,然后于室温下反应,收率为45%,方法中用到了发烟硝酸,不但操作危险,且收率仅为45%。本研究采用混酸为硝化试剂,浓硫酸为反应溶剂,反应后得到化合物2,再经乙醇重结晶,收率为64%。与文献方法比较,此方法避免了使用较为危险的发烟硝酸,且收率有所提高。
2.3P005091的合成
文献[2]用化合物3与2,3-二氯苯硫酚在含有甲醇钠的甲醇溶液中发生硫醚化反应,收率为65%。但是实际操作中发现采用文献方法得到的产物较为复杂,需要进行2次重结晶才能得到纯度较高(95%以上)的产品。本研究对文献方法进行了改进,采用碳酸钾为碱,N,N-二甲基甲酰胺为反应溶剂,在室温下进行反应,采用乙腈为重结晶溶剂,仅一次重结晶即可得到纯度较高(98.3%)的产品。与原方法相比,反应条件更为温和,操作更为简化,收率也有了一定的提高(76%)。目标化合物的结构经熔点、核磁共振氢谱、核磁共振碳谱和质谱确证,总收率为44%。
[1] SPATARO V, NORBURY C, HARRIS A L. The ubiquitin-proteasome pathway in cancer[J]. British Journal of Cancer,1998,77(3):448-455.
[2] MA Y M, HAN W, LI J, et al. Physalin B not only inhibits the ubiquitin-proteasome pathway but also induces incomplete autophagic response in human colon cancer cells in vitro[J]. Acta Pharmacol Sin,2015,36(4):517-527.
[3] DIFIORE P P,POLO S, HOFMANN K. When ubiquitin meets ubiquitin receptors: A signalling connection[J]. Nat Rev Mol Cell Biol,2003,4(6):491-497.
[4] NICHOLSON B, SURESH K K. The multifaceted roles of USP7:New therapeutic opportunities[J]. Cell Biochem Biophys,2011,60(1/2): 61-68.
[5] XU Y, LU S. Metformin inhibits esophagus cancer proliferation through upregulation of USP7[J]. Cell Physiol Biochem,2013,32(5):1178-1186.
[6] VOUTSADAKIS I A, PAPANDREOU C N. The ubiquitin-proteasome system in prostate cancer and its transition to castration resistance[J]. Urol Oncol,2012,30(6):752-761.
[7] 董先明, 胡艾希, 符若文,等. Friedel-Crafts酰基化反应研究进展[J].合成化学,2001,9(6):495-498.
DONG Xianming, HU Aixi, FU Ruowen,et al. Progress on Friedel-Crafts acylation reaction[J]. Chinese Journal of Synthetic Chemistry, 2001,9(6):495-498.
[8] CAO M N, ZHOU Y B, GAO A H, et al. Curcusone D, a novel ubiquitin-proteasome pathway inhibitor via ROS-induced DUB inhibition, is synergistic with bortezomib against multiple myeloma cell growth[J]. Biochim Biophys Acta,2014,1840(6):2004-2013.
[9] YANG Z, HUO S, SHAN Y, et al. STAT3 repressed USP7 expression is crucial for colon cancer development[J]. FEBS Lett,2012,586(19):3013-3017.
[10] VUCIC D, DIXIT V M, WERTZ I E. Ubiquitylation in apoptosis: A post-translational modification at the edge of life and death[J]. Nat Rev Mol Cell Biol,2011,12(7): 439-452.
[11] PARSONS J L,DIANOVA I I,KHORONENKOVA S V,et al. USP47 is a deubiquitylating enzyme that regulates base excision repair by controlling steady-state levels of DNA polymerase beta[J]. Mol Cell,2011,41(5): 609-615.
[12]PESCHIAROLI A,SKAAR J R,PAGANO M,et al. The ubiquitin-specific protease USP47 is a novel beta-TRCP interactor regulating cell survival[J]. Oncogene,2010,29(9): 1384-1393.
[13] PROGENRA I. Anti-neoplastic Compounds, Compositions and Methods[P] .WO:2010114881(A1),2010-10-01.
[14] WEINSTOCK J,WU J,CAO P,et al. Selective dual inhibitors of the cancer-related deubiquitylating proteases USP7 and USP47[J]. ACS Med Chem Lett,2012,3(10): 789-792.
[15] 韩新峰.国际抗肿瘤药物市场趋势及制剂技术进展[J]. 河北工业科技, 2010,27(3):207-209.
HAN Xinfeng. Analysis of international anticancer drug market trends preparation technology progress[J].Hebei Journal of Industrial Science and Technology,2010,27(3):207-209.
[16]HARTOUGH H D,KOSAK A I, SARDELLA J J. Acylation studies in the thiophene and furan series(Ⅲ):Natural and synthetic silica-metal oxide catalysts[J]. Journal of the American Chemical Society,1947,69(5): 1014-1016.
[17] HURD C D,KREUZ K L. Nitrothienols and halogenated nitrothiophenes [J]. Journal of the American Chemical Society,1952,74(12): 2965-2970.
[18] HE Fei,WU Huayue,CHEN Jiuxi,et al. Unexpectedly high activity of Zn(OTf)2·6H2O in catalytic Friedel-Crafts acylation reaction[J]. Synthetic Communications,2008,38(2): 255-264.
[19] SU W,JIN C. Ytterbium(Ⅲ) trifluoromethanesulfonate catalysed Friedel-Crafts acylation of substituted thiophenes[J]. Journal of Chemical Research,2003(11):694-695.
Synthesis of P005091
YU Ping1, YUAN Minghui2, NIU Lijun1, ZHANG Guogang1,3
(1.School of Chemical and Pharmaceutical Engineering, Hebei University of Science and Technology, Shijiazhuang, Hebei 050018, China; 2. Weihai Food & Drugs Testing Center, Weihai, Shangdong 264200, China; 3.Hebei Research Center of Pharmaceutical and Chemical Engineering, Shijiazhuang, Hebei 050018, China)
To improve the synthesis method of P005091 (1-(5-((2,3-dichlorophenyl) thio)-4-nitro-2-thienyl) ethanone), with 2-chlorothiophene as the starting material, acetyl chloride as the acetylation reagent and aluminium trichloride as the catalyst, acetyl is introduced in the 5th position of 2-chlorothiophene to get 2-acetyl-5-chlorothiophene (compound 2), and the yield is 91%; then with concentrated sulfuric acid as solvent and mixed acid as nitrating agent, 5-acetyl-2-chloro-3-nitrothiophene (compound 3) is obtained by nitration reaction with compound 2, and the yield is 64%; thioetherfication reaction of compound 3 and 2,3-dichlorobenzenethiol in DMF solution under the function of potassium carbonate takes place to obtain the target product P005091, and the yield is 76%. The structure of P005091 is confirmed by mp,1H-NMR,13C-NMR and MS, and the overall yield is 44%. The improved method has the advantages of low cost, simple operation, and a milder reaction condition compared with the former references, avoiding using the reagent with higher toxicity, and high yield on the premise that the product purity is assured.
organic synthetic chemistry; ubiquitin-specific proteases; thiophene; antitumor; synthesis;Friedel-Crafts acylation reaction
1008-1542(2016)03-0245-04
10.7535/hbkd.2016yx03005
2015-11-06;
2015-12-30;责任编辑:张士莹
河北省自然科学基金(H2014208118); 河北科技大学博士科研启动基金(QD201258);河北科技大学大学生科技立项
余 平(1988—),女,河北唐山人,硕士研究生,主要从事药物合成方面的研究。
张国刚博士。E-mail:zgg1980@hebust.edu.cn
R914.5
A
余 平,袁明辉,牛丽君,等.P005091的合成[J].河北科技大学学报,2016,37(3):245-248.
YU Ping, YUAN Minghui, NIU Lijun,et al.Synthesis of P005091[J].Journal of Hebei University of Science and Technology,2016, 37(3):245-248.

