柔嫩艾美耳球虫胱硫醚β合成酶基因克隆及在真核细胞中的表达
李 聪,董 辉,朱顺海,朱雪龙,王自文,赵其平,夏伟丽,2,门启斐,2,黄 兵,3,韩红玉
(1.中国农业科学院上海兽医研究所 农业部动物寄生虫学重点开放实验室,上海200241;2.上海师范大学生命与环境科学学院,上海 200234;3.江苏省动物动物疫病与人兽共患病防控协同创新中心,扬州 225009)
·研究论文·
柔嫩艾美耳球虫胱硫醚β合成酶基因克隆及在真核细胞中的表达
李 聪1,董 辉1,朱顺海1,朱雪龙1,王自文1,赵其平1,夏伟丽1,2,门启斐1,2,黄 兵1,3,韩红玉1
(1.中国农业科学院上海兽医研究所 农业部动物寄生虫学重点开放实验室,上海200241;2.上海师范大学生命与环境科学学院,上海 200234;3.江苏省动物动物疫病与人兽共患病防控协同创新中心,扬州 225009)
为构建柔嫩艾美耳球虫胱硫醚β合成酶(Eimeria tenella cystathionine β-synthase,Et CBS)基因的真核重组表达质粒pBiFC-VC155-EtCBS,利用RACE技术克隆了Et CBS基因的全长cDNA序列,对其编码的蛋白进行相关生物信息学分析。通过RT-PCR扩增含完整开放阅读框(open reading frame,ORF)的cDNA片段,将其与真核表达载体pBiFC-VC155连接,经PCR、双酶切和测序鉴定正确后,转染DF-1细胞,用免疫印迹和间接免疫荧光技术鉴定重组蛋白表达情况。结果显示,成功获得了Et CBS基因的全长cDNA序列,该基因全长2423 bp,ORF位于第201~2087 bp之间,编码629个氨基酸,编码蛋白的分子量约为68 kDa。生物信息学分析发现该基因编码的蛋白不具有信号肽,也不存在跨膜结构。Western blot可见大小约为68 kDa的重组表达蛋白条带,间接免疫荧光实验显示在转染的DF-1细胞中能检测到绿色荧光。研究结果表明,本研究已成功获得了Et CBS基因的全长cDNA序列,成功构建了Et CBS基因含完整ORF的真核重组表达质粒,并在DF-1细胞中实现了表达,为深入研究Et CBS基因的功能奠定了基础。
柔嫩艾美耳球虫;胱硫醚β合成酶;DF-1细胞;真核表达
鸡球虫病是由多种艾美耳球虫寄生于鸡肠道上皮细胞引起的一种寄生性原虫病[1],是一种危害极为严重的全球性寄生虫病。据报道全世界每年用于球虫病预防和治疗的费用,以及因球虫病引起的损失高达3亿美元,给世界家禽业造成了巨大的经济损失[2]。鸡球虫是属于顶复器门(Apicomplexa)、艾美耳属(Eimeria)的一类寄生于鸡肠道的原虫。顶复器原虫多数是专一性的细胞内寄生虫,包括疟原虫(Plasmodium)、弓形虫(Toxoplasma)、艾美耳球虫(Eimeria)、隐孢子虫(Cryptosporidium)等,有复杂的生活史,需入侵宿主细胞,完成生活史循环需要更替一个或多个宿主,或更换不同的细胞和组织,因而成功地入侵宿主细胞是这类寄生虫感染建立的前提。虽然顶复器原虫入侵的宿主细胞不同,包括红细胞、淋巴细胞、巨噬细胞和消化道细胞等,但都有一个共同的高度保守的入侵机制[3]。当虫体粘附宿主细胞后,在虫体顶端和宿主细胞膜表面会形成一个紧密的运动连接环(moving junction,MJ)[4]。对弓形虫、疟原虫等顶复器门原虫的研究表明,MJ对虫体成功入侵宿主细胞起着至关重要的作用[5],可作为支架推动虫体进入带虫空泡。另外,MJ还具有分子筛的功能,可以选择性的吸收宿主蛋白形成带虫空泡,阻止许多宿主细胞膜蛋白进入带虫空泡,从而保护虫体免受宿主溶酶体的破坏,逃避宿主的免疫反应[6]。研究发现MJ的形成是依赖棒状体和微线分泌的蛋白,其中微线分泌的顶膜抗原1(apical membrance protein-1,AMA1)和棒状体分泌的棒状体颈部蛋白(rhoptry neck proteins,RONs)是组成MJ的主要分子,在虫体入侵过程中发挥重要作用[7-9]。目前,对AMA1在弓形虫和疟原虫入侵细胞过程中与棒状体颈部蛋白等形成复合体,参与MJ的形成及在入侵宿主细胞过程中发挥作用的研究已经取得了一定的进展。虽然鸡球虫和弓形虫、疟原虫同属于顶复器门原虫,基因组分析也发现鸡球虫有组成MJ复合体的同源蛋白AMA1和RONs,但是在鸡球虫中,还没有对AMA1进行深入的研究,目前只对AMA1进行了一些初步的研究。姜连连等[10]根据柔嫩艾美耳球虫AMA1基因的ESTs序列,利用RACE技术扩增获得AMA1基因的全长cDNA序列,体外抑制结果显示Et AMA1参与了柔嫩艾美耳球虫子孢子入侵DF-1细胞。王烨等[11]构建了真核表达质粒pCAGGS-Et AMA1,对其免疫保护效果研究发现该真核表达重组质粒对柔嫩艾美耳球虫感染具有一定的免疫保护力。为了解柔嫩艾美耳球虫AMA1(Et AMA1)的相互作用分子以及在虫体入侵过程中发挥的作用,本实验室在前期研究中利用酵母双杂交技术,以Et AMA1为诱饵,筛选柔嫩艾美耳球虫子孢子酵母双杂交cDNA文库,获得了一些可能与Et AMA1相互作用蛋白的ESTs序列[12]。这些蛋白分子可能参与了柔嫩艾美耳球虫入侵宿主细胞,在虫体入侵宿主细胞过程中发挥重要作用。因此,我们选择编号为23的EST序列进一步对其进行研究,该EST序列含3'端Ploy(A)尾,Blast分析与柔嫩艾美耳球虫推测的胱硫醚β合成酶(cystathionine β-synthase of Eimeria tenella,Et CBS)同源。本研究利用RACE(rapid-amplification of cDNA ends)技术扩增获得了该基因的全长cDNA序列,通过RT-PCR扩增其开放阅读框,连接到真核表达载体pBiFC-VC155上,构建了真核重组表达质粒pBiFC-VC155-Et CBS,并在DF-1中成功表达,为进一步研究该蛋白的特性和功能提供基础。
1 材料与方法
1.1 材料
1.1.1 实验虫株和菌株 柔嫩艾美耳球虫(资源编号:CAAS21111611)由中国农业科学院上海兽医研究所原虫病团队保存;大肠杆菌TOP10感受态细胞购自上海天根生物技术有限公司。
1.1.2 载体、抗体和细胞 兔源性抗重组Et CBS(rEt CBS)蛋白抗体由本课题组制备保存;真核细胞DF-1由上海兽医研究所丁铲研究员馈赠;pGEM-Teasy载体克隆载体购自美国Promega公司;双分子荧光互补载体pBiFC-VC155由上海兽医研究所刘光清研究员馈赠。
1.1.3 主要试剂与工具酶 Trizol、限制性内切酶EcoR I和Bgl Ⅱ均购于大连宝生物工程有限公司;Lipofectamine 2000、opti-MEM培养基购自美国Invitrogen公司;FITC标记山羊抗兔二抗购自Sigma公司;胎牛血清和DMEM购自美国Gibco 公司;荧光(DyLight 488)标记羊抗兔IgG购自LI-COR 公司;RIPA 裂解液购自上海碧云天生物技术有限公司。
1.2 方法
1.2.1 子孢子的收集和纯化 将2.0×105柔嫩艾美耳球虫孢子化卵囊接种7日龄无球虫雏鸡,d 8收集未孢子化卵囊,在适宜条件下孢子化,待90%的卵囊为孢子化卵囊时,收集纯化孢子化卵囊。将纯化的孢子化卵囊加入含有适量灭菌PBS的玻璃匀浆器中,研磨至孢子囊完全释放,加入适量灭菌的HBBS,946×g离心10 min,将沉淀用HBBS重悬转移至三角烧瓶中,向其中加入0.5%的胰蛋白酶和5%的鸡胆汁,混匀后41℃水浴消化至95%以上的子孢子逸出,G3砂芯漏斗过滤,反复离心后,置于液氮保存。
1.2.2 总RNA的提取 按照Trizol试剂的说明书进行操作,提取子孢子的总RNA,取少量进行甲醛凝胶变性电泳分析总RNA的完整性,用紫外分光光度计测定浓度并分析纯度,符合要求后用于RACE模板的制备。
1.2.3 引物设计与合成
1.2.3.1 RACE引物 根据编号为23的EST 序列,该序列含有3' 端poly(A)尾,利用Primer Premier5.0软件设计扩增5' 端RACE的特异性引物。3'端引物:5'-GG CAAGAGACACCTGCGGCAGTGCCC-3';巢式引物:5'-CTGCGGCAGTGCCCACGCGTGACAGG-3';5'公用引物由试剂盒提供,包括 GeneRacerTM5' 引物: 5'-CGACTGGAGCACGAGGACACTGA-3'和GeneRacerTM5' 巢式引物:5'-GGACACTGACATGG ACTGAAGGAGTA-3'。
1.2.3.2 ORF扩增引物 根据拼接的全长cDNA 序列,设计上下游引物进行RT-PCR扩增含完整ORF 的cDNA 片段,在上下游引物引入酶切位点EcoR I和Bgl Ⅱ。上游引物:5'-CGAATTCGGGCCACCATG GAACCCATTAACAGCAGGCAGT-3';下游引物:5'-GCAGATCTGAGGAAGCGAACATTCCCCCTGC T-3'。所有引物均由上海赛百盛公司合成。
1.2.4 Et CBS基因的克隆与测序
1.2.4.1 cDNA 5'端的扩增和测序 利用GeneRacerTMKit扩增Et CBS基因的5'端,具体步骤按照说明书操作,对提取的柔嫩艾美耳球虫子孢子总RNA 依次进行去磷酸化、去mRNA 帽结构、连接RNA Oligo接头、反转录成cDNA第一链,然后进行cDNA 的5' 端扩增。PCR 扩增体系:含模板1 μL,上游引物1.5 μL、下游引物1 μL,总体积为25 μL。反应条件:94℃预变性 2 min ;94℃变性 30 s,72℃延伸 1 min,5 个循环;94℃变性 30 s,70℃延伸1 min,5 个循环;94℃预变性 30 s,64℃退火30 s,72℃延伸 1 min,25 个循环;72℃延伸10 min。反应结束后,取 10 μL 进行1% 琼脂糖凝胶电泳分析,无特异性条带,则以上一轮PCR产物为模板继续进行nested PCR,反应条件:94℃预变性 2 min ;94℃变性 30 s,68℃退火 30s,72℃延伸2 min,25个循环;72℃再延伸10 min。反应结束后取10 μL 进行1% 琼脂糖凝胶电泳分析,回收特异性条带与pGEM-Teasy 载体连接,连接产物转化TOP10 感受态细胞,进行蓝白斑筛选,挑选白斑菌落过夜培养后,进行PCR 鉴定。经鉴定分子量大小与预期一致的阳性菌落,送上海桑尼生物技术有限公司进行测序。
1.2.4.2 Et CBS基因ORF序列的扩增和测序 对5' RACE PCR的序列进行分析,利用NCBI的去载体序列分析软件去除载体序列,再利用DNAStar软件查找5' RACE PCR产物的序列与原EST序列的重叠部分,将两段序列拼接即可获得全长cDNA序列。根据拼接的目的基因全长cDNA序列,利用合成的引物进行PCR扩增ORF。PCR 扩增体系含模板1 μL,上游引物1 μL,下游引物1 μL,总体积为20 μL。反应条件:94℃预变性 2 min ;94℃变性 30 s,58℃退火 30 s,72℃延伸2 min,35 个循环;72℃延伸10 min。反应结束后取5 μL进行1% 琼脂糖凝胶电泳分析,回收特异性条带与pGEM-T easy载体连接,转化TOP10 感受态细胞,进行蓝白斑筛选,挑选白斑菌落过夜培养后,进行PCR 鉴定。经鉴定分子量大小与预期一致的阳性菌落,送上海桑尼生物技术有限公司进行测序。
1.2.5 Et CBS基因的生物信息学分析 利用NCBI的在线软件ORF finder分析获得的新基因全长cDNA序列,找出编码框。利用ProtParam工具(http://cn.expasy.org/tools/protparam.html)计算编码蛋白质的理论分子量、等电点、氨基酸组成等。利用TMHMM服务器(http://www.cbs.dtu.dk/services/TMHMM-2.0/)分析编码蛋白有无跨膜结构。利用SignalP3.0在线分析软件(www.cbs.dtu.dk/services/SignalP)分析编码蛋白有无信号肽。利用ProtScale分析软件(www.expasy.org/cgi-bin/protscale.pl)分析编码蛋白的疏水性。采用motif_scan(http://myhits.isb-sib.ch/cgi-bin/ motif_scan)寻找氨基酸序列的功能结构域。利用北京大学生物信息中心WebLab中提供的Antigenic程序(http://weblab.cbi.pku.edu.cn/program.inputForm.do?program=antigenic)分析其抗原位点。采用NCBI服务器中的CDD(http://www.ncbi.nlm.nih.gov/ structure/cdd/cdd.shtml)程序对氨基酸序列进行功能保守域分析,判断该蛋白是否具有完整的保守结构域。
1.2.6 真核重组质粒pBiFC-VC155-Et CBS的构建 小提质粒参照上海天根生物技术有限公司的质粒提取试剂盒提取重组克隆质粒pGEM-T-Et CBS和空载体pBiFC-VC155,利用EcoR Ⅰ和Bgl Ⅱ对重组质粒和空载体分别进行双酶切,酶切产物进行琼脂糖凝胶电泳后胶回收空载体条带和目的条带。将回收的目的基因与空载体连接构建重组质粒,连接体系中含2×Rapid Ligation Buffer 10.0 μL、Et CBS基因 7.0 μL、pBiFC-VC155载体2.0 μL、T4 DNA Ligase 1.0 μL。16℃连接6 h以上,转化至TOP10感受态细胞,挑取白斑至LB培养基中培养12 h后,进行PCR鉴定。对鉴定为阳性的菌液提取质粒用EcoR I和BglⅡ限制性内切酶进行双酶切鉴定,阳性克隆送至上海桑尼生物有限公司进行测序。
1.2.7 DF-1细胞的培养以及真核重组质粒的转染 从液氮中取出DF-1细胞,迅速放入37℃水浴,细胞液融化后将其420×g离心5 min,在超净工作台内吸出冻存液,加入含10%胎牛血清的完全培养基悬浮细胞,然后接种细胞到培养瓶中,并加入足量的培养基。将培养瓶放入37℃含5%CO2的细胞培养箱中,培养细胞至80%~90%丰度后进行传代培养。将处于对数生长期的细胞用胰蛋白酶消化后,加入完全培养基制成细胞悬液接种6孔细胞培养板,每孔接种约60万个细胞,放入37℃含5%CO2的培养箱中培养,至长满约80%时,将空质粒和重组质粒分别转染至DF-1细胞。转染步骤按照Lipofectamine 2000操作说明进行,6 h后将孔中溶液更换为含2%胎牛血清的完全培养基,在37℃含5%CO2的细胞培养箱中培养48 h后,分别用Western blot和间接免疫荧光(indirect immunoinfluscence assay,IFA)检测表达情况。
1.2.8 Western blot鉴定真核重组表达质粒pBiFCVC155-Et CBS在DF-1中的表达情况 收集转染过pBiFC-VC155-Et CBS和pBiFC-VC155并培养48 h的DF-1细胞,加入Western及IP细胞裂解液100 μL充分裂解细胞后,4℃、10 509×g离心3 min,取上清进行SDS-PAGE电泳,全湿法电转PVDF膜上,5%脱脂奶粉封闭过夜。PBS洗涤3次,加入1:100稀释的抗rEt CBS 蛋白兔血清,37℃孵育2 h;PBST洗膜3次,加入1:10 000稀释的荧光(DyLight 488)标记羊抗小鼠IgG,37℃孵育2 h,PBST洗膜5次,PBS洗膜3次,用Odyssey双色红外激光成像系统进行拍照。
1.2.9 间接免疫荧光(IFA)鉴定真核重组表达质粒pBiFC-VC155-Et CBS在DF-1中的表达 为了检测真核重组表达质粒pBiFC-VC155-Et CBS在DF-1中的表达情况,在转染的细胞培养48 h后,分别向每孔中加入2%多聚甲醛1 mL固定15 min;PBST洗涤3遍,加入1%Triton X-100 mL,室温下作用15 min;用PBST洗3次,加入2%BSA/PBS 2 mL,4℃封闭过夜;PBST洗涤3遍,加入1:100稀释的抗rEt CBS 蛋白兔源血清,37℃作用1 h;PBST洗涤3次,加入1:400稀释的绿色荧光标记的山羊抗兔二抗,37℃作用1 h,PBS洗涤3次后再荧光显微镜下观察结果。
2 结果
2.1 Et CBS基因的生物信息学分析 该序列全长2423 bp,包括5' 的UTR序列,长200 bp,含有CAAT序列,没有TATA序列;3' 端UTR序列,长336 bp,含poly(A)尾,没有典型的AATAAA序列,ORF 长1887 bp,编码629个氨基酸(图1),理论分子量为68 kDa,预测等电点为5.23。在溶液中的不稳定指数为48.93,高于域值40,在溶液中性质不稳定,脂肪族指数88.76,总平均亲水性-0.176;信号肽、跨膜结构的分析表明:该基因编码的蛋白不具有信号肽,也不存在跨膜结构。疏水性分析显示最大值为2.911,最小值为-3.900。抗原位点分析发现,该蛋白可能有24个抗原位点。Coil区分析发现该蛋白不具有卷曲螺旋结构。结构功能域分析发现该基因编码的蛋白可能含有4个N端糖基化位点,1个cAMP和cGMP依赖的蛋白激酶磷酸化位点,8个酪蛋白激酶Ⅱ磷酸化位点,13个蛋白激酶C磷酸化位点和1个异戊烯基的结合位点。与柔嫩艾美耳球虫基因组数据库(http://www.genedb.org/ Homepage/Etenella)比较发现,该基因的ORF与保守的假象蛋白(hypothEtical protein,conserved,ETH_00004510)100%同源,利用NCBI的CDD程序对该基因编码的氨基酸保守结构域进行搜索,结果显示该基因编码的氨基酸有胱硫醚-β-合成酶(cystathionine β-synthase)位点。使用NCBI (http://www.ncbi.nlm.nih.gov/BLAST/)BLAST发现该基因编码的蛋白与柔嫩艾美耳球虫推测的胱硫醚β合成酶(cystathionine β-synthase)100%同源,因此命名该基因为柔嫩艾美耳球虫胱硫醚β合成酶(Et CBS)。

图1 Et CBS cDNA的核苷酸序列及其氨基酸序列Fig.1 Nucleotide and predicted amino acid sequences of Et CBS gene
2.2 Et CBS基因ORF的克隆 根据拼接的全长cDNA序列,利用合成的引物以柔嫩艾美耳球虫子孢子的cDNA第一链为模板进行PCR扩增含ORF的cDNA片段,扩增产物经1%琼脂糖凝胶电泳分析,在1887 bp处有特异性的单一条带,与预期大小一致(图2)。将其回收后与pGEM-T easy载体连接,转化感受态细胞TOP10,经菌液PCR、双酶切、测序鉴定正确,表明成功扩增获得Et CBS基因含ORF的cDNA片段。
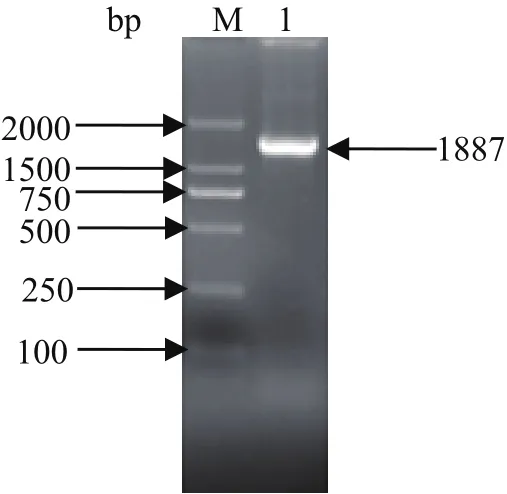
图2 Et CBS的PCR扩增结果Fig.2 Amplifi cation of Et CBS by PCR
2.3 重组真核表达质粒pBiFC-VC155- Et CBS的构建 分别用EcoR I 和Bgl Ⅱ对鉴定正确的重组克隆质粒pGEM-T-Et CBS和空载体pBiFC-VC155进行双酶切,胶回收纯化后进行连接,构建真核重组表达质粒pBiFC-VC155-Et CBS。对该重组表达质粒进行PCR和双酶切鉴定,结果显示均为阳性,测序结果显示该基因正确插入,表明真核重组表达质粒pBiFC-VC155-Et CBS构建成功(图3)。
2.4 Western blot鉴定真核重组表达质粒pBiFCVC155- Et CBS在DF-1中的表达情况 Western blot 结果显示,转染了真核重组表达质粒pBiFCVC155-Et CBS的DF-1细胞中可检测到大小约为68 kDa的目的条带,而转染空载体的DF-1细胞中却没有相应的条带出现,这表明构建的重组表达质粒pBiFC-VC155-Et CBS在DF-1细胞中成功转染和表达(图4)。
2.5 间接免疫荧光(IFA)鉴定真核重组表达质粒pBiFC-VC155- Et CBS在DF-1中的表达情况 用rEt CBS蛋白免疫兔制备的多克隆抗血清和绿色荧光标记山羊抗兔二抗作用后,进行免疫荧光检测。结果显示,在转染真核重组表达质粒pBiFC-VC155- Et CBS的DF-1细胞中,可以看到特异的绿色荧光,而在转染pBiFC-VC155空载体的DF-1细胞中,则无绿色荧光(图5)。结果表明重组表达质粒pBiFCVC155- Et CBS在DF-1细胞中成功转染和表达。

图3 重组质粒pBiFC-VC155- Et CBS的PCR及双酶切鉴定结果Fig.3 PCR and restriction enzyme digestion analysis of recombinant plasmid pBiFC-VC155-Et CBS
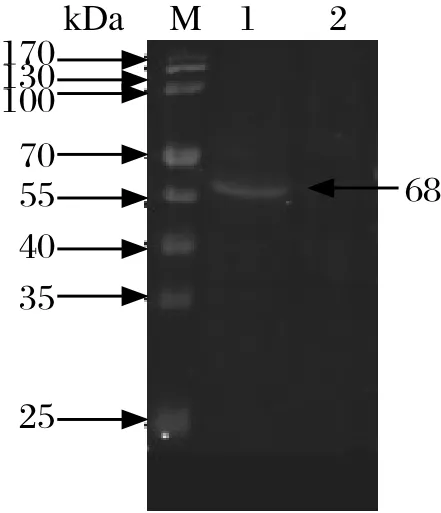
图4 pBiFC-VC155- Et CBS重组蛋白Western blot分析结果Fig.4 Western blot analysis of recombinant pBiFCVC155- Et CBS protein

图5 重组质粒pBiFC-VC155- Et CBS表达产物的间接免疫荧光检测Fig.5 IFA result of recombinant plasmids pBiFC-VC155-Et CBS expression product
3 讨论
本研究获得的Et CBS基因,是根据前期实验室利用柔嫩艾美耳球虫Et AMA1为诱饵蛋白,筛选子孢子酵母双杂交cDNA文库获得的EST,然后利用RACE技术扩增获得的,因此该蛋白很可能与Et AMA1相互作用,参与子孢子入侵宿主细胞的过程。该基因全长2423 bp,包括5' 的UTR序列,长200 bp,含有CAAT序列,没有TATA序列;5'UTR是指从真核生物mRNA 5' 末端的帽子结构到起始密码子之间的序列,是核糖体识别元件之一,主要参与翻译调节,影响转录后的各个阶段,包括mRNA的稳定,折叠和核糖体的相互作用。3' 端UTR序列,长336 bp,含poly(A)尾,没有典型的AATAAA序列,主要影响RNA的水平。对该基因ORF编码的氨基酸序列抗原位点分析发现该基因编码的蛋白可能有24个抗原位点,推测该蛋白具有良好的免疫原性,极有可能是很好的药物靶标。使用NCBI (http://www.ncbi.nlm.nih.gov/BLAST/)BLAST发现该基因编码的蛋白与柔嫩艾美耳球虫推测的胱硫醚β合成酶100%同源。胱硫醚β-合成酶(CBS)是一种磷酸吡哆醛依赖型酶,以3个结构域和1个血红素结构域组成的同源四聚体的形式存在,在动物体内是催化同型半胱氨酸(homocysteine,HCY)转硫途径的关键酶,其活性的下降容易导致HCY异常升高而形成同型半胱氨酸血症[13]。目前,人类[14]和哺乳动物CBS[15]的研究已经非常透彻,但对鸡球虫CBS的研究还未有报道,CBS是否在鸡球虫入侵宿主细胞过程以及生活史的完成过程中发挥重要作用,还需要进一步的研究,本研究成果对进一步研究鸡球虫的CBS提供了基础。
双分子荧光互补技术BiFC(bimolecular fluorescence complementation)是将荧光报告蛋白按照规则分成没有荧光的两段,分别与诱饵蛋白和捕获蛋白融合,只有在诱饵蛋白和捕获蛋白发生相互作用的情况下,两段不完整的荧光报告蛋白才会形成完整的报告蛋白,发出荧光[16]。BiFC技术不需要提取蛋白,在活细胞内可视化的观察蛋白质相互作用关系[17,18],该技术是将特定的荧光蛋白分子从环状结构的特定位点切割成N端片段和C端片段,然后将其和拟观察的目的蛋白融合表达。如果目的蛋白间可以相互作用,它们会相互靠近,使荧光蛋白的活性恢复,发出特定荧光[19]。根据切割位置的不同,目前有7对可以发出特定波长的双分子荧光载体,其中pBiFC-VC155和pBiFC-VN155就是将绿色荧光蛋白GFP从155位氨基酸处切开得到的一对双分子荧光载体[20]。本实验中成功地将Et CBS基因连接到pBiFC-VC155上与GFP的C端融合表达,并将重组质粒转染DF-1细胞,48 h后分别用IFA和Western blot 检测到构建的重组真核质粒能在DF-1细胞中成功表达,因此,在后续的试验中可以进一步探讨Et CBS基因和Et AMA1是否相互作用。
近年来,为了深入研究核酸疫苗和鸡球虫的功能基因,许多研究者将鸡球虫功能基因连接到真核表达载体上,成功构建了真核重组表达质粒,并在不同的真核细胞中获得表达。王晔等[21]在293T细胞中表达了柔嫩艾美耳球虫棒状体蛋白2(ROP2)。刘颖丽等[22]在Hela细胞中成功表达了柔嫩艾美耳球虫的微线体蛋白2(Et MIC2)。但是这些表达球虫蛋白所用的细胞均来自于哺乳动物而并非来自球虫的宿主鸡。本研究用鸡胚成纤维细胞DF-1来表达Et CBS基因,DF-1细胞系是一种稳定的、无肿瘤基因、自发无限增殖的细胞系,有正常的成纤维细胞形态,目前被广泛用于动物病毒研究、疫苗研制、癌症研究等诸多领域,是生命科学领域重要的病毒转染、培养生物的材料[23,24]。Lee等[25]研究发现,和MDCK细胞系相比较,DF-1细胞系对禽流感病毒有更高的转染效率和复制率。王永强等[26]的研究表明DF-1细胞比CEF细胞系更适合传染性法氏囊病病毒的传代。近年来,DF-1细胞也被用于鸡球虫体外培养的研究。姜连连等[27]首次建立了柔嫩艾美耳球虫DF-1传代细胞培养体系,子孢子在该培养体系中可以发育为第一代裂殖子,表明该细胞系可以用于鸡球虫的体外研究。本实验室已经成功利用该细胞表达了柔嫩艾美耳球虫保守蛋白 CHP559[28]和沉默信息调节因子2(silence information regulator 2,EtSIR2)[29]。
本研究首先利用RACE技术克隆获得了EtCBS基因含一个完整ORF的全长序列,通过RT-PCR扩增得到含完整开放阅读框的基因片段,并将其与真核表达载体pBiFC-VC155连接,成功构建了真核重组表达质粒pBiFC-VC155-Et CBS,间接免疫荧光实验显示在DF-1细胞中检测到绿色荧光。研究结果表明本实验已成功获得了Et CBS的全长序列并成功构建了Et CBS的真核重组表达质粒,且在真核细胞DF-1中获得表达。由于DF-1来自于柔嫩艾美耳球虫天然宿主的本源细胞,以其为平台更有利于研究球虫基因的功能以及与宿主蛋白间的互作关系。本研究结果将为深入研究Et CBS基因的功能以及验证该基因与Et AMA1的相互作用关系奠定了基础。
[1] 索勋, 李国清.鸡球虫病学[M].北京: 中国农业大学出版社, 1998.
[2] Dalloul R A, Lillehoj H S.Poultry coccidiosis: recent advancements in control measures and vaccine development[J].Expert Rev Vac, 2006, 5(1): 143-163.
[3] Besteiro S, DubremEtz J, Lebrun M.The moving junction of apicomplexan parasites: a key structure for invasion[J].Cell Microbiol, 2011, 13(6): 797-805.
[4] Aikawa M, Miller L H, Johnson J, et al.Erythrocyte entry by malarial parasites.A moving junction between erythrocyte and parasite[J].J Cell Biol, 1978, 77(1): 72-82.
[5] Mauld L, Sébastien B, Julien P, et al.The RON2-AMA1 interaction is a critical step in moving junction-dependent invasion by apicomplexan parasites[J].PLoS Pathog, 2011, 7(2): e1001276.
[6] Mordue D G, Desai N, Dustin M, et al.Invasion by Toxoplasma gondii establishes a moving junction that selectively excludes host cell plasma membrane proteins on the basis of their membrane anchoring[J].J Exp Med, 1999, 190(12): 1783-1792.
[7] Tyler J S, Boothroyd J C.The C-terminus of Toxoplasma RON2 provides the crucial link between AMA1 and the host-associated invasion complex[J].PLoS Pathog, 2011, 7(2): e1001282.
[8] Tonkin M L, Magali R, Lamarque M H, et al.Host cell invasion by apicomplexan parasites: Insights from the Co-Structure of AMA1 with a RON2 Peptide[J].Science, 2011, 333(6041): 463-467.
[9] Mauld L, Sébastien B, Julien P, et al.The RON2-AMA1 interaction is a critical step in moving junction-dependent invasion by apicomplexan parasites[J].PLoS Pathog, 2011, 7(2): e1001276.
[10] 姜连连.柔娕艾美耳球虫DF-1细胞培养体系的建立及EtSerpin, EtAMAl基因功能的初步研究[D].北京: 中国农业科学院, 2011.
[11] 王晔.柔嫩艾美耳球虫4种基因的真核重组质粒构建与EtAMA1核酸疫苗的保护效果初步评价[D].北京: 中国农业科学院, 2013.
[12] 薛璞.柔嫩艾美耳球虫子孢子酵母双杂交cDNA文库的构建及EtAMA1相互作用蛋白的初步筛选[D].上海: 上海师范大学, 2013.
[13] Janosík M , Kery V , Gaustadnes M, et al.Regulation of human cystathionine beta-synthase by S-adenosyl-L-methionine: evidence for two catalytically active conformations involving an auto inhibitory domain in the C-terminal region[J].Biochemistry, 2001, 40(35): 10625-10633.
[14] 王利群, 顾雅平, 曹利民, 等.截短人胱硫醚β-合成酶的可溶性表达、纯化及活性鉴定[J].华中科技大学学报:医学版, 2012, 41(6): 697-703.
[15] 刘梦洁, 陈秋霞, 高丹, 等.APP/PS1双转基因小鼠CBS过表达对Aβ代谢及认知功能的影响[J].第三军医大学学报, 2015, 37(17): 1750-1754.
[16] 严晶, 霍克克.双分子荧光互补技术及其在蛋白质相互作用研究中的应用[J].生物化学与生物物理进展, 2006, 6(6): 589-595.
[17] Hu C D, Kerppola T K.Simultaneous visualization of multiple protein interactions in living cells using multicolor fluorescence complementation analysis[J].Nat Biotechnol, 2003, 21(5): 539-545.
[18] Kerppola T K.Bimolecular fluorescence complementation (BiFC) analysis of protein interactions in live cells[J].Cold Spring Harb Protoc, 2013, 2013(8):798-803.
[19] Kerppola T K.Design of fusion proteins for bimolecular fluorescence complementation(BiFC)[J].Cold Spring Harb Protoc, 2013, 13(8): 714-718.
[20] 樊晋宇, 崔宗强, 张先恩.双分子荧光互补技术[J].中国生物化学与分子生物学报, 2008, 24(8): 767-774.
[21] 王晔, 姜连连, 韩红玉, 等.柔嫩艾美耳球虫棒状体颈部蛋白2基因真核表达载体的构建及在293T细胞中表达[J].中国动物传染病学报, 2012, 20(5): 39-44.
[22] 刘颖丽, 李建华, 郑君, 等.鸡柔嫩艾美耳球虫EtMIC-2基因真核表达载体的构建及其在Hela细胞中的表达[J].中国兽医学报, 2011, 31(8): 1142-1146.
[23] 盖丽丽, 张莉, 姜世金, 等.3种花色苷对DF-1细胞的影响[J].生物技术通讯, 2012, 23(4): 542-546.
[24] Himly M, Foster D N, Bottoli I, et al.The DF-1 chicken fibroblast cell line: Transformation induced by diverse oncogenes and cell death resulting from infection by avian leukosis viruses[J].Virology, 1998, 248(2): 295-304.
[25] Lee C W, Jung K, Jadhao S J, et al.Evaluation of chickenorigin (DF-1) and quail-origin (QT-6) fibroblast cell lines for replication of avian influenza viruses[J].J Virol Methods, 2008, 153(1): 22-28.
[26] Wang Y, Qi X, Gao H, et al.Comparative study of the replication of infectious bursal disease virus in DF-1 cell line and chicken embryo fibroblasts evaluated by a new real-time RT-PCR[J].J Virol Methods, 2009, 157(2): 205-210.
[27] 姜连连, 林矫矫, 韩红玉, 等.柔嫩艾美耳球虫DF-1细胞培养体系的建立及应用[J].中国兽医科学, 2011, 41(06): 551-556.
[28] 翟颀, 黄兵, 董辉, 等.柔嫩艾美耳球虫保守蛋白CHP559基因克隆与真核表达[J].生物技术通报, 2015, 31(7): 161-168.
[29] 杨斯涵, 赵其平, 韩红玉, 等.柔嫩艾美耳球虫沉默信息调节因子2真核表达质粒的构建及在细胞中的表达[J].中国动物传染病学报, 2015, 23(2): 53-59.
GENE CLONING AND EUKARYOTIC EXPRESSION OF CYSTATHIONINE β-SYNTHASE OF EIMERIA TENELLA
LI Cong1, DONG Hui1, ZHU Shun-hai1, ZHU Xue-long1, WANG Zi-wen1, ZHAO Qi-ping1, XIA Wei-li1,2, MEN Qi-fei1,2, HUANG Bing1,3, HAN Hong-yu1
(1.Key Laboratory of Animal Parasitology of Ministry of Agriculture, Shanghai Veterinary Research Institute, CAAS, Shanghai 200241, China; 2.College of Life and Environment Sciences; Shanghai Normal Unversity, Shanghai 200234, China; 3.Jiangsu Coinnovation Center for Prevention and Control of Important Animal Infections Diseases and Zoonoses, Yangzhou 225009, China)
The objective of the present study was to construct recombinant expression plasmids of cystathionine β-synthase of Eimeria tenella (Et CBS) and study the expression of Et CBS gene in transfected DF-1 cells.The full-length cDNA of EtCBS was obtained using rapid amplifi cation of cDNA ends (RACE).The ORF of Et CBS was amplifi ed in RT-PCR and ligated to the eukaryotic expression vector pBiFC-VC155.The recombinant plasmid pBiFC-VC155-Et CBS was confi rmed in PCR and restriction enzyme digestion.Subsequently, the recombinant plasmid was transfected into DF-1 cells.Western blot and indirect immunofl uorescence assay (IFA) were used to examine the expression of recombinant Et CBS.The results showed that the full-length cDNA of Et CBS was 2423 bp in length and contained a 1887-bp ORF located between 201~2087 bp encoding 407 amino acids with molecular weight of 68 kDa.The deduced amino acidsequence of the protein had neither transmembrane region nor signal peptide.Western blot indicated that a protein with molecular weight of 68 kDa in the transfected cells was strongly recognized by the antiserum of recombinant Et CBS protein (rEtCBS).Specifi c green fl uorescence was observed in the DF-1 cells by IFA.These results will provide important rationale to study the functions of Et CSB.
Eimeria tenella; cystathionine β-synthase; DF-1 cell; eukaryotic expression
S852.723
A
1674-6422(2016)02-0053-09
2015-12-18
国家自然科学基金(31201699、31572266);农业部中央级公益性科研院所项目(2015JB10)
李聪,女,硕士研究生,兽医学专业
韩红玉,E-mail:hhysh@shvri.ac.cn

