4种化学物质处理对多籽蒜种子萌发的影响
, , , (新疆农业大学林学与园艺学院, 乌鲁木齐 830052)
·研究报告·
4种化学物质处理对多籽蒜种子萌发的影响
王鹏,林辰壹,陈伟,隆燕
(新疆农业大学林学与园艺学院, 乌鲁木齐 830052)
为明晰多籽蒜种子的休眠类型和解除休眠的方法,研究了机械处理和4种化学物质对多籽蒜种子萌发的影响。结果表明:砂纸摩擦处理种子萌发率极显著高于对照;4种化学物质在一定浓度范围内表现为低浓度促进、高浓度抑制种子萌发,最佳处理浓度分别为150 mg/L GA3、5 mg/L 6-BA、0.1 mg/L SA、300 mg/L PG;提高种子萌发率的作用由大到小依次为:6-BA>SA>GA3>PG;多籽蒜种子的休眠是由种皮障碍和因胚尚未完成生理成熟引起的胚生理休眠共同引起的混合休眠,可以通过机械处理和一定浓度的化学物质调控后解除种子休眠,提高种子萌发率。
多籽蒜; 砂纸磨擦; 种皮障碍; 萌发率; 休眠
植物种子的休眠与萌发是植物种子维持生存及适应环境变化的一种特征,受许多基因调控和环境因子的影响[1]。种子休眠和萌发过程中,激素、类激素扮演着非常重要的角色,它们能通过信号传导对种子内各种生理变化做出反应,调节一系列蛋白质、酶的代谢,从而调控种子的休眠和萌发[2],研究种子萌发调控的意义是为深入开展植物种子休眠与萌发研究及解除休眠与种子人工萌发的生产实践工作指明方向,并提供理论依据[3]。外源适宜浓度的赤霉素(GA3)和6-苄氨基嘌呤(6-BA)能够促进种子提前萌发,影响种子的生理和代谢活动,有效提高种子发芽率[4-5];水杨酸(SA)被认为是一种具有多种生理作用的物质,不仅具有诱导作物抗病、抗逆境胁迫的作用,还具有促进种子萌发的作用[6-9];青霉素(PG)作为一种高效低毒的抗菌药物,越来越多的研究者认为其作用类似于IAA、GA3等,可促进种子萌发[10-12]。
多籽蒜(AlliumfetisowiiRegel)属于葱属植物,国内分布于新疆霍城、青河、塔城和新源等地的背阴山坡、草地灌木和干旱坡地,是一种集烹饪、观赏及药用价值为一身的特色野生植物,是新疆特殊地理环境下分布的重要资源[13]。在人工栽培训化过程中发现,当年采集的新鲜多籽蒜种子的萌发率为0,如何用简单、易行的方法提高多籽蒜种子的发芽率,促进种子发芽,实现人工栽培的目标是生产上需要解决的重要问题。本研究通过赤霉素、6-苄基氨基嘌呤、水杨酸、青霉素浸种处理多籽蒜种子,掌握多籽蒜休眠机制,寻求提高多籽蒜种子萌发率的方法,以期为其引种驯化和人工栽培提供参考依据,为野生多籽蒜的合理开发利用和制定保护措施提供指导。
表1 种皮机械磨擦处理对多籽蒜种子萌发的影响
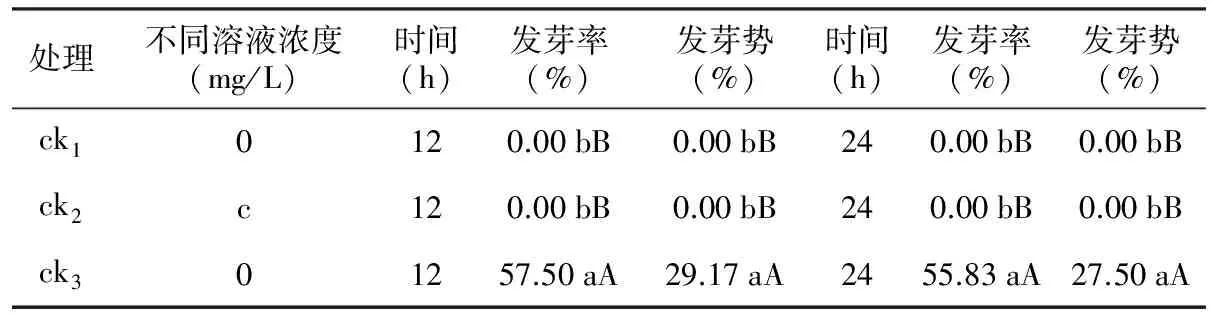
处理不同溶液浓度(mg/L)时间(h)发芽率(%)发芽势(%)时间(h)发芽率(%)发芽势(%)ck10120.00bB0.00bB240.00bB0.00bBck2c120.00bB0.00bB240.00bB0.00bBck301257.50aA29.17aA2455.83aA27.50aA
注:c分别代表不同溶液的不同处理浓度。
1 材料与方法
1.1 材 料
供试种子于2015年6月采自伊宁市新源县(43°15′N,83°25′E)。在室温下晾干后装入网袋保存、备用。
1.2 试验方法
按照50,100,150,200 mg/L的浓度梯度配置赤霉素(GA3)水溶液[14];按照5,10,15,20 mg/L的浓度梯度配置6-苄基氨基嘌呤(6-BA)水溶液[15];按照0.05,0.1,0.2,0.3 mg/L的浓度梯度配置水杨酸(SA)水溶液[16];按照100,200,300,400 mg/L的浓度梯度配置青霉素(PG)水溶液[11]。以上溶液各取30 mL分别放入三角瓶中备用。取大小均匀、饱满的种子经0.1% KMnO4溶液表面消毒5 min,无菌蒸馏水冲洗3次,无菌纱布吸干表面水分后备用。种子用砂纸磨擦处理种皮后完全浸入上述溶液中,置于黑暗条件下分别浸种12 h和24 h,取出处理后的种子用无菌蒸馏水冲洗,均匀播于铺有2层湿润滤纸的玻璃培养皿(Φ=9 cm)中,15 ℃/25 ℃黑暗条件下变温培养。以没有经过砂纸磨擦处理直接用无菌蒸馏水浸种的种子为对照1(ck1),以没有经过砂纸磨擦处理直接用上述溶液分别浸种的种子为对照2(ck2),以经过砂纸磨擦处理后用无菌蒸馏水浸种的种子为对照3(ck3)。每皿30粒种子,重复4次[17]。
1.3 数据处理
每隔24 h观察并记录培养皿内种子发芽数,胚根长度超过种子纵径的1/2计为发芽种子。7 d计算发芽势,第14天计算种子的发芽率,并计算发芽指数和平均萌发时间[18-19]。试验数据用SPASS 17.0进行数据统计和方差分析。
发芽率(%)=正常发芽的种子数/供试种子数×100%;
发芽势(%)=7 d内正常发芽的种子数/供试种子数×100%;
发芽指数(GI)=∑(Gt/Dt),式中,Gt表示时间t日的发芽数;Dt表示相应的发芽日数;
平均萌发时间(MGT)=(A1T1+A2T2+…+AnTn)/(A1+A2+…+An),式中,An为培养第n天发芽数;Tn为相应发芽天数。
2 结果与分析
2.1 种子磨擦处理对多籽蒜种子萌发的影响
无论是否经过GA3、6-BA、SA和PG处理,种子没有经过砂纸磨擦而保持固有种皮特征的ck1和ck2的发芽率都为0,种子不具有萌发能力(表1)。然而种皮经过机械磨擦失去种皮固有特征的ck3,即使不经过以上溶液处理直接用无菌蒸馏水浸种,其发芽率可达到55.83%~57.50%,说明多籽蒜种子萌发过程中存在一定的种皮障碍。
2.2 GA3处理对多籽蒜种子萌发的影响
方差分析结果表明,与ck3相比,经过机械磨擦处理后的多籽蒜的种子萌发率极显著(p<0.01),受到GA3的影响,随着GA3浓度的增大以及处理时间的延长,多籽蒜种子的发芽率呈先升高后降低的趋势(表2)。
50~200 mg/L GA3处理12 h后的种子发芽率为78.33%~91.00%,发芽势为37.5%~51.67%,发芽指数为6.48~7.56,与ck3相比存在极显著差异(p<0.01),处理后的种子发芽率提高了20.83~33.50个百分点,发芽势提高了8.33~22.5个百分点,发芽指数提高了2.00~2.78,最佳浓度为150 mg/L。而在400~800 mg/L GA3浓度范围内,种子的发芽率为46.67%~56.67%,发芽势为10%~16.67%,发芽指数为3.86~4.69,极显著(p<0.01)低于50~200 mg/L GA3浓度下的发芽指标,种子发芽指标呈下降趋势,说明当GA3浓度达到400 mg/L以上时,多籽蒜种子萌发受到严重抑制。
50~400 mg/L GA3处理24 h后的种子发芽率为60.00%~83.50%,发芽势为20.00%~56.67%,发芽指数为4.99~6.72,与ck3相比存在极显著差异(p<0.01),处理后的种子发芽率提高了4.17~27.67个百分点,发芽势提高了17.5~29.17个百分点,发芽指数提高了0.35~2.08,最佳浓度为150 mg/L。而随着GA3浓度升高(600~800 mg/L),种子的发芽率为43.33%~46.67%,发芽势为16.67%,发芽指数为3.60~3.88,极显著(p<0.01)低于50~200 mg/L GA3浓度下的发芽指标,种子发芽指标呈现出下降趋势,说明当GA3浓度达到600 mg/L以上时,多籽蒜种子萌发受到严重抑制。
表2 GA3处理对多籽蒜种子萌发的影响
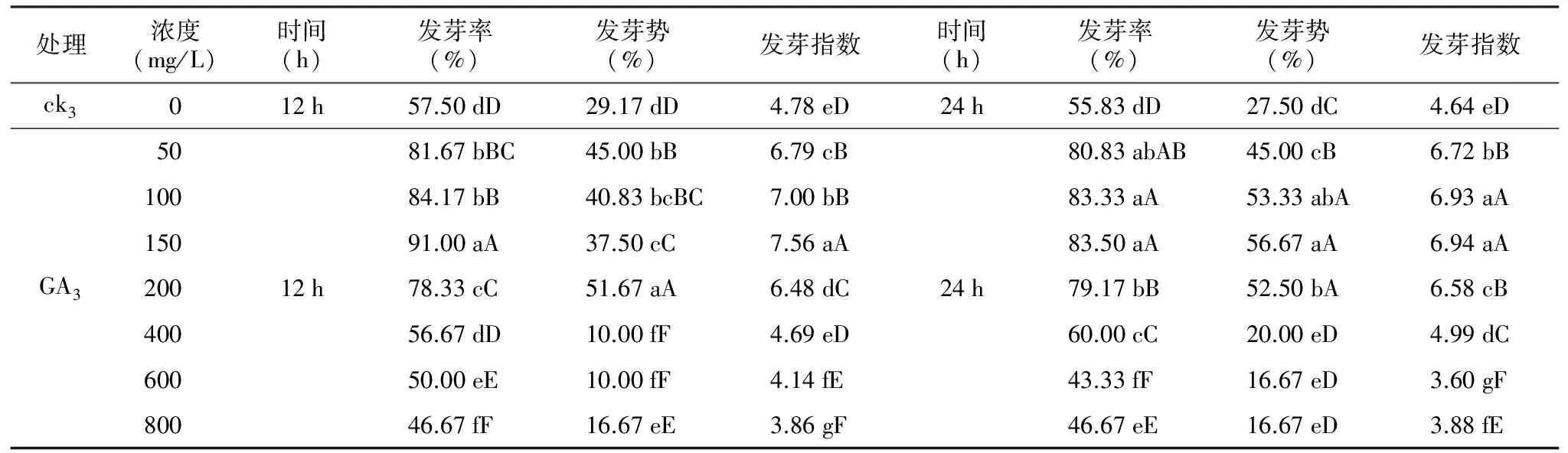
处理浓度(mg/L)时间(h)发芽率(%)发芽势(%)发芽指数时间(h)发芽率(%)发芽势(%)发芽指数ck3012h57.50dD29.17dD4.78eD24h55.83dD27.50dC4.64eD5081.67bBC45.00bB6.79cB80.83abAB45.00cB6.72bB10084.17bB40.83bcBC7.00bB83.33aA53.33abA6.93aA15091.00aA37.50cC7.56aA83.50aA56.67aA6.94aAGA320012h78.33cC51.67aA6.48dC24h79.17bB52.50bA6.58cB40056.67dD10.00fF4.69eD60.00cC20.00eD4.99dC60050.00eE10.00fF4.14fE43.33fF16.67eD3.60gF80046.67fF16.67eE3.86gF46.67eE16.67eD3.88fE
注:不同小写字母表示同列差异显著(p<0.05);不同大写字母表示同列差异极显著(p<0.01)。ck3为不经过上述溶液处理的种皮不完整的种子。下同。
表3 6-BA处理对多籽蒜种子萌发的影响
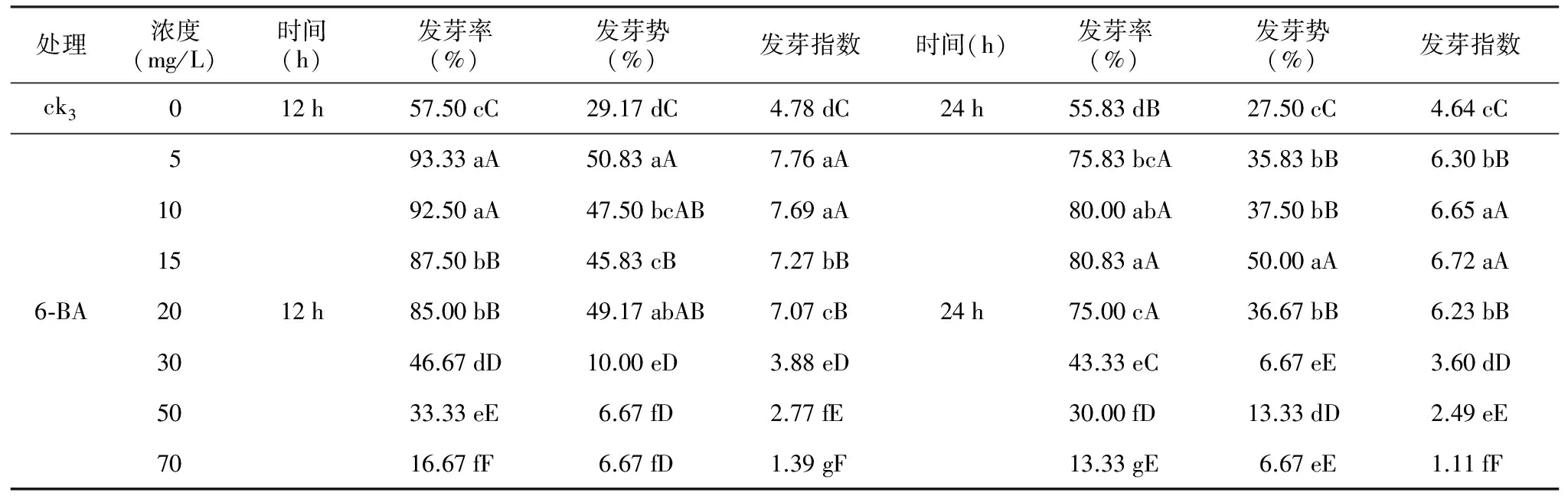
处理浓度(mg/L)时间(h)发芽率(%)发芽势(%)发芽指数时间(h)发芽率(%)发芽势(%)发芽指数ck3012h57.50cC29.17dC4.78dC24h55.83dB27.50cC4.64cC593.33aA50.83aA7.76aA75.83bcA35.83bB6.30bB1092.50aA47.50bcAB7.69aA80.00abA37.50bB6.65aA1587.50bB45.83cB7.27bB80.83aA50.00aA6.72aA6⁃BA2012h85.00bB49.17abAB7.07cB24h75.00cA36.67bB6.23bB3046.67dD10.00eD3.88eD43.33eC6.67eE3.60dD5033.33eE6.67fD2.77fE30.00fD13.33dD2.49eE7016.67fF6.67fD1.39gF13.33gE6.67eE1.11fF
2.3 6-BA处理对多籽蒜种子萌发的影响
方差分析结果表明,与ck3相比,经过机械磨擦处理后的多籽蒜种子的萌发率极显著(p<0.01)受到6-BA的影响,随着6-BA浓度的增大以及处理时间的延长,多籽蒜种子的发芽率呈下降的趋势(表3)。
5~20 mg/L 6-BA处理12 h后的种子发芽率为85.00%~93.33%,发芽势为45.83%~50.83%,发芽指数为7.07~7.76,与ck3相比存在极显著差异(p<0.01),处理后的种子发芽率提高了27.5~35.83个百分点,发芽势提高了16.66~21.66个百分点,发芽指数提高了2.29~2.98,最佳浓度为5 mg/L。而随着6-BA浓度升高(30~70 mg/L)种子的发芽率为16.67%~46.67%,发芽势为6.67%~10.00%,发芽指数为1.39~3.88,极显著(p<0.01)低于50~20 mg/L 6-BA浓度下的发芽指标,种子萌发指标呈现出下降趋势,说明当6-BA浓度达到30 mg/L以上时,多籽蒜种子萌发受到严重抑制。
5~20 mg/L 6-BA处理24 h后的种子发芽率为75.00%~80.83%,发芽势为35.83%~50.00%,发芽指数为6.23~6.72,与ck3相比存在极显著差异(p<0.01),处理后的种子发芽率提高了19.17~25个百分点,发芽势提高了8.33~22.5个百分点,发芽指数提高了1.59~2.08,最佳浓度为15 mg/L。而随着6-BA浓度升高(30~70 mg/L),种子的发芽率为13.33%~43.33%,发芽势为6.67%~13.33%,发芽指数为1.11~3.60,极显著(p<0.01)低于5~20 mg/L 6-BA浓度下的发芽指标,种子发芽指标呈现出下降趋势,说明当6-BA浓度达到30 mg/L以上时,多籽蒜种子萌发受到严重抑制。
表4 SA处理对多籽蒜种子萌发的影响
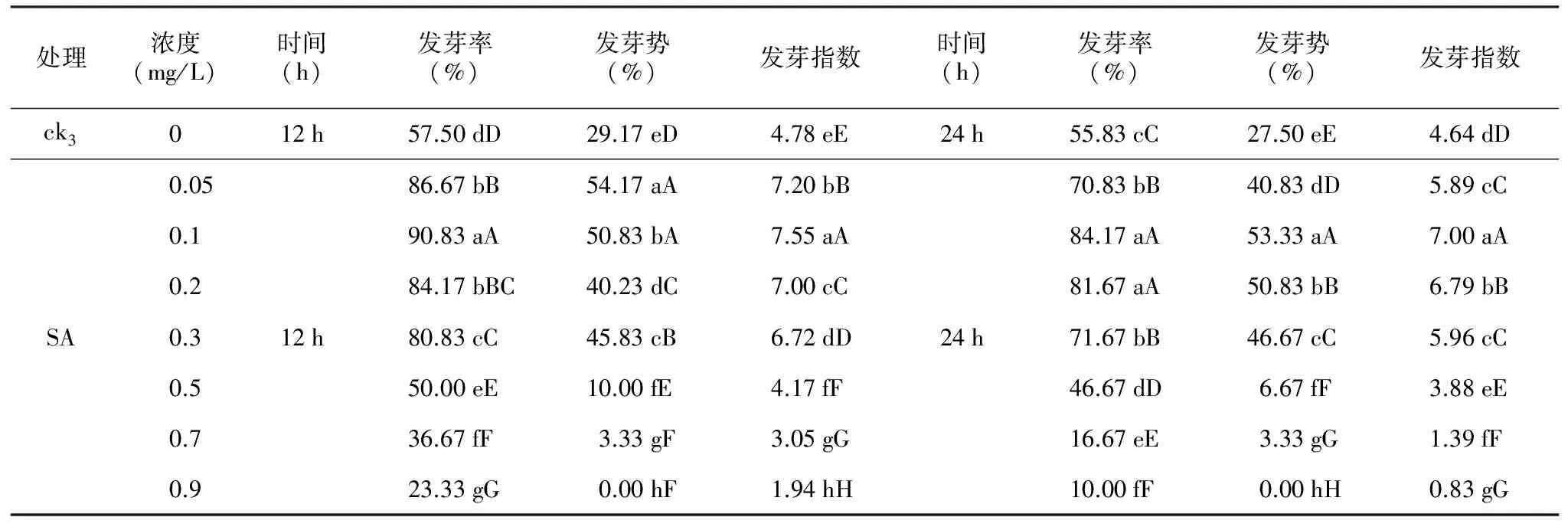
处理浓度(mg/L)时间(h)发芽率(%)发芽势(%)发芽指数时间(h)发芽率(%)发芽势(%)发芽指数ck3012h57.50dD29.17eD4.78eE24h55.83cC27.50eE4.64dD0.0586.67bB54.17aA7.20bB70.83bB40.83dD5.89cC0.190.83aA50.83bA7.55aA84.17aA53.33aA7.00aA0.284.17bBC40.23dC7.00cC81.67aA50.83bB6.79bBSA0.312h80.83cC45.83cB6.72dD24h71.67bB46.67cC5.96cC0.550.00eE10.00fE4.17fF46.67dD6.67fF3.88eE0.736.67fF3.33gF3.05gG16.67eE3.33gG1.39fF0.923.33gG0.00hF1.94hH10.00fF0.00hH0.83gG
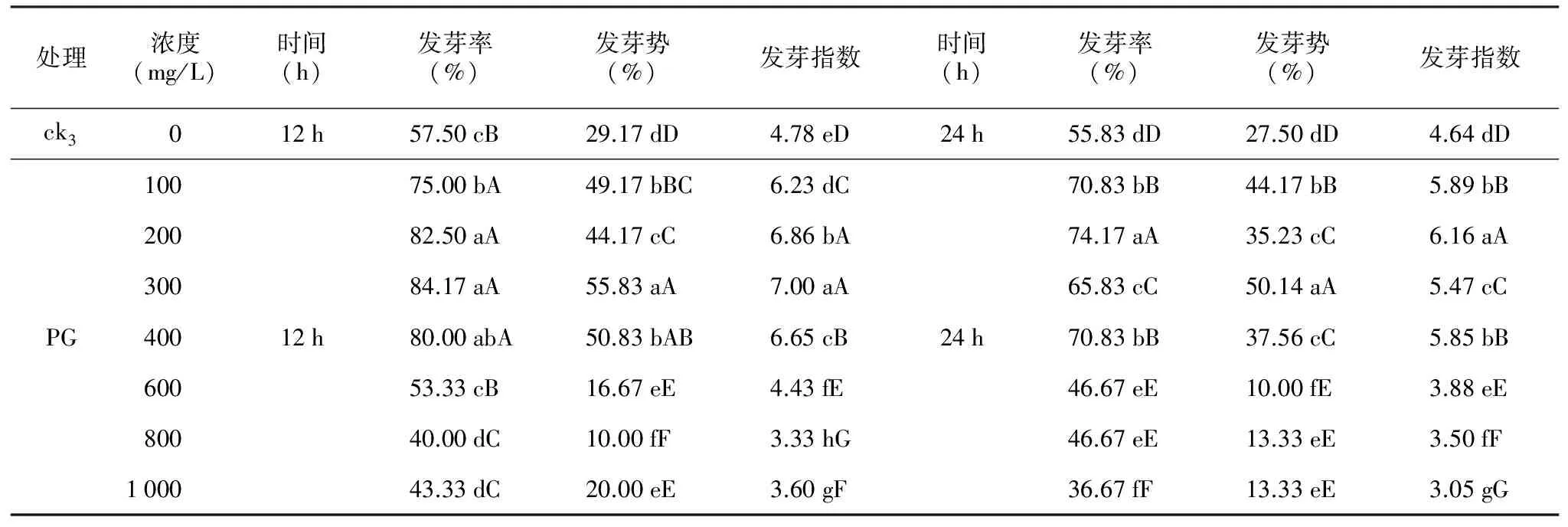
表5 PG处理对多籽蒜种子萌发的影响
处理浓度(mg/L)时间(h)发芽率(%)发芽势(%)发芽指数时间(h)发芽率(%)发芽势(%)发芽指数ck3012h57.50cB29.17dD4.78eD24h55.83dD27.50dD4.64dD10075.00bA49.17bBC6.23dC70.83bB44.17bB5.89bB20082.50aA44.17cC6.86bA74.17aA35.23cC6.16aA30084.17aA55.83aA7.00aA65.83cC50.14aA5.47cCPG40012h80.00abA50.83bAB6.65cB24h70.83bB37.56cC5.85bB60053.33cB16.67eE4.43fE46.67eE10.00fE3.88eE80040.00dC10.00fF3.33hG46.67eE13.33eE3.50fF100043.33dC20.00eE3.60gF36.67fF13.33eE3.05gG
2.4 SA处理对多籽蒜种子萌发的影响
方差分析结果表明,与ck3相比,经过机械磨擦处理后的多籽蒜种子的萌发率极显著(p<0.01)受到SA的影响,随着SA浓度的增大以及处理时间的延长,多籽蒜种子的发芽率呈现下降趋势(表4)。
0.05~0.3 mg/L SA处理12 h后的种子发芽率为80.83%~90.83%,发芽势为40.23%~54.17%,发芽指数为6.72~7.55,与ck3相比存在极显著差异(p<0.01),处理后的种子发芽率提高了23.33~33.33个百分点,发芽势提高了11.06~25个百分点,发芽指数提高了1.94~2.77,最佳浓度为0.1 mg/L。而随着SA浓度升高(0.5~0.9 mg/L),种子的发芽率为10.00%~46.67%,发芽势为0%~10%,发芽指数为1.94~4.17,极显著(p<0.01)低于0.05~0.3 mg/L SA浓度下的发芽指标,种子萌发指标呈现出下降趋势,相比ck3种子发芽率下降了10.83~47.50个百分点,发芽势下降了9.17~29.17个百分点,发芽指数下降了0.61~2.84,当SA浓度达到0.5 mg/L以上时,多籽蒜种子萌发受到严重抑制。
0.05~0.3 mg/L SA处理24 h后的种子发芽率为70.83%~84.17%,发芽势为40.83%~53.33%,发芽指数为5.89~7.00,与ck3相比存在极显著差异(p<0.01),处理后的种子发芽率提高了15.00~28.34个百分点,发芽势提高了13.33~25.83个百分点,发芽指数提高了1.25~2.36,最佳浓度为0.1 mg/L。而随着SA浓度升高(0.5~0.9 mg/L),种子的发芽率为10.00%~46.67%,发芽势为0%~6.67%,发芽指数为0.83~3.88,极显著(p<0.01)低于0.05~0.3 mg/L SA浓度下的发芽指标,种子萌发指标呈现出下降趋势,相比ck3种子发芽率下降了8.33~45.83个百分点,发芽势下降了24.50~27.45个百分点,发芽指数下降了0.73~3.39,当SA浓度达到0.5 mg/L以上时,多籽蒜种子萌发受到严重抑制。
2.5 PG处理对多籽蒜种子萌发的影响
方差分析结果表明,与ck3相比,经过机械磨擦处理后的多籽蒜种子的萌发率极显著(p<0.01)受到PG的影响,随着PG浓度的增大以及处理时间的延长,多籽蒜种子的发芽率呈现下降的趋势(表5)。
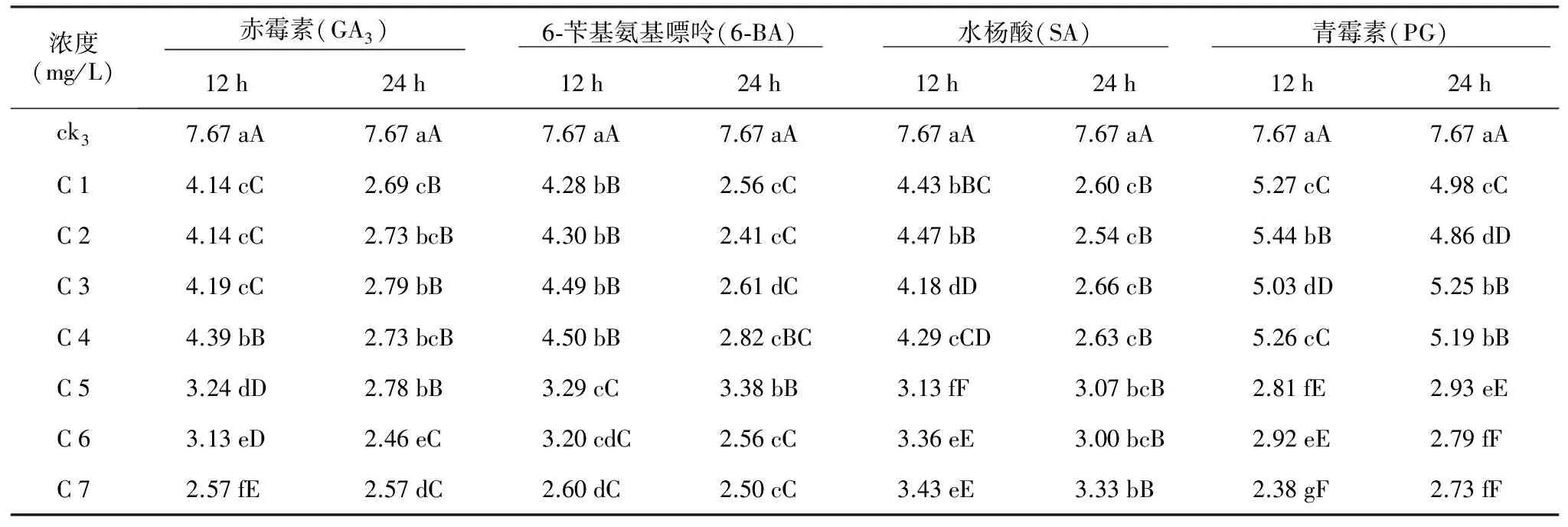
表6 化学物质对多籽蒜种子平均萌发时间的影响
浓度(mg/L) 赤霉素(GA3) 6⁃苄基氨基嘌呤(6⁃BA) 水杨酸(SA) 青霉素(PG) 12h24h12h24h12h24h12h24hck37.67aA7.67aA7.67aA7.67aA7.67aA7.67aA7.67aA7.67aAC14.14cC2.69cB4.28bB2.56cC4.43bBC2.60cB5.27cC4.98cCC24.14cC2.73bcB4.30bB2.41cC4.47bB2.54cB5.44bB4.86dDC34.19cC2.79bB4.49bB2.61dC4.18dD2.66cB5.03dD5.25bBC44.39bB2.73bcB4.50bB2.82cBC4.29cCD2.63cB5.26cC5.19bBC53.24dD2.78bB3.29cC3.38bB3.13fF3.07bcB2.81fE2.93eEC63.13eD2.46eC3.20cdC2.56cC3.36eE3.00bcB2.92eE2.79fFC72.57fE2.57dC2.60dC2.50cC3.43eE3.33bB2.38gF2.73fF
注:不同小写字母表示同列差异显著(p<0.05);不同大写字母表示同列差异极显著(p<0.01)。C 1~C 7分别代表不同溶液的不同处理浓度。
100~400 mg/L PG处理12 h后的种子发芽率为75.00%~82.50%,发芽势为44.17%~55.83%,发芽指数为6.23~7.00,与ck3相比存在极显著差异(p<0.01),处理后的种子发芽率提高了17.50~25.00个百分点,发芽势提高了15~26.66个百分点,发芽指数提高了1.45~2.22,最佳浓度为300 mg/L。而随着PG浓度升高(600~1 000 mg/L),种子的发芽率为40%~53.33%,发芽势为10%~20%,发芽指数为3.33~4.43,极显著(p<0.01)低于100~400 mg/L PG浓度下的发芽指标,种子萌发指标呈现出下降趋势,相比ck3发芽率下降了4.17~17.5个百分点,发芽势下降了9.17~19.17个百分点,发芽指数下降了0.35~1.45,当PG浓度达到600 mg/L以上时,多籽蒜种子萌发受到严重抑制。
100~400 mg/L PG处理24 h后的种子发芽率为65.83%~74.17%,种子发芽势为35.23%~50.14%,发芽指数为5.47~6.16,与ck3相比存在极显著差异(p<0.01),处理后的种子发芽率提高了10.00~18.34个百分点,发芽势提高了7.73~22.64个百分点,种子发芽指数提高了0.83~1.52,最佳浓度为200 mg/L。而随着PG浓度升高(600~1 000 mg/L),种子的发芽率为36.67%~46.67%,发芽势为10%~13.33%,发芽指数为3.05~3.88,极显著(p<0.01)低于100~400 mg/L PG浓度下的发芽指标,种子萌发指标呈现出下降趋势,相比ck3发芽率下降了9.16~19.16个百分点,发芽势下降了14.17~17.50个百分点,发芽指数下降了0.76~1.59,当PG浓度达到600 mg/L以上时,多籽蒜种子萌发受到严重抑制。
2.6 对种子平均萌发时间的影响
平均萌发时间这一指标可以用来衡量多籽蒜种子萌发的快慢(表6)。4种不同化学物质的处理显著缩短了其种子的平均萌发时间(p<0.05)。4种不同化学物质处理12 h,多籽蒜种子的平均萌发时间缩短了2.4~5.29 d;4种不同化学物质处理24 h,多籽蒜种子的平均萌发时间缩短了2.42~5.26 d;4种不同化学物质处理24 h多籽蒜种子萌发要快于处理12 h。
3 讨 论
种子的休眠主要分为种皮引起的休眠、胚休眠、抑制物质引起的休眠、不适宜外界条件引起的二次休眠中的一种或综合作用[20]。本研究表明,去除种皮能解除多籽蒜种子的休眠,因此种皮障碍是多籽蒜种子引起休眠的重要因素之一。关于种皮引起种子休眠的原因有种皮的透性差或不透气,对胚生长的机械束缚,阻止抑制物质渗漏或向胚供应抑制物,阻碍光线到达胚部[20],为了确定多籽蒜种子种皮调控种子休眠的机制,对种子进行了去皮处理和生长调节剂处理,研究表明:种子没有经过砂纸磨擦在解除了种皮障碍后,再经过一定浓度范围4种化学物质处理的种子萌发率极显著提高,综合种子机械处理后的发芽率结果和低浓度的植物生长调节剂有利于种子萌发的试验结果,认为多籽蒜种子的休眠是由种皮障碍和因胚尚未完成生理成熟引起的胚生理休眠共同引起的混合休眠。鱼小军等研究认为,草玉梅种子的休眠是由种皮障碍和胚生理休眠共同引起的,除去果皮能有效破除草玉梅种子的休眠[20]。
植物外源激素和生长调节物质对植物的生长发育和代谢调控有重要的作用,不仅对植物生长发育具有调控作用,还对一些植物种子萌发具有促进或抑制的作用[17]。不同外源激素对不同植物都有一定的最适处理浓度范围及处理时间,100~300μg/g的 GA3均能促进吉生和野生羊草种子的萌发,而600~700μg/g的GA3则不同程度地抑制其发芽[13];25μg/g 6-BA可以促进羊草种子萌发,而50μg/g抑制了种子萌发[21];低浓度SA可以促进黑果枸杞种子在盐旱胁迫下的萌发及幼根的生长[22];SA浸种可以提高蓖麻种子含水量,降低膜相对透性,加快种子萌发[23];100 mg/L PG溶液对洋葱种子发芽和幼苗生长有促进作用[12],本研究证实了多籽蒜种子的发芽也受这4种物质的调控。
4种化学物质处理种子不同时间,其发芽率、发芽势、发芽指数各不相同。仙客来种子不同GA3浓度下处理最佳时间为4 h和2 h[24]。6-BA处理紫花苜蓿种子时发现浸种2 h种子发芽率、发芽势均高于浸种5 h[25]。本研究发现,处理12 h的效果要好于处理24 h的效果,可能是因为长时间处理种子降低了种子渗透调节能力,影响了物质代谢和某些酶的活性。
经过50~200 mg/L GA3、5~20 mg/L 6-BA、0.05~0.3 mg/L SA以及100~400 mg/L PG处理12 h和24 h后,多籽蒜种子的发芽率、发芽势、发芽指数均极显著高于对照,各项指标呈现上升趋势;而经过400~800 mg/L GA3、30~70 mg/L 6-BA、0.5~0.9 mg/L SA、600~1 000 mg/L PG处理12 h和24 h后,多籽蒜种子的发芽率、发芽势、发芽指数均极显著低于对照,呈下降趋势,抑制了多籽蒜种子的萌发,表现出低浓度下促进种子萌发,高浓度下抑制种子萌发。多籽蒜种子最佳处理浓度分别为150 mg/L GA3、5 mg/L 6-BA、0.1 mg/L SA和300 mg/L PG,最佳处理时间为12 h,处理效果依次为6-BA>SA>GA3>PG。
[1]乌凤章,刘桂丰,姜静,等.种子萌发调控的分子机理研究进展[J].北方园艺,2008(2):54-58.
[2]杨荣超,张海军,王倩,等.植物激素对种子休眠和萌发调控机理的研究进展[J].草地学报,2012,20(1):1-9.
[3]程鹏,王平,孙吉康,等.植物种子休眠与萌发调控机制研究进展[J].中南林业科技大学学报,2013,33(5):52-58.
[4]Duan C R,Wang B C,Liu W Q,et al.Effect of chemical and physical factors to improve the germination rate of Echinacea An-gustifolia seeds[J].Colloids and Surfaces B:Biointerfaces,2004,37:101-105.
[5]康冰,陈彦生,张小红.GA3、6-BA及IAA对香椿种子发芽及幼苗生长的影响(简报)[J].植物生理学通讯,2001,37(5):399-400.
[6]毛爱军,王永健,冯兰香,等.水杨酸诱导辣椒抗疫病生化机制的研究[J].中国农学通报,2005,21(5):219-222.
[7]李玉红,程智慧,陈晓光.几种化学诱导物对黄瓜幼苗霜霉病抗性的诱导作用[J].中国农学通报,2005,21(8):343-344,392.
[8]吴建国,陆晓民,张晓婷,等.水分胁迫下水杨酸对毛豆幼苗生长及其抗渍性的影响[J].中国农学通报,2006,22(1):153-155.
[9]杨江山,种培芳,费赟.水杨酸对甜瓜种子萌发及其生理特性的影响[J].甘肃农业大学学报,2005,40(1):38-41.
[10]申承环.青霉素处理对陈豌豆种子发芽及幼苗生长的影响[J].长江蔬菜,2011(10):40-42.
[11]徐小玉,张凤银,张铃铃.青霉素对百日草种子萌发及幼苗生长的影响[J].北方园艺,2015(5):86-88.
[12]林辰壹,张丽辉,赵芸.青霉素对老化洋葱种子发芽及幼苗生长的影响[J].新疆农业大学学报,2007,30(1):44-47.
[13]杨天灵,宁雅楠,林辰壹,等.健蒜、多籽蒜和新疆蒜的核型特征[J].园艺学报,2014,41(7):1 391-1 399.
[14]刘彩红,李成云.GA3浸种对羊草种子发芽和幼苗生长的影响[J].草业科学,2011,28(5):797-801.
[15]杨东清,王振林,尹燕枰,等.外源ABA和6-BA对不同持绿型小麦旗叶衰老的影响及其生理机制[J].作物学报,2013,39(6):1 096-1 104.
[16]赵春旭,刘芳芳,赵韦,等.水杨酸浸种对高羊茅在干旱胁迫下萌发的影响[J].草业科学,2011,28(11):1 945-1 949.
[17]王非,王金侠,李强,等.GA3和IAA处理对4种铁线莲种子萌发的影响[J].草业科学,2013,31(4):672-676.
[18]田宏,刘洋,张鹤山,等.扁穗雀麦种子萌发条件的研究[J].草业科学,2009,26(8):112-117.
[19]张蕾,张春辉,吕俊平,等.光照强度对青藏高原东缘九种紫草科植物种子萌发的影响[J].兰州大学学报(自然科学版),2011,47(5):67-72.
[20]鱼小军,徐长林,王芳,等.草玉梅种子休眠原因及解除休眠方法[J].生态学杂志,2014,33(1):65-70.
[21]马红媛,梁正伟,黄立华,等.4种外源激素处理对羊草种子萌发和幼苗生长的影响[J].干旱地区农业研究,2008,26(2):69-73.
[22]李永洁,李进,吕海英.不同浓度水杨酸(SA)浸种对盐旱交叉胁迫下黑果枸杞种子萌发的影响[J].种子,2014,33(8):34-43.
[23]刘晶,王翠花,王云,等.水杨酸浸种对蓖麻种子萌发的影响[J].内蒙古民族大学学报,2002,18(1):53-55.
[24]夏含嫣,杜红梅,黄丹枫.GA3处理对仙客来种子萌发的影响[J].种子,2006,25(4):15-17.
[25]湛润生,岳新丽,刘根科,等.GA3和6-BA对紫花苜蓿种子萌发的影响[J].山西农业科学,2010,38(3):16-17,38.
Effects of Four Chemicals on Seed Germination ofAlliumfetisowiiRegel
WANGPeng,LINChenyi,CHENWei,LONGYan
(College of Forestry and Horticulture,Xinjiang Agricultural University,Urumuqi 830052,China)
To clear the type of seed dormancy and dormancy release method,with sandpaper rubbing treatment and not treated as control seeds,the four kinds of chemical substances treatment on seed germination was studied.The results show that sandpaper rubbing treatment on seed germination rate is significantly higher than the control;four kinds of chemical substances within a certain range of concentrations showed that a high concentration inhibited the seed germination and low concentration promoted the seed germination.The best treatment concentration was 150 mg/L GA3,5 mg/L 6-BA,0.1 mg/L SA and 300 mg/L PG separately.The effect of increasing the rate of seed germination was from large to low in order was 6-BA>SA>GA3>PG.Seed dormancy was caused by the seed coat obstacle and the physiological dormancy caused by the physiological dormancy.Dormancy can be improved by mechanical treatment and control of chemical substances in a certain concentration.
AlliumfetisowiiRegel; sandpapering; seed coat obstacle; germination rate; dormancy
2016-02-25
国家自然科学基金项目(编号:31160396)。
王 鹏(1991—),男,新疆伊宁市人;在读硕士研究生,主要从事新疆野生大蒜近缘种种质资源评价研究;E-mail:1500139126@qq.com。
林辰壹(1965—),女,新疆乌鲁木齐人;教授,博士,主要从事新疆野生葱属植物种质资源评价与利用研究;E-mail:linchenyi65@sina.com。
10.16590/j.cnki.1001-4705.2016.08.001
S 633.4
A
1001-4705(2016)08-0001-06

