凝血酶抑制剂nexin-1尾状核注射对大鼠脑出血后脑水肿的治疗作用
贾文志,赵金超,武海龙,李鹏,赵凤鸣,姚志刚,孙晓立
(1石家庄市第三医院,石家庄 050011;2石家庄市第五医院)
凝血酶抑制剂nexin-1尾状核注射对大鼠脑出血后脑水肿的治疗作用
贾文志1,赵金超2,武海龙1,李鹏1,赵凤鸣1,姚志刚1,孙晓立1
(1石家庄市第三医院,石家庄 050011;2石家庄市第五医院)
目的 观察凝血酶抑制剂nexin-1尾状核注射对大鼠脑出血后脑水肿的治疗作用。方法 将90只Wistar大鼠随机分为对照组、模型组和干预组各30只。模型组、干预组尾状核注射自体动脉血制备脑出血大鼠模型,对照组注射等量生理盐水;对照组、模型组术后于大脑尾状核部位注射10 μL生理盐水,干预组注射10 μL凝血酶抑制剂nexin-1。各组大鼠在给药后12、24、36 h分别进行脑组织形态学观察、脑组织凋亡神经细胞检测、脑组织含水量检查和脑组织血脑屏障通透性检测。结果 干预组脑神经细胞排列有轻微紊乱,形态结构异常程度较轻,细胞核有胞核固缩和胞质凝集的现象,但程度较模型组轻。与对照组相比,模型组各时间点凋亡神经细胞数多、脑组织含水量高、血脑屏障通透性高(P均<0.05)。与模型组相比,干预组各时间点凋亡神经细胞数少、脑组织含水量低、血脑屏障通透性低(P均<0.05)。结论 凝血酶抑制剂nexin-1尾状核注射对大鼠脑出血后脑水肿具有治疗作用。
凝血酶抑制剂;脑出血;脑水肿
脑出血后易发生多种并发症,其中脑水肿是脑出血最常见和最严重的并发症[1,2]。凝血酶作为一种丝氨酸蛋白酶,在脑出血后的炎症反应、脑细胞毒性损伤、脑水肿等并发症的发生发展中起重要作用[3~6]。凝血酶抑制剂nexin-1是一种内生的丝氨酸蛋白水解酶,能迅速抑制凝血酶的表达及活性。本研究观察了nexin-1尾状核注射对大鼠脑出血后脑水肿的治疗作用,为临床上治疗脑出血后脑水肿提供依据和方法。
1 材料与方法
1.1 动物 清洁级Wistar大鼠90只,雄性,体质量200~250 g,由哈尔滨医科大学实验动物中心提供,合格证号为SCXK(黑):2013-002。
1.2 主要试剂及仪器 凝血酶抑制剂nexin-1(Gibco公司),水合氯醛(山东齐鲁制药厂),伊文思蓝(Bioworlde公司)。立体定位仪(Amersham Biosciences公司),分析天平(上海精密科学仪器有限公司),分光光度计(上海美谱达仪器有限公司)。
1.3 大鼠脑出血模型制备及nexin-1用法 将90只Wistar大鼠按随机数字表法分为对照组、模型组和干预组各30只。模型组、干预组采用自体动脉血注射的方法制备脑出血大鼠模型:大鼠适应性喂养1周,3.5%水合氯醛腹腔注射麻醉,后置于立体定位仪,在大鼠头皮正中行切口,左侧颅骨钻孔(中线旁开3 mm,前囟前0.2 mm),将动脉血(50 μL尾动脉自体血,不加抗凝剂)迅速注入颅骨下5.5 mm的左侧尾状核,然后换另一侧,尽量减少反流,用骨蜡封闭颅骨钻孔,缝合头皮。对照组尾状核部位注射等量生理盐水,其余手术步骤与上述一致。对照组、模型组术后于大脑尾状核部位注射10 μL生理盐水,干预组注射10 μL凝血酶抑制剂nexin-1。
1.3 观察方法
1.3.1 脑组织形态学观察 将各组大鼠在给药后12、24、36 h腹腔注射3.5%的水合氯醛,麻醉后迅速断头取出脑组织,以进针孔(尾状核的所在位置)为界,冠状切开脑组织,取其前半部脑出血周围厚度为3 mm的脑组织标本,用10%甲醛固定、脱水、包埋,用石蜡切片机对包埋后的脑组织标本进行切片,切片厚度为5 μm,对切片进行脱蜡和HE染色,在光学显微镜下对各组大鼠的脑组织形态进行观察。
1.3.2 大鼠脑组织凋亡神经细胞检测 取各组大鼠脑组织石蜡切片,使用TUNEL染色法检测大鼠脑组织中的凋亡神经细胞。用倒置显微镜观察,在400倍镜视野下随机选取5个视野观察并记录阳性细胞数。以脑组织神经细胞质或细胞核中出现棕黄色颗粒作为脑组织神经细胞凋亡的阳性判断标准。
1.3.3 大鼠脑组织含水量检测 采用干湿重法对各组大鼠脑组织含水量进行检测。各组大鼠在腹腔麻醉处死后迅速取出大脑,并快速称取大脑湿重,然后将大脑放在95 ℃的烘箱中烘烤24 h,快速称取大脑干重。大鼠脑组织含水量=(大脑湿重-大脑干重)/大脑湿重×100%。
1.3.4 大鼠血脑屏障通透性检测 各组大鼠在各处理时间点处死前1 h尾静脉注射2%伊文思蓝(0.3 mL/100 g),当大鼠的眼球结膜和四肢出现蓝色时表明伊文思蓝注射成功,停止注射。取大鼠大脑双侧的纹状体和皮层(在取之前将大鼠左心室灌注生理盐水,直至大鼠的右耳有清亮色的液体流出),用分析天平进行精密称重。将称重后的纹状体和皮层放在容量为5 mL的二甲基甲酰胺溶液试管中,37 ℃水浴48 h,3 000 r/min离心15 min,收集上清液。采用分光光度法检测上清液中伊文思蓝在632 nm波长处的最大吸光度,根据伊文思蓝的标准曲线计算纹状体、皮层中伊文思蓝的含量。

2 结果
2.1 各组大鼠脑组织病理形态 对照组大鼠大脑皮层中的脑组织结构正常,神经细胞形态正常并且排列顺序整齐,脑皮层中的细胞着色均匀,细胞核为蓝色,细胞质为淡红色。模型组大鼠大脑皮层中的脑组织结构出现异常变化,神经细胞之间的间隙增大并且排列顺序紊乱,神经细胞出现显著性变异,有部分神经细胞出现凋亡现象(细胞核核质浓缩,并且细胞核固缩、溶解,细胞质凝集,细胞体积减小),在12 h时最为严重,随后异常程度减轻。干预组脑神经细胞排列轻微紊乱,形态结构异常程度较轻,细胞核仍然有胞核固缩和胞质凝集的现象,但程度较模型组轻;随着干预时间的延长,脑组织病理异常恢复的程度逐渐增加。
2.2 各组大鼠脑组织凋亡神经细胞数比较 结果见表1。
表1 给药后不同时间各组大鼠脑组织凋亡神经细胞数比较(个,±s)
注:与对照组相比,*P<0.05;与模型组相比,#P<0.05。
2.3 各组大鼠脑组织含水量比较 结果见表2。
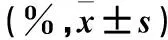
表2 给药后不同时间各组大鼠脑组织含水量比较
注:与对照组相比,*P<0.05;与模型组相比,#P<0.05。
2.4 各组大鼠脑组织血脑屏障通透性比较 各组大鼠脑组织皮层、纹状体伊文思蓝含量比较见表3。

表3 给药后不同时间各组大鼠脑组织皮层、纹状体伊文思蓝含量比较±s)
注:与对照组相比,*P<0.05;与模型组相比,#P<0.05。
3 讨论
脑出血是临床中的常见疾病,常采用甘露醇脱水治疗[7]。脑出血在临床中有较高的病死率和致残率,在发病30 d内的病死率高达50%,未死亡的脑出血患者在6个月内仅有20%左右的患者能有功能意义上的恢复[8]。致使脑出血患者死亡和残疾的主要危险因素是脑出血后早期对脑神经细胞的毒性以及晚期脑水肿,其中脑水肿是最重要的危险因素[9]。凝血酶在正常人大脑中的量极少,但脑出血后产生的血肿块可以诱发产生大量的凝血酶[10]。少剂量的凝血酶在机体发生出血时有非常重要的保护作用[11,12],可以保护脑神经细胞和脑星形细胞,避免其因为微环境的缺血、缺氧、低血糖而死亡;可以促进脑胶质细胞合成和分泌神经生长因子,进而促进脑神经细胞轴突生长;可以降低出血范围的增加,减轻脑水肿。但同时还有研究发现,大剂量的凝血酶在脑出血后脑损伤中起着非常重要的作用,特别是与脑出血后脑水肿的发生关系密切。大剂量的凝血酶会促进脑出血后脑神经细胞损伤、脑血肿、炎症、脑神经细胞凋亡等[13]。动物实验[14]表明,脑出血后并发的脑水肿主要是由于大量的凝血酶产生的毒性作用所引起的。可见,凝血酶为脑出血后并发脑水肿的启动点,通过调节脑出血后凝血酶的水平及活性成为治疗脑出血的一个新方法。
凝血酶抑制剂nexin-1是一种内生的凝血酶抑制剂,是44 kD的丝氨酸蛋白水解酶,属于连接蛋白家族和丝氨酸超家族[15]。nexin-1能迅速抑制凝血酶,通过丝氨酸蛋白酶催化剂与凝血酶形成稳定的SDS复合物[16]。nexin-1和凝血酶在神经系统创伤早期或损伤血脑屏障的其他情况下可以调节星型胶质细胞和神经细胞的生存能力。nexin-1主要分布在脑血管内和脑血管周围,当脑内血脑屏障的通透性增加时,nexin-1可以对抗凝血原,降低凝血酶的活性,进而降低凝血酶对脑神经细胞的毒性及脑水肿[17,18]。本研究中脑出血大鼠相较于正常大鼠,脑神经细胞排列紊乱、间隙增加,并有部分脑神经细胞出现凋亡,而用nexin-1干预大鼠脑组织异常病理变化程度降低,且干预组脑组织凋亡神经细胞数较模型组少,可见nexin-1对脑出血后大鼠大脑组织具有保护作用。同时,nexin-1可以降低脑出血后脑组织的含水量和血脑屏障的通透性,说明nexin-1可以通过改善脑出血后血脑屏障损伤,降低血脑屏障的通透性,降低脑水肿,保护脑组织。
综上可见,凝血酶抑制剂nexin-1尾状核注射对大鼠脑出血后脑水肿具有治疗作用。
[1] 聂志红,王德发,马卫琴,等.醒脑静对自发性脑出血患者血清基质金属蛋白酶-9及神经功能的影响[J].中国医药导报,2014,11(5):75-77.
[2] 周庆博,贾青,张媛,等.黄芩苷对脑出血大鼠脑组织凝血酶受体-1表达及细胞凋亡的影响[J].中国中西医结合杂志,2010,30(12):1302-1305.
[3] Wagner KR, Xi G, Hua Y, et al. Ultra-early clot aspiration after lysis with tissueplasminogen activator in a porcine model of intracerebral hemorrhage :edema reduction and blood brain barrier protection[J]. J Neurosurg, 1999,90(3):491-498.
[4] Rohatgi T, Henrich-Noack P, Sedehizade F, et al. Transient focal ischemia in rat brain differentially regulates mRNA expression of protease-activated receptors 1 to 4[J]. J Neurosci Res, 2004,75(2):273-279.
[5] Martini SR, Flaherty ML, Brown WM, et al. Risk factors for intracerebral hemorrhage differ according to hemorrhage location[J]. Neurology, 2012,79(23):2275-2282.
[6] Wu B, Ma Q, Khatibi N, et al. Ac-YVAD-CMK decreases blood-brain barrier degradation by inhibiting caspase-1 activation of interleukin-1β in intracerebral hemorrhage mouse model[J]. Transl Stroke Res, 2010,1(1):57-64.
[7] 李萍,赵建军,赵树明.活血化瘀法治疗脑出血的实验研究进展[J].中华老年心脑血管病杂志,2012,14(10):1117-1118.
[8] Dowlatshahi D, Demchuk AM, Flaherty ML, et al. Defining hematoma expansion in intracerebral hemorrhage: relationship with patient outcomes[J]. Neurology, 2011,76(14):1238-1244.
[9] Xue M, Del-Bigio MR. Comparison of brain cell death andinflammatory reaction in three models of intracerebral hemorrhage inadult rats[J]. J Stroke Cerebrovasc Dis, 2003,12(3):152-159.
[10] Vajda Z, Pedersen M, Fuchtbauer EM, et al. Delayed onsetof brain edema and mislocalization ofaquaporin-4 indystrophin-null transgenic mice[J]. Proc Natl Acad Sci USA, 2002,99(20):13131-13136.
[11] Kasuya H, Shimizu T, Takakura K. Thrombin activity in CSF afterSAH is correlated with the degree of SAH, the persistence ofsubarachnoid clot and the development of vasospasm[J]. Acta Neurochir(Wien), 1998,140(6):579-584.
[12] Sinnreich M, Meins M, Niclou SP, et al. Prothrombin overexpressed in post-natal neurons requires blood factors foractivation in the mouse brain[J]. J Neurochem, 2004,88(6):1380-1388.
[13] Striggow F, Riek M, Breder J, et al. The protease thrombin is an endogenous mediator of hippocampalneuroprotection against ischemia at low concentrations but causesdegeneration at high concentrations[J]. Proc Natl Acad Sci USA, 2000,97(5):2264-2269.
[14] Riek-Burchardt M, Striggow F, Henrich-Noack P, et al. Increase of prothrombin-mRNA after global cerebral ischemia inrats, with constant expression of protease nexin-1 and proteaseactivated receptors[J]. J Neurosci Lett, 2002,329(2):181-184.
[15] Wu H, Zhao R, Qi J, et al. The expression and the role of protease nexin-1 on brain edema after intracerebral hemorrhage[J]. J Neurol Sci, 2008,270(1-2):172-183.
[16] Reinhard E, Suidan HS, Pavlik A, et al. Glia-derived nexin/protease nexin-1 is expressed by a subset of neurons in the rat brain[J]. J Neurosci Res, 1994,37(2):256-270.
[17] Richard B, Arocas V, Guillin MC, et al. Protease nexin-1: a cellular serpin down-regulated bythrombin in rat aortic smooth muscle cells[J]. J Cell Physiol, 2004,201(1):138-145.
[18] Hoffman MC, Nitsch C, Scotti AL, et al. Theprolonged presence of glia-derived nexin an endogenous proteaseinhibitor in the hippocampus after ischemia-induced delayed neuronaldeath[J]. Neuroscience, 1992,49(2):397-408.
孙晓立(E-mail: 15030182566@163.com)
10.3969/j.issn.1002-266X.2016.35.015
R743.34
A
1002-266X(2016)35-0048-03
2015-09-25)

