大米鲊海椒抗氧化活性及其对肝脏脂质过氧化的影响
韦 诚 周才琼 葛平珍,2 朱丽娟 谢月英
(1. 西南大学食品科学学院,重庆 400715; 2. 毕节市农业科学研究所,贵州,毕节 551700 )
大米鲊海椒抗氧化活性及其对肝脏脂质过氧化的影响
韦 诚1周才琼1葛平珍1,2朱丽娟1谢月英1
(1. 西南大学食品科学学院,重庆 400715; 2. 毕节市农业科学研究所,贵州,毕节 551700 )
以总还原力最高发酵时间15 d和ORAC最高发酵时间60 d 大米鲊海椒为样品,研究大米鲊海椒DPPH•清除率、BSA氧化抑制率、红细胞溶血和对肝脏脂质过氧化的影响。结果显示,发酵15 d样品DPPH•清除率优于发酵60 d样品;发酵15 d样品对蛋白质氧化损伤有较好的保护作用,但发酵60 d有潜在促BSA氧化的作用;发酵15 d和60 d样品均有抑制肝脏脂质过氧化和较好的抗细胞溶血作用,且发酵15 d样品优于发酵60 d样品;相关分析显示样品总酚含量与抑制肝脏脂质过氧化显著正相关(P<0.01),与抑制BSA氧化和细胞溶血负相关。表明单独用化学抗氧化方法评价食物抗氧化能力不太全面,在化学抗氧化研究基础上,结合对红细胞溶血以及对蛋白质和肝脏脂质过氧化的影响能更客观判断食物的抗氧化能力。
辣椒;鲊海椒;BSA氧化抑制率;红细胞溶血;肝脏脂质过氧化
鲊海椒是以鲜红辣椒经粉碎后与玉米粉、大米粉和芋头等淀粉原料以一定比例混合并添加适量盐后,经乳酸菌自然发酵而成的一种流行于西南地区的地方特色发酵辣椒制品。考虑辣椒含多酚类、胡萝卜素类和辣椒素等具有抗氧化作用的功能成分[1-2]、发酵过程的复杂性以及发酵促进有机酸增加和结合型多酚释放等带来的抗氧化活性改变,因此,研究其发酵过程中抗氧化活性的变化,对于西南地区特色发酵辣椒制品的功能化开发及工业化生产具有重要的意义。
在对辣椒与谷物等进行抗氧化评价方面,目前报道[3-6]的主要方法有DPPH•清除法、总氧自由基清除法、总还原力和氧自由基吸收能力(oxygen radical absorbance capacity,ORAC)等,其中抗氧化组分的总还原力和ORAC与其抗氧化性有显著相关性,均可作为衡量待测物总抗氧化能力的重要指标[7-8]。而对鲊海椒早期研究[9]显示,发酵(0~90 d)过程中总还原力和ORAC均呈先增后保持稳定的趋势,总还原力峰值在发酵15 d,ORAC峰值在发酵60 d;经与发酵过程中抗氧化成分VC、VE、总酸、总多酚和总黄酮变化进行相关分析,结果显示仅总多酚含量与总还原力、ORAC显著相关(P<0.05)。然而,有研究报道这些化学分析法未考虑抗氧化物质生物利用率及细胞对其的吸收代谢情况而存在一定缺陷[10],而采用细胞抗氧化评价体系可作为研究食物抗氧化能力的补充手段[11-13]。因此,基于现有研究结果,拟采用发酵15 d(总还原力最高)和60 d(ORAC最高)的鲊海椒作为试验样品,参考Liu等[14-16]和Blasa等[17]通过模拟机体细胞生存环境建立的细胞内测定物质抗氧化活性方法(CAA),进一步研究其细胞抗氧化及对大分子的保护作用,并与多酚进行相关分析,验证化学抗氧化作用研究结果与细胞抗氧化活性及对大分子的保护之间的关联度,旨在进一步评价自然乳酸发酵食品大米鲊海椒的抗氧化能力,同时为传统发酵功能性食品的开发提供理论依据。
1 材料与方法
1.1 试验材料
二荆条新鲜红椒:重庆市北碚区天生农贸市场;
加碘食盐、大米:重庆市北碚区永辉超市;
SD大鼠:清洁级,体重180~200 g,实验动物许可证号SCXK(渝)2007-0008,重庆藤鑫比尔实验动物销售有限公司。
1.2 主要试剂与仪器
盐酸胍、2,4-二硝基苯肼、无水乙醇、乙酸乙酯:分析纯,成都市科龙化工有限公司;
BSA(牛血清蛋白):生化试剂,上海伯奥生物科技有限公司;
真空干燥箱:DZF-6020型,上海齐欣科学仪器有限公司;
旋转蒸发器:RE-52A型,上海亚荣生化仪器厂;
紫外可见分光光度计:UV-2450型,日本岛津公司;
多功能酶标仪:Synergy H1型,美国基因公司;
微波炉:EG823LA6-NR型,美的微波电器制造有限公司。
1.3 试验方法
1.3.1 鲊海椒的制作方法 辣椒洗后沥干,粉碎;大米炒至微黄后粉碎机粉碎,过40目筛。大米鲊海椒配比:辣椒∶粳米面1∶1,盐添加量5%。将各种原料按配比混匀后装坛,倒置,水密封,20~30 ℃发酵。
1.3.2 试验样液制备及总酚含量分析
(1) 样液制备:微波辅助水提取。料液比1∶8(g/mL),50 ℃水浴浸提2 h。微波辅助提取条件:微波功率300 W,微波时间4 min。冷却后过滤,滤液3 000 r/min离心30 min得上清液,冷冻干燥[18]。发酵15 d和60 d样品得率分别为(21.18±0.72),(18.61±0.62) g/100 g·干基。
(2) 总酚:Folin-Ciocalteu法[19]。以每100 g样品中所含没食子酸当量表示(mg GAE/100 g· FW)。
1.3.3 相对DPPH•清除能力(RDSC) 将Trolox配成0.5 mmol/L 储备液并进行系列稀释得0.00,6.25,12.50,25.00,37.50,50.00 μmol/L 6个浓度工作液,以此绘制标准曲线。将样品水提物配成10 mg/mL储备液,稀释得到合适浓度稀释液。分别移取100 μL溶剂、不同浓度Trolox标准液及合适浓度样品水提物溶液加到96孔板中,然后快速加入100 μL 0.208 mmol/L DPPH•溶液,放入多功能酶标仪,振摇,515 nm下测定40 min内的吸光值,每个样品重复测定3次。DPPH•清除能力按式(1)、(2)计算[20]:

(1)
式中:
P——DPPH•清除率,%;
Asample——样品提取物于515 nm条件下的吸光度值;
Acontrol——Trolox标准液于515 nm条件下的吸光度值;
Ablank——溶剂于515 nm条件下的吸光度值。
根据反应时间及式(1)得到不同反应时间DPPH•清除率,绘制t—DPPH•清除率图,根据式(2)计算清除率曲线的面积(AUC),计算公式:
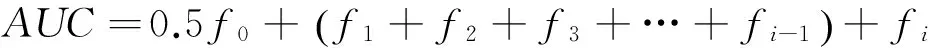
(2)
式中:
f0——t=0 min时DPPH·清除率,%;
fi——t=40 min时DPPH•清除率,%。
样品在40 min内相对DPPH•清除能力(RDSC)计算公式:

(3)
式中:
RDSC——以每克样品水提物中抗氧化成分对DPPH•清除能力相当于Trolox的微摩尔表示,μmol TE/g 样品水提物;
AUCsample——样品水提物清除率曲线面积;
AUCtrolox——Trolox标准液清除率曲线面积;
M——trolox分子量,250.3 g/mol;
m——提取物质量,g。
1.3.4 对蛋白质氧化损伤的保护作用 参照文献[21],修改如下:BSA用100 mmol/L KH2PO4—KOH缓冲溶液(pH 7.4)配成1.25 mg/mL溶液。反应体系包括2.4 mL 1.25 mg/mL BSA溶液,0.3 mL 2.0 mg/mL 水提物溶液,0.3 mL 100 mmol/L AAPH 溶液。将以上混合液37 ℃温育90 min。取20 mmol/L DNPH(溶于2.0 mol/L HCl溶液)0.5 mL加入到放有1 mL反应混合液的离心管中,室温下黑暗放置1 h(每隔10 min振摇1次),再向其中加入0.5 mL 20 g/100 mL TCA溶液终止反应,将离心管于冰中放置10 min后,3 000 r/min离心10 min,弃上清液,沉淀用3.0 mL乙醇—乙酸乙酯(体积比1∶1)混合液洗3次,去掉残余DNPH,蛋白质沉淀用1 mL 6 mol/L 盐酸胍(pH 2.3)重新溶解,37 ℃孵育10 min,370 nm测吸光值,按式(4)计算羰基含量,用缓冲液代替AAPH作为蛋白质自氧化对照(control),用溶剂取代水提物溶液作对照(control+AAPH),缓冲溶液取代BSA液作空白(blank),按式(5)计算蛋白质氧化抑制率。
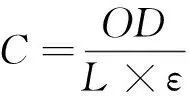
(4)

(5)
式中:
C——羰基含量,nmol/mg;
OD——吸光度值;
L——比色皿厚度,cm;
ε——吸光系数,22 000 L/(mol·cm)。
R——抑制率,%;
Asample——样品于370 nm的吸光度值;
Acontrol+AAPH——对照于370 nm的吸光度值;
Ablank——空白于370 nm的吸光度值。
1.3.5 对肝脏匀浆脂质过氧化的抑制作用 SD大鼠禁食过夜,次日处死。迅速取出肝脏,用4 ℃预冷生理盐水反复漂洗去除血液,剔除脂肪及结缔组织,滤纸吸干水分,称重。冰浴条件下将肝脏置匀浆机中,用生理盐水制成质量分数为10%的组织匀浆,4 ℃条件下3 000 r/min离心10 min,取上清液待用。在试管中加入0.1 mL肝脏匀浆及1 mL不同浓度水提物溶液,37 ℃温育2 h。向其中加入1 mL TCA溶液(20 g/100 mL)终止反应,混匀,5 000 r/min离心10 min。取上清液1 mL,向其中加入1 mL TBA(0.67 g/100 mL),混匀,沸水浴15 min,冰水中冷至室温,532 nm下测定吸光值,根据式(6)计算丙二醛抑制率[22]。

(6)
式中:
R——抑制率,%;
Asample——样品于532 nm的吸光度值;
Ablank——空白于532 nm的吸光度值。
1.3.6 对细胞氧化损伤的保护作用 取SD大鼠血液,在4 ℃,2 500 r/min下离心25 min,使红细胞从血浆中分离,红细胞用预冷的PBS缓冲液(pH 7.4)清洗2次,2 500 r/min下离心10 min,除去血浆、血小板及血沉棕黄层。用PBS缓冲液(pH 7.4)按1∶100比例对红细胞进行稀释,制成细胞悬液备用。用血球计数板计数,得到细胞悬液中红细胞个数为1.52×1011个/L。向96孔板中加入50 μL细胞悬液(1%)及100 μL不同浓度水提物溶液或100 μL缓冲液。加入100 μL H2O及50 μL细胞悬液作为完全溶血对照。37 ℃振荡培养10 min,向平板中加入50 μL AAPH(160 mmol/L,用PBS缓冲液溶解,现配现用),3 h内每10 min测定660 nm时光密度值(OD)。根据式(7)、(8)计算红细胞完整率和溶血延迟时间[23]。
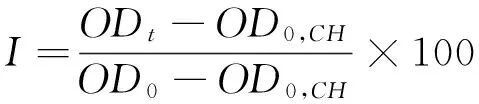
(7)
ΔT=HT50(sample)-HT50(blank),
(8)
式中:
I——红细胞完整率,%;
ODt——样品于tmin的光密度值;
OD0——样品于0 min的光密度值;
OD0,CH——完全溶血0 min时的光密度值;
ΔT——溶血延迟时间,min;
HT50(samole)——从样品溶血曲线中得到50%溶血所需时间,min;
HT50(blank)——从对照溶血曲线中得到50%溶血所需时间,min。
1.3.7 数据分析 每个样品重复测定3次,结果以 mean±SD 表示,采用origin 8.6作图及SPSS 20.0分析。
2 结果与分析
2.1 大米鲊海椒相对DPPH•清除能力(RDSC)
DPPH是较稳定的有机自由基,通过加入抗氧化物质,将其由紫色还原成黄色,用吸光度的变化来衡量样品抗氧化能力的强弱,而EC50为反应体系中DPPH•清除率为50%时所对应的水提物浓度,与反应体系中稳定状态和反应达到平衡时DPPH•浓度有关[24]。图1为大米鲊海椒发酵15,60 d鲊海椒样品的相对DPPH•清除能力(RDSC)及其相应的EC50。由图1可知,发酵15 d样品的RDSC高于发酵60 d样品,但无显著差异(P>0.05),且其EC50略低,说明发酵15 d样品化学抗氧化活性更好。
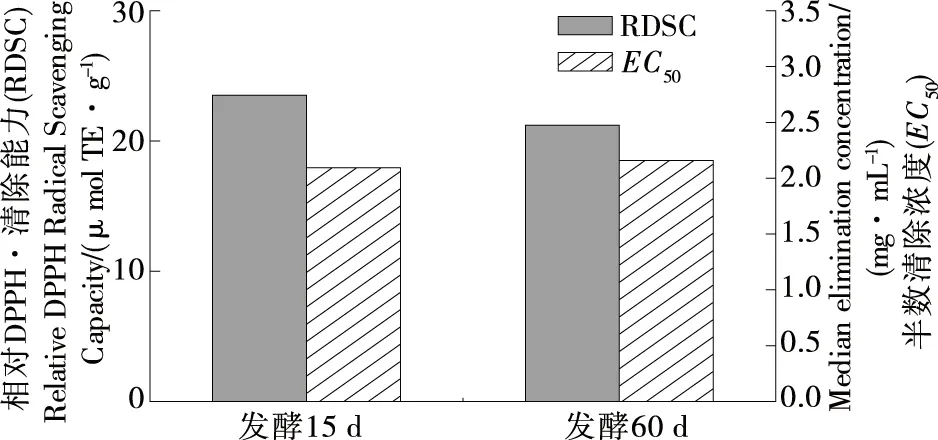
图1 鲊海椒样品的RDSC和EC50
样品各浓度提取液对DPPH•清除率见图2。发酵15 d和60 d样品在处理浓度范围内清除率均与浓度呈正相关,分别为26.48%~55.05%和13.71%~56.95%,表明水提物有一定的DPPH•清除能力,即抗氧化活性。其中低浓度时发酵15 d样品清除率高于发酵60 d样品,但随处理浓度升高,二者清除率逐渐趋近。
2.2 大米鲊海椒对蛋白质氧化损伤的保护作用
羰基值高说明蛋白质氧化损伤程度高。当加入AAPH后,羰基含量增加,发酵15,60 d样品羰基含量分别为control组的2.0,3.2倍,为control+AAPH组的70.9%和114.4%(图3),表明发酵15 d样品水提物有更好的抑制羰基形成的作用,对蛋白质氧化损伤具有一定保护作用,与体外化学抗氧化活性研究结果吻合。
鲊海椒对蛋白质氧化损伤的抑制率见图4,发酵15 d样品有较好的保护作用,但发酵60 d样品有潜在促BSA氧化的作用,可能是随着发酵时间延长,样品进一步降解产生了能攻击BSA的自由基。
2.3 大米鲊海椒对肝脏脂质过氧化的抑制作用
脂质能被自由基、非自由基氧化剂、酶等氧化,生成丙二醛等氧化产物[25]。由图5可知,在试验浓度范围内,发酵15 d和60 d样品水提物均对脂质过氧化有抑制作用,且抑制效果与浓度呈依赖性,相对应的抑制率分别为10.55%~87.16%和10.99%~82.98%,但抑制作用无差异性(P>0.05)。对肝脏脂质过氧化抑制作用的IC50见图6。由图6可知,发酵15 d样品的IC50略低于发酵60 d样品(P>0.05)。

图2 40 min时鲊海椒样品对DPPH•的清除率

图3 大米鲊海椒样品对羰基形成的抑制作用

图4 大米鲊海椒样品对蛋白质氧化的抑制率
2.4 大米鲊海椒对红细胞溶血的影响
红细胞易受自由基攻击从而导致细胞膜的完整性被破坏,因此其可用作研究细胞膜氧化损伤的细胞模型[26]。由图7可知,水提物浓度越大,红细胞在3 h内的完整率越高,说明水提物在一定程度上能明显抑制溶血反应的发生,有效保护红细胞的结构完整性。当水提物浓度≥1 mg/mL时,发酵60 d样品水提物保持细胞完整的时间较长,抗细胞溶血作用较好;水提物浓度为0.5 mg/mL时,红细胞溶血延迟时间△T(其越长,水提物对细胞溶血的抑制作用越强)如图8所示,发酵15 d样品△T远高于发酵60 d样品。从水提物对细胞完整性的影响及各水提物浓度为0.5 mg/mL时的△T,可知样品对细胞溶血的抑制作用受发酵时间及水提物浓度的影响,发酵15 d优于发酵60 d样品,推测可能是发酵60 d后样品中抗氧化生物活性成分发生了显著变化。
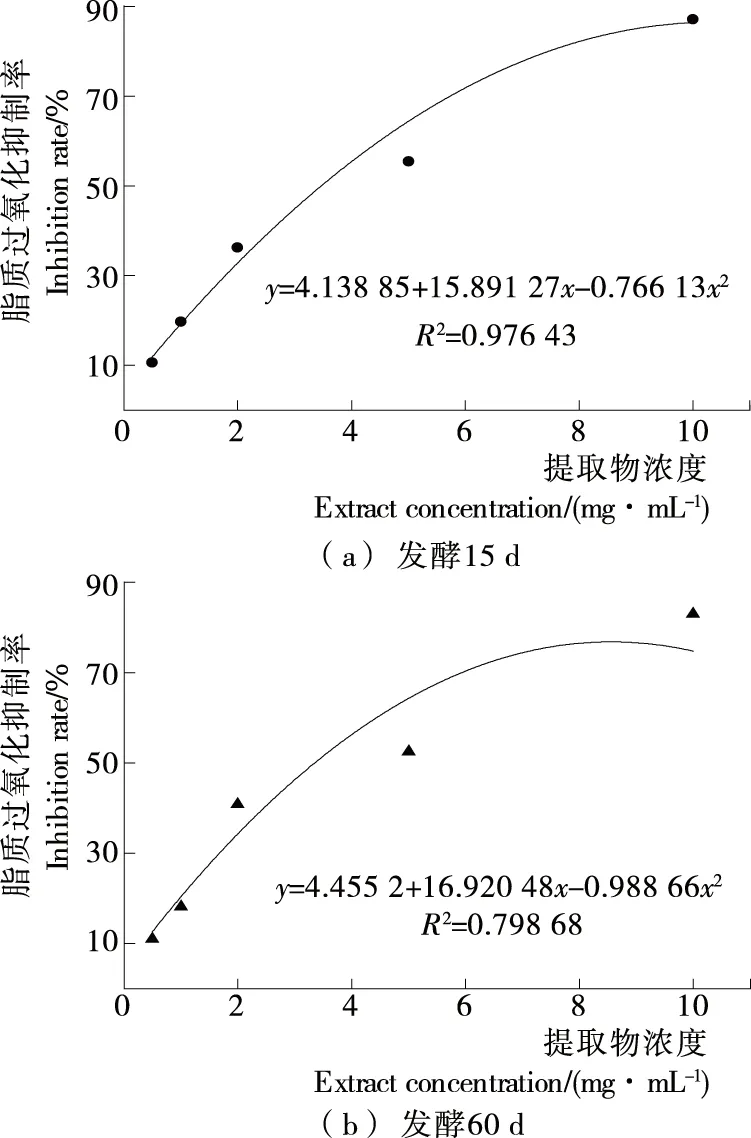
图5 大米鲊海椒样品对肝脏脂质过氧化的抑制率
Figure 5 The inhibition rate with the liver lipid peroxidation of the fermented Rice-Chili

图6 大米鲊海椒样品水提物对脂质过氧化抑制作用的IC50Figure 6 The IC50 of inhibition effect of lipid peroxidation on the fermented Rice-Chili sample extracts
2.5 样品提取物多酚含量与其抗氧化作用相关分析
有大量多酚及黄酮类等植物化学素有较强清除各种自由基的报道[15,27]。早前的研究[9]也显示鲊海椒发酵过程中多酚含量与总还原力和ORAC变化显著相关(P<0.05)。经分析发酵15 d和60 d样品多酚含量分别为(10.56±0.89),(12.79±0.77) mg GAE/g 提取物,发酵60 d样品多酚略高。经其与DPPH·清除率、红细胞溶血、蛋白质和脂质过氧化的抑制进行相关分析,结果显示(表1),多酚与RDSC正相关(P>0.05),与抑制肝脏脂质过氧化显著正相关(P<0.01),而与抑制BSA氧化和抑制细胞溶血负相关(P>0.05),可能是细胞中存在的某些金属离子与多酚化合物反应,促进了蛋白氧化作用,且当酚类物质达到一定浓度后也会提高促氧化的可能性[28-29]。表明抗氧化活性研究的复杂性,不能仅以多酚含量变化判断样品抗氧化活性和对大分子如蛋白质氧化的保护等。
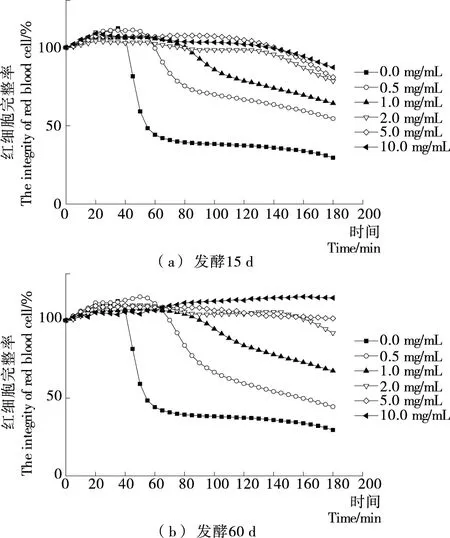
图7 大米鲊海椒样品水提物的红细胞溶血曲线
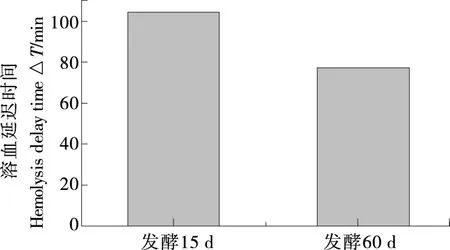
图8 水提物浓度为0.5 mg/mL时的溶血延迟时间

抗氧化指标RDSC抑制肝脏脂质过氧化抑制BSA氧化抑制细胞溶血r0.4310.922**-0.798-0.744
† **表示在P<0.01水平上极显著。
3 结论
本研究以发酵过程中总还原力最高发酵时间15 d和ORAC最高发酵时间60 d大米鲊海椒为样品,进一步采用不受酶的抑制或其他自由基影响的DPPH•进行化学抗氧化活性试验[30],同时通过对蛋白质氧化损伤的保护作用、对肝脏匀浆脂质过氧化的抑制及对红细胞氧化损伤的保护作用等的研究进一步评价样品对细胞氧化损伤的保护作用。研究结果显示,发酵15 d样品的DPPH•清除能力略高于发酵60 d样品,但无显著差异(P>0.05);发酵15 d样品对蛋白质氧化损伤有较好的保护作用,而发酵60 d样品则有潜在促BSA氧化的作用,但其促氧化机制有待于进一步研究;各水提物在一定浓度范围内,与肝脏匀浆脂质过氧化及红细胞溶血的抑制效果呈正相关,但发酵15 d样品红细胞溶血延迟时间(△T)更长;相关分析显示,样品提取物多酚含量与抑制肝脏脂质过氧化显著正相关(P<0.01),与抑制BSA氧化和细胞溶血负相关。
结果表明,发酵15 d样品具有较好的细胞抗氧化活性及抑制蛋白质氧化和肝脏脂质过氧化的作用。尽管总还原力和ORAC与鲊海椒样品中具有抗氧化活性的多酚含量显著相关,发酵15,60 d的样品水提物均有一定DPPH•清除能力,但是在进一步细胞抗氧化、肝脏脂质过氧化和对大分子物质如蛋白质氧化的保护作用研究中发现其抗氧化活性不尽相同。这些研究结果与Dorman等[31]报道的植物抗氧化成分水提物对BSA和DNA有潜在的促氧化活性相似。研究表明,食物的抗氧化能力是由不同作用机制的抗氧化成分共同作用的结果[32],它们相互作用、相互协调,共同清除自由基,避免细胞氧化损伤造成伤害[33],所以应该采取不同的方法来评价食物的抗氧化能力。本试验表明,仅以多酚含量变化和体外化学抗氧化方法衡量食物抗氧化活性不够完整,应该结合肝脏匀浆脂质过氧化的抑制及对细胞氧化损伤的保护作用等试验来综合评价食物的抗氧化能力。
[1] 陈龙. 云南十种辣椒抗氧化及抑菌活性的研究[D]. 昆明: 昆明理工大学, 2010: 1-4.
[2] MATERSKA M, PERUCKA I. Antioxidant activity of the main phenolic compounds isolated from hot pepper fruit (CapsicumannuumL.)[J]. Journal of Agricultural and Food Chemistry, 2005, 53(5): 1 750-1 756.
[3] 赵艳红, 李建科, 李国秀. 天然抗氧化物体外活性评价方法的优选与优化[J]. 食品科学, 2008, 29(6): 64-69.
[4] PRIOR RONALD L, WU Xian-li, SCHAICH Karen. Standardized methods for the determination of antioxidant capacity and phenolics in foods and dietary supplements[J]. Journal of agricultural and food chemistry, 2005, 53(10): 4 290-4 302.
[5] LUO Xiu-ju, PENG Jun, LI Yuan-jian. Recent advances in the study on capsaicinoids and capsinoids[J]. European Journal of Pharmacology, 2011, 650(1): 1-7.
[6] ARSLAN D, ÖZCANM M. Dehydration of red bell-pepper (CapsicumannuumL.): Change in drying behavior, colour and antioxidant content[J]. Food and Bioproducts Processing, 2011, 89(4): 504-513.
[7] DORMAN H J D, PELTOKETO A, HILTUNEN R, et al. Characterisation of the antioxidant properties of de-odourised aqueous extracts from selected Lamiaceae herbs[J]. Food Chemistry, 2003, 83(2): 255-262.
[8] 续洁琨, 姚新生, 栗原博. 抗氧化能力指数(ORAC)测定原理及应用[J]. 中国药理学通报, 2006(8): 1 015-1 022.
[9] 李成龙, 葛平珍, 周才琼. 不同淀粉原料制备鲊海椒发酵过程中抗氧化活性[J]. 食品科学, 2016(5): 50-55.
[10] BARTASIUTE A, WESTERINK B H C, VERPOORTEE, et al. Improving the in vivo predictability of an on-line HPLC stable free radical decoloration assay for antioxidant activity in methanol-buffer medium[J]. Free Radical Biology and Medicine, 2007, 42(3): 413-423.
[11] YOKOMIZO A, MORIWAKI M. Effects of uptake of flavonoids on oxidative stress induced by hydrogen peroxide in human intestinal caco-2 cells[J]. Bioscience Biotechnology & Biochemistry, 2006, 70(6): 1 317-1 324.
[12] SEREM JUNE C, BESTER MEGAN J. Physicochemical properties,antioxidant activity and cellular protective effects of honeys from southern Africa[J]. Food Chemistry, 2012, 133(4): 1 544-1 550.
[13] DONATO A, LORENZO G, MANUELAB, et al. Chemical and cellular antioxidant activity of phytochemicals purified from olive mill waste waters[J]. Journal of Agricultural & Food Chemistry, 2011, 59(5): 2 011-2 018.
[14] WOLFE K L, LIU Rui-hai. Cellular antioxidant activity (CAA) assay for assessing antioxidants, foods, and dietary supplements[J]. Journal of Agricultural and Food Chemistry, 2007, 55(22): 8 896-8 907.
[15] WOLFE K L, KANG Xin-mei, HE Xiang-jiu, et al. Cellular antioxidant activity of common fruits[J]. Journal of Agricultural and Food Chemistry, 2008, 56(18): 8 418-8 426.
[16] WEI Song, DERITO C M, LIU Ke-shu, et al. Cellular antioxidant activity of common vegetables[J]. Journal of Agricultural and Food Chemistry, 2010, 58(11): 6 621-6 629.
[17] BLASAM, ANGELINO D, GENNARI L, et al. The cellular antioxidant activity in red blood cells (CAA-RBC): A new approach to bioavailability and synergy of phytochemicals and botanical extracts[J]. Food Chemistry, 2011, 125(2): 685-691.
[18] ZHANG Zhong. Thermal processing enhances the nutritional value of tomatoes by increasing total antioxidant activity[J]. Journal of Agricultural & Food Chemistry, 2002, 50(10): 3 010-3 014.
[19] 王希春. 固态发酵高溶栓活性豆豉及其抗氧化特性的研究[D]. 无锡: 江南大学, 2007: 20-23.
[20] CHENG Zhi-hong, JEFFREY M, YU Liang-li. High-throughput relative DPPH radical scavenging capacity assay[J]. Journal of Agricultural and Food Chemistry, 2006, 54(20): 7 429-7 436.
[21] MOO-HUCHIN V M, MOO-HUCHIN M I, ESTRADA-León R J, et al. Antioxidant compounds, antioxidant activity and phenolic content in peel from three tropical fruits from Yucatan, Mexico[J]. Food chemistry, 2015, 166: 17-22.
[22] TAI Zhi-gang, CAI Le, DAI Lin, et al. Antioxidant activity and chemical constituents of edible flower of Sophora viciifolia [J]. Food Chemistry, 2011, 126(4):1 648-1 654.
[23] TAKEBAYASHI J, IWAHASHI N, ISHIMIY, et al. Development of a simple 96-well plate method for evaluation of antioxidant activity based on the oxidative haemolysis inhibition assay (OxHLIA)[J]. Food Chemistry, 2012, 134(1): 606-610.
[24] CHENG Zhi-hong, MOORE Jeffrey, YU Liang-li. High-throughput relative DPPH radical scavenging capacity assay[J]. Journal of Agricultural and Food Chemistry, 2006, 54(20): 7 429-7 436.
[25] ETSUO Niki. Biomarkers of lipid peroxidation in clinical material[J]. Biochimica et Biophysica Acta (BBA) - General Subjects, 2014, 1 840(2): 809-817.
[26] 刘培勋, 高小荣, 徐文清, 等. 银耳碱提多糖抗氧化活性的研究[J]. 中药药理与临床, 2005, 21(4): 35-37.
[27] 曹清明, 邬靖宇, 钟海雁, 等. 油茶叶中黄酮的超声辅助提取及其抗氧化活性研究[J]. 食品与机械, 2015, 31(3): 162-166.
[28] HALLIWELL B. Are polyphenols antioxidants or pro-oxidants? What do we learn from cell culture and in vivo, studies?[J]. Archives of Biochemistry & Biophysics, 2008, 476(2): 107-112.
[29] 周才琼, 程道梅, 谢静. 茶多酚对菜籽色拉油的抗氧化作用研究[J]. 西南农业大学学报: 自然科学版, 2000, 22(4): 350-352.
[30] PRIOR R L, WU Xian-li, SCHAICH K. Standardized methods for the determination of antioxidant capacity and phenolics in foods and dietary supplements[J]. Journal of Agricultural & Food Chemistry, 2005, 53(10): 4 290-4 302.
[31] DORMANH J D, HILTUNEN R. Antioxidant and pro-oxidant in vitro evaluation of water-soluble food-related botanical extracts[J]. Food Chemistry, 2012, 129(4):1 612-1 618.
[32] PÉREZ-JIMÉNEZ J, ARRANZ S, TABERNEROM, et al. Updated methodology to determine antioxidant capacity in plant foods, oils and beverages: Extraction, measurement and expression of results[J]. Food Research International, 2008, 41(3): 274-285.
[33] 李好, 钟海雁, 方学智, 等. 油茶籽成熟过程中抗氧化物质的变化规律[J]. 食品与机械, 2013, 29(5): 6-9.
Antioxidant activity of fermented Rice-Chili and its effect on liver lipid peroxidation
WEICheng1ZHOUCai-qiong1GEPing-zhen1,2ZHULi-juan1XIEYue-ying1
(1.FoodScienceCollege,SouthwestUniversity,Chongqing400715,China;2.AgriculturalSciencesInstituteofBijieCity,Bijie,Guizhou551700,China)
Selecting the for 15 days, which has the highest otal reducing power, and 60 days of the fermented Rice-Chili, which has the highest ORAC, as samples, The effects were studied, including the fermented Rice-Chili on the free radical DPPH· scavenging activity, oxidation inhibition rate of BSA, erythrocyte hemolysis and liver lipid peroxidation. Results showed that the DPPH· scavenging rate of samples fermented 15 days was better than 60 days and had a better protective effect from protein oxidative damage. However, the sample fermented 60 days had potential to promote the oxidation of BSA. Besides, both samples fermented 15 days and 60 days had a good effect on inhibition of the liver lipid peroxidation and anti-hemolysis, but the sample fermented 15 days was better. Correlation analysis indicated that the total phenols content in sample was associated with the inhibition of liver lipid peroxidation significantly positive correlation (P<0.01) while negatively correlated with inhibition of BSA oxidation and cell hemolysis. All those suggested that, only by chemical antioxidant method to evaluate antioxidant activity was less comprehensive. Therefore, based on studying the chemical antioxidant, combining the effects on erythrocyte hemolysis, protein oxidation and liver lipid peroxidation would be more objective to evaluate food antioxidant activity.
chili; fermented Rice-Chili; oxidation inhibition rate of BSA; erythrocyte hemolysis; the liver lipid peroxidation
重庆市特色食品工程技术研究中心能力提升项目(编号:cstc2014pt-gc8001)
韦诚,男,西南大学在读硕士研究生。
周才琼(1964-),女,西南大学教授,博士。
E-mail:zhoucaiqiong@swu.edu.cn
2016—06—21
10.13652/j.issn.1003-5788.2016.10.001

