氯化锂抑制丙泊酚诱导原代培养神经元凋亡
李建立,朱喜春,崔红赏,刘 锐
氯化锂抑制丙泊酚诱导原代培养神经元凋亡
李建立1,朱喜春1,崔红赏2,刘 锐3
目的 探讨氯化锂对丙泊酚诱导原代培养皮层神经元凋亡的影响及机制。方法 体外原代培养7 d的大鼠皮层神经元,用MTT法检测不同浓度氯化锂(0.1、1、5、10 μmol/L)单独作用皮层神经元12 h后神经元存活率的变化。神经元随机分为6组:溶剂对照组(给予等容积的20%脂肪乳),丙泊酚组(终浓度为500 μmol/L),氯化锂+丙泊酚组(氯化锂终浓度分别为0.1、1、5、10 μmol/L,丙泊酚终浓度为500 μmol/L),药物处理12 h后,MTT法检测神经元存活率的变化,Hoechst33258核染色法和流式细胞仪检测神经元调亡,Western blot法测定神经元磷酸化糖原合成酶激酶-3β(pGSK-3β)和裂解半胱天冬酶-3(cleaved-Caspase-3)蛋白水平。结果 与溶剂对照组比较,不同浓度氯化锂单独作用神经元12 h后,神经元存活率未见显著变化。与溶剂对照组比较,丙泊酚组神经元存活率显著下降(P<0.01),神经元凋亡率显著增加(P<0.01),pGSK-3β蛋白水平显著下降(P<0.01), cleaved-Caspase-3蛋白水平显著增加(P<0.01)。与丙泊酚组比较,氯化锂可剂量依赖性增加神经元存活率(P<0.01),神经元凋亡率显著下降(P<0.01),pGSK-3β蛋白水平显著增加(P<0.01), cleaved-Caspase-3蛋白水平显著下降(P<0.01)。结论 氯化锂可抑制丙泊酚诱导的原代培养皮层神经元凋亡,其机制可能与提高神经元pGSK-3β蛋白水平和降低cleaved-Caspase-3蛋白水平有关。
丙泊酚;氯化锂;神经凋亡;原代培养皮层神经元;pGSK-3β;cleaved-Caspase-3
研究[1-2]表明出生7 d SD大鼠连续大剂量应用丙泊酚可引起大脑多个脑区神经细胞的凋亡,并引起大鼠成年后的学习记忆功能损伤。体外原代培养细胞实验也表明丙泊酚可诱导神经元凋亡[3-4]。氯化锂作为精神科的常用药物,在临床上被广泛用于治疗双向情感障碍[5]。近年来研究[6-7]表明锂剂可用于治疗中枢神经系统损伤和老年退行性疾病,如阿尔茨海默病等。以往有研究[8]表明氯化锂可对抗麻醉药氯胺酮和丙泊酚所引起的发育期大鼠大脑神经细胞损伤,但具体机制目前还不清楚,该研究利用原代培养皮层神经元,探讨氯化锂对丙泊酚诱导皮层神经元凋亡的影响及其可能机制。
1 材料与方法
1.1 材料 丙泊酚(propofol,意大利AstraZeneca公司,批号:KW814);20%脂肪乳(广州百特公司);Neurobasal培养液、B27促生长剂、DMEM培养液、胎牛血清(美国Gibco公司); DMSO、MTT、17β雌二醇(美国Sigma公司); 胰蛋白酶和Hoechst33258染料(北京索来宝公司); Annexin V-FITC 试剂盒(浙江联科生物技术有限公司);磷酸化糖原合成酶激酶-3β(phospho glycogen synthase kinase-3β,pGSK-3β)和裂解半胱天冬酶-3(cleaved-cysteine protease protein-3,cleaved-Caspase-3)(美国Cell signal Technology公司)。
1.2 皮层神经元原代培养 新生1 d 内的SD幼鼠取额叶皮质,用冷PBS液冲洗,去除脑膜和血管后放入DMEM培养基中剪碎,然后放入37 ℃水浴锅内将皮层组织充分消化(0.125%胰蛋白酶)15 min,然后将皮层组织移入DMEM培养基中(含10%胎牛血清)终止胰蛋白酶的作用,然后把细胞转移到含DMEM培养基中(含10%胎牛血清)轻轻吹打制成细胞悬液。用100目钢丝筛将细胞悬液过滤,计数后接种于多聚赖氨酸包被的培养板中,放于5% CO2培养箱37 ℃恒温培养24 h后,将培养液换成Neurobasal+B27培养基继续培养,每隔2 d半量换液1次。神经元体外培养至7 d用于实验。
1.3 实验分组 观察不同浓度氯化锂对皮层神经元存活率的影响,分为4组:溶剂对照组,氯化锂处理组(终浓度分别为0.1、1、5、10 μmol/L)。 观察氯化锂对丙泊酚引起皮层神经元损伤的影响时,分为6组:溶剂对照组(给予等容积的20%脂肪乳),丙泊酚组(终浓度为500 μmol/L),氯化锂+丙泊酚不同浓度组(丙泊酚终浓度为500 μmol/L,氯化锂终浓度分别为0.1、1、5、10 μmol/L)。
1.4 MTT法检测神经元存活率 按不同分组将神经元给予药物处理12 h,每组设6个复孔。然后每孔加入10 μl MTT液,放入37 ℃恒温培养箱中继续孵育4 h,加入DMSO 200 μl/孔,震荡5 min溶解甲臜,酶标仪测定570 nm处的吸光度值。以对照组平均吸光度值为100%,以各处理组吸光度值与对照组的比值计算细胞存活率。
1.5 Hoechst33258核染色法测定神经元凋亡 体外培养7 d的神经元,按分组分别给予不同药物处理12 h后,显微镜下观察神经元成长情况。然后移去培养液,用冷PBS冲洗神经元去除杂质和死细胞, 每孔加入4%多聚甲醛200 μl将细胞固定30 min,去除多聚甲醛后,用冷PBS冲洗1次,然后每孔加入Hoechst33258染液1 ml处理神经元8 min后,冷PBS漂洗。在荧光显微镜(日本奥林巴斯,型号B×41)下随机选取5个视野进行计数,计算神经元的凋亡率,凋亡率(%)=(凋亡细胞数/细胞总数)×100%。
1.6 流式细胞仪检测神经元凋亡 体外培养至7 d给予不同干预措施处理神经元12 h后,移去培养液,冷PBS液冲洗神经元3次,加入0.125%胰酶,边消化边镜下观察,当细胞突起回缩,胞体变圆时立即加入培养基终止消化。然后轻轻吹打混匀用PBS重悬细胞并计数使每管细胞数目不少于1× 109/ml,然后转移到离心管中,1 000 r/min离心5 min,去除上清液,收集细胞。PBS液冲洗细胞2次,1 000 r/min离心5 min,去除上清液, 暗室中加入195 μl Annexin V-FITC结合液轻轻重悬细胞,然后加入10 μl PI染色液,轻轻混匀,各组设3个复孔。用美国BD公司流式细胞仪上机检测各处理组神经元的凋亡率。
1.7 Western blot法测定神经元pGSK-3β和cleaved-Caspase-3蛋白水平 体外培养至7 d给予不同干预措施处理神经元12 h后,用0.25%胰酶将细胞消化收集后裂解,BCA法测定总蛋白含量。将蛋白加上样缓冲液煮沸变性,以10% SDS二聚丙烯酰胺凝胶电泳1.5 h分离, 经过2 h将蛋白转至PVDF膜,室温下封闭1 h分别加入一抗pGSK-3β和cleaved-Caspase-3抗体(1 ∶2 000稀释), 4 ℃孵育过夜, 常规洗涤,加入二抗(1 ∶5 000)37 ℃孵育60 min,洗涤,电化学法发光显色,X线片曝光。用凝胶图像处理系统分析目标条带与内参照条带吸光度的比值。实验重复3次, 设β-actin蛋白为内参。
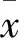
2 结果
2.1 不同浓度氯化锂对皮层神经元存活率的影响 与溶剂对照组(99.8±6.3)%比较,不同浓度氯化锂(0.1、1、5、10 μmol/L)单独作用皮层神经元12 h后,神经元存活率分别为(98.8±4.9)%、(99.1±5.2)%、(98.6±6.7)%、(99.2±7.2)%,未见显著性变化(F=2.125,P>0.05)。
2.2 氯化锂对丙泊酚诱导皮层神经元损伤的影响 与溶剂对照组(99.9±7.9)%比较,丙泊酚组神经元存活率(57.3±4.5)%显著下降(P<0.01)。不同浓度氯化锂(0.1、1、5、10 μmol/L)处理后,神经元存活率分别为(60.2±4.6)%、(70.3±6.1)%、(79.3±6.2)%、(85.7±6.7)%,与丙泊酚组比较,1、5、10 μmol/L氯化锂处理组均显著增加(F=65.095,P<0.01),其中10 μmol/L氯化锂保护作用最好。
2.3 氯化锂对丙泊酚诱导皮层神经元凋亡的影响 Hoechst33258核染色法检测神经元凋亡,结果显示:与溶剂对照组比较,丙泊酚组神经元凋亡率显著增加(P<0.01)。与丙泊酚组比较,氯化锂+丙泊酚组神经元凋亡率显著下降(F=34.636,P<0.01)。见图1。流式细胞术检测结果进一步证实了氯化锂抑制丙泊酚诱导皮层神经元凋亡。见图2。

图1 Hoechst33258核染色法检测氯化锂对丙泊酚诱导皮层神经元凋亡的影响±s) ×400
A:溶剂对照组;B:丙泊酚组;C:氯化锂+丙泊酚组;与溶剂对照组比较:**P<0.01;与丙泊酚组比较:##P<0.01
2.4 不同处理对皮层神经元pGSK-3β蛋白水平的影响 与溶剂对照组比较,丙泊酚组神经元pGSK-3β蛋白水平显著降低(P<0.01)。与丙泊酚组比较,氯化锂+丙泊酚组神经元pGSK-3β蛋白水平显著增加(F=98.546,P<0.01)。见图3。
2.5 不同处理对皮层神经元cleaved-Caspase-3蛋白水平的影响 与溶剂对照组比较,丙泊酚组神经元cleaved-Caspase-3蛋白水平显著增加(P<0.01)。与丙泊酚组比较,氯化锂+丙泊酚组神经元cleaved-Caspase-3蛋白水平显著下降(F=76.329,P<0.01)。见图4。


A:溶剂对照组;B:丙泊酚组;C:氯化锂+丙泊酚组

图3 不同处理对皮层神经元pGSK-3β蛋白水平的影响
与溶剂对照组比较:**P<0.01;与丙泊酚组比较:##P<0.01
3 讨论
丙泊酚是否适用于新生儿和婴幼儿的全身麻醉,目前观点不一。研究[1-4]表明丙泊酚具有发育期神经毒性,大剂量长时间应用可对发育期动物大脑广泛脑区神经细胞和原代培养神经元产生凋亡样损伤,因此丙泊酚对婴幼儿大脑产生损伤的机制以及寻找药物防治其损伤引起了学者的广泛关注。

图4 不同处理对皮层神经元cleaved-Caspase-3蛋白水平的影响
与溶剂对照组比较:**P<0.01;与丙泊酚组比较:##P<0.01
动物试验研究[8]表明氯化锂可抑制丙泊酚引起的发育期大鼠大脑神经细胞凋亡,但作用机制还不十分清楚。为进一步研究氯化锂抑制丙泊酚引起的发育期大脑损伤的机制,本实验应用原代培养皮层神经元,显示氯化锂可通过提高神经元pGSK-3β蛋白水平和降低cleaved-Caspase-3蛋白水平进而抑制丙泊酚诱导原代培养皮层神经元凋亡。
研究[9-11]表明以GSK-3β为中心的信号通路在麻醉药诱导发育期大脑神经损伤中发挥着重要作用。GSK-3β在大脑分布广泛,主要定位于神经元样细胞,是细胞内多种信号转导通路的重要组成部分,其活化与神经元的凋亡直接相关。在中枢神经系统中,GSK-3β通过激活转录调节细胞的增殖、分化、存活与凋亡,参与神经系统的多种病理生理过程,GSK-3β活性异常会引起下游信号通路的异常,进而引起许多中枢神经系统疾病的发生[12]。以往研究[11]显示丙泊酚可降低发育期大鼠大脑pGSK-3β蛋白的表达水平,进而引起大鼠大脑广泛脑区神经细胞的凋亡。细胞凋亡是麻醉药引起发育期大脑神经损伤的主要机制之一。凋亡受凋亡调节基因的控制,Bcl-2是调控凋亡的主要基因,可抑制凋亡过程中起重要作用的因子如Caspase-3和Caspase-9的活化。Caspase-3是凋亡发生的最终执行者,是凋亡蛋白级联反应的必经之路,随着Caspase-3蛋白的活化,细胞将发生不可逆性凋亡。GSK-3β诱导Caspase-3活化可能是引起凋亡的重要机制。本研究结果表明丙泊酚作用皮层神经元12 h,降低了神经元GSK-3β Ser9 位点的磷酸化水平,引起神经元pGSK-3β蛋白水平的显著性下降,同时使cleaved-Caspase-3蛋白表达水平显著性增加,提示丙泊酚诱导皮层神经元凋亡可能与pGSK-3β蛋白水平下降和cleaved-Caspase-3蛋白水平增加有关。
与促凋亡作用相反,抑制GSK-3β活性提高pGSK-3β蛋白表达水平产生抗凋亡作用,对细胞存活发挥着重要作用。氯化锂作为一种GSK-3β活性抑制剂,具有广泛的生物学效应,在精神障碍性疾病的治疗中发挥着重要作用。近年来氯化锂的神经保护作用受到广泛重视。研究[13]表明氯化锂通过抑制神经细胞凋亡发挥神经保护作用,可治疗脑缺血和慢性神经退行性病变。另有研究[14]表明氯化锂可抑制新生鼠缺血缺氧引起的大脑神经细胞凋亡。本研究进一步观察氯化锂对丙泊酚诱导皮层神经元损伤的影响,结果表明不同浓度氯化锂单独作用皮层神经元12 h未发现对皮层神经元存活率产生影响,但可抑制丙泊酚引起的皮层神经元损伤,表现为神经元存活率显著增加和神经元凋亡率显著下降。同时结果表明氯化锂可通过抑制丙泊酚引起的神经元pGSK-3β蛋白水平下降,降低cleaved-Caspase-3蛋白水平,抑制丙泊酚诱导的皮层神经元凋亡,对神经元产生保护作用。
综上所述,氯化锂具有抑制丙泊酚诱导皮层神经元凋亡的作用,其机制可能是通过提高神经元pGSK-3β蛋白水平和降低cleaved-Caspase-3蛋白水平实现的。本研究为围术期应用氯化锂预防丙泊酚对婴幼儿大脑产生神经损伤提供了初步的实验依据。
[1] Huang J, Jing S, Chen X, et al. Propofol administration during early postnatal life suppresses hippocampal neurogenesis[J]. Mol Neurobiol, 2016, 53(2):1031-44.
[2] Karen T, Schlager G W, Bendix I, et al. Effect of propofol in the immature rat brain on short-and long-term neurodevelopmental outcome[J]. PLoS One, 2013,8(5):e64480.
[3] Zhong Y, Liang Y, Chen J, et al. Propofol inhibits proliferation and induces neuroapoptosis of hippocampal neuronsinvitroviadownregulation of NF-κB p65 and Bcl-2 and upregulation of caspase-3[J].Cell Biochem Funct, 2014, 32(8):720-9.
[4] Berns M, Seeberg L, Schmidt M, et al. High-dose propofol triggers short-term neuroprotection and long-term neurodegeneration in primary neuronal cultures from rat embryos[J].J Int Med Res, 2009,37(3):680-8.
[5] Benedetti F, Bollettini I, Barberi I,et al. Lithium and gsk3-beta promoter gene variants influence white matter microstructure in bipolar disorder[J].Neuropsychopharmacology, 2013, 38(2):313-7.
[6] Qu Z S, Li L, Sun X, et al. Glycogen synthase kinase-3 regulates production of amyloid-beta peptides and tau phosphorylation in diabetic rat brain[J]. Sci World J,2014, 2014:878123.
[7] Sofola O, Kerr F, Rogers I, et al. Inhibition of gsk-3 ameliorates abeta pathology in an adult onset drosophila model of Alzheimer′s disease[J]. PLoS Genet,2010,6(9):e1001087.
[8] Straiko M M, Young C, Cattano D, et al. Lithium protects against anesthesia-induced developmental neuroapoptosis[J]. Anesthesiology, 2009, 110(4):862-8.
[9] Li Y, Wang F, Liu C, et al. JNK pathway may be involved in isoflurane-induced apoptosis in the hippocampi of neonatal rats[J]. Neurosci Lett, 2013, 545:17-22.
[10]Liu J R, Baek C, Han X H, et al. Role of glycogen synthase kinase-3beta in ketamine-induced developmental neuroapoptosis in rats[J]. Br J Anaesth, 2013, 110 Suppl 1:i3-9.
[11]Soriano S G, Liu Q, Li J,et al. Ketamine activates cell cycle signaling and apoptosis in the neonatal rat brain[J]. Anesthesiology, 2010,112(5):1155-63.
[12]唐倩倩,郭小云,刘 迪,等. GSK-3β参与神经精神疾病的研究进展[J].中国药理学通报,2014,30(9):1193-6.
[13]Marmol F. Lithium:bipolar disorder and neurodegenerative diseases possible cellular mechanisms of the therapeutic effects of lithium[J]. Prog Neuropsychopharmacol Biol Psychiatry, 2008, 32(8):1761-71.
[14]邹艳平,栗艳芳.锂剂抑制新生鼠缺氧缺血后的细胞凋亡及炎症反应研究[J].中国实用神经疾病杂志,2013,16(6):1-5.
Lithium chloride ptotects against propofol-induced apoptosis on primary cultured neurons
Li Jianli1, Zhu Xichun1, Cui Hongshang2, et al
(1DeptofAnesthesiology,2DeptofThoracicSurgery,HebeiGeneralHospital,Shijiazhuang050051)
ObjectiveToinvestigatetheprotectiveeffectsandthemechanismsoflithiumchlorideonthepropofol-inducedneuroapoptosisonprimaryculturedcorticalneurons.MethodsCorticalneuronswereprimarilyculturedforsevendays,andtreatedwithdifferentconcerntrationsoflithiumchloride(0.1,1,5,10μmol/L),andtheneuronviabilitywasmeasuredbyMTTassayafter12htreatments.Corticalneuronsweredividedintothreegroups:vehicle-controlgroup(treatedwithequalvolumeofintralipid),propofol-treatedgroup(treatedwith500μmol/Lpropofol),propofol+lithiumchloridetreatedgroup(treatedwith500μmol/Lpropofoland10μmol/Llithiumchloride).Theneuronsweretreatedfor12h;theneuronviabilitywasmeasuredbyMTTassay;neuroapoptosiswasdetectedbyHoechst33258stainingandFCMassay,andpGSK-3βandcleaved-Caspase-3proteinsweredetectedbyWesternblot.ResultsTheneuronviabilitywasnotaffectedbyvariousconcentrationsoflithiumchloride.Comparedwiththevehicle-controlgroup,theneuronviabilitydecreasedgreatly(P<0.01),theneuroapoptosisincreasedgreatly(P<0.01),thepGSK-3βproteinleveldecreased(P<0.01),andcleaved-Caspase-3proteinlevelincreased(P<0.01)inpropofol-treatedgroup.Comparedwiththepropofol-treatedgroup,lithiumchlorideincreasedneuronviabilityindose-dependentmanner(P<0.01),theneuroapoptosisdecreasedgreatly(P<0.01),thepGSK-3βproteinlevelincreased(P<0.01),andcleaved-Caspase-3proteinleveldecreased(P<0.01)inpropofol+lithiumchloridetreatedgroup.ConclusionLithiumchloridecanprotectagainstpropofol-inducedneuroapoptosisonprimaryculturedneuronsbyincreasingthelevelofpGSK-3βanddecreasingthelevelofcleaved-Caspase-3.
propofol;lithiumchloride;neuroapoptosis;primaryculturedcorticalneuron;pGSK-3β;cleaved-Caspase-3
河北省医学科学研究重点课题计划(编号:ZL20140095);2015年政府资助临床医学优秀人才培养和基础课题研究项目(编号:361003-6)
河北省人民医院1麻醉科、2胸外科,石家庄 0500513河北省胸科医院呼吸内科,石家庄 050000
李建立,男,副教授,博士,责任作者,E-mail:hblijianli@163.com
时间:2016-10-12 13:23:00
http://www.cnki.net/kcms/detail/34.1065.R.20161012.1323.012.html
R 971.2;R 965
A
1000-1492(2016)11-1608-05
10.19405/j.cnki.issn1000-1492.2016.11.012
2016-06-27接收

