透明质酸-齐墩果酸靶向给药系统对HL-60细胞增殖的抑制作用及机制
侯正平 徐 辉 宋琳琳 侯 玥 刘安康 吕东鹤 张 丽 于 莲 张鹏霞
(佳木斯大学基础医学院,黑龙江 佳木斯 154007)
透明质酸-齐墩果酸靶向给药系统对HL-60细胞增殖的抑制作用及机制
侯正平 徐 辉 宋琳琳1侯 玥2刘安康2吕东鹤3张 丽4于 莲1张鹏霞
(佳木斯大学基础医学院,黑龙江 佳木斯 154007)
目的 制备透明质酸(HA)-齐墩果酸(OA)靶向给药系统,探讨其对HL-60细胞的增殖抑制作用及cav-1、PI3K和AKT mRNA表达的影响。方法 采用乳化超声法制备HA-OA靶向给药系统,将其作用于HL-60细胞,CCK-8检测HL-60细胞增殖抑制作用,采用RT-PCR方法检测cav-1、PI3K、AKT mRNA表达。结果 经核磁、红外检测,成功构建HA-OA靶向给药系统。将HA-OA靶向给药系统作用于HL-60细胞,HA-OA靶向给药系统对HL-60细胞有抑制作用。RT-PCR检测发现,HA-OA靶向给药系统组增加cav-1 mRNA的表达量;降低PI3K和AKT mRNA的表达量。结论 HA-OA靶向给药系统作用于HL-60细胞表面CD44,靶向给药进入HL-60细胞,可以通过cav-1/PI3K/AKT途径诱导HL-60细胞凋亡。
齐墩果酸;靶向给药系统;增殖抑制
天然药物齐墩果酸(OA)对白血病HL-60细胞具有治疗作用,但作用浓度高〔1~3〕。为减少OA的用量,提高其对HL-60细胞的精准治疗,本文合成了透明质酸(HA)-OA靶向给药系统,并检测对HL-60细胞的生长抑制作用,探讨其机制。
1 材料与方法
1.1 材料与试剂 急性早幼粒细胞白血病系HL-60细胞株,中国典型培养物保藏中心(武汉大学)购买;OA标准品(西安玉泉生物科技有限公司);RPMI1640培养基、胎牛血清(Hyclone);二甲基亚砜(Sigma公司);PCR引物设计、合成(生工生物工程有限公司);焦碳酸二乙酯(DEPC,大连宝生物工程有限公司)。PCR引物,cav-1:上游CCAGCTTCACCACCTTCACT,下游AGATGGAATAGACACGGCTGA,扩增片段192 bp;磷脂酰肌醇-3-激酶(PI3K):上游AACAGTGCCAGACCCAAGAG,下游AAAGTGCCATCTCGCTTCC,扩增片段455 bp;AKT:上游CCACGCTACTTCCTCCTCAA,下游GTCCATCTCCTCCTCCTCCT,扩增片段368 bp;内参β-actin上游TCCTCCCTGGAGAAGAGCTA,下游ATCTCCTTCTGCATCCTGTC,扩增片段251 bp。
1.2 HA-Cys的制备 采用1-乙基-3-碳化二亚胺盐酸盐(EDAC)和N-羟基丁二酰亚胺(NHS),修饰HA,利用NaOH将其配置成碱性溶液,室温下避光反应45 min,然后将L-半胱氨酸盐酸盐(Cys)加入到反应液中,同样条件下反应5 h。反应后得到HA-Cys溶液,将其装入透析袋中,在4℃且避光的条件下,用5 mmol/ml的盐酸透析2次;5 mmol/ml、1%的NaCl盐酸溶液透析2次,用1 mmol/ml的盐酸溶液彻底透析2次,并取出透析袋中的液体,置于-80℃冰箱中预冻,随后将其放入冷冻干燥机里冻干,获得HA-Cys聚合物,使聚合物溶解在适量的三蒸水中,制备HA-Cys聚合物水溶液,将此水溶液加入到纳米粒水混悬液中60℃搅拌1 h后,形成HA修饰的核壳纳米粒。
1.3 HA-OA的制备 采用甲氧基封端的聚乙二醇和马来酰亚胺基封端的聚乙二醇,利用聚合反应与己内酯(PCL)结合反应4 h。冰水冷却后,洗涤除去未反应的PCL及其PCL均聚物,随后将其纯化,干燥。改变PCL与Mal-PEG和Me-PEG的质量比,得到不同分子量的 Mal-PEG-PCL和Me-PEG-PCL共聚物。将两者的共聚物与OA先溶解于二氯甲烷,再溶解在胆酸钠溶液中,冰浴并利用超声乳化法,进行Hitrap脱盐柱纯化法,用PBS收集纯化后的产物,并向其中加入修饰过的HA-Cys,两者避光反应,充入氮气6 h,制备HA-OA靶向给药系统。
1.4 HA-OA靶向给药系统对HL-60细胞的抑制作用 配制细胞悬液,取96孔板,设为空白对照组、OA组和HA-OA组,每孔10万个细胞。用药组分为100、80、60 μmol/L组,每组设5个孔,对照组补加10 μl无血清培养液。将96孔板每孔细胞悬液混匀,放入5%CO2培养箱37℃ 培养24 h。24 h后取出96孔板,每孔加10 μl胆率收缩素八肽(CCK-8)溶液混匀,继续培养2 h,用酶标仪450 nm检测。
1.5 HA-OA靶向给药系统对HL-60细胞基因表达的影响 选用80 μmol/L的HA-OA靶向给药系统对HL-60细胞进行处理。采用RT-PCR检测cav-1、PI3K和AKT mRNA表达。反应条件:94℃ 5 min;94℃ 30 s;53~55℃ 30 s;72℃ 30 s~1 min;35~40个循环;72℃ 7 min。扩增产物经琼脂糖凝胶电泳及紫外成像系统分析,以与内参照基因 β-actin扩增产物的灰度值之比表示mRNA表达水平。
1.6 统计学方法 应用SPSS11.0软件,多组间比较采用方差分析;两组比较采用独立样本t检验。
2 结 果
2.1 HA-OA纳米粒的成功制备 运用1H-NMR图谱进行分析,在1.5 PPM处出现的信号峰表示Cys分子亚甲基上的氧原子,结果表明HA与Cys以共价的形式连接在一起。说明通过EDAC/NHS修饰的HA-Cys已成功制备。经红外光谱检测,在1 722 cm处以及2 943 cm增加了羟基的峰和己内酯的脂肪碳氢的伸缩振动峰,2 881 cm处峰的强度减弱,标志着聚乙二醇-己内酯嵌段聚合物的形成。说明通过mPEG-PCL/Mal-PEG-PCL修饰的OA与HA有效的结合,成功制备了HA-OA纳米粒。见图1,2。
2.2 CCK-8检测HA-OA纳米粒对HL-60细胞的抑制作用 空白对照组对 HL-60 细胞的存活率并无明显影响;OA组对HL-60细胞有抑制作用;HA-OA组使HL-60细胞的存活率明显降低(P<0.01)。OA组与HA-OA组相比,HA-OA组对HL-60细胞的抑制效果明显高于OA组。随着HA-OA纳米粒浓度的升高,对 HL-60细胞抑制作用也增强。见表1。

图1 1H-NMR图谱检测疏基化HA

图2 红外光谱检测聚乙二醇-己内酯嵌段聚合物

浓度(μmol/L)OA组HA⁃OA组0100±229100±017606450±3711)5324±0491)806246±1821)5092±1362)1005963±2281)4934±0592)
与0 μmol/L组相比:1)P<0.05,2)P<0.01
2.3 HA-OA靶向给药系统对HL-60细胞的基因表达的检测 与空白对照组和OA组比较,HA-OA组降低HL-60细胞PI3K、AKT mRNA 的表达量;HA-OA增加HL-60细胞cav-1 mRNA的表达量。见表2,图3~图5。

表2 HA-OA对HL-60细胞cav-1、PI3K和AKT mRNA表达的影响
与空白对照组相比:1)P<0.05

图3 HA-OA对HL-60细胞PI3K mRNA表达的影响

图4 HA-OA对HL-60细胞AKT mRNA表达的影响
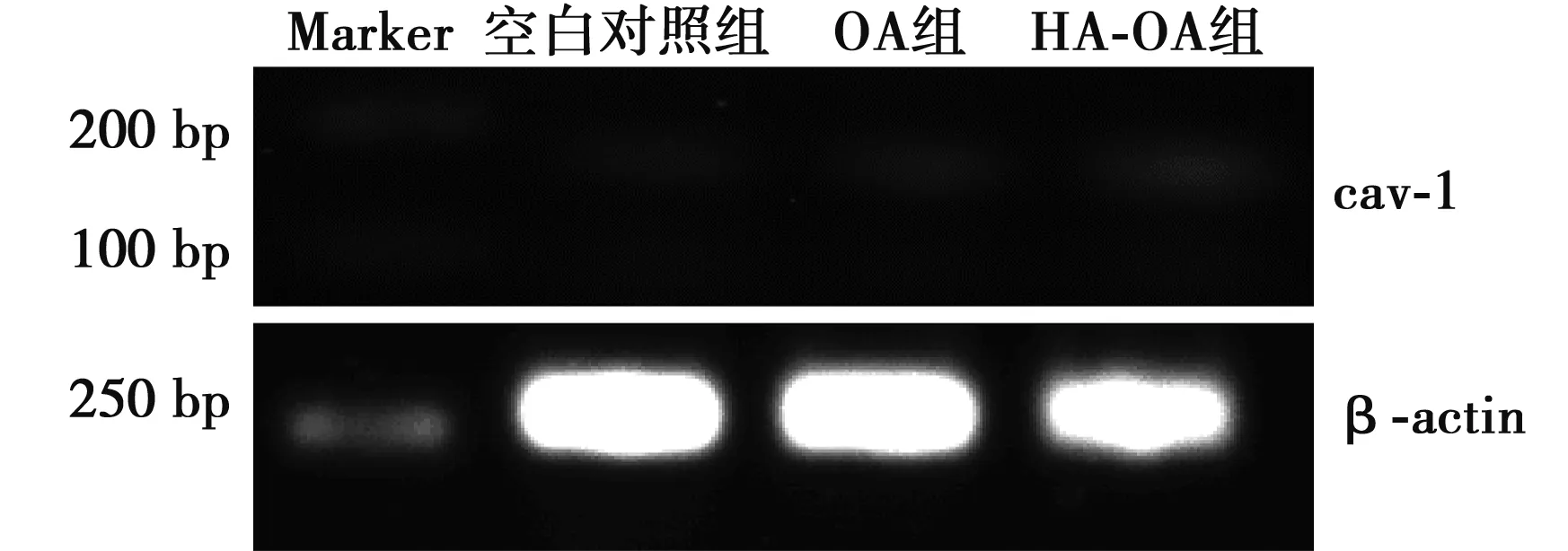
图5 HA-OA对HL-60细胞cav-1 mRNA表达的影响
3 讨 论
肿瘤靶向治疗已经成为临床肿瘤治疗的主要方法之一〔4〕。急性髓系白血病(AML)约占急性白血病的15%~20%〔5〕,HL-60细胞是AML中最常见的一种,OA能够诱导HL-60细胞凋亡,但由于OA为脂溶性,需要DMSO为溶剂溶解,有一定毒性,损害正常细胞。为使药物靶向作用HL-60细胞,利用HL-60细胞表明的跨膜糖蛋白CD44,可与其配体HA结合的特点。HA由美国的两位教授首次在牛眼的玻璃体中所提取〔6〕,作为载体,HA可以加强药物的亲水性,增加药物的稳定性,还可以延长药物在体内的存留时间,提高有效的作用浓度。HA还具有肿瘤的靶向性,这在肿瘤治疗新型给药系统中奠定了基础〔7〕。本实验将HA通过EDAC/NHS修饰后,制备了疏基化HA。将OA经过mPEG-PCL/Mal-PEG-PCL修饰之后,通过超声乳化法,将HA-Cys与OA结合,制备HA-OA靶向给药系统。HA-OA靶向给药系统作用于HL-60细胞,由于巯基化聚合物可以使药物黏附在肠道黏膜的表面,抑制药物与肠道蛋白酶的接触,从而抑制了药物的降解,将巯基化聚合物作为载体,它可以提高黏液层药物浓度,使药物发挥有效作用浓度,从而增强药物的作用〔8〕。目前,cav-1在肿瘤细胞的信号通路中逐渐成为一个新的研究热点,它是信号通路交联的中心,曾被认为是“广谱”激酶抑制剂〔9〕。PI3K/Akt是cav-1下游的一条信号通路,也是蛋白酪氨酸激酶(PTKs)主要信号转导通路之一,cav-1与神经酰胺形成复合物,抑制PI3K/Akt通路,进而诱导细胞凋亡。本结果推测HA-OA通过增加cav-1 mRNA的表达,抑制PI3K/Akt信号通路,减少HL-60细胞的增殖,从而导致HL-60细胞凋亡。
1 Ma W,Wang DD,Li L,etal.Caveolin-1 plays a key role in Oleanolic acid-induced apoptosis of HL-60 cells〔J〕.Oncol Repor,2014;32(1):293-301.
2 马 微,王迪迪,王 昭,等.慢病毒介导的CAV1过表达对HL-60细胞增殖与凋亡的影响〔J〕.中国实验血液学杂志,2013;21(4):905-10.
3 王迪迪,葛堂栋,杨 玉,等.Ly294002对人白血病HL-60细胞的体外抑制作用〔J〕.中国老年学杂志,2013;33(22):5617-9.
4 张会鲜,何琪杨.基于精准医学的抗肿瘤靶向药物敏感性预测及其研发应用〔J〕.中国新药杂志,2015;24(16):1820-4.
5 张之南.血液病学〔M〕.第2版,北京:人民卫生出版社,2005:138-940.
6 王天琪,张 娜.透明质酸在肿瘤治疗中的应用〔J〕.生命的化学,2014;34(5):690-5.
7 邱丽筠,黄丽丽,俞淑文.透明质酸在肿瘤治疗药物新型给药系统中的应用〔J〕.中国实用医药,2014;9(16):238-41.
8 黄爱文,赵佳丽,刘志宏,等.胰岛素巯基化透明质酸纳米粒的制备与体外性质评价〔J〕.中国生化药物杂志,2014;35(34):77-80.
9 Yan SL,Huang CY,Wu ST,etal.Oleanolic acid and ursolic acid induce apoptosis in four human liver cancer cell lines〔J〕.Toxicol In Vitro,2010;24(3):842-8.
〔2016-07-05修回〕
(编辑 袁左鸣)
国家自然科学基金面上项目(81274101;81070428);佳木斯大学校级交叉学科研究项目(jc2014-001);佳木斯大学创新团队(cxtd-2016-03);佳木斯大学研究生科技创新重点项目(LZZ2015-008;LZZ2015-009);国家级大学生创新创业训练计划项目(201410222006,201510222002,201610222007)
于 莲(1960-),女,教授,硕士生导师,主要从事药物靶向治疗研究。 张鹏霞(1967-),女,教授,博士生导师,主要从事白血病发病机制与靶向治疗研究。
侯正平(1989-),男,在读硕士,主要从事白血病发病机制与靶向治疗研究。
R733.7;R944.1
A
1005-9202(2016)22-5510-03;
10.3969/j.issn.1005-9202.2016.22.007
1 佳木斯大学药学院 2 佳木斯大学临床医学卓越医师班学生
3 佳木斯大学康复医学院2014级本科生
4 佳木斯大学临床医学院

