红树莓不同溶剂提取物抗氧化活性
宁玮钰,冯建文,吕长山,王金玲,*,旷 慧,姚丽敏
(1.东北林业大学 林学院,黑龙江哈尔滨 150040; (2.东北农业大学 应用技术学院,黑龙江哈尔滨 150030)
红树莓不同溶剂提取物抗氧化活性
宁玮钰1,冯建文1,吕长山2,王金玲1,*,旷 慧1,姚丽敏1
(1.东北林业大学 林学院,黑龙江哈尔滨 150040; (2.东北农业大学 应用技术学院,黑龙江哈尔滨 150030)
以红树莓鲜果为原料,采用体外抗氧化方法研究不同溶剂提取对红树莓抗氧化活性的影响。分别以水、25%乙醇、50%乙醇、75%乙醇、100%乙醇、乙酸乙酯、正丁醇为提取溶剂,测定提取物中总酚、黄酮、原花青素和花色苷含量;研究提取物体外抗氧化活性的差异;对活性物质含量与抗氧化能力进行相关性分析。结果表明,50%乙醇粗提物的总酚、黄酮、原花青素和花色苷含量均最高,分别为257.19、10.48、406.45、22.47 mg/100 g;7种不同红树莓提取物中50%乙醇提取物的总还原力与VC相近,50%和75%乙醇提取物对DPPH·清除能力强于VC,7种溶剂提取物对羟基自由基清除能力均弱于VC;红树莓7种溶剂提取物中总酚与对DPPH·的清除率及总还原能力的相关性较大。比较发现,50%~75%的乙醇水溶液能够更好的溶出红树莓中的活性成分,而具有更强的抗氧化活性。
红树莓,不同溶剂,提取物,抗氧化活性
红树莓(RubusideausL.)属蔷薇科浆果,俗称托盘、覆盆子、梅子等,它营养丰富,拥有“黄金水果”的美誉[1]。红树莓果实中具有多种生物活性。肖俊霞等[2]发现以盐酸酸化的80%乙醇提取的红树莓花色苷提取物具有良好的抗氧化活性;李小萍[3]发现经70%丙酮提取的红树莓鞣花酸提取物具有抗氧化活性及抑菌活性;韩加[4]研究发现90%乙醇提取经石油醚脱脂,乙酸乙酯、正丁醇依次萃取的红树莓提取物对自发性高血压大鼠(SHR)有降压作用;Chen等[5]研究发现野生树莓经模拟胃液(猪胃蛋白酶与盐酸混合,pH2)处理后能够抑制诱导型丙烯酰胺对细胞的氧化作用。
对红树莓抗氧化活性成分的研究已有报道,主要针对某一种或几种成分的抗氧化能力,而对总提取物抗氧化活性的研究鲜有报道[6]。本研究采用不同溶剂对红树莓进行提取,分析比较不同溶剂粗提物的抗氧化活性,并研究抗氧化能力与其中所含活性成分的相关性,旨在探明溶剂对红树莓提取物抗氧化能力的影响,为红树莓作为天然抗氧化剂的开发与利用提供参考。
1 材料与方法
1.1 材料与仪器
红树莓(秋福,Autumn Bliss) 采自黑龙江省尚志市,速冻处理后运回东北林业大学食品科学与工程实验室冻藏;没食子酸、芦丁、儿茶素(分析纯) 上海源叶生物科技有限公司;福林-酚试剂、DPPH(1,1-diphenyl-2-picrylhydrazyl radical;1,1-二苯基-2-苦基肼自由基)(分析纯) Sigma公司;无水乙醇、乙酸乙酯、正丁醇、硫酸亚铁、磷酸氢二钠、磷酸二氢钠、三氯化铁、抗坏血酸、甲醇、硝酸铝、铁氰化钾、三氯乙酸、香草醛等 均为分析纯。
RE-52A旋转蒸发仪 上海亚荣生化仪器厂;DHG-9240型电热恒温鼓风干燥箱 上海一恒科技有限公司;ALC-1104电子天平 北京赛多利斯仪器系统有限公司;TDL-5-W台式低速离心机 湖南星科科学仪器有限公司;FA2004电子天平 上海天平仪器厂;722S可见分光光度计 上海精密科学仪器有限公司。
1.2 实验方法
1.2.1 红树莓不同溶剂提取物制备 称取(10.0±0.16) g红树莓样品,分别以水、25%乙醇、50%乙醇、75%乙醇、100%乙醇、乙酸乙酯和正丁醇做提取溶剂,按1∶10(w/v)的料液比提取。
具体提取流程如下:速冻红树莓→室温避光解冻→研磨→不同提取溶剂恒温水浴密封提取4 h(45 ℃)→离心去滤渣(3000 r/min,15 min)→真空旋转浓缩(49 ℃,0.1 MPa)→蒸馏水定容→4 ℃下保藏。
1.2.2 红树莓提取物活性成分含量的测定
1.2.2.1 福林-酚法测定总酚的含量 参考Pantelidis等[7]方法测定。以没食子酸为标准品。以没食子酸标准溶液浓度(mg/mL)为横坐标,溶液吸光值为纵坐标,得到标准曲线为:y=8.3487x+0.0383(R2=0.9971)。总酚含量表示为每100克红树莓果实(鲜重)中总酚的毫克数。
1.2.2.2 硝酸铝比色法测定黄酮的含量 参考Zhang等[8]方法测定。以芦丁为标准品。以芦丁标准溶液浓度(mg/mL)为横坐标,溶液吸光值为纵坐标,得到标准曲线为:y=1.9551x+0.0118(R2=0.9952)。黄酮含量表示为每100克红树莓果实(鲜重)中黄酮的毫克数。
1.2.2.3 香草醛-浓硫酸法测定原花青素的含量 参考薄艳秋[9]方法测定。以儿茶素为标准品。以儿茶素标准溶液浓度(mg/mL)为横坐标,溶液吸光值为纵坐标,得到标准曲线为:y=0.8953x+0.0011(R2=0.9964)。原花青素含量表示为每100克红树莓果实(鲜重)中原花青素的毫克数。
1.2.2.4 pH示差法测定花色苷的含量 参考Verma等[10]方法测定。按照下列公式计算提取液中花色苷含量(以每100克红树莓中矢车菊素-3-葡萄糖苷含量计):
X=ΔTVFM×1000×100/(εbm)
式中:X为红树莓花色苷含量,(mg/100 g);ΔT为吸光值(ApH1-ApH4.5)的差值;V为稀释体积,L;F为稀释倍数;M为矢车菊素-3-葡萄糖苷的相对分子质量(449 g/mol);ε为矢车菊素-3-葡萄糖苷的摩尔消光系数[29600 L/(mol·cm)];m为样品质量,g;b为比色皿厚度(1 cm)。
1.2.3 红树莓提取物清除DPPH·能力测定 参考Fagerlund等[11]方法,略有改动。配制0.2 mmol/L DPPH乙醇溶液,放在棕色试剂瓶中于4 ℃保存,在试管中加入600 μL的DPPH乙醇溶液及300 μL不同浓度的样品溶液,混合均匀,室温避光放置30 min,于517 nm波长下用无水乙醇调零,并测定吸光值A1;将DPPH乙醇溶液用等体积的无水乙醇代替,其他操作相同,测定吸光值A2;将样品溶液用等体积无水乙醇溶液代替,其他操作相同,测定吸光值A0。清除率用下式计算:
清除率(%)=[1-(A1-A2)/A0]×100
式中:A0为空白的吸光值;A1为试样的吸光值;A2为样品吸光值。
1.2.4 红树莓提取物清除羟基自由基能力测定 参考涂宗财等[12]和姚兴存等[13]方法,略有改动。将1.0 mL的6 mmo1/L FeSO4溶液,1.0 mL的8 mmol/L H2O2溶液,l.0 mL不同浓度的样品溶液,l.0 mL的6 mmol/L水杨酸溶液依次加入试管,反应混合物体系共4.0 mL。混匀后静置30 min,于510 nm波长下用蒸馏水调零,并测定吸光值A1;将水杨酸溶液用等体积的蒸馏水代替,其他操作相同,测定吸光值A2;将样品溶液用等体积蒸馏水代替,其他操作相同,测定吸光值A0。清除率用下式计算:
清除率(%)=[l-(A1-A2)/A0]×100
式中:A0为空白的吸光值;A1为试样的吸光值;A2为样品的吸光值。
1.2.5 红树莓提取物总还原力测定 参考周波等[14]方法,略有改动。在1.0 mL pH6.6的磷酸盐缓冲液中加入1.0 mL不同浓度的样品液,再加入1.0 mL质量浓度为1%的铁氰化钾溶液,混合均匀后,于50 ℃恒温水浴20 min,再加入1.0 mL体积分数10%的三氯乙酸溶液,离心10 min(3000 r/min),取2 mL上层清液加入2 mL蒸馏水和0.4 mL质量浓度为0.1% FeCl3溶液,于700 nm波长下用蒸馏水调零并测定吸光值;吸光值越高,还原能力越强。
1.3 数据处理
2 结果与分析
2.1 不同溶剂对红树莓活性成分提取效果的影响
2.1.1 不同溶剂对总酚提取效果的影响 红树莓不同溶剂提取物中总酚含量的测定结果见图1。
红树莓7种不同溶剂提取物中总酚含量在77.01~257.19 mg/100 g之间。红树莓7种不同溶剂提取物中总酚含量均存在极显著差异(p<0.01),其中50%乙醇提取物总酚含量最高,为257.19±0.84 mg/100 g,是正丁醇提取物多酚含量的3.33倍。对比红树莓不同溶剂提取物中总酚含量发现,根据相似相溶原理,在相同提取条件下乙醇水溶液能够更好的溶解样品中的酚类化合物[15]。由于多酚类化合物种类较多,不同极性溶剂对不同酚类化合物的溶解性不同,因此可能会得到成分和含量均存在差异的提取物。
2.1.2 不同溶剂对黄酮提取效果的影响 红树莓不同溶剂提取物黄酮含量的测定结果见图2。

图2 红树莓不同溶剂提取物的黄酮含量Fig.2 The contents of flavonoids in red raspberry extracts with various solvents
红树莓7种不同溶剂提取物中黄酮含量在3.45~10.48 mg/100 g之间。不同溶剂对黄酮的提取效果具有不同程度的影响。50%乙醇提取物中黄酮含量最高,为(10.48±0.32) mg/100 g,25%乙醇提取物中黄酮含量次之,为(8.09±0.03) mg/100 g。水提物、75%乙醇提取物、100%乙醇提取物和乙酸乙酯提取物中黄酮含量无显著差异(p>0.05)。正丁醇提取物中黄酮含量最低,只有(3.44±0.07) mg/100 g,与50%乙醇提取物中黄酮含量差异极显著(p<0.01),这种差异可能在于黄酮的结构特点,使其更易溶于极性较大溶剂,因此影响了不同样品中黄酮的溶出。
2.1.3 不同溶剂对原花青素提取效果的影响 红树莓不同溶剂提取物原花青素含量的测定结果见图3。

图3 红树莓不同溶剂提取物的原花青素含量Fig.3 The contents of proanthocyanidins in red raspberry extracts with various solvents
红树莓7种不同溶剂提取物中原花青素含量,在202.79~406.45 mg/100 g之间。不同溶剂对原花青素的提取效果具有不同程度的影响。其中,50%乙醇提取物中原花青素含量最高为406.45±16.71 mg/100 g,与25%乙醇提取物中原花青素含量无显著差异(p>0.05)。水提物中原花青素含量相对较高。乙酸乙酯提取物中原花青素含量最低,与其他6种提取物中原花青素含量差异极显著(p<0.01)。对比红树莓7种提取物中原花青素的含量发现,极性较大的溶剂(50%乙醇、25%乙醇、水)中的原花青素含量高于极性较小的溶剂(100%乙醇、正丁醇、乙酸乙酯)。涂宗财等[16]研究不同溶剂红薯叶提取物中的花青素含量发现,丙酮比乙醇对花青素有更好提取效率,而乙酸乙酯提取物中未检测到。
2.1.4 不同溶剂对花色苷提取效果的影响 红树莓不同溶剂提取物花色苷含量的测定结果见图4。

图4 红树莓不同溶剂提取物的花色苷含量Fig.4 The contents of anthocyanins in red raspberry extracts with various solvents
红树莓7种不同溶剂提取物中花色苷含量在10.15~22.47 mg/100 g之间。不同溶剂对花色苷的提取效果具有不同程度的影响。乙酸乙酯提取物中花色苷含量最低,50%乙醇提取物中花色苷含量最高,是乙酸乙酯提取物的2.21倍,差异极显著(p<0.01)。100%、75%乙醇提取物与水提物的花色苷含量无显著差异(p>0.05)。李立[17]研究表明60%乙醇是黑莓果渣活性物质的最佳提取溶剂;李颖畅等[18]研究发现60%乙醇是提取蓝莓中花色苷的最佳溶剂。由此可以看出溶剂极性大小,影响了提取物中花色苷的含量,而50%乙醇水溶液能够更好的溶出红树莓中花色苷。
2.2 提取物抗氧化活性研究
2.2.1 对DPPH·清除能力分析 红树莓不同溶剂提取物对DPPH·清除率测定结果见图5。
表1 红树莓不同溶剂提取物清除DPPH·的IC50值
Table 1 The IC50values of scavenging DPPH· of red raspberry extracts with various solvents

样品IC50(mg/mL)样品IC50(mg/mL)水提物0529±0072100%乙醇提取物0818±003525%乙醇提取物0320±0021乙酸乙酯提取物0976±001050%乙醇提取物0237±0007正丁醇提取物0858±000875%乙醇提取物0277±0007VC0292±0050
表2 红树莓不同溶剂提取物清除羟基自由基的IC50值
Table 2 The IC50values of scavenging OH· radicals of red raspberry extracts with various solvents

样品IC50(mg/mL)样品IC50(mg/mL)水提物1404±0119100%乙醇提取物4079±024825%乙醇提取物2108±0023乙酸乙酯提取物1560±003850%乙醇提取物1668±0091正丁醇提取物1657±067975%乙醇提取物1329±0318VC0606±0050
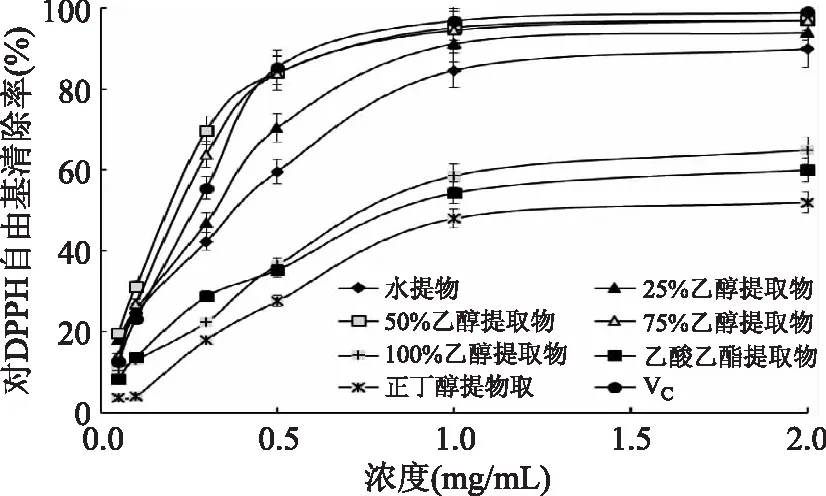
图5 红树莓不同溶剂提取物对DPPH·清除率Fig.5 The scavenging capacities of red raspberry extracts with various solvents against DPPH·
由图5可知,当样品浓度在0.1~1 mg/mL之间时,红树莓不同溶剂提取物清除DPPH·的能力随着浓度的增大而增强;当浓度大于1 mg/mL时,变化趋势平缓。在浓度为0.3 mg/mL时,50%乙醇提取物和75%乙醇提取物对DPPH·的清除率分别为69.89%和63.86%,显著高于其他浓度乙醇提取物和VC,并在浓度大于1 mg/mL时对DPPH·清除率与VC相近。红树莓不同溶剂提取物清除DPPH·的IC50值见表1。
由表1可知,红树莓50%乙醇提取物和75%乙醇提取物对DPPH·清除率的IC50值均小于VC,25%乙醇提取物IC50值与VC接近,表明红树莓不同溶剂提取物都具有较强的清除DPPH·能力。红树莓不同溶剂提取物对DPPH·的清除能力由大到小顺序为:50%乙醇提取物>75%乙醇提取物>25%乙醇提取物>水提取>100%乙醇提取物>正丁醇提取物>乙酸乙酯提取物。
表明红树莓不同溶剂提取物对DPPH·清除能力与提取溶剂的极性相关,不同极性溶剂得到的红树莓提取物的有效成分的含量之间存在差异,溶剂的极性越小,得到的红树莓提取物对DPPH·清除率越低。综合比较发现:乙醇水溶液提取物>水提取>正丁醇提取物>乙酸乙酯提取物。本研究中不同浓度的乙醇水溶液对DPPH·的清除能力不同,但乙醇水溶液提取物对DPPH·的清除能力优于纯有机溶剂提取物。
2.2.2 对羟基自由基清除能力分析 红树莓不同溶剂提取物对羟基自由基清除率测定结果见图6。
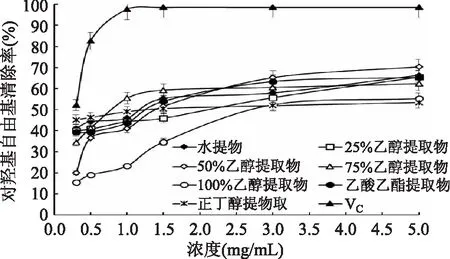
图6 红树莓不同溶剂提取物对羟基自由基的清除率Fig.6 The scavenging capacities of red raspberry extracts with various solvents against OH· radicals
由图6可知,当样品浓度在0.3~3 mg/mL之间时,红树莓不同溶剂提取物清除羟基自由基的能力随着浓度的增大而增强;当浓度为0.3 mg/mL时,25%乙醇提取物、75%乙醇提取物、正丁醇提取物、乙酸乙酯提取物和水提物均已达到较高清除率,但随着浓度增加,清除率增长幅度减弱。韩加等[19]研究发现新疆红树莓果实对羟基自由基在较低浓度时便具有很好的清除率,但浓度过高时清除率不增高,与本研究结果一致。当浓度为3 mg/mL时,除100%乙醇提取物外其他溶剂提取物对羟基自由基的清除率均大于50%,但清除效果弱于VC。当浓度大于3 mg/mL时,清除率变化趋于平缓。红树莓不同溶剂提取物的对羟基自由基的清除能力与其质量浓度呈量效关系。
红树莓不同溶剂提取物清除羟基自由基的IC50值见表2。
由表2可知,红树莓不同溶剂提取物清除羟基自由基的IC50值均大于VC,表明它们清除羟基自由基能力较VC弱。红树莓不同溶剂提取物对羟基自由基的清除能力由大到小顺序为75%乙醇提取物>水提取物>乙酸乙酯提取物>50%乙醇提取物>正丁醇提取物>25%乙醇提取物>100%乙醇提取物。韩加等[19]研究新疆红树莓果实对羟基自由基清除率由大到小的顺序为:乙酸乙酯部位>正丁醇部位>水部位,与本研究结果存在差异。可能由于本研究中乙酸乙酯不是作为萃取溶剂对实验中的粗提物进行萃取。
2.2.3 总还原能力分析 红树莓不同溶剂提取物总还原力测定结果见图7。
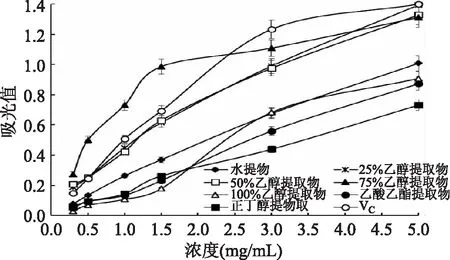
图7 红树莓不同溶剂提取物的总还原能力Fig.7 The total reducing capacities of red raspberry extracts with various solvents
由图7可知,红树莓不同溶剂提取物的总还原能力与样品浓度呈良好的效量关系。当浓度为0.3~2 mg/mL时,75%乙醇提取物总还原能力强于VC,其他6种提取物总还原能力弱于VC。李丽华[20]研究发现苹果皮的60%乙醇提取物还原能力优于水提取物、无水乙醇提取物、乙酸乙酯提取物,与本研究结果相近。可能由于较高浓度的乙醇水溶液更好地溶出的活性成分,具有更好的还原能力。
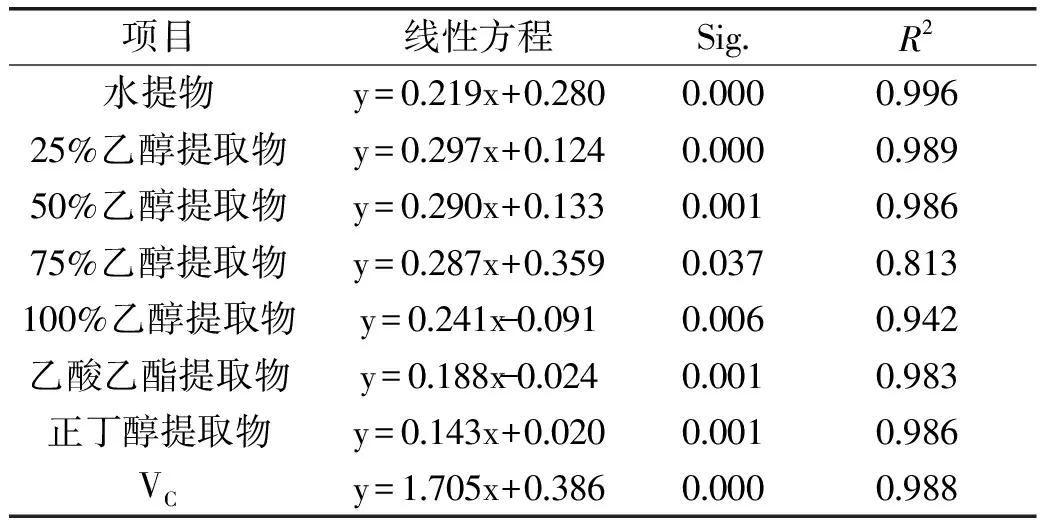
对红树莓不同溶剂提取物的总还原力曲线进行线性模拟回归处理,得出线性模拟方程及相关系数见表3。
表3 红树莓不同溶剂提取物的总还原能力分析
Table 3 The analysis of the total reducing capacity of red raspberry extracts with various solvents
项目线性方程SigR2水提物y=0219x+02800000099625%乙醇提取物y=0297x+01240000098950%乙醇提取物y=0290x+01330001098675%乙醇提取物y=0287x+035900370813100%乙醇提取物y=0241x-009100060942乙酸乙酯提取物y=0188x-002400010983正丁醇提取物y=0143x+002000010986VCy=1705x+038600000988
注:y:吸光值,x:样液浓度(mg/mL)。Sig.:回归关系的显著性系数,Sig.≤0.05,说明回归关系具有统计学意义。
表4 红树莓不同溶剂提取物的抗氧化活性与活性成分含量的相关性分析
Table 4 The correlation analysis between the antioxidant activities and the contents of active ingredients in red raspberry extracts with various solvents

项目总酚黄酮原花青素花色苷总还原力对羟基自由基IC50值对DPPH·IC50值总酚-0804∗∗0761∗∗0865∗∗0831∗∗0187-0889∗∗黄酮--0813∗∗0462∗0549∗∗0190-0508∗原花青素---0879∗∗0605∗∗0054-0740∗∗花色苷----0476∗0184-0831∗∗总还原力------0414∗-0305对羟基自由基IC50值------0247对DPPH·IC50值-------
注:**表示在0.01水平上极显著相关,*表示在0.05水平上显著相关。
由表3可知,除75%乙醇提取物外,其他提取物样液的质量浓度与总还原能力呈较好线性关系,水提物样液的质量浓度与总还原能力的线性关系最好。
2.3 活性成分含量与抗氧化能力的相关性分析
对提取物抗氧化活性与活性成分含量进行相关性分析,结果见表4。
由表4可知,本研究中红树莓不同溶剂提取物中总酚与黄酮、原花青素和花色苷呈极显著相关(r=0.804,p<0.01;r=0.761,p<0.01;r=0.865,p<0.01)。黄酮与原花青素呈极显著相关,与花色苷呈显著相关。原花青素与花色苷相关性最大,呈极显著相关(r=0.879,p<0.01)。
红树莓不同溶剂提取物的总还原能力与总酚、黄酮和原花青素极显著相关,这与刘文旭等[21]研究结果一致,与花色苷显著相关;DPPH·的清除能力与总酚、原花青素和花色苷呈极显著相关(r=-0.889,p<0.01,r=-0.740,p<0.01,r=-0.831,p<0.01),与黄酮显著相关(r=-0.508,p<0.05)。王睿婷等[22]和王友升等[23]研究发现,红树莓果对DPPH·的清除率与多酚和黄酮显著相关,与花色苷的相关性较小,这与本研究结果不完全一致;Golmohamadi等[24]研究发现红树莓果中花色苷含量越高,其对DPPH·的清除率越高,两者相关性显著,与本研究结果一致。由表4还可发现,红树莓不同溶剂提取物中总酚与黄酮、原花青素和花色苷与对羟基自由基清除能力不相关。但总还原力与对羟基自由基清除能力呈显著相关(r=-0.414,p<0.05)。比较分析发现,红树莓不同溶剂提取物中活性成分含量与总还原能力、对DPPH·清除能力均具有相关性,与对羟基自由基清除率不相关。这可能是由于不同溶剂提取物中各活性成分的含量也存在差异,而复杂的活性成分之间的相互协同或拮抗作用影响了提取物不同的抗氧化能力,或者不同的提取溶剂对活性成分溶出情况的不同,间接影响了提取物的抗氧化能力。
综合分析,红树莓不同溶剂提取物抗氧化活性与总酚、原花青素含量相关性较大,Maksimovic等[25]发现,秋福果实的抗氧化活性与总酚含量相关性极显著(R2=0.9999,p<0.01),与原花青素含量的相关性也极显著(R2=0.9939,p<0.01)。
3 结论
7种提取溶剂对红树莓提取物中各活性成分含量均有差异,50%乙醇提取物中各活性成分含量均为最高。而乙酸乙酯和正丁醇提取物中活性成分含量相对较低。说明乙醇水溶液能够更好的溶出红树莓中的活性成分。
红树莓7种不同溶剂提取物均具有一定抗氧化能力,且与质量浓度在一定范围内呈量效关系。75%乙醇提取物和50%乙醇提取物的抗氧化活性较强,而100%乙醇提取物和乙酸乙酯提取物的抗氧化活性相对较弱。相关性分析结果表明,红树莓提取物的抗氧化活性与总酚、原花青素具有较大相关性。由此推断,50%~75%的乙醇水溶液能够更好的溶出红树莓中的活性成分,提高活性成分含量,从而影响提取物的抗氧化活性,红树莓提取物的抗氧化活性与酚类活性物质有较大相关性,但不同溶剂提取物中活性成分的具体组成还需要进一步研究。
[1]张成涛,万国盛,赵余庆,等.红树莓果实中鞣花酸和树莓酮的含量测定[J].中国实验方剂学杂志,2013,19(19):140-143.
[2]肖军霞,黄国清,仇宏伟.红树莓花色苷的提取及抗氧化活性研究[J].食品科学,2011,32(8):15-18.
[3]李小萍,梁琪,辛秀兰,等.红树莓果中鞣花酸提取物的抗氧化性研究[J].食品科技,2010,35(5):182-185.
[4]韩加.新疆红树莓果实提取物降低SHR大鼠血压及改善氧化应激作用的可能机制研究[D].乌鲁木齐:新疆医科大学.2011.23-27.
[5]Chen W,Su H M,Xu Y,et al. Protective effect of wild raspberry(RubushirsutusThunb.)extract against acrylamide-induced oxidative damage is potentiated after simulated gastrointestinal digestion[J]. Food Chemistry,2016,196(3):943-952.
[6]高玉李,辛秀兰.树莓功能性成分及提取方法的研究进展[J].食品工业科技,2011,32(07):451-454.
[7]Pantelidis G E,Vasilakakis M,Manganaris G A,et al. Antioxidant capacity,phenol,anthocyanin and ascorbic acidcontents in raspberries,blackberries,red currants,gooseberries and Cornelian cherries[J]. Food Chemistry,2016,102(3):777-783.
[8]Zhang G,He L,Hu M. Optimized ultrasonic-assisted extraction of flavonoids from Prunella vnlgaris L. and evaluation ofantioxidant activitiesinvitro[J]. Innovative Food Science and Emerging Technologies,2011,12(1):18-25.
[9]薄艳秋.蓝莓花青素的提取和抗氧化活性研究[D].哈尔滨:东北农业大学,2012:16-17.
[10]Verma P R,Deshpande S A,Kamtham Y N,et al. Hypolipidemic and antihyperlipidemic effects from an aqueous extract of Pachyptera hymenaea(DC.)leaves in rats[J]. Food Chemistry,2012,132(3):1251-1257.
[11]Fagerlund A,Sunnerheim K,Dimbe g L H. Radical scavenging and antioxidant activity of avenanthramide[J]. Food Chemistry,2009,113(2):550-556.
[12]涂宗财,寇玉,王辉,等.荷叶多糖的超声波辅助提取和抗氧化活性[J].食品科学,2013,34(16):108-112.
[13]姚兴存,舒留泉,盘赛昆,等.条斑紫菜蛋白提取与抗氧化活性[J].食品科学,2012,33(20):113-118.
[14]周波,王晓红,陈丽丽,等.玉米紫色植株色素体外抗氧化活性实验研究[J].现代食品科技,2007,23(4):23-25.
[15]陆建,樊伟,孔维宝,等.大麦总多酚不同溶剂提取物对DPPH自由基清除能力的影响[J].食品与生物技术学报,2008,27(1):57-61.
[16]涂宗财,傅志丰,王辉,等.红薯叶不同溶剂提取物抗氧化性及活性成分鉴定[J].食品科学,2015,36(17):1-6.
[17]李立. 黑莓果渣提取物抗氧化活性评价及提取工艺研究[D].兰州:兰州大学,2011:23-25.
[18]李颖畅.蓝莓花色苷提取纯化及生理功能研究[D].沈阳:沈阳农业大学,2008:21-23.
[19]韩加,海力茜,陈培培,等.新疆红树莓果实不同有效部位提取及其抗氧化活性测定[J].卫生研究,2009,38(5):596-598.
[20]李利华.苹果皮不同溶剂提取物抗氧化活性研究[J].现代食品科技,2012,28(11):1470-1473.
[21]刘文旭,黄午阳,曾晓雄,等.草莓、黑莓、蓝莓中多酚类物质及其抗氧化活性研究[J].食品科学,2011,32(23):130-133.
[22]王睿婷,王鑫,张富敏,等.树莓的抗氧化活性与主要化成分的相关分析[J].沈阳药科大学学报,2013,30(11):901-904.
[23]王友升,谷组臣,张帆.不同品种和成熟度树莓和黑莓果实的氧化和抗氧化活性比较[J].食品科学,2012,33(9):81-86.
[24]GolmohamadiL A,Moller G,Powers J,et al. Effect of ultrasound frequency on antioxidant activity,total phenolic andanthocyanin content of red raspberry puree[J]. Ultrasonics Sonochemistry,2013,20(5):1316-1323.
[25]Maksimovic J D,Milivojevic J M,Poledica M M,et al. Profiling antioxidant activity of two primocane fruiting red raspberry cultivars(Autumn bliss and Polka)[J]. Journal of Food Composition and Analysis,2013,31(2):173-179.
Antioxidant activity of different solvents extracts from red raspberry
NING Wei-yu1,FENG Jian-wen1,LV Chang-shan2,WANG Jin-ling1,*,KUANG Hui1,YAO Li-min1
(1.School of Forestry,Northeast Forestry University,Harbin 150040,China; 2.Applied Technique College,Northeast Agricultural University,Harbin 150030,China)
Theantioxidantcapacitiesofsevendifferentextractionsofredraspberry,whichwereextractedwithdistilledwater,25%ethanol,50%ethanol,75%ethanol,100%ethanol,ethylacetateandn-butylalcohol,respectively,werecomparedusingantioxidantdeterminingmethodsin vitro.Resultsshowedthatthehighestcontentsoftotalphenols,flavonoids,proanthocyanidinsandanthocyaninsweredeterminedin50%ethanolextracts,whichwererespectivelyupto257.19,10.48,406.45mg/100gand22.47mg/100g.Thetotalreducingcapacitiesof50%ethanolextractsapproachedtoVc’s.Exceptfor50%and75%ethanolextracts,theothersheldweakercapacityofscavengingDPPH·thanthatofVc’sandnoneheldstrongercapacityofscavengingOH·thanthatofVc’s.Theanalysispointedthatinextractionsfromredraspberry,therewererelativelysignificantcorrelationsbetweenthetotalphenolsandthecapacitiesofscavengingDPPH·andthetotalreducingcapacities,respectively.Conclusively,50%~75%ethanol-aqueoussolventofredraspberryextractsheldstrongerantioxidantactivity.
redraspberry;varioussolvents;extracts;antioxidantactivities
2016-04-05
宁玮钰(1988-),女,硕士研究生,研究方向:植物源活性物质研究,E-mail:ningweiyu2010@163.com。
*通讯作者:王金玲(1975-),女,博士,副教授,研究方向:植物源活性物质研究,E-mail:wangjinling08@163.com。
中央高校基本科研业务费专项资金项目(2572014CA14)。
TS255.1
A
1002-0306(2016)19-0117-06
10.13386/j.issn1002-0306.2016.19.014

