基于点击化学反应的半乳糖糖基化马蹄金素衍生物的合成及抗HBV活性
袁 洁, 刘青川, 徐广灿, 梁光义, 徐必学
(1. 贵州省中国科学院天然产物化学重点实验室, 贵阳 550002;2. 中国人民解放军第三○二医院, 北京 100039;3. 贵阳中医学院, 贵阳 550002; 4. 新疆医科大学厚博学院, 克拉玛依 834000)
基于点击化学反应的半乳糖糖基化马蹄金素衍生物的合成及抗HBV活性
袁 洁1,4, 刘青川2, 徐广灿1,3, 梁光义1,3, 徐必学1
(1. 贵州省中国科学院天然产物化学重点实验室, 贵阳 550002;2. 中国人民解放军第三○二医院, 北京 100039;3. 贵阳中医学院, 贵阳 550002; 4. 新疆医科大学厚博学院, 克拉玛依 834000)
以D-半乳糖和二缩三乙二醇为原料, 经乙酰化、 糖基化和叠氮化钠取代等反应合成了带叠氮连接臂的半乳糖配基, 通过点击化学反应将其与炔丙基修饰的马蹄金素(MTS)衍生物进行连接, 设计合成了6个具有潜在肝靶向性的半乳糖糖基化MTS衍生物. 通过1H NMR,13C NMR,1H-1H COSY, HMQC, DEPT和ESI-MS对其结构进行了表征; 采用HepG2 2.2.15细胞模型初步评价了目标化合物的抗乙型肝炎病毒(HBV)活性. 结果表明, 所有目标化合物对HBV DNA的复制均有抑制作用, 且具有一定的量效关系; 化合物15f在50 μg/mL浓度下对HepG2 2.2.15细胞株的抑制率为83%, 具有进一步研究的价值.
肝靶向; 半乳糖; 马蹄金素衍生物; 点击化学; 抗HBV活性
乙型肝炎病毒(HBV)感染已呈世界流行趋势, 全球每年约有65万人死于HBV感染所引起的肝衰竭、 肝硬化和肝癌(HCC)[1]. 迄今, 临床上还未有能彻底治愈乙型肝炎的有效药物[2]. 因此, 寻求新型的抗HBV药物对于乙型肝炎患者的治疗具有重大意义. 本研究组前期对从贵州民族药马蹄金中分离得到的马蹄金素[MTS, 图1(A)]进行结构修饰, 设计合成了系列抗HBV活性较好的马蹄金素衍生物[3~6]. 其中1个MTS衍生物(研发代号Y101)已进入Ⅰ期临床试验(药品名: 替芬泰, 英文名: Tyrophentide). 该化合物的药代动力学实验结果显示, 其在组织中分布广泛, 但在肝脏中的分布浓度不太高. 因此, 为使该类化合物能高效聚集于肝脏组织, 降低全身性毒副作用, 本文对MTS衍生物进行肝靶向设计与合成.
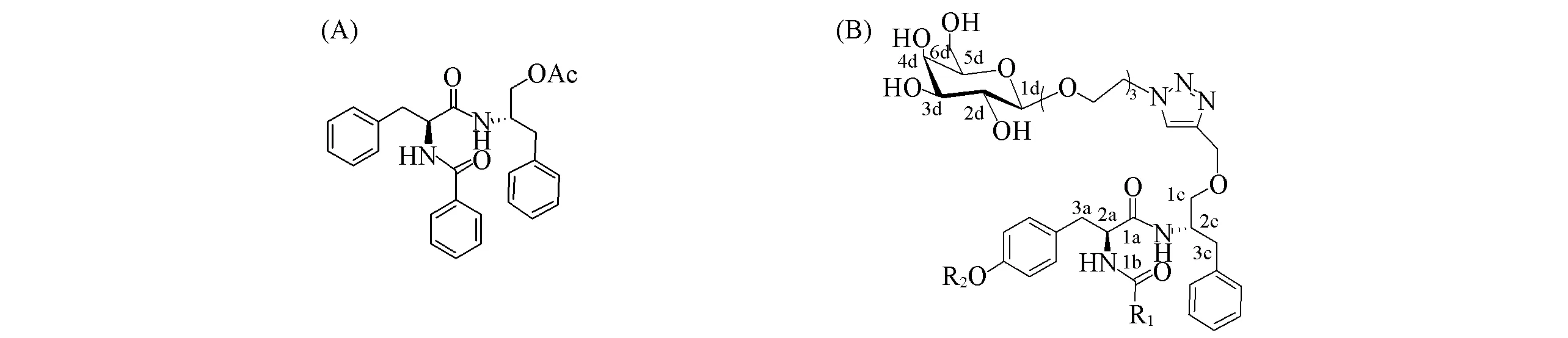
Fig.1 Chemical structure of MTS(A) and general stucture of hepatic targeting MTS derivatives(B)
去唾液酸糖蛋白受体(ASGP-R)[7]介导的肝靶向药物已成为研究热点之一,D-半乳糖或N-乙酰-D-氨基半乳糖修饰后的药物对HepG2细胞具有专属性识别功能[8~11]. 前文[12]设计合成了系列具有肝靶向潜力的直接半乳糖糖基化MTS衍生物, 并用HepG2 2.2.15细胞模型初步评价了该类衍生物的抗HBV活性. 结果表明, 该类化合物对体外HBV DNA复制的抑制效果不显著, 这可能是由于空间位阻使半乳糖基与ASGP-R受体的结合力变弱所致. 基于此, 本文通过连接臂使MTS衍生物与D-半乳糖基相连, 改变糖基与MTS衍生物的空间结构, 期望能够提高该类衍生物的抗HBV活性. 连接臂的长度将会影响糖基与受体的亲和力, Ernst等[13]发现连接臂与半乳糖基之间的距离为1.4~2 nm时, 半乳糖基与ASGP-R受体的结合能力最强. 二缩三乙二醇、 三缩四乙二醇等[14~16]被广泛应用于间接糖基化药物设计. 而1,2,3-三氮唑类化合物具有良好的抗癌[17]、 抗菌[18]、 抗病毒[19]及抗高血糖[20]等生物活性且对人体细胞毒性较小, 简便高效的Cu(Ⅰ)催化的叠氮与炔的点击化学反应使1,2,3-三氮唑常被用作药物合成中重要的链接单元[21~23]. 基于此, 本文以经叠氮化的二缩三乙二醇为连接臂, 通过点击化学反应合成了6个含1,2,3-三氮唑结构的肝靶向MTS衍生物[经Chemdraw软件计算得连接臂与半乳糖之间的距离为1.49 nm, 如图1(B)所示], 期望能够获得具有深入研究价值的化合物.
1 实验部分
1.1 试剂与仪器
对甲基苯磺酰氯(TsCl, 纯度99%)、 三氟乙酸(TFA, 纯度99.9%)、 四丁基碘化铵(TBAI, 纯度99.9%)和二碳酸二叔丁酯[(Boc)2O, 纯度99%]均购自百灵威科技有限公司; 氯甲酸异丁酯(IBCF, 纯度98%)和N,N-二异丙基乙基胺(DIPEA, 纯度99%)购自阿法埃莎中国化学有限公司;N-甲基吗啡啉(NMM, 纯度99%)购自上海迈瑞尔化学技术有限公司;N,N-二甲基甲酰胺(DMF, 分析纯, 加分子筛干燥24 h后待用)和二氯甲烷(分析纯, 加氢化钙回流4 h后蒸馏待用)购自上海国药集团化学试剂有限公司.
Inova 400 MHz型超导核磁共振仪(美国Varian公司)和WNMR-Ⅰ 500 MHz型超导核磁共振仪(中国科学院武汉物理与数学研究所, 以DMSO-d6, CDCl3或者CD3OD为溶剂, TMS为内标); HP-5793型质谱仪或HP1100 LC-MS型液相色谱-质联用仪(美国Hewlett-Packard公司); 柱色谱硅胶(300~400目)及高效薄层板均为青岛海洋化工厂产品.
1.2 实验过程
目标化合物15a~15f的合成路线如Scheme 1所示.

Scheme 1 Synthetic routes of target compounds 15a—15f
1.2.1 糖供体1,2,3,4,6-五-O-乙酰基-β-D-吡喃半乳糖(1)的合成 参照文献[15]方法制备糖供体1, 得白色固体, 收率43%, m. p. 142~144 ℃(文献值[15]: 143~144 ℃).
1.2.2 中间体3~5的合成 参照文献[17]方法制备化合物3~5.
1.2.3 中间体O-炔丙基-L-苯丙氨醇8的合成 取L-苯丙氨醇(1.80 g, 11.9 mmol)置于反应瓶中, 用5 mL DMF和10 mL H2O溶解, 再加入二碳酸二叔丁酯(3.29 mL, 14.3 mmol), 室温下搅拌反应至析出大量白色固体, 停止搅拌, 室温下继续放置2 h. 将反应液分散到乙酸乙酯和水中, 萃取, 所得有机层以无水硫酸镁干燥, 减压蒸馏溶剂至干, 干燥. 向所得粗品中加入50 mL DMF溶解, 用冰水浴冷却至0 ℃, 在氩气保护下缓慢加入1.2 mL炔丙基溴(质量分数80%), 再迅速加入氢化钠(质量分数60%, 1.15 g), 继续搅拌反应50 min至TLC检测反应完毕. 将反应液分散到乙酸乙酯和水中, 萃取, 所得有机层依次用饱和碳酸氢钠和水洗涤, 无水硫酸镁干燥, 减压蒸馏溶剂至干, 得到中间体7.
将中间体7溶于10 mL二氯甲烷中, 用冰水浴冷却至0 ℃, 在氩气保护下缓慢加入10 mL三氟乙酸, 继续搅拌反应30 min至TLC检测反应完毕. 将反应液分散到乙酸乙酯/冰饱和碳酸钠混合物中, 萃取, 所得有机层以水洗涤, 无水硫酸镁干燥, 减压蒸馏溶剂至干, 所得残留物经硅胶柱层析纯化, 得0.83 g化合物8.
1.2.4 中间体11a~11c, 12a~12c和13a~13f的合成 参照文献[5,6]方法制备化合物11a~11c, 12a~12c和13a~13f, 其中化合物11a~11c未经柱层析纯化直接用于下一步反应.
1.2.5 中间体14a~14f的合成 向100 mL单口烧瓶中加入中间体5(138 mg, 0.28 mmol), 13a~13f(0.22 mmol), 5.4 mL DMF和0.6 mL水, 待反应物完全溶解, 再依次加入L-抗坏血酸钠(18 mg, 0.09 mmol)、 碘化亚铜(17 mg, 0.09 mmol)和N,N-二异丙基乙基胺(48 μL, 0.28 mmol), 室温下搅拌反应2.5 h至TLC检测反应完毕. 将反应液分散到乙酸乙酯和水中, 萃取, 所得有机层依次以盐酸、 饱和碳酸氢钠和饱和食盐水(浓度均为0.1 mol/L)洗涤, 经无水硫酸镁干燥, 减压蒸馏溶剂至干, 所得残留物经硅胶柱层析分离纯化后得中间体14a~14f.
所有中间体的理化性质、 质谱及核磁共振数据分别列于表1~表3. 中间体 12a~12c, 13a~13f 和 14a~14f的核磁共振谱图见图S1~S30(见本文支持信息).

Table 1 Appearance, yields, melting points, specific rotation and ESI-MS data for all intermediates*
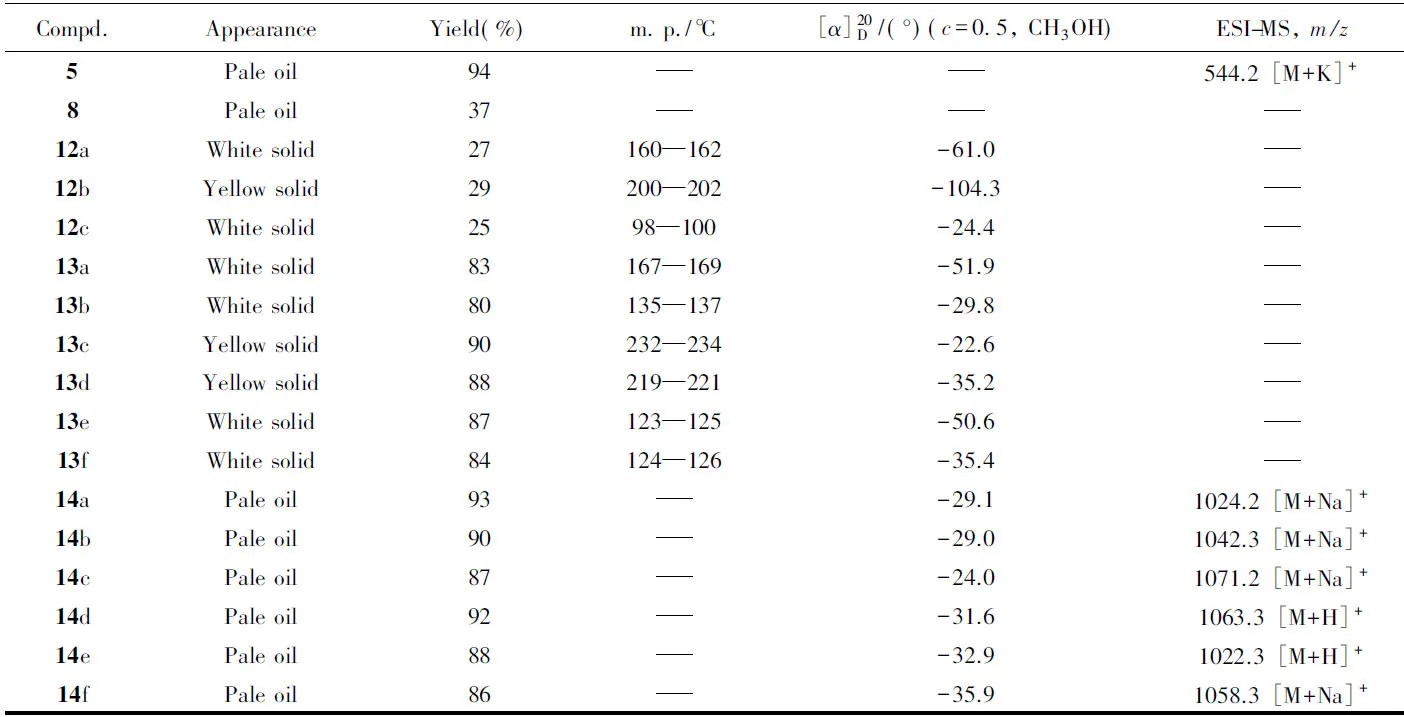
Continued
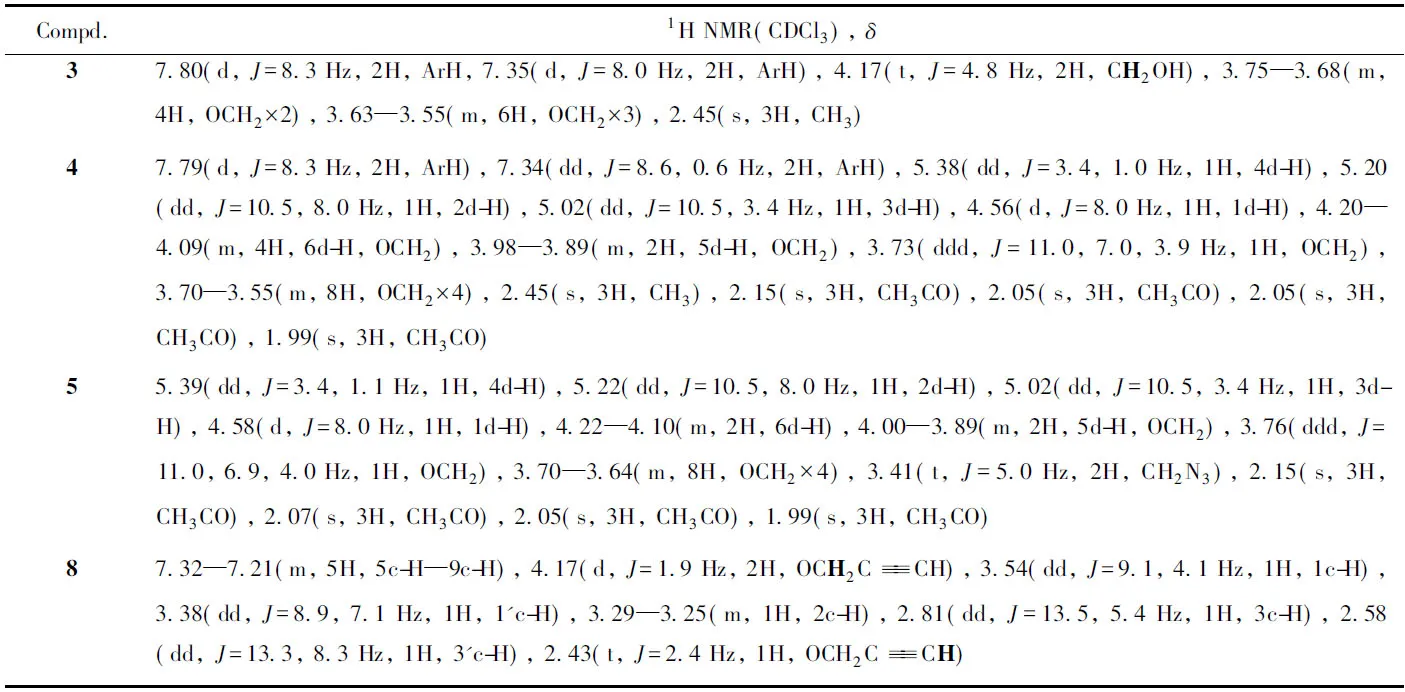
Table 2 1H NMR data for intermediates 3—5 and 8*
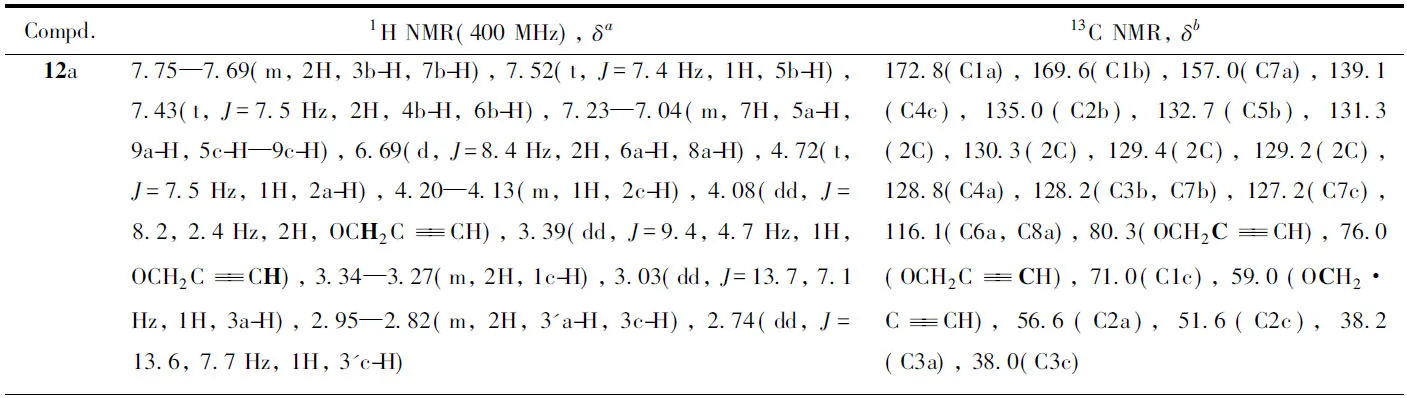
Table 3 1H NMR and 13C NMR data for intermediates 12a—12c,13a—13f and 14a—14f

Continued

Continued

Continued

Continued
1.2.6 目标化合物15a~15f的合成 取中间体14a~14f(0.18 mmol)置于反应瓶中, 加入4 mL甲醇和1 mL二氯甲烷溶解, 缓慢加入甲醇钠(0.88 mL, 0.41 mol/L, 0.36 mmol), 室温下搅拌30 min后, 加入阳离子交换树脂中和, 调节pH至5~6, 过滤, 将浓缩滤液至干, 所得残留物经硅胶柱层析纯化后得目标化合物15a~15f.
目标化合物15a~15f的理化性质、 质谱及核磁共振数据分别列于表4和表5, 核磁共振谱图见图S31~S42(见本文支持信息).
1.3 药物对HBV DNA抑制实验
参照文献[12]方法测试了目标化合物15a~15f对HepG2 2.2.15细胞HBV DNA复制的抑制率.
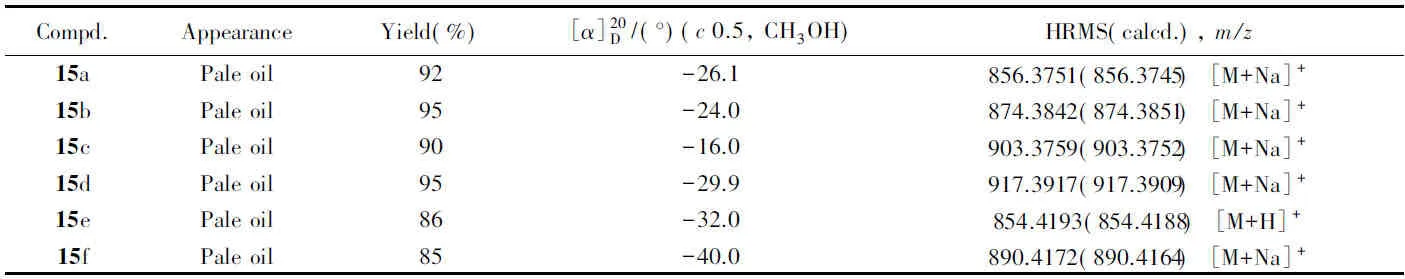
Table 4 Appearance, yields, specific rotation and HRMS data for target compounds 15a—15f

Table 5 1H NMR and 13C NMR data for target compounds 15a—15f*

Continued
结果表明, 在50 μg/mL的浓度下, 目标化合物15a~15f的抑制率分别为44.07%, 32.52%, 63.53%, 72.55%, 55.66%和83.06%. 其中化合物15d和15f在25 μg/mL的浓度下仍具有较好的活性, 其抑制率分别为56.37%和57.61%.
2 结果与讨论
2.1 化合物的合成
以二缩三乙二醇和D-半乳糖为原料, 经乙酰化、 糖基化及叠氮化钠取代等反应合成关键中间体5. 以L-苯丙氨醇为原料, 用二碳酸二叔丁酯[(Boc)2O]选择性保护氨基, 再对其醇羟基进行炔丙基化得到中间体7, 中间体7在三氟乙酸存在下脱Boc保护, 得重要中间体8; 同时以L-苯丙氨醇、L-酪氨酸甲酯盐酸盐和一系列苯甲酸衍生物为原料经缩合、 水解反应合成中间体11a~11c; 中间体11a~11c和8经缩合、 烷基化反应即得炔丙基修饰的MTS衍生物13a~13f. 将13a~13f分别与中间体5进行Cu(Ⅰ)催化的点击化学反应得中间体14a~14f, 最后在甲醇钠作用下对其进行脱乙酰基保护即得目标化合物15a~15f. 所有目标化合物结构均经1H NMR,13C NMR,1H-1H COSY, HMQC, DEPT和ESI-MS确认, 核磁共振谱图见图S31~S42, DEPT谱图见图S43~S48(见本文支持信息). 实验中尝试了2条路线合成中间体5. 合成路线Ⅰ(见Scheme 2)的反应步骤虽短, 但中间体5与原料极性无差异, 不利于反应监测, 2步反应总收率为46%; 而合成路线Ⅱ(见Scheme 3)虽然以3步反应得中间体5, 但增大了产物与原料的极性差异, 且49%的总收率略高于合成路线Ⅰ, 故选择合成路线Ⅱ合成中间体5.
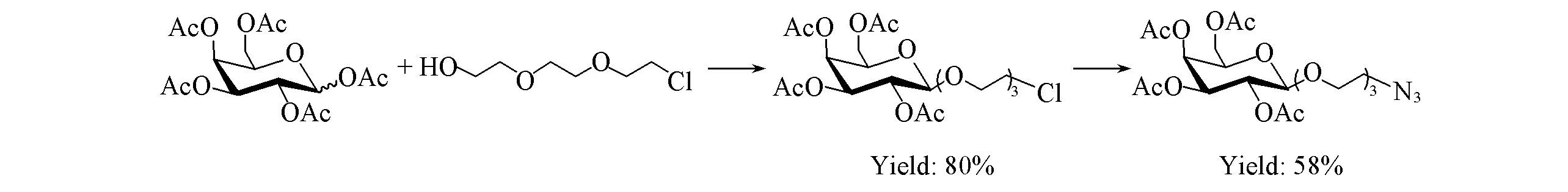
Scheme 2 Synthetic route Ⅰ for intermediate 5
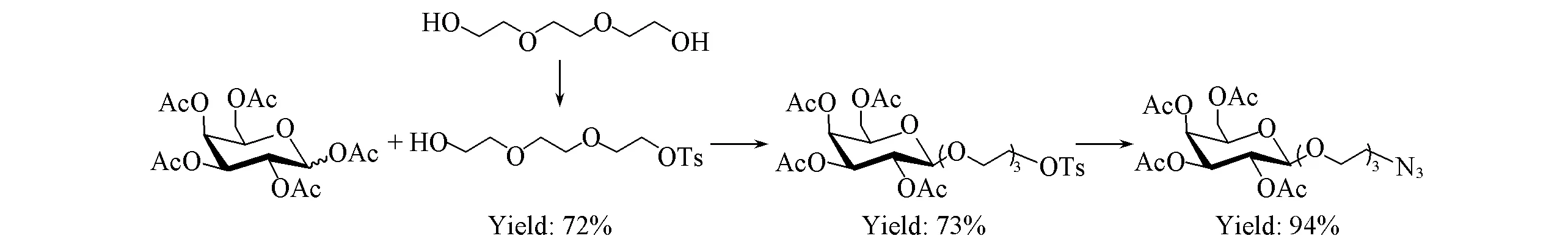
Scheme 3 Synthetic route Ⅱ for intermediate 5
在合成中间体12a~12c时, 曾尝试多种反应条件对MTS衍生物的1c-位醇羟基进行炔丙基化, 包括NaH/DMF,(CH3)3COK/DMF, Ag2CO3/DMF等, 但是均未成功. 因此, 本文采用Scheme 1所示的合成路线, 先对Boc保护的苯丙氨醇进行炔丙基化, 而后脱保护基得含游离氨基的中间体8, 多步反应一锅法完成, 总收率37%, 再将其与中间体11a~11c缩合即可. 在进行点击化学反应时, 用Cu(Ⅰ)作催化剂, 以较高收率(>85%)得到三唑环连接的半乳糖苷MTS衍生物, 反应条件温和、 操作简便. 之后的脱乙酰基反应采用了室温下以甲醇钠催化的策略, 此法反应快速且没有副产物; 然后用强酸性阳离子交换树脂中和pH, 避免使用常规无机酸中和而引入无机盐, 简便高效.
2.2 化合物氧苷键构型的确证
在糖基化过程中, 利用全乙酰半乳糖2-位羟基上乙酰基的邻基参与效应, 可立体特异性地生成β-型糖苷键,1H NMR谱中化合物4半乳糖基C1—H与C2—H的偶合常数为8.0 Hz, 可判断糖苷键的构型为β构型, 通过目标化合物半乳糖基的C1的C13化学位移和氢谱中端基质子C1—H与C2—H的偶合常数可再次确认目标化合物中糖苷键的构型均为β构型[24].
2.3 生物活性
对化合物15a~15f的抗HBV活性测试结果表明, 在所测试的浓度范围内, 所有目标化合物对HepG2 2.2.15细胞内HBV DNA的复制均有抑制作用. 化合物15f在50 μg/mL浓度下对HepG2 2 2.2.15细胞株的抑制率为83%, 具有进一步研究的价值.
3 结 论
以叠氮化的二缩三乙二醇为连接臂, 全乙酰化半乳糖为糖给体, 以L-苯丙氨醇、L-酪氨酸甲酯盐酸盐、 苯甲酸及其衍生物等为原料, 经缩合、 水解、 烷基化、 糖基化、 环加成及脱乙酰基等反应步骤, 设计合成了6个具有肝靶向潜力的马蹄金素(MTS)衍生物, 确认了所得目标化合物的结构, 并测试了其抗乙型肝炎病毒(HBV)活性. 结果表明, 所有目标化合物对HepG2 2.2.15细胞的HBV DNA的复制均有抑制作用, 并具有一定的量效关系, 且较前期设计合成的直接半乳糖糖基化MTS衍生物对体外HBV DNA的抑制率有所提高. 此结果为下一步设计更多新类型的具有肝靶向潜力的MTS衍生物, 并选择抗HBV活性较好的衍生物进行其体内活性测试及肝靶向性研究奠定了基础.
支持信息见http://www.cjcu.jlu.edu.cn/CN/10.7503/cjcu20160098.
所有核磁数据由贵州省中国科学院天然产物化学重点实验室张建新研究员测试、 提供, 在此表示衷心的感谢.
[1] Lozano R., Naghavi M., Foreman K., Lim S., Shibuya K. J., Aboyans V.,Lancet, 2012, 380(9859), 2095—2128
[2] Goulis I., Karatapanis S., Akriviadis E., Deutsch M., Dalekos G. N., Raptopoulou-Gigi M., Mimidis K., Germanidis G., Drakoulis C., Triantos C., Zintzaras E., Bakalos G., Papatheodoridis G.,LiverInt., 2015, 35(5), 1540—1548
[3] Liang G. P., Hu Z. X., Liu Q. C., Huang Z. M., Zhang J. X., Liang G. Y., Xu B. X.,Chem.J.ChineseUniversities, 2014, 35(11), 2353—2359(梁光平, 胡占兴, 刘青川, 黄正明, 张建新, 梁光义, 徐必学. 高等学校化学学报, 2014, 35(11), 2353—2359)
[4] Qiu J. Y., Xu B. X., Huang Z. M., Pan W. D., Cao P. X., Liu C. X., Hao X. J., Song B. A., Liang G. Y.,Bioorg.Med.Chem., 2011, 19(18), 5352—5360
[5] Qiu J. Y., Huang Z. M., Pan W. D., Cao P. X., Liang G. Y.,J.Chin.Pharm.Univ., 2012, 43(5), 390—394(邱净英, 黄正明, 潘卫东, 曹佩雪, 梁光义. 中国药科大学学报, 2012, 43(5), 390—394)
[6] Liang G. P., Cao P. X., Yang X. X., Huang Z. M., Liu Q. C., Liang G. Y., Xu B. X.,Chin.J.Org.Chem., 2014, 34(5), 973—979(梁光平, 曹佩雪, 杨秀虾, 黄正明, 刘青川, 梁光义, 徐必学. 有机化学, 2014, 34(5), 973—979)
[7] Spiess M.,Biochem., 1990, 29(43), 10009—10018
[8] Ding J. X., Xiao C. S., Li Y., Cheng Y. L., Wang N. N., He C. L., Zhuang X. L., Zhu X. J., Chen X. S.,J.Control.Release, 2013, 169(3), 193—203
[9] Wang Y. Q., Su J., Cai W. W., Lu P., Yuan L. F., Jin T., Chen S. Y., Sheng J.,Drug.Des.Devel.Ther., 2013, 7(3), 211—221
[10] Naicker K., Ariatti M., Singh M.,ColloidsSurfacesB:Biointerfaces, 2014, 122, 482—490
[11] Tao Y. F., He J. L., Zhang M. Z., Hao Y., Liu J., Ni P. H.,Polym.Chem., 2014, 5(10), 3443—3452
[12] Yuan J., Liu Q. C., Xu G. C., Hu Z. X., Liang G. P., Huang Z. M., Liu C. X., Liang G. Y., Xu B. X.,Chin.J.Org.Chem., 2015, 35(10), 2176—2183(袁洁, 刘青川, 徐广灿, 胡占兴, 梁光平, 黄正明, 刘昌孝, 梁光义, 徐必学. 有机化学, 2015, 35(10), 2176—2183)
[13] Khorev O., Stokmaier D., Schwardt O., Cutting B., Ernst B.,Bioorg.Med.Chem., 2008, 16(9), 5216—5231
[14] LaBell R. Y., Jacobsen N. E., Gervay-Hague J., O’Brian D. F.,BioconjugateChem., 2002, 13(1), 143—149
[15] Percec V., Leowanawat P., Sun H. J., Kulikov O., Nusbaum C. D., Tran T. M., Bertin A., Wilson D. A., Peterca M., Zhang S. D., Kamat N. P., Vargo K., Moock D., Johnston E. D., Hammer D. A., Pochan D. J., Chen Y. X., Chabre Y. M., Shiao T. C., Bergeron-Blerk M., André S., Roy R., Gabius H. J., Heiney P. A.,J.Am.Chem.Soc., 2013, 135(24), 9055—9077
[16] Zhang S. D., Moussodia R. O., Sun H. J., Leowanawat P., Muncan A., Nusbaum C. D., Chelling K. M., Heiney P. A., Klein M. L., André S., Roy R., Gabius H. J., Percec V.,Angew.Chem.Int.Ed., 2014, 53(41), 10899—10903
[17] Zhao J., Xuan L. N., Zhao H. C., Cheng J., Fu X. Y., Jing F. M.,Chem.Res.ChineseUniversities, 2014, 30(5), 764—769
[18] LiY. D., Mao W. T., Fan Z. J., Fang Z., Ji X. T., Zong G. N., Li F. Y.,Chem.Res.ChineseUniversities, 2014, 30(3), 390—395
[19] Salameh B. A., Cumpstey I., Sundin A., Leffler H., Nilsson U. J.,Bioorg.Med.Chem., 2010, 18(14), 5367—5378
[20] Zhang S. S., Wan J., Li X. M., Li C. L., Xu L. Z.,Chem.Res.ChineseUniversities, 2007, 23(1), 120—124
[21] Johansson J. R., Lincoln P., Nordén B., Kann N.,J.Org.Chem. 2011, 76(7), 2355—2359
[22] Mishra K. B., Tiwari V. K.,J.Org.Chem., 2014, 79(12), 5752—5762
[23] Li L. F., Chang K. C., Zhou Y. M., Shieh B., Ponder J., Abraham A. D., Ali H., Snow A., Mark Petrash J., LaBarbera D. V.,J.Med.Chem., 2014, 57(1), 71—77
[24] Cai M. S., Li Z. J.,CarbohydrateChemistry:Fundamentals,Reactions,Synthesis,IsolationandStructure, Chemical Industry Press, Beijing, 2006, 370—373(蔡孟深, 李中军. 糖化学—基础、 反应、 合成、 分离及结构, 北京: 化学工业出版社, 2006, 370—373)
(Ed.: P, H, N, K)
Synthesis and Anti-HBV Activity Evaluation of the Galactopyranosyl Derivatives of MTS Based on Click Reaction†
† Supported by the National Natural Science Foundation of China(No.81360472) and the Western Light Talent Culture Project, China(2014).
YUAN Jie1,4, LIU Qingchuan2, XU Guangcan1,3, LIANG Guangyi1,3*, XU Bixue1*
(1.TheKeyLaboratoryofChemistryforNaturalProductsofGuizhouProvinceandChineseAcademyofSciences,Guiyang550002,China; 2. 302HospitalofPLA,Beijing100039,China;3.GuiyangCollegeofTraditionalChineseMedicine,Guiyang550002,China;4.CollegeofHoubo,XinjiangMedicalUniversity,Klamayi834000,China)
Matijin-Su [N-(N-benzoyl-L-phenylalanyl)-O-acetyl-L-phenylalanol, MTS], a dipeptide derivative, was isolated from a Chinese ethnic drug Matijin(DichondrarepensForst.) which has been widely used in the treatment of chronic liver disease as folk medicine in China. A series of MTS derivatives with anti-hepatitis B virus(HBV) activitiy was synthesized by structural modification of MTS. One of MTS derivatives named “Tyrophentide” had been finished pre-clinical research and has been approved to do clinical study of phase Ⅰ by China Food and Drug Administration(CFDA). The preliminary pharmacokinetic experiments showed that it was widely distributed in many organs, and the concentration in liver was low. To improve the concentration in liver lesion tissue and increase the anti-HBV activity of MTS derivatives, a series of hepatic targeting galactopyranosyl derivatives of MTS 15a—15f was designed according to asialoglycoprotein receptor(ASGP-R) mediation and synthesized. Starting from unexpensive and commercially available galactose and triethylene glycol, the glycosyl donor with azide linker was achievedviaacetylation, glycosylation and azidation reaction. At the same time, propargylated MTS derivatives usingL-phenylalaninol,L-tyrosine methyl ester hydrochloride, benzoic acid and its derivatives as the starting materials were prepared by acylation, hydrolysis, alkylation, condensation reactions and so on. Then compounds 15a—15f with a 1,2,3-triazole unit were obtained from “click” chemistry reaction using copper(Ⅰ) catalyst in high yield(over 85%), which were deacetylated in the 0.41 mol/L solution of sodium methoxide to give target compounds. The structures of target compounds were confirmed by1H NMR,13C NMR,1H-1H COSY, HMQC, DEPT and ESI-MS. The anti-HBV activities of target compounds were evaluated in HepG2 2.2.15 cells. The screening results showed that all target compounds had inhibitory effect on HBV DNA replication in HepG2 2.2.15 cells. Compound 15f showed inhibition rate anti-HBV activity of 83% at 50 μg/mL and could be worthy of further research.
Hepatic targeting; Galactose; Derivatives of Matijin-Su; “Click” chemistry; Anti-hepatitis B virus activity
国家自然科学基金(批准号: 81360472)和“西部之光”人才项目(2014年)资助.
10.7503/cjcu20160098
O629
A
联系人简介: 梁光义, 男, 教授, 博士生导师, 主要从事天然产物化学方面的研究. E-mail: guangyi_liang@126.com
徐必学, 男, 博士, 副研究员, 主要从事药物化学方面的研究. E-mail: bixue_xu@126.com

