沼泽型水牛VASA基因启动子的克隆及转录活性检测
段安琴,庞春英,朱 鹏,邓廷贤,陆杏蓉,陈明棠,杨炳壮,梁贤威
(中国农业科学院 广西水牛研究所 广西水牛遗传繁育重点实验室,广西 南宁 530001)
沼泽型水牛VASA基因启动子的克隆及转录活性检测
段安琴,庞春英,朱 鹏,邓廷贤,陆杏蓉,陈明棠,杨炳壮,梁贤威
(中国农业科学院 广西水牛研究所 广西水牛遗传繁育重点实验室,广西 南宁 530001)
【目的】 克隆沼泽型水牛VASA基因5′侧翼序列,对启动子进行生物信息学分析及转录活性检测,为后续水牛繁殖性能的分子机理研究奠定基础。【方法】 根据GenBank已公布的河流型水牛(Bubalusbubalis)的VASA5′ 侧翼序列,经过同源比对,设计PCR引物。以沼泽型水牛血液基因组为模板扩增VASA基因5′ 侧翼序列并进行测序和生物信息学分析。将扩增的VASA基因5′ 侧翼片段插入pEGFP-1多克隆位点处,构建pVASA-EGFP-1载体。载体经脂质体转染HEK-293T和CHO细胞系,分析其转录活性。【结果】 成功克隆沼泽型水牛VASA5′侧翼序列及部分CDS区序列,共3 081 bp,同源性分析表明,沼泽型水牛VASA基因5′侧翼序列与河流型水牛、黄牛、绵羊、山羊、小鼠和人的相似性分别为99%,96%,93%,95%,90%和79%。对其5′侧翼序列2 000 bp进行启动子预测及转录因子结合位点预测,发现在其翻译起始位点上游-635--586处存在TATA box,启动子区存在Nobox、Stat1、Stat3、Stat4、Stat5a、Stat5b、Stat6、Gata3、Smad2、Smad3和Smad4等反式作用因子结合位点,其中Stat家族基因在VASA启动子区存在多个结合位点,且同一位点又存在多个Stats基因结合的情况。水牛VASA启动子能启动EGFP在HEK-293T细胞中的表达,但非常微弱;能启动EGFP在CHO细胞中表达,且启动活性与CMV启动子相似。【结论】 成功克隆了沼泽型水牛VASA基因启动子,分析了其启动子序列特征并成功验证其组织特异性和转录活性。
沼泽型水牛;VASA基因;生物信息学分析;转录活性
水牛具有适应性强、耐高温高湿、耐粗饲、抗病力强、使用年限长、静默发情、繁殖力低和产奶量低等生物学特点,非常适合于我国南方地区养殖[1-2]。近年来,随着生活水平的提高,人们对水牛肉和水牛奶的需求日益增加,但是水牛繁殖力低严重制约了该产业的发展,而造成这一现状的主要原因是水牛性成熟晚,属季节性发情动物,产后卵巢长时间不活动,发情症状不明显,怀孕率低,各地调查的繁殖率为30%~60%。通过超数排卵结合活体采卵技术(ovum pick up,OPU)每个水牛卵巢可以获得2~25 枚卵母细胞[3-4],而黄牛平均获得的卵母细胞则高达(30.84±0.88) 枚[5]。因此,亟待应用动物生物技术尤其是基因改良技术开发利用水牛这一庞大的畜种资源,提高其繁殖力及生产性能,但是当前关于水牛繁殖分子机制的研究较少[6-10]。VASA(又称DDX4)编码依赖ATP的RNA解旋酶,属于DEAD-box RNA蛋白家族,是调控生殖系统发育的重要因子[11]。在大多数动物中,VASA基因仅在生殖细胞系中特异性表达,已成为公认的原始生殖细胞(Primordial germ cells,PGCs)和生殖细胞的理想分子标记物,广泛用于研究生殖细胞的产生、迁移和分化途径[12]。鉴于此,本研究克隆了沼泽型水牛VASA基因5′端侧翼序列,对其序列特征进行生物信息学分析,并构建pVASA-EGFP-1真核表达载体,转染HEK-293T细胞和CHO细胞,分析VASA启动子的表达特异性。
1 材料与方法
1.1 材 料
1.1.1 试验动物、细胞及载体 试验用沼泽型水牛选自中国农业科学院广西水牛研究所水牛养殖基地。试验所用pEGFP-1载体、HEK-293T细胞和CHO细胞,均为中国农业科学院广西水牛研究所保存。
1.1.2 主要试剂及仪器 血液基因组提取试剂盒TIANamp Marine Animals DNA Kit、琼脂糖凝胶DNA回收试剂盒、质粒提取试剂盒和大肠杆菌DH5α感受态细胞,均购自天根生化科技有限公司;去内毒质粒提取试剂盒,购自OMEGA公司;LATaq酶、AgeⅠ和BglⅡ限制性内切酶、pMD18-T Vector,均购自大连TaKaRa公司;T4连接酶,购自Fermentas公司;DMEM高糖基础液体培养基、胎牛血清(FBS)、胰酶和脂质体转染试剂盒(Lipofectamine 3000, Invitrogen)等,均购自Life公司。其他试剂无特殊说明均购自Sigma公司。
倒置荧光显微镜(Nikon),0.22 μm过滤器(Millipore)。
1.2 试验方法
1.2.1 引物的设计与合成 以GenBank中河流型水牛VASA基因序列(GenBank登录号:NW 005785580.1)为参考,进行同源比对,根据In-Fusion引物设计特点,应用Oligo 6.0软件针对VASA的同源保守区域设计1对引物:VASA-F,5′-TACCGGACTCAGATCTGCTAGCCTAAACCG-TGCTTGTCTTTTTTTCAC-3′;VASA-R,5′-CA-TGGTGGCGACCGGTTGCTAATAATATTATA-CCC-3′。VASA-F和VASA-R 5′端下划线处为In-Fusion引物同源区域。引物预期扩增VASA基因5′ 端侧翼序列长度为3 081 bp,由上海生工生物工程有限公司合成。
1.2.2 水牛血液基因组的提取及5′ 端侧翼序列PCR扩增 严格按照血液基因组提取试剂盒TIANamp Marine Animals DNA Kit操作说明书提取水牛基因组。PCR反应体系20 μL:模板1 μL,上、下游引物(均20 μmol/L)各1 μL,PrimeSTAR Max Premix(2×) 10 μL,ddH2O补至20 μL。PCR反应条件为:98 ℃预变性3 min;98 ℃变性10 s,55 ℃退火15 s,72 ℃延伸15 s,35个循环;72 ℃延伸7 min,4 ℃终止反应。PCR产物用1%琼脂糖凝胶电泳检测后胶回收并进行TA克隆,送至上海生工生物工程有限公司进行测序鉴定。
1.2.3 pVASA-EGFP-1真核表达载体的构建 应用AgeⅠ和BglⅡ双酶切骨架载体pEGFP-1,酶切体系及方法严格按照酶的使用说明书进行,酶切3 h后进行1%琼脂糖凝胶电泳检测,按胶回收试剂盒说明书进行胶回收。应用In-Fusion技术构建pVASA-EGFP-1真核表达载体,In-Fusion连接体系:5×In-Fusion HD Enzyme Premix 2 μL,PCR胶回收产物 6 μL,线性化骨架载体 2 μL。反应条件为:50 ℃、15 min后4 ℃保存。连接产物转化至大肠杆菌DH5α感受态细胞,挑取克隆,37 ℃摇菌16 h扩增质粒,通过OMEGA去内毒质粒提取试剂盒提取质粒。重组质粒经1%琼脂糖凝胶电泳鉴定后,阳性质粒送至上海生工生物工程有限公司进行测序鉴定。
1.2.4 生物信息学分析 应用NCBI数据BLAST程序(http://blast.ncbi.nlm.nih.gov/Blast.cgi)对沼泽型水牛VASA测序结果进行同源序列比对;应用MEGA5.0软件进行进化树构建;应用Promoter软件(http://www.fruitfly.org/seq_tools/promoter.html) 和Softberry软件(http://linux1.softberry.com/berry.phtml?topic=fprom&group=programs&subgroup=promoter)进行启动子预测;用Gpminer软件(http://gpminer.mbc.nctu.edu.tw/index.php) 进行启动子、转录因子预测;用Jaspar软件(http://jaspar.genereg.net/cgi-bin/jaspar_db.pl?rm=browse&db=core&tax_group=vertebrates) 进行转录因子预测;用Methprimer软件(http://www.urogene.org/cgi-bin/methprimer/methprimer.cgi) 进行CpG岛预测。
1.2.5 pVASA-EGFP-1真核表达载体转录活性的检测 HEK-293T和CHO细胞系用含体积分数10%胎牛血清(FBS)的DMEM培养液,于37 ℃、体积分数5% CO2、饱和湿度培养箱培养,隔天传代。按照Lipofectamine 3000脂质体转染试剂盒的操作说明书,将阳性对照载体pEGFP-N1、阴性对照载体pEGFP-1及所构建的pVASA-EGFP-1载体分别转染HEK-293T和CHO细胞系,48 h后置于倒置荧光显微镜下检测EGFP的表达情况。
2 结果与分析
2.1 沼泽型水牛VASA5′端侧翼序列的克隆
以沼泽型水牛血液基因组为模板,应用设计的特异性引物进行扩增,获得了3 081 bp的特异性条带(图 1),与预期结果一致。
2.2 pVASA-EGFP-1真核表达载体的鉴定
通过In-Fusion技术构建了pVASA-EGFP-1真核表达载体,获得7 229 bp阳性重组质粒(图2),进行测序分析,获得沼泽型水牛VASA基因5′侧翼序列。将测序结果与河流型水牛进行比对,基因相似性为99%,表明重组质粒所克隆的基因为沼泽型水牛VASA基因5′侧翼序列。

1.λ-Hind Ⅲ digest DNA Marker;2.样品PCR VASA扩增产物 PCR product
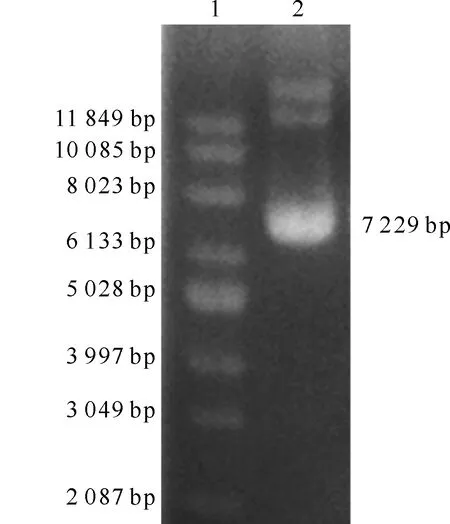
1.Supercoiled DNA Ladder;2.pVASA-EGFP-1
2.3 沼泽型水牛VASA基因5′侧翼序列分析
应用NCBI的BLAST软件相似性比对分析显示,沼泽型水牛VASA基因5′侧翼序列与河流型水牛、黄牛、绵羊、山羊、小鼠和人的相似性分别为99%,96%,93%,95%,90%和79%,表明VASA基因在不同哺乳动物中具有较高的序列保守性。选取部分沼泽型水牛VASA基因5′侧翼序列与黄牛、小鼠、绵羊、山羊和人进行多重序列比较,结果(图3)表明,沼泽型水牛VASA基因序列与黄牛具有较高的相似性,与人的该序列差别较大。
2.4 沼泽型水牛VASA基因5′侧翼序列系统进化分析
应用MEGA5.0软件,用NJ法构建系统进化树,结果见图4。由图4可知,沼泽型水牛与河流型水牛的相应序列聚为一支,与黄牛的遗传距离相对较近,进化树的形态与分类学保持了较高的一致性,进一步说明克隆的为水牛VASA基因5′侧翼序列。

图 3 沼泽型水牛与其他物种VASA基因5′侧翼序列的多重比对

图 4 沼泽型水牛与其他物种VASA基因5′侧翼序列的系统进化树
2.5 沼泽型水牛VASA基因启动子和转录因子的生物信息分析
Promoter和Softberry在线网站预测结果均显示,在翻译起始位点上游-635--586区域存在启动子特征序列,序列为TCAAAGAAACTAAAT-AAACCCCACGGGAAATGTCGTACCCAGTTT-TGAAG,其中序列CTAAATAAACCCCAC为TA-TA box元件,应用Jaspar和Gpminer软件进一步分析发现,启动子特征序列附近存在TBP(-625--611)、SP1(-694--632)、CEBPA (-825--805,-554--544)和USF1 (-825--805)等顺式作用元件位点,分别结合TATA box、GC box、CAAT box和E box等反式作用因子(图5);此外在沼泽型水牛VASA基因5′侧翼序列2 000 bp内,也存在Nobox、Stat1、Stat3、Stat4、Stat5a、Stat5b、Stat6、Smad2、Smad3、Smad4和Gata3等反式作用因子结合位点,其中Stat家族基因在VASA基因启动子区存在多个结合位点,且VASA同一位点处存在多个Stat家族基因结合的情况(图5)。Methprimer对VASA基因5′侧翼序列预测发现,在其翻译起始位点上游1 163-1 456存在CpG岛(图6)。

图 5 沼泽型水牛VASA启动子区转录因子结合位点分布图
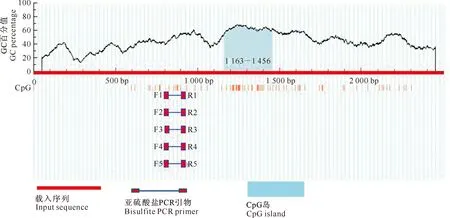
图 6 沼泽型水牛VASA启动子区CpG岛的预测
2.6 pVASA-EGFP-1真核表达载体转录活性的检测
将阳性对照载体pEGFP-N1、阴性对照载体pEGFP-1及所构建的pVASA-EGFP-1载体分别转染HEK-293T和CHO细胞系,结果见图7。
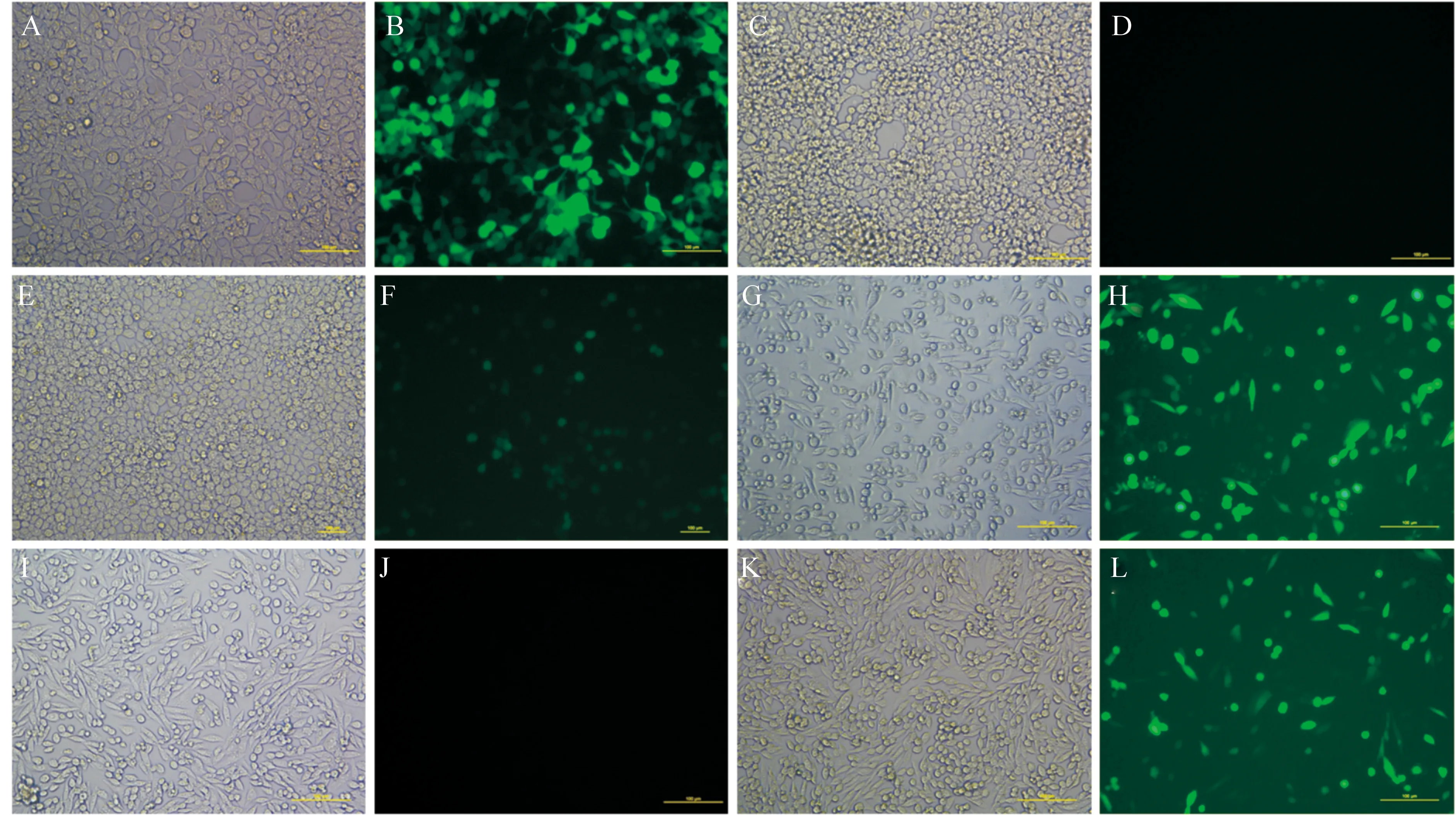
A、B.pEGFP-N1转染HEK-293T细胞;C、D.pEGFP-1转染HEK-293T细胞;E、F.pVASA-EGFP-1转染HEK-293T细胞;G、H.pEGFP-N1转染CHO细胞;I、J.pEGFP-1转染CHO细胞;K、L.pVASA-EGFP-1转染CHO细胞;A、C、E、G、I、K.明场;B、D、F、H、J、L.荧光
由图7可以看出,阳性对照载体pEGFP-N1在HEK-293T和CHO细胞系中均表达EGFP蛋白,且在HEK-293T中的荧光信号显著强于CHO细胞系(图 7-B、H);阴性对照载体pEGFP-1在HEK-293T和CHO细胞系中均无EGFP蛋白表达(图 7-D、J);所构建的载体pVASA-EGFP-1在HEK-293T细胞系中表达EGFP蛋白,但很微弱,在CHO细胞系中也表达EGFP蛋白,其表达强度与pEGFP-N1相似,即载体pVASA-EGFP-1的启动子强度与载体pEGFP-N1的CMV启动子相似 (图 7-F、L)。
3 讨 论
VASA是公认的生殖标记物,对生殖系统发育具有重要的调节功能。通过将果蝇的VASA敲除,发现其具有正向调节生殖细胞发育和维持的功能[13-14]。小鼠VASA从原始生殖脊时期到减数分裂后期持续表达,且雄雌皆如此[15]。 雌性VASA敲除小鼠在生殖方面表现正常;而雄性VASA敲除小鼠由于精母细胞在减少分裂Ⅰ期中细线期到偶线期过渡时受阻,致使不育[16]。然而将雌性果蝇VASA突变,将会影响卵子的发生,导致雌性果蝇不孕及胚胎发育时期不能形成生殖细胞[14]。由此可见,VASA在不同物种间对生殖细胞的作用有所差异。本研究构建了pVASA-EGFP-1表达载体,为后续研究VASA启动子绿色荧光蛋白基因在水牛生殖细胞中的特异性表达奠定了基础,促进了VASA基因对水牛生殖细胞作用机制的研究。
本研究通过生物信息学分析发现,VASA在哺乳动物中具有高度的保守性。在水牛VASA启动子区内的核心启动子区,其中一处为-544至-825区域,此区域存在TBP、SP1、CEBPA和USF1等结合位点,此外还存在Gata3、SMADs、STATs等反式作用因子结合位点,且存在Stat3,4,5a,5b和Stat6同时结合的位点,暗示STATs可能通过形成二聚体的形式调控VASA的表达。通过构建pVASA-EGFP-1表达载体并将其转染HEK-293T和CHO细胞发现,VASA5′侧翼序列能够启动绿色荧光蛋白表达于CHO细胞中,但不能启动其表达于HEK-293T细胞中,表明所克隆获得的沼泽型水牛VASA5′侧翼序列具有组织表达特异性。
成功克隆了沼泽型水牛VASA5′侧翼区域,并验证了其转录活性。但对其转录调节机制仍不明确,需通过构架启动子区不同缺失片段的荧光素酶报告载体或序列突变来验证预测调控元件的真实性,以及对其核心区域的SNPs、甲基化状态和乙酰化水平展开进一步研究。
4 结 论
成功克隆获得沼泽型水牛VASA5′侧翼序列及部分CDS区,共3 081 bp,同源性分析等表明,其与河流型水牛和黄牛的序列相似性较高。通过生物信息学分析发现了可能对沼泽型水牛VASA转录调控的潜在顺式作用元件。通过构建pVASA-EGFP-1表达载体转染HEK-293T和CHO细胞,验证了其转录活性和组织特异性。
[1] Nandi S,Raghu H M,Ravindranatha B M,et al.Production of buffalo (Bubalusbubalis) embryosinvitro:premises and promises [J].Reprod Domest Anim,2002,37(2):65-74.
[2] Zicarelli L,Esposito L,Campanile G,et al.Effects of using vasectomized bulls in artificial insemination practice on the reproductive efficiency of Italian buffalo cows [J].Anim Reprod Sci,1997,47(3):171-180.
[3] Manjunatha B M,Ravindra J P,Gupta P S,et al.Oocyte recovery by ovum pick up and embryo production in river buffaloes (Bubalusbubalis) [J].Reprod Domest Anim,2008,43(4):477-480.
[4] Di Francesco S,Novoa M V,Vecchio D,et al.Ovum pick-up andinvitroembryo production (OPU-IVEP) in Mediterranean Italian buffalo performed in different seasons [J].Theriogenology,2012,77(1):148-154.
[5] Pontes J H,Melo Sterza F A,Basso A C,et al.Ovum pick up,invitroembryo production,and pregnancy rates from a large-scale commercial program using Nelore cattle (Bosindicus) donors [J].Theriogenology,2011,75(9):1640-1646.
[6] 崔奎青,刘庆友,李秀林,等.基于线粒体控制区变异的水牛群体遗传分析 [J].华南农业大学学报,2013(1):76-82.
Cui K Q,Liu Q Y,Li X L,et al.Phylogenetic analysis of water buffalo based on the polymorphism of mitochondrial D-loop [J].Journal of South China Agricultural University,2013(1):76-82.
[7] 崔奎青,张会娜,刘 帅,等.沼泽型水牛NANOG基因5′调控序列克隆与功能分析 [J].畜牧兽医学报,2013,44(3):387-394.
Cui K Q,Zhang H N,Liu S,et al.Cloning and function analysis of swamp buffaloNANOGgene 5′ regulatory region [J].Acta Veterinaria et Zootechnica Sinica,2013,44(3):387-394.
[8] 邓彦飞,刘真真,李云芳,等.不同逆转录载体系统应用于水牛胎儿成纤维细胞转基因的探索 [J].华南农业大学学报,2013(4):558-563.
Deng Y F,Liu Z Z,Li Y F,et al.Infection of buffalo fetal fibroblasts by two retrovirus systems [J].Journal of South China Agricultural University,2013(4):558-563.
[9] 龚 云,乔树叶,林 浪,等.水牛YY1基因克隆及其shRNA片段的筛选 [J].畜牧兽医学报,2014,45(1):62-68.
Gong Y,Qiao S Y,Lin L,et al.Cloning of buffaloYY1 gene and screening its shRNA fragments [J].Acta Veterinaria et Zootechnica Sinica,2014,45(1):62-68.
[10] 苏 节,刘庆友,朱 鹏,等.沼泽型水牛CYP19A1基因克隆、序列分析及组织表达研究 [J].畜牧兽医学报,2013,44(4):514-521.
Su J,Liu Q Y,Zhu P,et al.Cloning and sequence analysis of swamp buffalo CYP19A1 gene and determination of its expression pattern in different tissues [J].Acta Veterinaria et Zootechnica Sinica,2013,44(4):514-521.
[11] Hay B,Jan L Y,Jan Y N.A protein component of Drosophila polar granules is encoded by Vasa and has extensive sequence similarity to ATP-dependent helicases [J].Cell,1988,55(4):577-587.
[12] Park E S,Tilly J L.Use of DEAD-box polypeptide-4 (Ddx4) gene promoter-driven fluorescent reporter mice to identify mitotically active germ cells in post-natal mouse ovaries [J].Mol Hum Reprod,2015,21(1):58-65.
[13] Lasko P F,Ashburner M.The product of the Drosophila gene Vasa is very similar to eukaryotic initiation factor-4A [J].Nature,1988,335(6191):611-617.
[14] Johnstone O,Lasko P.Interaction with eIF5B is essential for Vasa function during development [J].Development,2004,131(17):4167-4178.
[15] Noce T,Okamoto-Ito S,Tsunekawa N.Vasa homolog genes in mammalian germ cell development [J].Cell Struct Funct,2001,26(3):131-136.
[16] Tanaka S S,Toyooka Y,Akasu R,et al.The mouse homolog of Drosophila Vasa is required for the development of male germ cells [J].Genes & Development,2000,14(7):841-853.
Cloning and transcriptional activity ofVASAgene promoter of swamp buffalo
DUAN Anqin,PANG Chunying,ZHU Peng,DENG Tingxian,LU Xingrong,CHEN Mingtang,YANG Bingzhuang,LIANG Xianwei
(GuangxiBuffaloResearchInstitute,ChineseAcademyofAgriculturalScience,GuangxiKeyLaboratoryofBuffaloGenetics,BreedingandReproduction,Nanning,Guangxi530001,China)
【Objective】 Cloning and bioinformatics analyses ofVASA5′flanking sequence were conducted to lay foundation for investigating molecular regulatory mechanism of swamp buffalo reproduction.【Method】 PCR primers ofVASA5′flanking were designed according to the homologous sequence inBubalusbubalispublished in GenBank.TheVASA5′flanking fragment was cloned by PCR and then bioinformatics analysis was conducted.This fragment was then inserted into pEGFP-1 reporter vector to construct pVASA-EGFP-1 vector.Transcription activity was analyzed by transfecting the vector into HEK-293T and CHO cell lines.【Result】 The 3 081 bpVASA5′ flanking and partial CDS region of swamp buffalo were successfully cloned and sequenced.The sequence showed high homologous with river type buffalo,cattle,sheep,goat,mouse and human with nucleotide similarities of 99%,96%,93%,95%,90% and 79%,respectively.A TATA box was predicted at the -635――586 from the translation initiation site,and other transcription factor binding sites of Nobox,Stat1,Stat3,Stat4,Stat5a,Stat5b,Stat6,Gata3 and Smad2,Smad3,Smad4.Many potential binding sites of Stat family genes were also found in theVASApromoter region.The promoter ofVASAgene could weakly activate EGFP expression in HEK-293T cells,and activate it in CHO cells lines as strong as promoted by CMV promoter.【Conclusion】 The promoter ofVASAgene was successfully cloned,its sequence features were analyzed and its tissue specificity and transcriptional activity were verified.
swamp buffalo;VASAgene;bio-informatics analysis;transcriptional activity
时间:2016-10-09 10:08
10.13207/j.cnki.jnwafu.2016.11.002
网络出版地址:http://www.cnki.net/kcms/detail/61.1390.S.20161009.1008.004.html
2015-04-30
农业部转基因重点项目(2014ZX08010-012B);广西科技攻关国际交流与合作项目(桂科合14123001-5);广西水牛研究所基本业务费项目(水牛基160206)
段安琴(1988-),女,广西柳州人,实习研究员,硕士,主要从事细胞生物学研究。E-mail:duanaq321@163.com
梁贤威(1962-),男,广西钦州人,研究员,博士,主要从事动物繁殖和营养研究。E-mail:liangbri@126.com
S823.8+3;Q78
A
1671-9387(2016)11-0008-07

