鼠李糖脂生物表面活性剂胶束性质研究❋
闫乐乐, 梁生康, 宋丹丹, 李一鸣, 李雁宾
(1.中国海洋大学化学化工学院,海洋化学理论与工程技术教育部重点实验室,山东 青岛 266100;2.河南省科学院高新技术研究中心,河南 郑州 450002)
鼠李糖脂生物表面活性剂胶束性质研究❋
闫乐乐1, 梁生康1, 宋丹丹2, 李一鸣1, 李雁宾1
(1.中国海洋大学化学化工学院,海洋化学理论与工程技术教育部重点实验室,山东 青岛 266100;2.河南省科学院高新技术研究中心,河南 郑州 450002)
在考察鼠李糖脂生物表面活性剂所形成胶束的临界胶束浓度(CMC)及其表面吸附行为的基础上,研究鼠李糖脂胶束直径随溶液浓度、pH、盐度的变化特征以及重金属Cd2+和Pb2+共存时对其胶束直径的影响。结果表明,鼠李糖脂的CMC为0.13mmol·L-1。由于鼠李糖脂分子具有较大的空间体积,在表面吸附层中占据较大的吸附面积,吸附量较小,在CMC时的表面最大吸附量(Γmax)为2.48×10-6mol·m-2,单个分子占有的最小面积(Amin)较大,达到66.9Å2。在0.2~0.8mmol·L-1的浓度范围内,鼠李糖脂形成尺寸较大的囊泡状胶束,其胶束直径分布在50~300nm范围内,集中于100~180nm,且随鼠李糖脂浓度、溶液盐度的增大和重金属离子的加入而增大;溶液pH对胶束尺寸具有显著影响,最大胶束直径出现在pH为5.5~6.0时。
鼠李糖脂;临界胶束浓度;表面吸附;动态激光散射法;胶束直径
表面活性剂增效修复是一种很有前途的去除土壤中重金属和疏水性有机污染物技术。生物表面活性剂是一类由微生物分泌而成的具有亲水基和疏水基的两亲化合物[1]。与化学合成表面活性剂相比,生物表面活性剂具有高表(界)面活性、低毒、易于生物降解等突出特点,在原油开采、日用化工、环境修复等领域具有良好的应用潜力[2-4]。鼠李糖脂生物表面活性剂是由铜绿假单胞菌(Pseudomonasaeruginosa)发酵生成的具有表面活性的代谢产物,其亲水基团一般由1~2分子的鼠李糖构成,憎水基团由1~2分子具有不同碳链长度的含β-羟基的脂肪酸构成[5]。鼠李糖脂本身具有的两亲结构特性,使得其对疏水性有机物具有较高的胶束増溶能力[6],因而在疏水性有机污染场地修复中受到越来越多的关注[7-8]。研究表明。鼠李糖脂可有效促进土壤中疏水性有机物的解吸,且较结构相近的化学合成表面活性剂更为有效,如鼠李糖脂对原油的增溶性能是相同质量化学表面活性剂十二烷基硫酸钠(SDS)的50倍[9]。表面活性剂的胶束结构和性能是指导其应用的重要依据。然而,目前关于鼠李糖脂胶束行为的研究较少[10-11],尚难以直接指导其在环境修复等领域的应用。深入研究鼠李糖脂的胶束行为及其影响因素,对提高其增溶效率,减少使用量,降低修复成本具有重要意义。
本论文在研究鼠李糖脂生物表面活性剂所形成胶束的CMC和确定其表面吸附行为的基础上,应用动态激光散射仪测定其胶束直径,同时考察了pH、盐度和共存重金属离子等环境因子对其胶束直径的影响。
1 实验部分
1.1 仪器与试剂
Malvern Zetasizer Nano ZS90纳米激光粒度仪(英国Malvern公司),JYW-200A型自动界面张力仪(承德精密试验机有限公司)。
鼠李糖脂为本实验室通过Pseudomonasaeruginosa(O-2-2)以花生油为碳源发酵合成,并经过乙酸乙酯萃取和硅胶柱层析纯化,纯度在97.5%以上,液相色谱/质谱联用仪分析结果表明,该菌株所产生物表面活性剂含有21种鼠李糖脂的同系物,都由1~2分子的鼠李糖和1~2个含β-羟基的碳链长度为8~12的饱和或不饱和脂肪酸构成,主要组分为α-L-吡喃鼠李糖苷-β-羟基癸酰-β-羟基癸酸和2-O-α-L-吡喃鼠李糖苷-α-L-吡喃鼠李糖苷-β-羟基癸酰-β-羟基癸酸,摩尔占比分别为14.56%和19.26%。平均分子量为576[10]。其他试剂均为分析纯,实验用水均为mili-Q超纯水,pH为5.30。
1.2 表面张力法测定临界胶束浓度
鼠李糖脂表面张力(γ)以吊环法在常温下测定,其临界胶束浓度(CMC)以γ对鼠李糖脂浓度对数变化作图求得。
1.3 激光光散射法测定胶束直径
配制系列浓度的鼠李糖脂溶液经0.45μm滤膜过滤后,应用激光光散射法测定其动态平均直径(d)。散射角为90°,测定温度为25℃。
2 结果与讨论
2.1 临界胶束浓度
鼠李糖脂溶液的表面张力随浓度的变化测定结果如图1所示,其水溶液表面张力随糖脂浓度的增大而快速减小,到30.0mN·m-1后基本保持不变,说明浓度已达到CMC以上。可以求算出该鼠李糖脂的CMC为0.13mmol·L-1,这与铜绿假单胞菌(P.aeruginosa) MIG-N146所产鼠李糖脂的CMC基本一致[11],但低于铜绿假单胞菌(P.aeruginosa)SP4所产鼠李糖脂的CMC[12]。这与不同菌株所产生的鼠李糖脂同系物的组成和比例有关。研究表明,鼠李糖脂的CMC随其中所含疏水基碳链长度增大而减小,如双鼠李糖脂的CMC仅为5mg·L-1,而单鼠李糖脂的CMC则高达200mg/L[13]。进一步分析表明,本研究中鼠李糖脂CMC与非离子表面活性剂吐温系列相差不大[14],远小于阴离子表面活性剂SDS;而鼠李糖脂糖脂pKa为5.6左右[15],在本实验中溶液pH在5.8左右,鼠李糖脂以非离子态和阴离子态混合存在,但以非离子形态为主。
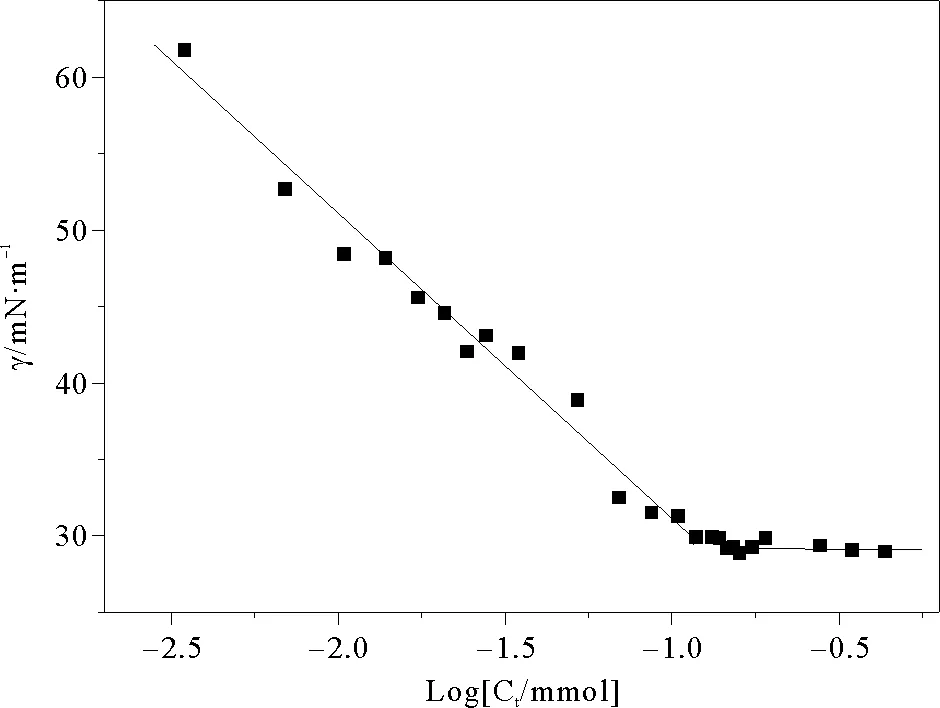
图1 鼠李糖脂表面张力(γ)随浓度(logCt)变化曲线
2.2 鼠李糖脂的表面吸附特点
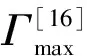
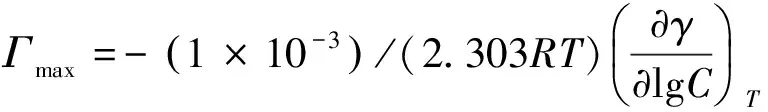
(1)
式中:R为气体常数(8.314J·mol-1·K-1);T为绝对温度。根据γ-log Ct(γ为mN·m-1,C为mol·L-1)曲线的斜率可得CMC时对应的气/液表面最大吸附量Γmax,单位为mol·m-2。
根据公式(2)可求算平均每个分子占有的最小面积Amin,单位为Å2,其中,NA为阿伏伽德罗常数,结果见表1。
Amin=1020/NΓmax。
(2)
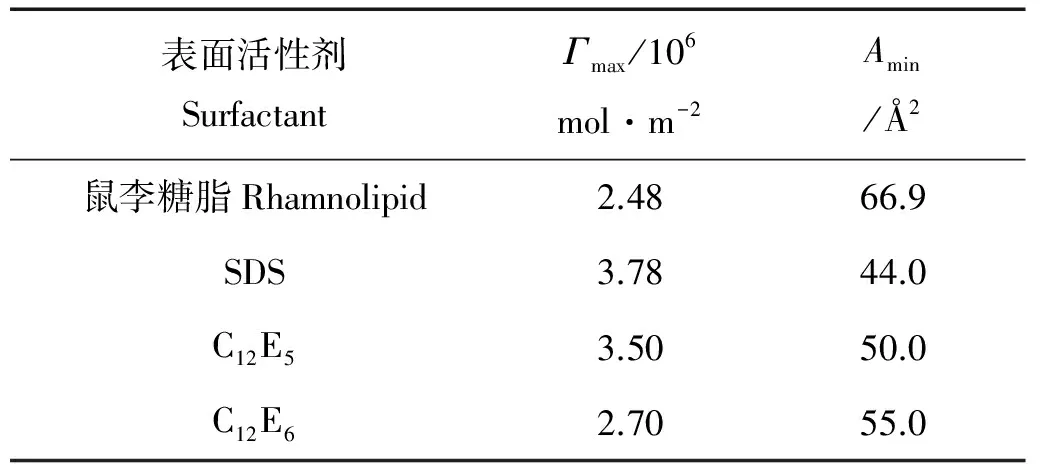
表1 25℃时鼠李糖脂生物表面活性剂和化学合成表面活性剂[17]的表面吸附行为比较
由表1可以看出,鼠李糖脂在CMC时对应的气/液表面最大吸附量Γmax为2.48×10-6mol·m-2,不仅小于阴离子型化学合成表面活性剂SDS,而且小于非离子表面活性剂C12E5和C12E6,而Amin则达到66.9Å2,分别是SDS、C12E5和C12E6的1.5、1.3和1.2倍,这可能是由于鼠李糖脂较大的空间体积在表面吸附层中占据较大的吸附面积而导致吸附量较少,Amin较大。
2.3 鼠李糖脂的胶束直径
2.3.1鼠李糖脂浓度对胶束直径的影响 鼠李糖脂浓度为0.20、0.50、0.80mmol·L-1时的水合直径测定结果如图2所示。可以看出,不同浓度鼠李糖脂所形成的胶束尺寸在50~250nm之间,分布比较集中,峰值集中于110~180nm,且随着浓度增大,其平均水合直径呈现逐渐增大的趋势。这与Pornsunthorntawee等[12]的研究结果基本一致。在CMC值附近时,鼠李糖脂所形成的胶束直径约为阴离子表面活性剂SDS的19倍[18]。这是由于鼠李糖脂分子中含有葡萄糖基和带支链的长链疏水基,占据较大空间,不利于分子间的有序排列,导致其可能形成尺寸较大的疏松囊泡状结构[13],这种胶束结构有利于疏水性有机物的增溶[19]。表明鼠李糖脂在疏水性污染物增效修复方面具有良好的应用潜力。
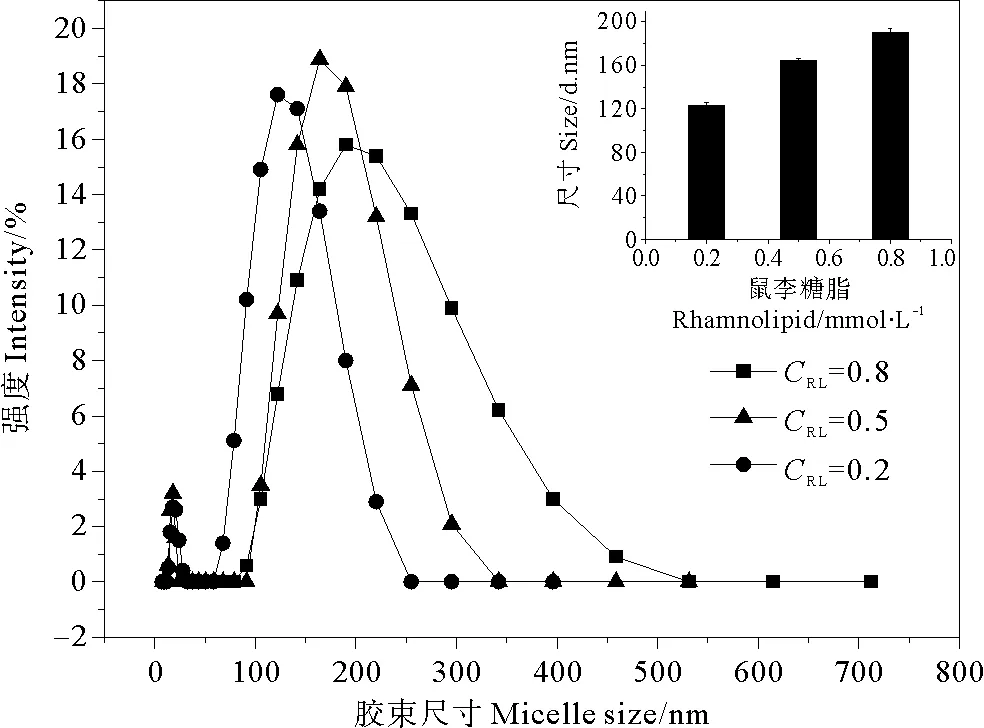
图2 不同浓度鼠李糖脂的胶束尺寸分布
2.3.2 pH对鼠李糖脂胶束直径的影响 为考察溶液pH值对鼠李糖脂水合直径的影响,将0.5mmol·L-1的鼠李糖脂溶液pH分别调为5.5、6.0、6.5、7.0、7.5和8.0,测定其胶束直径。由于当pH<5.0时,鼠李糖脂溶液不稳定而出现沉淀,溶液pH<5.0未考察。测定结果如图3所示,pH对鼠李糖脂的胶束直径有较大影响,最大胶束直径出现在pH为5.5~6.0时,接近或达到170nm;在溶液pH为6.5~8.0时,其胶束直径明显减小,在105~130nm之间。这主要是由于鼠李糖脂属弱酸型表面活性剂,其离子基团的直径取决于鼠李糖基团上羧基的质子化程度。鼠李糖脂的离子化程度随pH值增大而增大。研究表明,当溶液pH值高于5.6时,鼠李糖脂主要呈阴离子态;当pH值低于5.6时,则以非离子形态为主[15]。Champion等[20]应用冷冻透射电镜研究了鼠李糖脂胶束结构随pH值的变化。结果表明,溶液pH值从5.5增加到8.0,鼠李糖脂的胶束结构从较大的层状胶团变成较小的棒状胶团再转变成更小的胶束。鼠李糖脂的这种胶束结构随pH的变化可能与表面活性剂分子所带负电荷有关,随着pH值增大,鼠李糖脂亲水基团所荷负电增多,表面活性剂分子间排斥力增大,不利于大尺寸胶束的形成[12]。
2.3.3 盐度对鼠李糖脂胶束直径的影响 为考察盐度对鼠李糖脂胶束直径的影响,在浓度为0.5mmol·L-1的鼠李糖脂溶液中加入NaCl,使NaCl分别达到0.01、0.05和0.10mmol·L-1,测定鼠李糖脂的胶束直径分布。实验结果见图4。
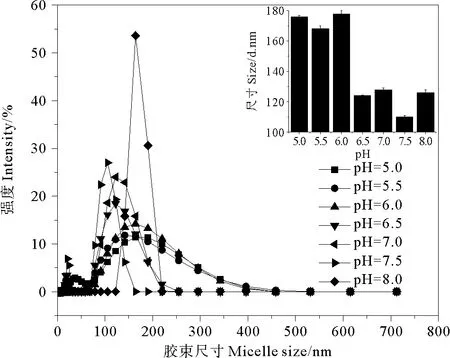
图3 溶液pH对鼠李糖脂胶束直径的影响
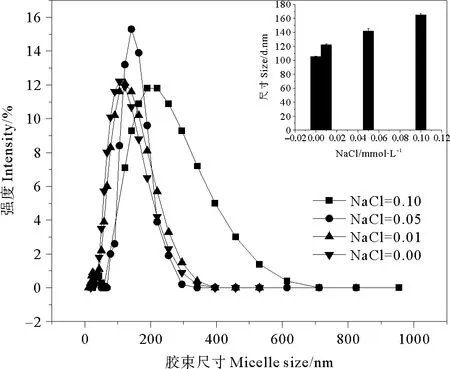
图4 盐度对鼠李糖脂胶束尺寸分布的影响
可以看出,在实验考察的盐度范围内,鼠李糖脂的胶束直径随盐度的增大而增大。一般认为,对离子型表面活性剂,电解质的存在使胶团的双电层压缩,减少了表面活性剂离子头之间的相互排斥作用,从而使得更多的表面活性剂离子进入胶团中,胶团聚集数增多,CMC值降低,胶束直径和体积增大[21]。
2.3.4 共存重金属离子对鼠李糖脂胶束直径的影响 在应用鼠李糖脂进行污染水体或土壤环境修复时,环境介质中往往是重金属离子与疏水性有机污染物共存[22];共存的金属离子会对鼠李糖脂的胶束结构和性质产生影响。因此,研究考察了在重金属离子Cd2+和Pb2+存在下,鼠李糖脂胶束直径的变化,鼠李糖脂浓度为0.5mmol·L-1,Cd2+和Pb2+的浓度为0.10mmol·L-1。实验结果见图5。
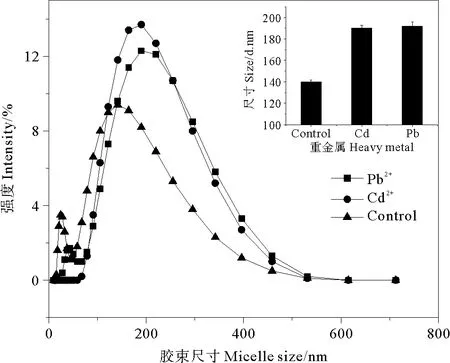
图5 重金属离子对鼠李糖脂尺寸分布的影响
Cd2+和Pb2+加入鼠李糖脂的胶束直径略有增大。也有研究发现在鼠李糖脂溶液中加入Cd2+,可以增大其对正十八烷的增溶能力[20]。这是由于鼠李糖脂中部分羧基被离子化,可以与添加的金属离子Pb2+、Cd2+发生络合作用[23],减少了鼠李糖脂亲水基团中离子头之间的相互排斥作用,导致使其所形成胶团双电层压缩,CMC值降低,这样胶束可以缔合为直径和体积更大的胶团,有利于疏水性有机物的増溶[23,24]。
3 结语
由于鼠李糖脂本身具有鼠李糖基和带支链的长链疏水基,因而具有较低的CMC值,仅为0.13mmol·L-1;且在表面吸附层中占据较大的吸附面积大,吸附量较小,在CMC时的Γmax为2.48×10-6mol·m-2,仅为SDS的67%,单分子Amin较大,达到66.9Å2,为SDS的1.5倍。同时,鼠李糖脂空间结构决定其易于形成尺寸较大的囊泡状胶束结构,其胶束直径分布在50~300nm范围内,集中于100~180nm之间,且随浓度增大而增大;同时,溶液pH值对胶束直径有较大影响,最大胶束直径出现在pH为5.5~6.0时。另外,其胶束直径随盐度的增大和重金属离子的加入而略有增大。
[1] Henkel M, Müller M M, Kügler J H, et al. Rhamnolipids as biosurfactants from renewable resources: Concepts for next-generation rhamnolipid production[J]. Process Biochemistry, 2012, 47(8): 1207-1219.
[2] Christofi N, Ivshina I B. Microbial surfactants and their use in field studies of soil remediation[J]. Journal of Applied Microbiology, 2002, 93(6): 915-929.
[3] 可欣, 李培军, 巩宗强, 等. 重金属污染土壤修复技术中有关淋洗剂的研究进展[J]. 生态学杂志, 2004, 23(5): 145-149. Ke X, Li P, Gong Z, et al. Advances in eluents used in the remediation of soil contaminated by heavy metals[J]. Chinese Journal of Ecology, 2004, 23(5): 145-149.
[4] Banat I M, Makkar R S, Cameotra S S. Potential commercial applications of microbial surfactants[J]. Applied Microbiology and Biotechnology, 2000, 53(5): 495-508.
[5] Mulligan C N. Environmental applications for biosurfactants[J]. Environmental Pollution, 2005, 133(2): 183-198.
[6] Wan J, Chai L, Lu X, et al. Remediation of hexachlorobenzene contaminated soils by rhamnolipid enhanced soil washing coupled with activated carbon selective adsorption[J]. Journal of Hazardous Materials, 2011, 189(1-2): 458-464.
[7] Urum K, Pekdemir T. Evaluation of biosurfactants for crude oil contaminated soil washing[J]. Chemosphere, 2004, 57(9): 1139-1150.
[8] Liu Y, Ma M, Shi Z, et al. A study on remediation of PCBs-contaminated soil by a combination of biosurfactant washing, UV-irradiation and biodegradation[J]. Advanced Science Letters, 2012, 10(1): 344-348.
[9] Noordman W H, Ji W, Brusseau M L, et al. Effects of rhamnolipid biosurfactantson removal of phenanthrene from soil[J]. Environmental Science & Eechnology, 1998, 32(12): 1806-1812.
[10] Wang X, Gong L, Liang S, et al. Algicidal activity of rhamnolipid biosurfactants produced byPseudomonasaeruginosa[J]. Harmful Algae, 2005, 4(2): 433-443.
[11] 林晖, 胡勇有, 张潇予, 等. 不同组分鼠李糖脂的胶束性质及其对三氯生的增溶作用[J]. 环境科学学报, 2011, 31(12): 2609-2615. Lin H, Hu Y, Zhang X, et al. Micellization properties of different rhamnolipidic fractions and their solubilization of triclosan [J]. Journal of Environmental Sciences, 2011, 31(12): 2609-2615.
[12] Pornsunthorntawee O, Chavadej S, Rujiravanit. Solution properties and vesicle formation of rhamnolipid biosurfactants produced byPseudomonasaeruginosaSP4[J]. Colloids and Surface B: Biointerfaces, 2009, 72: 6-15.
[13] Rahman K S M, Rahman T J, Mc Clean S, et al. Rhamnolipid biosurfactant production by strains ofPseudomonasaeruginosausing low-cost raw materials[J]. Biotechnology Progress, 2002, 18(6): 1277-1281.
[14] 宋丹丹, 梁生康, 王江涛, 等. 稳态荧光探针法研究槐糖脂生物表面活性剂的胶束化行为[J]. 光谱学与光谱分析, 2012, 32(8): 2171-2175. Song D, Liang S, Wang j, et al. Studies on micelle behaviors of sophorolipid biosurfactant by steady-state fluorescence probe method[J]. Spectroscopy and Spectral Analysis, 2012, 32(8): 2171-2175.
[15] Ishigami Y, Gama Y, Nagahora H, et al. The pH-sensitive conversion of molecular aggregates of rhamnolipid biosurfactant[J]. Chemistry Letters, 1987, 16(5): 763-766.
[16] Li F, Rosen M J, Sulthana S B. Surface properties of cationic gemini surfactants and their interaction with alkylglucoside or-maltoside surfactants[J]. Langmuir, 2001, 17(4): 1037-1042.
[17] Lu J R, Thomas R K, Penfold J. Surfactant layers at the air/water interface: Structure and composition[J]. Advances in Colloid and Interface Science, 2000, 84(1): 143-304.
[18] Norman A M, George B B, Martin C C. An investigation of the micellar phase of sodium dodecyl sulfate in aqueous sodium chloride solutions using quasielastic light scatting spectroscopy[J]. Journal of Physical Chemistry, 1976, 80(10): 1075-1085
[19] Gadelle F, Koros W J, Schechter R S. Solubilization isotherms of aromatic solutes in surfactant aggregates[J]. Journal of Colloid and Interface Science, 1995, 170(1): 57-64.
[20] Champion J T, Gilkey J C, Lamparski H, et al. Electron microscopy of rhamnolipid (biosurfactant) morphology: Effects of pH, cadmium, and octadecane[J]. Journal of Colloid and Interface Science, 1995, 170(2): 569-574.
[21] Cetin B, Yatkin S, Bayram A, et al. Ambient concentrations and source apportionment of PCBs and trace elements around an industrial area in Izmir, Turkey[J]. Chemosphere, 2007, 69(8): 1267-1277.
[22] Zehetner F, Rosenfellner U, Mentler A. Distribution of road salt residues, heavy metals and polycyclic aromatic hydrocarbons across a highwayforesy interface[J]. Water, Air & Soil Pollution, 2009, 198(1): 121-128.
[23] Mulligan C N, Wang S. Remediation of a heavy metal-contaminated soil by a rhamnolipid foam[J]. Engineering Geology, 2006, 85: 75-81.
[24] El Zeftawy M A M, Mulligan C N. Use of rhamnolipid to remove heavy metals from wastewater by micellar-enhanced ultrafiltration (MEUF)[J]. Separation and Purification Technology, 2011, 77(1): 120-127.
责任编辑 徐 环
Studies on Some Micelle Properties of Rhamnolipid Biosurfactant
YAN Le-Le1, LIANG Sheng-Kang1, SONG Dan-Dan2, LI Yi-Ming1, LI Yan-Bin1
(1.The Key Laboratory of Marine Chemistry Theory and Technology, Ministry of Education, College of Chemistry and Chemical Engineering, Ocean University of China, Qingdao 266100, China; 2.High and New Technology Research Center of Henan Academy of Sciences, Zhengzhou 450002, China)
The critical micelle concentration (CMC) and surface adsorption of rhamnolipid biosurfactant as well as micelle diameter of rhamnolipid varied with the biosurfactant concentration, salinity, pH and metal ionswere investigated. The results show that the rhamnolipid has a CMC of 0.13 mmol·L-1. Due to the large space volumes of rhamnolipid molecules, the adsorption quantity of rhamnolipid in the water-air interface is small and the maximum adsorption quantity (ΓMax) is as low as 2.48×10-10mol·cm-2. Accordingly, the smallest area of the single molecule (Amin) is as large as 66.9 Å2. The micelle diameters of rhamnolipid with the concentration of 0.2~0.8 mmol·L-1are distributed in 50~300 nm and gathered on 100~180 nm. The micelle diameters increase slightly with the increase of the salinity and withthe additionof metal ions in the solution. On the other hand, the rhamnolipid micelle charge properties are determined by the pH value of the solution, and its micelle sizesare influenced greatly by the pH value. The largest micellediameter was found with the pH value of 5.5~6.0.
rhamnolipid; critical micelle concentration; surface adsorption; dynamic light scattering; micelle mean diameter
国家自然科学基金项目(41371314)资助 Supported by Natural Science Foundation of China (41371314)
2015-06-30;
2015-11-25
闫乐乐(1990-),女,硕士。E-mail: yanll2924@163.com
❋❋ 通讯作者:E-mail: liangsk@ouc.edu.cn
O647
A
1672-5174(2016)12-068-05
10.16441/j.cnki.hdxb.20150235
闫乐乐, 梁生康, 宋丹丹, 等. 鼠李糖脂生物表面活性剂胶束性质研究[J]. 中国海洋大学学报(自然科学版), 2016, 46(12): 68-72.
YAN Le-Le, LIANG Sheng-Kang, SONG Dan-Dan, et al. Studies on some micelle properties of rhamnolipid biosurfactant[J]. Periodical of Ocean University of China, 2016, 46(12): 68-72.

