枸骨叶水提物对高脂小鼠胆固醇合成代谢的影响*
王宏婷,何丹,王存琴,邵海彬,尚文龙,王宏梅,叶灵
(1.皖南医学院基础医学院,安徽 芜湖 241000;2.皖南医学院药学院,安徽 芜湖 241000)
论著
枸骨叶水提物对高脂小鼠胆固醇合成代谢的影响*
王宏婷1,何丹2,王存琴2,邵海彬2,尚文龙2,王宏梅2,叶灵2
(1.皖南医学院基础医学院,安徽 芜湖 241000;2.皖南医学院药学院,安徽 芜湖 241000)
目的探讨枸骨叶水提物对高脂小鼠血清胆固醇水平及合成代谢信号通路的影响机制。方法实验小鼠随机分5组,其中3组用高、中、低剂量枸骨叶水提物灌胃30d后,测其血清总胆固醇(TC)、三酰甘油(TG)、高密度脂蛋白胆固醇(HDL-c)和低密度脂蛋白胆固醇(LDL-C)含量,并与辛伐他汀组进行比较;采用酶联免疫吸附测定(ELISA)肝脏细胞中3-羟基-3-甲戊二酸单酰辅酶A还原酶(HMG-CoA);采用蛋白质印迹法(Western blot)检测磷酸化表皮生长因子受体(p-EGFR)的表达。结果枸骨叶高、中、低剂量组有降低TC的作用(P<0.01),与辛伐他丁组降低TC作用无差异;此外枸骨叶组均可降低HMG-CoA水平,降低肝细胞中p-EGFR的表达。结论枸骨叶水提物对高脂饮食小鼠在清除TC方面发挥重要作用,它降低肝细胞中p-EGFR的表达,抑制HMG-CoA活性,进而降低高脂饮食小鼠体内TC水平而发挥降血脂作用。
枸骨叶;3-羟基-3-甲戊二酸单酰辅酶A还原酶(HMG-CoA);表皮生长因子受体;高脂血症
高脂血症已成为威胁人类健康的主要疾病之一。目前,临床用于治疗高脂血症的西药具有很多不良反应。因此,以中草药为代表的植物药以及生长、代谢过程中产生的具有特殊生理活性且结构多样的植物次生代谢产物成为天然药物研究者高度关注的热点[1]。
枸骨叶作为苦丁茶药材的主要来源,具有降低血脂的功效[2-3],现代药理研究表明,枸骨叶具有降血脂、抗心肌缺血、抗氧化、抗菌、免疫抑制、抗生育等作用[4-11],并且毒性很低[12],但降脂机制尚未清楚。本实验拟通过动物学、分子生物学方法测定高血脂模型小鼠饮用枸骨叶水提物后血脂水平的改变,并通过对小鼠肝脏内磷酸化表皮生长因子受体(phosphorylation-epidermal growth factor receptor,p-EGFR)的表达,探究分子水平上降血脂的作用机制,为枸骨叶降血脂的开发提供科学依据。
1 材料与方法
1.1 实验动物
8~10周龄雄性昆明小鼠由常州卡文斯实验动物有限公司提供,生产许可证:Scxk(苏)2011-0003。70只,体重(25±2)g左右。
1.2 材料与试剂
干燥的枸骨叶,一般基础饲料,高脂饲料(含猪油10%、胆固醇2%、牛胆盐0.2%和蛋黄粉10%),小鼠垫料,由江苏省协同医药生物工程有限责任公司提供。3%~5%的苦味酸溶液(用75%的乙醇溶解),血脂四项试剂盒(南京建成生物工程研究所),p-EGFR(Tyr1608)XP Rabbit mAb、辣根过氧化物酶标记的羊抗兔免疫球蛋白IgG和内参蛋白GAPD(美国Cell Signalling公司),3-羟基-3-甲戊二酸单酰辅酶A还原酶(3-hydroxy-3-methylglutaryl coenzyme A reductase,HMG-CoA)、酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)试剂盒(上海研谨生物科技有限公司),蛋白浓度测量试剂盒(BCA)和化学发光试剂盒(HRP-ECL)(碧云天生物科技研究所),PVDF膜(美国Immobilon)。
1.3 实验仪器
DNM-9602酶标分析仪(北京普朗),荧光紫外凝胶成像系统Fluor ChemQ(美国ALPHA),5417R小型台式高速冷冻离心机(德国Eppendorf),电磁炉(中国Suboe),铝合金煎煮锅(定制),粉碎机(中国中诚制药机械XFB-500),电子天平(中国富朗FA2004)。
1.4 方法
1.4.1 枸骨叶水提物的制备干燥的枸骨叶粉碎成粗粉,每次称取适量的枸骨叶15倍水浸泡20 min,煎煮1 h,加水煎煮2次,合并煎煮液,过滤,减压浓缩后静置过夜,将提取液离心后取其上清液(相对密度约为1.05),经D101型大孔吸附树脂,依次用水,45%、75%和95%乙醇梯度洗脱,取95%、75%和45%乙醇洗脱部位浸膏,得到不同浓度的乙醇水提物半固体浸膏,使每1 ml含原生药1 g。按高剂量组12 g/kg,中剂量组8 g/kg,低剂量组4 g/kg[13-14](注:按照大鼠和小鼠的换算系数为2计算)分别量取不同体积的枸骨叶水提物待用。
1.4.2 辛伐他汀溶液的配制取5 mg辛伐他汀片剂溶于30 ml 0.5%羧甲基纤维素钠溶液中配成浓度为0.167mg/ml的均匀混悬液,供实验小鼠灌胃使用。
1.4.3 动物分组与给药小鼠适应性观察1周,用一般小鼠饲料喂2周,使其体重增长至平均体重30 g左右。随机分为空白对照组、高脂模型组、高剂量枸骨叶组(12 g/kg)、中剂量枸骨叶组(8 g/kg)、低剂量枸骨叶组(4 g/kg)、辛伐他汀对照组。实验期间空白对照组小鼠给予一般饲料,其余5组给予含2%胆固醇的高脂饲料,连续喂养2周后用枸骨叶水提物灌胃,高、中、低枸骨叶组分别给予12、8和4 g/kg枸骨叶,辛伐他汀组给予4.11 mg/kg的辛伐他汀[14](注:根据人和小鼠的换算系数为12.33计算,辛伐他汀的一般规格为20mg/d,人均体重60kg)。各组小鼠分别灌胃给药4周,剪尾取血,测其血清总胆固醇(total cholesterol,TC)、三酰甘油(triacylglycerol,TG)、高密度脂蛋白胆固醇(high density lipoprotein-cholesterol,HDL-C)和低密度脂蛋白胆固醇(low density lipoprotein-cholesterol,LDL-C)含量,并取小鼠肝脏测定肝脏p-EGFR水平。
1.4.4 TC和TG的测定70只小鼠用剪尾的方法依次取血,放入1.5 ml试管中,室温血液自然凝固10~20 min,离心20 min左右(2 000~3 000 r/min),取上清液。在微量加样板上设空白孔、标准孔和待测样品孔,6个实验组均取2.5μl的上清液加入待测样品孔中,空白孔加入等量的蒸馏水,标准孔加入等量的标准液,再依次加入相应的工作液,混匀,37℃孵育10 min,在规定波长下,用酶标仪测定各孔吸光度值,根据相关公式计算出TC和TG含量(具体操作见说明书)。
1.4.5 HMG-CoA的测定取小鼠血清(方法同上),在酶标包被板上进行加样,分别设空白孔、标准孔和待测样品孔,待测样品孔中先加样品稀释液50μl,然后再加待测样品10μl,加样时样品加于酶标板孔底部,尽量不触及孔壁,轻轻晃动,混匀,标准孔加入稀释的标准液,空白对照孔不加样品及酶标试剂,其余操作相同。加样后用封板膜封板后置37℃温育30 min,孵育完毕进行洗涤,小心揭掉封板膜弃去液体,甩干,每孔加满洗涤液,静置30 s后弃去,如此重复5次,拍干。每孔加入酶标试剂50μl,空白孔除外,再次温育、洗涤(操作同上),然后进行显色,轻轻震荡混匀,37℃避光显色15min,每孔加终止液50μl终止反应(此时蓝色立转黄色),以空白空调零,450nm波长依序测量各孔的吸光度值(OD值),用吸光度值代入相关公式计算得出HMG-CoA的含量。
1.4.6 蛋白质印迹法(Western blot)取适量肝脏匀浆液加入细胞裂解液,以4℃、12 000 r/min高速离心15 min,取上清液进行蛋白定量。调整上样量进行聚丙烯酰胺凝胶电泳(SDS-PAGE),200 V恒压湿转150 min,含3%牛血清蛋白(BSA)的Tris-HCL缓冲液室温封闭2 h。加入特异性抗体(phospho-EGFR XPS Rabbit mAb)(1∶1 000稀释),4℃过夜。HRP偶联的羊抗兔免疫球蛋白IgG作为二抗(1∶1 000稀释),37℃孵育2 h。用增强化学发光检测试剂盒(HRP-ECL)进行发光成像,于荧光-紫外凝胶成像系统中曝光3~10 min。
1.5 统计学方法
数据分析采用SPSS 19.0统计软件,计量资料以均数±标准差(±s)表示,采用方差分析,两两比较用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 高脂血症小鼠模型
高脂模型组与空白对照组比较,高脂模型组的胆固醇含量高于空白对照组,且结果差异有统计学意义(F=4.590,t=4.741,P=0.006)(见表1),而高脂模型组的TG水平比空白对照组低,TG水平未升高。
表1 高脂血症小鼠模型的复制(n=12,mmol/L±s)
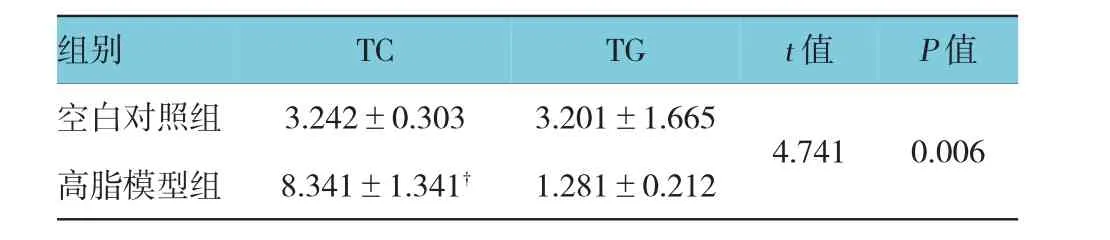
表1 高脂血症小鼠模型的复制(n=12,mmol/L±s)
注:†与空白对照组比较,P<0.05
组别TCTGt值P值空白对照组3.242±0.3033.201±1.665 4.7410.006高脂模型组8.341±1.341†1.281±0.212
2.2 枸骨叶水提物对小鼠TC水平的影响
高、中、低剂量枸骨叶组TC含量比高脂模型组低,且结果差异有统计学意义(F=1.471,P高=0.036,t高=3.177,P中=0.009,t中=3.736,P低=0.047,t低= 2.888)(P<0.05),枸骨叶水提物能有效降低小鼠体内的TC(见表2)。
表2 枸骨叶水提物对小鼠TC水平的影响(mmol/L±s)
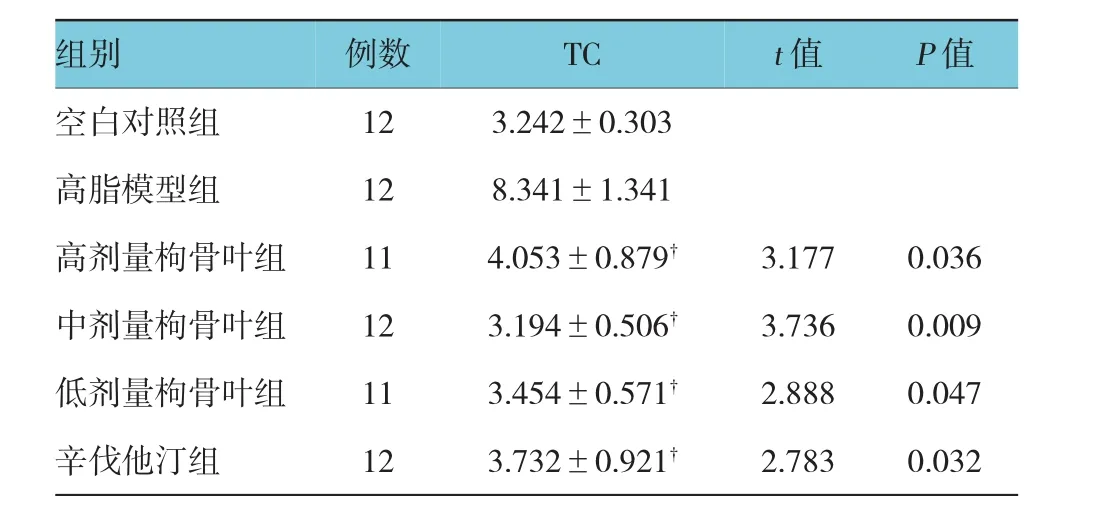
表2 枸骨叶水提物对小鼠TC水平的影响(mmol/L±s)
注:†与高脂模型组比较,P<0.05
组别例数TCt值P值空白对照组123.242±0.303高脂模型组128.341±1.341高剂量枸骨叶组114.053±0.879†3.1770.036中剂量枸骨叶组123.194±0.506†3.7360.009低剂量枸骨叶组113.454±0.571†2.8880.047辛伐他汀组123.732±0.921†2.7830.032
2.3 枸骨叶水提物对小鼠HMG-CoA的影响
实验结果显示,各枸骨叶给药组的HMG-CoA水平均降低(F=2.435,P高=0.001,t高=8.533,P中=0.008,t中=4.770,P低=0.027,t低=3.407),提示枸骨叶水提物可能通过抑制HMG-CoA的表达来减少内源性TC的合成,使小鼠血清中TC水平下降。见表3。
表3 枸骨叶水提物对小鼠HMG-CoA的影响(±s)
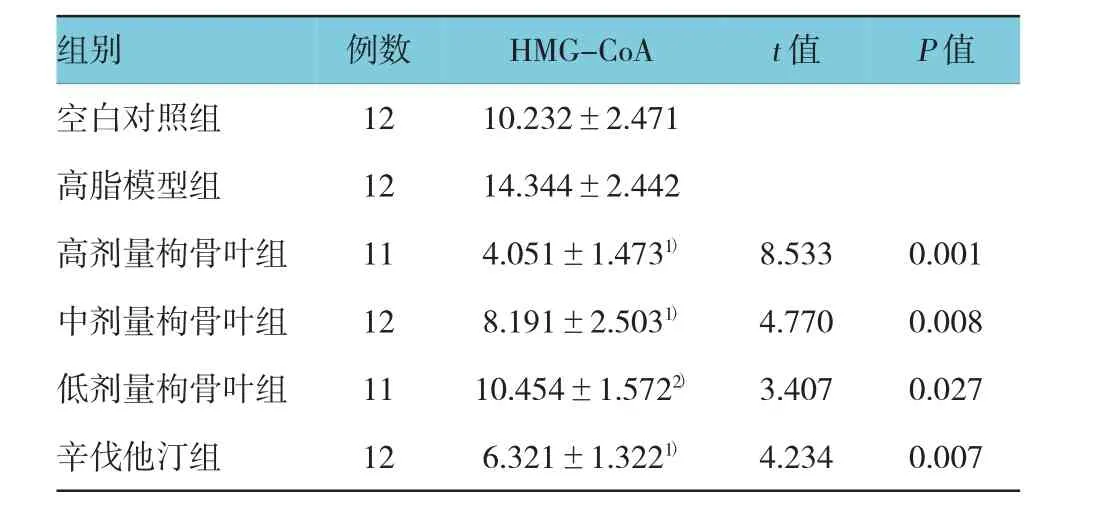
表3 枸骨叶水提物对小鼠HMG-CoA的影响(±s)
注:1)与高脂模型组比较,P<0.01;2)与高脂模型组比较,P<0.05
组别例数HMG-CoAt值P值空白对照组1210.232±2.471高脂模型组1214.344±2.442高剂量枸骨叶组114.051±1.4731)8.5330.001中剂量枸骨叶组128.191±2.5031)4.7700.008低剂量枸骨叶组1110.454±1.5722)3.4070.027辛伐他汀组126.321±1.3221)4.2340.007
2.4 枸骨叶水提物对小鼠肝脏p-EGFR表达的影响
高脂模型组与空白对照组p-EGFR表达比较,经t检验差异有统计学意义(F=1.792,t=2.849,P= 0.044),高脂模型组EGFR磷酸化水平更高。枸骨叶高剂量组与高脂模型组比较,经t检验差异有统计学意义(F=2.209,t=3.073,P=0.037),高剂量组肝脏细胞内的p-EGFR水平降低,并且从附图中可以看到高、中、低剂量组的趋势。高剂量组p-EGFR的表达与辛伐他汀组比较,辛伐他汀无抑制小鼠肝脏p-EGFR表达水平的作用。
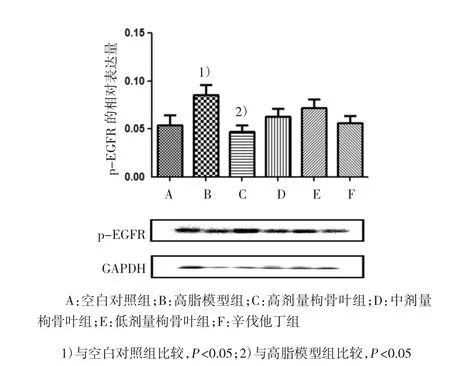
附图枸骨叶水提物对小鼠肝脏p-EGFR的影响(n=3±s)
3 讨论
EGFR是表皮生长因子受体(HER)家族成员之一,HER家族在细胞生理过程中发挥重要的调节作用。EGFR广泛分布于哺乳动物细胞表面,对EGFR信号通路的调节发挥重要作用[15]。EGFR磷酸化反映该信号通路被激活,肝细胞p-EGFR可促进肝细胞TG、胆固醇、LDL合成[16-18]。因此探究枸骨叶提取物对肝脏EGFR信号通路的影响有很重要的现实意义。本次实验通过对高血脂小鼠灌胃枸骨叶,发现其具有降低小鼠胆固醇的作用;此外,还从分子水平上探究其发生的机制。实验结果显示,高脂模型组与空白对照组比较其TC含量明显升高(P<0.05),提示高脂模型EGFR信号通路激活并促进肝脏合成TG,游离胆固醇的释放增多[19],进一步说明高脂模型造模成功,但TG水平未升高,这可能与其在体内的分布情况有关,小鼠体内含有大量的脂肪组织,当一次性或长期摄入过多的高脂类饲料,体内的脂肪组织会暂时把它贮存起来,一旦脂溶性的外来物进入脂肪组织就很难释放出来,在体内长期蓄积,所以血清中游离的TG水平就显著降低,笔者的实验数据显示高脂模型组TG水平比空白对照组低。HMG-CoA是胆固醇合成限速酶,在胆固醇的合成中起着决定性作用[20]。笔者进一步检测HMG-CoA水平,实验结果显示各给药组HMG-CoA含量降低,与高脂模型组比较差异有统计学意义(P<0.05)。在肝脏细胞内,EGF通常与EGFR特异性结合,蛋白质的磷酸化和去磷酸化过程几乎调节着包括细胞的生长、增殖、发育、分化、信号传导、凋亡和神经活动等所有的生命过程[21]。蛋白质印迹法检测结果表明给药组小鼠肝脏内磷酸化的EGFR表达较空白对照组低,提示枸骨叶水提物可能通过影响肝脏细胞内EGFR的磷酸化,调控EGFR通路以抑制HMG-CoA表达,进而降低血清胆固醇水平。
综上所述,枸骨叶水提物通过抑制肝细胞内EGFR的磷酸化水平,调控EGFR下游信号通路传导,从而使胆固醇的合成限速酶HMG-CoA合成受阻,降低血清胆固醇水平。
[1]WOHLFARTH C,EFFERTH T.Natural products as promising drug candidates for thetreatment of hepatitis B and C[J].Acta. Pharmacol Sin,2009,30:25-30.
[2]刘彬,许宏大.苦丁茶降血脂的实验及临床研究[J].护理研究, 2005,19(1):21.
[3]申梅淑,张淑芹,郭新民,等.苦丁茶对大鼠血脂和载脂蛋白的影响[J].中国林副特产,2012(63):7.
[4]李维林,吴菊兰,任冰如,等.枸骨中3种化合物的心血管药理作用[J].植物资源与环境学报,2003,12(3):6-10.
[5]旷春桃,陈如锋,吴斌,等.枸骨叶中多酚类物质的提取及抗氧化性能分析[J].湖北农业科学,2009,48(2):427-429.
[6]申梅淑,李元柱.苦丁茶对大鼠血脂和载脂蛋白的影响[J].中国林副特产,2002(4):403.
[7]林晨,谭玉波,张晶,等.枸骨叶不同溶媒萃取物对小鼠体外T淋巴细胞活化增殖的影响[J].暨南大学学报(医学版),2006,27(2): 199-203.
[8]邢莹莹,岑颖洲,王一飞,等.瑶药枸骨叶不同溶剂组分体外抑菌活性比较[J].暨南大学学报(自然科学版),2004,25(1):119-121.
[9]张晶,林晨,岑颖洲,等.枸骨叶抗真菌作用初探[J].中国病理生理杂志,2003,19(11):1562.
[10]杨卫华,赵玉丛.中药枸骨叶化学成分和药理作用的研究进展[J].医药世界,2007(3):103-105.
[11]魏成武,杨翠芝,任华能,等.枸骨抗生育作用[J].中药通报,1988, 13(5):48-50.
[12]许实波,蒋建敏,许东晖,等.苦丁茶水提物的毒理学研究[J].中山大学学报(自然科学版),2001,40(3):93-111.
[13]潘慧娟,应奇才,等.苦丁茶大叶冬青的降脂作用研究[J].茶叶科学,2004,24(1):49.
[14]黄继汉,黄晓晖,陈志扬,等.药理实验中动物间和动物与人体间的等效剂量换算[J].中国临床药理学与治疗学,2004,9(9):1069-1072.
[15]STATEVA S R,SALAS V,BENGURÍA A,et al.The activating role of phospho(Tyr)-calmodulin on the epidermal growth factor receptor[J].Biochem J,2015,2(472):195-204.
[16]SCHEVING L A,ZHANG X Q,GARCIA1 O A.Epidermal growth factor receptor plays a role in the regulation of liver andplasma lipid levels in adult male mice[J].American Journal of Physiology:Gastrointestinal and Liver Physiology,2014,5(306): 370-381.
[17]GNONI G V,PAGLIALONGA G,SICULELLA L.Quercetin inhibits fatty acid and triacylglycerol synthesis in rat liver cells[J]. Eur J Clin Invest,2009,39(9):761-768.
[18]LU C H S,LIU K,TAN L P,et al.Current chemical biology tools for studying protein phosphorylation and dephosphorylation[J]. Chemistry European Journal,2012,1(18):28-39.
[19]LEE J C,PARK B K,CHOUNG S,et al.Amelioration of hypercholesterolemiabyanEGFRtyrosinekinaseinhibitorin mice with liver-specific knockout of mig-6[J].PLoS One,2014, 12(9):1-13.
[20]ZHANG Z,HO W K,HUANG Y,et al.Hawthorn fruit is hypolipidemic in rabbits fed a high cholesterol diet[J].J Nutr, 2002,132(1):5-10.
[21]SALINERO-FORT M Á,SAN ANDRÉS-REBOLLO F J,DE BURGOS-LUNAR C,et al.Cardiovascular and all-cause mortality in patients with type 2 diabetes mellitus in the MADIABETES cohort study:Association with chronic kidney disease[J]. J Diabetes Complications,2016,30(2):227-236.
(申海 菊编辑)
Influence of Iiex cornuta extracts on constructive metabolism of cholesterol in high-fat mice*
Hong-ting Wang1,Dan He2,Cun-qin Wang2,Hai-bin Shao2, Wen-long Shang2,Hong-mei Wang2,ling Ye2
(1.School of Preclinical Medicine,2.School of Pharmacy,Wannan Medical College, Wuhu,Anhui 241000,China)
Objective To evaluate the potential synergistic effect of Iiex cornuta or its essential component on serum cholesterol level and metabolism signal pathway of high-fat diet mice.Methods The mice were divided into 5 groups in random.Three groups took Iiex cornuta orally with different doses for 30 days.After that,serum total cholesterol(TC),triglyceride(TG),high-density lipoprotein cholesterol(HDL-C)and low density lipoprotein cholesterol(LDL-C)were measured,and compared with those in Simvastatin group.The level of 3-hydroxy-3-methyl glutaric acid acyl coenzyme A(HMG-CoA)in liver cells was measured by ELISA. The expression of phosphorylated epithelial growth factor receptor(p-EGFR)in liver cells was detected by Western blot.Results Serum total cholesterol was lowered in the Iiex cornuta groups with different doses(P<0.01).This effect was similar to that of the Simvastatin group.In addition,the HMG-CoA level obviously declined in the Iiex cornuta groups.The p-EGFR expression in the liver cells of the Iiex cornuta groups decreased compared to that of the control group.Conclusions Iiex cornuta plays an important role in clearing serum total cholesterol in the mice of high-fat diet.It can lower the expression of p-EGFR,inhibit the activity of 3-hydroxy-3-methyl glutaric acid acyl coenzyme A in liver cells and then reduce serum total cholesterol in the high-fat diet mice.
Iiex cornuta;HMG-CoA;epithelial growth factor receptor;hyperlipemia
R589.2
A
10.3969/j.issn.1005-8982.2016.23.001
1005-8982(2016)23-0001-05
2016-04-21
国家自然科学基金(No:81402818);安徽省高等学校省级自然科学研究项目(No:KJ2010B246,KJ2014A268);安徽省高校优秀青年人才支持计划重点项目(No:gxyqZD2016177);安徽省高校优秀中青年骨干人才国内外访学研究重点项目(No:gxfxZD2016161);安徽省国家级创新创业训练项目(No:201410368014)
王存琴,E-mail:wcq5188b@163.com;Tel:0553-3932497

