快速线扫描拉曼成像技术在研究CaSki细胞凋亡过程中的应用
张金亮, 马 鑫, 徐梦溪, 宗 铖, 任 斌
(厦门大学化学化工学院, 固体表面物理化学国家重点实验室, 厦门 361005)
快速线扫描拉曼成像技术在研究CaSki细胞凋亡过程中的应用
张金亮, 马 鑫, 徐梦溪, 宗 铖, 任 斌
(厦门大学化学化工学院, 固体表面物理化学国家重点实验室, 厦门 361005)
应用快速线扫描拉曼成像技术研究了在抗肿瘤药物顺铂诱导下宫颈癌CaSki细胞凋亡过程中细胞色素c、 蛋白质和脂质等的时空变化规律. 结果表明, 细胞色素c与蛋白质的相对拉曼峰强可以反映细胞凋亡程度. 与常用的表征细胞活性的噻唑蓝(MTT)实验的统计方法相比, 利用拉曼成像技术可以更灵敏地观察到细胞凋亡早期生物活性分子的变化, 从而在单细胞水平检测细胞凋亡过程, 为解析药物与细胞的作用机制提供分子水平信息.
宫颈癌; 细胞色素c; 凋亡; 拉曼光谱; 拉曼成像; 噻唑蓝法
癌细胞的凋亡是大量胞内分子同时参与的复杂过程. 从单细胞水平上研究癌细胞在药物作用下的凋亡过程将有助于认识药物与癌细胞作用机理, 对高效治疗癌症具有重要的科学意义. 但目前从单个活细胞和单分子水平上探究生命问题对于传统生物医学手段仍是一个巨大的挑战, 对癌细胞凋亡过程的分子动态时空演变信息仍然了解甚少.
近年来, 流式细胞术、 扫描探针显微技术和荧光显微术等单细胞技术发展较快, 其中流式细胞术可以实现单个细胞快速高通量的生物学分析, 获得细胞的物理化学特性, 但缺乏空间分辨的信息[1~3]. 扫描探针显微技术不仅可以研究单个细胞膜表面微结构的形貌信息, 还可以对胞内相关细胞器进行分子水平上的操作, 但是会对细胞产生应力, 影响细胞的正常生理功能[4]. 荧光显微技术为在单细胞水平上研究细胞生物学过程提供了丰富的信息, 也是目前单细胞研究的主要方法, 但荧光技术需要借助外来标记分子, 会对细胞的微环境以及被标记分子的功能产生一定的干扰, 难以如实反映生物分子的本征信息, 特别是对一些重要的生物活性分子, 如小分子和脂类等尚难以进行荧光标记而不影响其生物学活性; 此外, 荧光峰通常较宽, 难以同时实现多组分检测[5~7]. 拉曼光谱技术不会发生生物分子光漂白, 适合长时间对活体样品进行检测; 无需标记即可获得体系的指纹特征, 排除了标记分子对生物体系的干扰甚至破坏; 其光谱特征由分子自身振动特征决定, 不易受外界干扰; 谱峰窄, 可以进行多组分同时检测. 因此, 拉曼光谱能够同时获得整个细胞的光谱信息, 对研究细胞内多种分子同时参与的凋亡过程具有显著优势.
宫颈癌是全球女性的第二大癌症杀手, 根据其携带的人类乳头瘤病毒的型号, 宫颈癌细胞可分为HeLa, SiHa, C33A和CaSki等几种[8~11]. 顺铂是常见的抗肿瘤药物, 具有很好的抗肿瘤功效[12~15]. 目前认为顺铂与癌细胞的作用机理主要有2种: 一种认为顺铂与细胞核内DNA的碱基形成络合物, 阻止DNA的解旋、 复制等过程, 从而抑制癌细胞的增长[16~18]; 另一种认为顺铂可以诱导细胞内产生活性氧, 从而诱导细胞凋亡[19~22].
本文选择宫颈癌CaSki细胞作为研究的细胞系, 运用快速线扫描拉曼成像技术对顺铂作用后的CaSki细胞的凋亡过程进行实时监测. 通过拉曼成像分析对活细胞内生物分子如细胞色素c、 蛋白质、 脂质等的含量和分布进行了分析, 从而获得细胞凋亡过程的分子信息, 为顺铂抗肿瘤机理的研究提供分子水平信息.
1 实验部分
1.1 试剂与仪器
DMEM高糖培养基(美国Gbcio公司); 链霉素、 青霉素、 噻唑蓝(MTT)和二甲基亚砜(DMSO)(厦门鹭隆生物科技有限公司); 胎牛血清(美国Hyclone公司); 胰蛋白酶(Trypsin, 美国Amersco公司)、 磷酸盐缓冲溶(PBS, pH=7.2~7.4, 每升含NaCl 8.0 g, KCl 0.2 g, Na3HPO41.15 g, KH3PO40.2 g); 顺铂(上海阿拉丁试剂有限公司). 顺铂药物采用DMEM培养基配制, 现配现用.
AE20型倒置显微镜(厦门MOTIC公司); DK-S22型电热恒温水槽(上海精宏设备有限公司); Sterilgard Ⅲ型生物安全柜(美国Baker公司), SCO6AD型气套式CO2培养箱(美国Shellab公司); Raman-11快速共聚焦拉曼成像光谱仪(日本Nanophoton公司); EnSpire酶标仪(美国PerkinElmer公司).
1.2 细胞培养与细胞活性MTT实验
实验细胞系为宫颈癌CaSki细胞. 细胞培养基为含1%(体积分数)链霉素, 1%(体积分数)青霉素和10%(体积分数)胎牛血清的DMEM高糖培养基. 培养环境为含5%(体积分数)CO2和95%(体积分数)空气的混合气环境, 培养温度为37 ℃.
通过细胞计数板将CaSki细胞的密度控制在105Cell/mL左右, 然后将细胞悬浮液种在96孔板中, 每孔种100 μL, 并设置调零孔和空白组. 种片24 h后, 分别加入0, 2, 4, 8, 10 mmol/L的顺铂溶液, 并作用24 h, 获得顺铂对CaSki细胞的半抑制浓度(IC50).
将IC50浓度的顺铂溶液加入到96孔板中, 每孔加150 μL, 分别和细胞作用4, 8, 12, 16, 24, 48 h后加入5 mg/mL的MTT溶液各10 μL, 孵育4 h. 小心吸去上层溶液, 每孔加入150 μL DMSO溶液, 作用0.5 h后摇匀, 用酶标仪测量孔板的吸光度, 激光波长为490 nm.
1.3 细胞拉曼成像实验
将Caski细胞种片24 h后, 加入IC50浓度的顺铂溶液分别作用4, 8, 12, 16, 24, 48 h, 然后将细胞放到经除菌处理过的盖玻片上, 滴加PBS对细胞封片处理, 然后进行拉曼成像. 该处理方法可以避免细胞暴露在外界环境下发生不可控变化, 保持细胞的正常生命活动, 从而在成像时间内可以固定细胞的形貌, 避免发生显著变化, 使检测到的细胞信号变化可以如实反映顺铂与细胞的作用.
将532 nm激光束通过柱面镜转换为椭形光斑, 并经过动镜扫描形成均匀的线光源, 再通过100倍油镜[数值孔径(NA)=1.4, Nikon公司, Type A型浸润油]照射在细胞上, 对应成像宽度为80 μm. 结合动镜扫描, 获得80 μm×20 μm细胞拉曼成像图, 拉曼图像中每个像素大小约为200 nm×200 nm. 每条线的曝光时间为10 s, 线激光功率为6 mW/像素. 选择600 道光栅进行分光, 对应采谱范围为580~3025 cm-1.
2 结果与讨论
2.1 细胞活性MTT实验分析
首先采用生物医学中常用的MTT法来测算顺铂对CaSki细胞作用的IC50. 与不同浓度顺铂作用24 h后细胞的存活率如图1所示. 可见, 细胞凋亡比例与顺铂药物浓度呈良好的正相关性. 当顺铂浓度为4 mmol/L时, 细胞24 h的存活率降到50%左右, 该浓度即为顺铂作用于CaSki细胞的IC50值. 选择4 mmol/L这一药物浓度研究了顺铂对细胞作用不同时间后细胞的凋亡情况, 结果如图2所示. 可见, 4 mmol/L的顺铂与CaSki细胞作用4 h和8 h后, 细胞存活率和无药物的对照组基本一致, 说明该时间范围内顺铂并没有导致细胞发生明显的凋亡. 而当药物作用12 h后, 细胞存活率降低到70%. 作用时间延长到48 h后, 细胞的存活率低于20%. 采用MTT法检测细胞毒性时, 需要作用较长时间才能反映出细胞的凋亡信息, 而且无法获得细胞凋亡过程中细胞内分子动态变化信息.
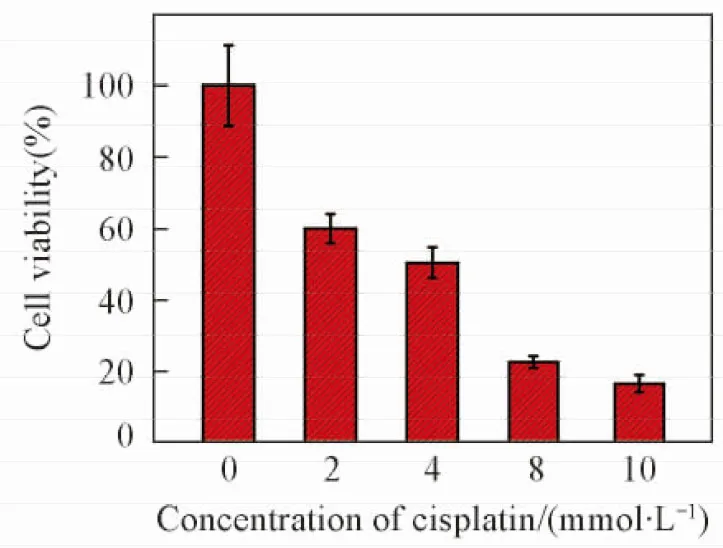
Fig.1 Viability of CaSki cells after being treated with different concentrations of cisplatin for 24 h
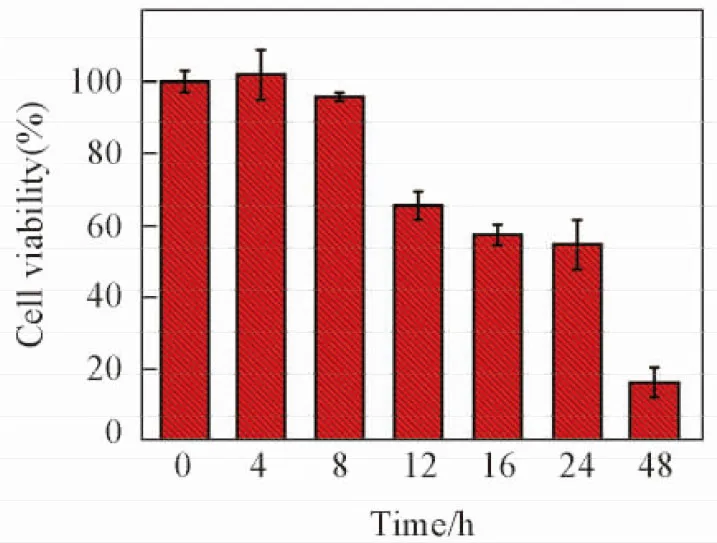
Fig.2 Time-depended viability of CaSki cells after being treated with 4 mmol/L cisplatin
2.2 拉曼成像分析

Fig.3 Time depended bright field images(A1—F1) and Raman images using raman peaks of cytochrome c(750 cm-1)(A2—F2), protein(1660 cm-1)(A3—F3), and lipid(2852 cm-1)(A4—F4) of cells after being treated with 4 mmol/L cisplatin for 0 h(A1—A4), 4 h(B1—B4), 8 h(C1—C4), 12 h(D1—D4), 24 h(E1—E4) and 48 h(F1—F4)
2.2.1 细胞内生物分子成像分析 根据上述MTT实验, 选择用4 mmol/L顺铂溶液来诱导CaSki细胞的凋亡. 待药物和细胞作用不同时间后, 对细胞进行显微观察和拉曼成像, 结果如图3所示. 可见, 当顺铂与细胞作用时间短于12 h时, 从细胞白光显微图像上观察不到细胞形貌的明显变化; 当作用时间延长到24 h后, 细胞发生皱缩, 细胞膜结构消失, 表明细胞已经发生明显凋亡, 如图3(A1~F1)所示. 在显微观察时用拉曼光谱对细胞进行成像, 图3(A2~F2), (A3~F3), (A4~F4)分别是用代表细胞色素c(750 cm-1)、 蛋白质酰胺Ⅰ带(1660 cm-1)和细胞内饱和脂质(2852 cm-1)[16,18,23,24]的特征拉曼峰强度作的拉曼显微图像. 可见, 在没有顺铂作用下, 细胞内的细胞色素c含量较多, 呈颗粒状分布, 表明细胞色素c分布在线粒体内, 而且细胞内含有少量脂滴. 当用顺铂作用4 h和8 h后, 细胞色素c的含量减少, 并呈云雾状弥散分布, 表明细胞色素c开始从线粒体内释放到细胞质中. 作用时间继续延长, 细胞色素c继续减少, 48 h后完全消失. 脂质的含量随着药物作用时间的延长而增加, 脂滴逐渐增多. 拉曼光谱中1660 cm-1处的信号峰可归属于蛋白质和脂质. 由于蛋白质分布在整个细胞中, 而饱和脂类主要出现在脂滴部分, 因此观察到1660和2852 cm-1处的峰在脂滴部分重合, 而在细胞其它部位没有明显重合的现象. 此外, 随着顺铂作用时间的延长, 细胞内非脂滴区域蛋白质的成像结果没有发生明显变化, 说明细胞内蛋白质的含量和分布基本稳定. 因此在后面数据处理中皆以细胞内非脂滴区域1660 cm-1处的峰强度作为内标. 拉曼成像结果表明, 细胞在凋亡过程中, 细胞色素c会从线粒体中释放到细胞质中, 被细胞内活性氧氧化而信号强度减弱, 并逐渐消失. 细胞中的脂质会在细胞凋亡过程中显著增多, 这可能是由细胞凋亡过程中细胞中的脂质受到活性氧作用发生团聚所致[19].
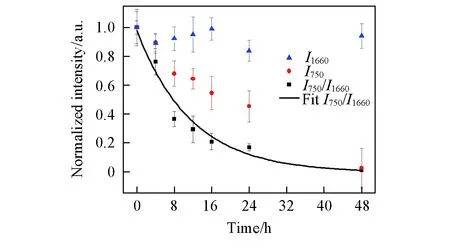
Fig.4 Intensity of 750 and 1660 cm-1 peaks and ratio of I750/I1660 of the cells after being treated with 4 mmol/L cisplatin for different time
2.2.2 细胞色素c与蛋白质拉曼信号相对强度分析 在药物与细胞作用不同时间的拉曼成像数据中, 蛋白质酰胺Ⅰ带(1660 cm-1)的强度随时间变化不大(图4), 表明细胞内的蛋白质总量与个体差异不明显, 而且在细胞凋亡过程中也不会发生明显变化; 而归属于细胞色素c的750 cm-1处的峰则变化显著. 因此选择1660 cm-1处的峰作为内标, 研究细胞与药物作用后细胞色素c的含量变化. 实验中, 每个作用时间随机选择3个细胞作为平行样品. 每个细胞随机选取细胞质中5个12×12像素的拉曼信号进行分析. 数据选择过程中注意避开脂滴聚集区域. 由图4可见, 在没有药物作用条件下, 细胞中I750/I1660的比值较高, 说明此时细胞中的细胞色素c含量较高. 当加入顺铂作用4 h 和8 h后,I750/I1660的比值显著降低, 说明细胞内的细胞色素c含量降低; 继续延长作用时间,I750/I1660的比值继续减小; 作用48 h后该比值趋于零, 表明细胞色素c基本消失. 因此, 通过拉曼成像研究, 可以根据细胞内细胞色素c的含量和分布, 灵敏地判断细胞是否发生凋亡, 以及凋亡的程度, 并且可以同时观察细胞在凋亡过程中蛋白质、 脂质等的动态变化, 这对研究细胞的早期凋亡机制具有重要意义. 而常规MTT实验由于只能宏观地评估细胞活性, 因此在药物作用的短时间内, 无法通过MTT实验统计结果说明药物是否开始诱导细胞凋亡, 因此, 拉曼成像法对研究单细胞凋亡过程具有独特的优势.
3 结 论
通过拉曼成像技术研究了顺铂诱导细胞凋亡过程中, 细胞内相关生物分子的含量变化与分布形态. 拉曼成像结果表明, 宫颈癌CaSki细胞与顺铂作用后, 细胞色素c会从线粒体中释放到细胞质中, 且随着作用时间的延长, 细胞色素c的含量逐渐减少, 脂质发生氧化和聚集, 验证了顺铂诱导细胞内产生活性氧而导致细胞凋亡的药物机制. 在顺铂与宫颈癌Caski细胞作用短时间后, 细胞色素c与细胞内蛋白质的拉曼信号强度比会减小, 因此将细胞色素c作为细胞凋亡的标记分子, 可以获得细胞凋亡早期的分子变化信息. 传统细胞活性实验(MTT法)结果表明, 顺铂作用CaSki细胞24 h后的IC50值为4 mmol/L, 但顺铂诱导细胞凋亡早期(8 h内), 作用时间与存活率时间相关性较差. 与MTT法的结果相比, 拉曼成像在研究药物与细胞作用过程中具有更高的时空分辨率, 可以更灵敏地反映细胞凋亡早期生物分子的变化规律, 为研究药物与细胞的作用机制提供了分子水平上的信息.
[1] Alvarez-Barrientos A., Arroyo J., Canton R., Nombela C., Sanchez-Perez M.,Clin.Microbiol.Rev., 2000, 13(2), 167—195
[2] Davey H. M., Kell D. B.,Microbiol.Rev., 1996, 60(4), 641—696
[3] Winson M. K., Davey H. M.,Methods, 2000, 21(3), 231—240
[4] Hansma H. G.,Proc.Natl.Acad.Sci., 1999, 96(26), 14678—14680
[5] Barer M. R., Harwood C. R.,Adv.Microb.Physiol., 1999, 41, 93—137
[6] Yao Z., Rut C. L.,Annu.Rev.Microbiol., 2014, 68, 459—476
[7] Chidananda S. M., Satyamoorthy K., Rai L., Manjunath A. P., Kartha V. B.,Int.J.Cancer, 2006, 119(1), 139—145
[8] Ostrowska K. M., Garcia A., Meade A. D., Malkin A., Okewumi I.,leary J. J., Martin C., Byrne H. J., Lyng F. M.,Analyst, 2011, 136(7), 1365—1373
[9] Diao M. K., Liu C. Y., Liu H. W., Li J. T., Li F., Mehryar M. M., Wang Y. J., Zhan S. B., Zhou Y. B., Zhong R. G., Zeng Y.,LifeSci., 2015, 127, 46—52
[10] Bedford S.,Br.J.Nurs., 2009, 18(2), 80—84
[11] Zhang H. P., Zheng C., Lu L., Zou Y. B., Wang C. H., Xu S. P., Xu W. Q., Fan Z. M., Lu L. J., Han B.,Chem.J.ChineseUniversities, 2014, 35(9), 1877—1882(张海鹏, 郑超, 路璐, 邹亚斌, 王翠花, 徐抒平, 徐蔚青, 范志民, 路来金, 韩冰. 高等学校化学学报, 2014, 35(9), 1877—1882
[12] Gonzalez V. M., Fuertes M. A., Alonso C., Perez J. M.,Mol.Pharmacol., 2001, 59(4), 657—663
[13] Kelland L.,Nat.Rev.Cancer, 2007, 7(8), 573—584
[14] Natile G., Coluccia M.,Top.Biol.Inorg.Chem., 1999, 1, 73—98
[15] Xie F., Zhang J. W., Pan T. T., Zhou C., Ren H., Jin Q. H., Mu Y.,ChemJ.ChineseUniversities, 2014, 35(1), 30—36(解飞, 张金伟, 潘婷婷, 周超, 任昊, 金钦汉, 牟颖. 高等学校化学学报, 2014, 35(1), 30—36)
[16] Matthaus C., Chernenko T., Newmark J. A., Warner C. M., Diem M.,Biophys.J., 2007, 93(2), 668—673
[17] Novakova O. K., Jana M., Jaroslav N., Giovanni B.,NucleicAcidsRes., 2003, 31(22), 6450—6460
[18] Okada M., Smith N. I., Palonpon A. F., Endo H., Kawata S., Sodeoka M., Fujita K.,Proc.Natl.Acad.Sci., 2012, 109(1), 28—32
[19] Miyajima J. N., Yoshioka K., Tachibana M., Tazaki H., Murai M.,Br.J.Cancer, 1997, 76(2), 206—210
[20] Robert S., Marullo R., Werner E., Degtyareva N., Moore B., Altavilla G., Ramalingam S. S., Doetsch P. W.,PlosONE, 2013, 8(11), 81162
[21] Berndtsson M., Hagg M., Panaretakis T., Havelka A. M., Shoshan M. C., Linder S.,Int.J.Cancer, 2007, 120(1), 175—180
[22] Bragado P., Armesilla A., Silva A., Porras A.,Apoptosis, 2007, 12(9), 1733—1742
[23] Hamada K., Fujita K., Smith N. I., Kobayashi M., Inouye Y., Kawata S.,J.Biomed.Opt., 2008, 13(4), 044024—044027
[24] Zheng J. W., Gu R. A., Lu T. H.,Chem.J.ChineseUniversities, 2002, 23(1), 42—45(郑军伟, 顾仁敖, 陆天虹. 高等学校化学学报, 2002, 23(1), 42—45
(Ed.: S, Z, M)
Study on Apoptosis Process of CaSkiviaFast Line-scanning Raman Imaging†
† Supported by the National Basic Research Program of China(No.2013CB933703).
ZHANG Jinliang, MA Xin, XU Mengxi, ZONG Cheng*, REN Bin*
(StateKeyLaboratoryofPhysicalChemistryofSolidSurfaces,CollegeofChemistryandChemicalEngineering,XiamenUniversity,Xiamen361005,China)
Cisplatin-induced apoptosis of CaSki cell was studiedviaRaman imaging technique. Fast line-scanning Raman imaging method could reveal the high temporal and spatial information of biomolecules including cytochrome c, protein and lipid during the apoptosis process. The results indicate that the relative intensity of cytochrome c to protein(I750/I1660) could reflect the stage of apoptosis. Compared with the traditional methylthiazoletetrazolium(MTT) method, Raman imaging could investigate the apoptosis of single living cell at a much higher temporal resolution and provide the molecular fingerprint information for revealing the cell-drug interaction.
Cervical cancer; Cytochrome c; Apoptosis; Raman spectroscopy; Raman imaging; Methylthiazoletetrazolium(MTT) method
2016-04-20.
日期: 2016-06-27.
国家重点基础研究计划项目(批准号: 2013CB933703)资助.
10.7503/cjcu20160265
O657.37; O644
A
联系人简介: 任 斌, 男, 博士, 教授, 主要从事拉曼光谱、 电化学和单细胞研究. E-mail: bren@xmu.edu.cn
宗 铖, 男, 博士, 主要从事拉曼光谱、 电化学和单细胞研究. E-mail: czong@xmu.edu.cn

