锂铝基类水滑石的制备及其光催化性能表征*
孔婷婷,张颖萍,张亚刚,周安宁
(西安科技大学 化学与化工学院, 西安 710054)
锂铝基类水滑石的制备及其光催化性能表征*
孔婷婷,张颖萍,张亚刚,周安宁
(西安科技大学 化学与化工学院, 西安 710054)
CO2作为温室气体的主要成分,其捕集与光催化利用已成为减排的主要手段。高效节能的CO2吸附剂和光催化剂的制备成为近年来研究的热点。本文采用共沉淀法,制备了一系列类水滑石Li/Al-LDHs(Li/Al- layered double hydroxides)催化剂。通过原子吸收光谱(AAS)、X射线衍射(XRD)、扫描电镜(SEM)、热重分析(TG)、紫外可见分光光度计(UV)等技术对样品进行表征。考察了不同制备条件(pH值、水浴时间)及Ti4+的添加对类水滑石的结构、形貌及CO2光催化性能的影响。结果表明,pH值在7~8,水浴时间为36 h时的Li3Al1-LDHs结晶度最好。不同摩尔比的Li/Al-LDHs均具有光催化反应活性;Ti1Li3Al1-LDHs的光催化性能较好,CH4产率较高。
CO2; 光催化; 类水滑石; Li/Al-LDHs; Ti4+; 甲烷
0 引 言
类水滑石,亦被称为层状双金属氢氧化物(LDHs,layered double hydroxides),因其阳离子可替代性及阴离子可交换性,在吸附剂、催化剂的制备等诸多方面应用广泛[1-4]。Walspurger等[5-8]对Mg基LDHs的CO2捕集性能进行了研究,发现在常压、中温条件下,其CO2吸附效果最好。Ye等[9]采用共沉淀法合成了不同摩尔比的Cu/Al-LDHs,并研究了其CO2吸附性能。贺学智等制备了一系列多金属类水滑石,并研究其光催化转化CO2-H2O的活性。发现,不同元素组合对CO2光催化产物的选择性不同,Ti4+的存在使反应产物更多的为CO和CH4。近期研究发现,在LDHs中引入特定的功能离子,可强化其特殊的“记忆效应”,较好地实现材料的回收再利用,达到节能环保的目的[10]。因此,其成为CO2光催化还原中的重要选择对象,在环境治理方面显示出广阔的应用前景[11]。
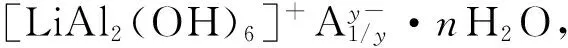
因此,本文采用共沉淀法制备了一系列锂铝基类水滑石,考察了制备条件对锂铝基类水滑石结构和光催化性能的影响,以及钛元素的添加对类水滑石性能的影响,为后期复合材料的制备打下基础。
1 实 验
1.1 样品的制备
锂铝基类采用共沉淀法[17]进行制备,具体制备方法如下:
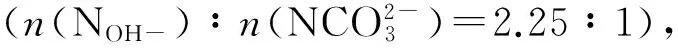
用同样的方法制备Li/Al摩尔比为1∶2、2∶1的水滑石样品,记为Li1Al2-LDHs、Li2Al1-LDHs。
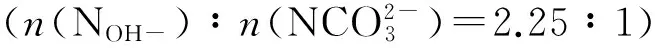
1.2 样品的表征
样品的金属元素比例的检测均采用德国耶拿公司的原子吸收光谱仪 AAS Various 6测定。样品的晶体结构均采用日本理学公司的台式X射线衍射MiniFlex600测定,测定的条件为:Cu靶Kα辐射,管电压30.0 kV,管电流10.0 mA,步程0.02,扫描范围3~80°。样品的微观形貌采用日本日立冷场发射SU8010样品的TG-DSC 分析采用瑞士梅特勒-托利多公司生产的热分析仪测定,测试时连续通入氮气,测试的温度范围为35~700 ℃,升温速率为10 ℃/min。样品的紫外-可见漫反射光谱采用美国Perkin Elmer Lambda 950型紫外可见分光光度计测定,将BaSO4作为参比标准白板,进而得到紫外-可见漫反射光谱。
1.3 (Ti)/Li/Al-LDHs光催化还原CO2的实验
图1为光催化还原 CO2的石英固定床反应器及在线检测系统。在连续进样式活性评价系统中测试所有的样品光催化转化CO2-H2O(g)的活性。将1.0 g催化剂均匀平铺在石英管中间部位,打开水汽发生器,温度上升至设定温度60 ℃后,打开CO2气瓶及流量控制器,流量为80 mL/min,连续通入CO2气体10 min以排出管道内空气。在紫外光(光源采用河北旭普瑞电光源制造有限公司生产的型号为T8UVC,功率为30 W,波长为325 nm紫外灯)照射下进行CO2光催化还原,还原后的混合气体由上海灵华仪器有限公司制造的GC9890型气相色谱仪进行在线定量分析。
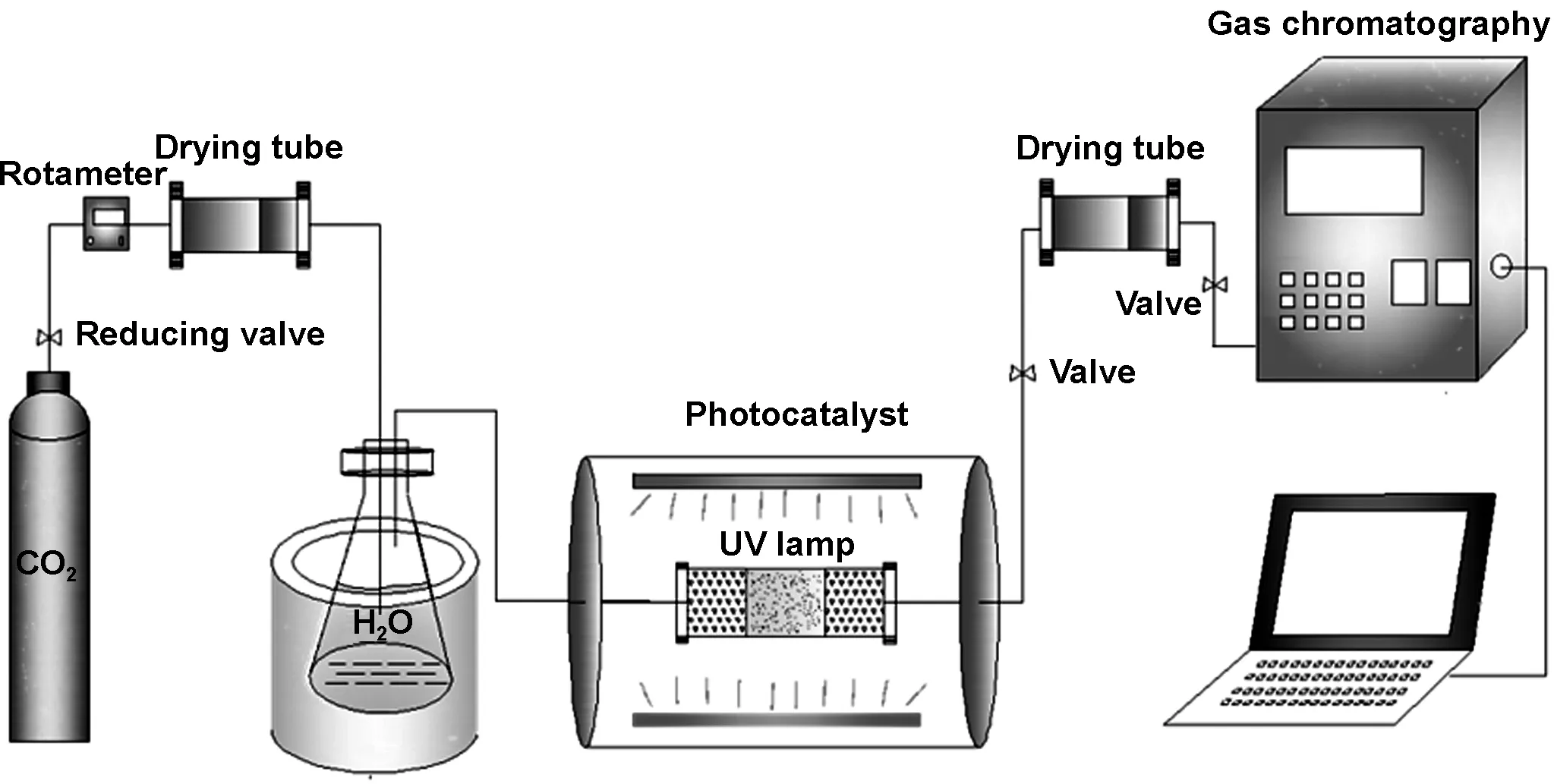
图1 光催化还原CO2的装置图
Fig 1 Schematic drawing of the apparatus for CO2photoreduction
2 结果与讨论
2.1 XRD分析
类水滑石的结构与性能与其制备方法、原料及其配比、体系酸碱度、晶化时间等有关,理想的类水滑石制备方法应满足制备方法简单、结晶度好等特点。图2、3和4为不制备条件下的(Ti)/Li/Al-LDHs的XRD谱图。由XRD谱图可知,所有样品均呈现类水滑石的等晶面衍射峰,为典型的LDHs层状结构特征衍射峰。其中,Li/Al-LDHs在11.88,23.46,35.58,47.10,63.03和64.74°附近出现该水滑石(003)、(006)、(112)、(118)、(300)、(303)等晶面有特征衍射峰;在(006)晶面有双峰出现,与文献[18]中报道的Li/Al-LDHs的XRD谱图类似,说明层间出现一价Li+电荷。这是因为Li+半径与Mg2+相近,易于替代Mg2+、Al3+形成水滑石阳离子层,但其电荷量小,进入层板后由于电荷密度不均匀而使晶胞结构产生变形,在(006)晶面处出现峰的分裂[19]。
2.1.1 金属元素变化对Li/Al-LDHs结构的影响
图2为不同物质量比的Ti4+、Li+、Al3+的(Ti)/Li/Al-LDHs的XRD图谱。
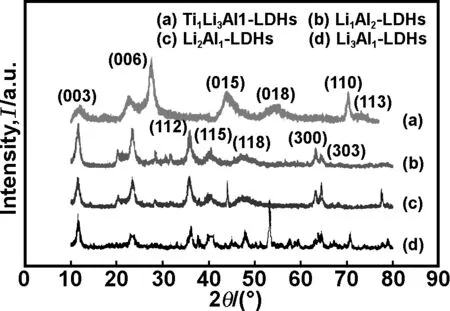
图2 不同物质量比的Ti4+、Li+、Al3+的(Ti)/Li/Al-LDHs XRD图谱
Fig 2 XRD patterns of (Ti)/Li/Al-LDHs with different Ti4+、Li+、Al3+mole ratio
比较图2(a)和(d)发现,与Li3Al1-LDHs相比,Ti1Li3Al1-LDHs衍射峰宽且峰型弥散,说明Ti元素的添加使样品结构发生了改变,结晶度变小。这是因为添加Ti4+会使层间产生多于的正电荷,使层板间产生排斥,导致结晶度下降,八面体结构畸变[20]。
进一步比较图2(b)和(d)可以看出,随着Al3+含量的下降和Li+含量的增加,Li/Al-LDHs的特征衍射峰逐渐变弱,杂峰变多,结晶度下降。这说明由一价锂离子取代二价的锌、镁离子,层板间电荷量减小,电荷密度不均匀,随着电荷密度的减小,二价和三价阳离子的比例失调,导致晶胞结构变形,此时的杂质主要为LiO.H2O[21]。
2.1.2 合成条件对Li/Al-LDHs结构的影响
图3为Li3Al1-LDHs分别在pH值在7~8、8~9、9~10、10~11时的X 射线衍射图谱。
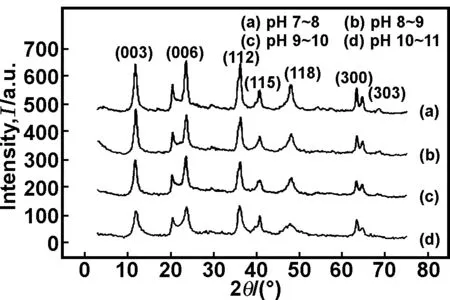
图3 不同pH值Li3Al1-LDHs的XRD
Fig 3 The XRD patterns of Li3Al1-LDHs in different pH
从图中可以看出,不同pH值条件下合成的Li3Al1-LDHs均显示出水滑石的特征衍射峰(003)、(006)、(009)、(105)、(110)等。比较图3(a)-(d)发现,随着pH值的不断增大,水滑石的衍射峰逐渐变宽,峰形不再尖锐,说明Li3Al1-LDHs的结晶度逐渐下降。
图4中显示了Li3Al1-LDHs在不同水浴时间的X 射线衍射图谱。从图中可以看出,随着水浴时间的延长,水滑石的特征衍射峰逐渐尖锐、规整,半峰宽先减小后增大。在水浴时间为36 h时,Li3Al1-LDHs的层间距较大,d值更符合d(003)=2d(006)=3d(009)的特征,表明在36 h时水滑石结晶度最好,层板结构最规整。
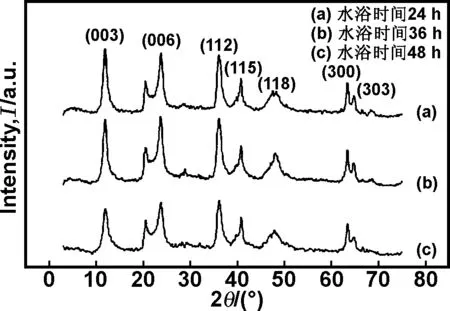
图4 不同水浴时间Li3Al1-LDHs的XRD
Fig 4 The XRD patterns of Li3Al1-LDHs on different water bath time
2.2 SEM分析
图5分别为Li3Al1-LDHs和Ti1Li3Al1-LDHs的SEM照片。由图可以知,所有样品的类水滑石层片结构明显,图5(a)、(b)中的Li3Al1-LDHs为六边形片状结构。由图5(c)和(d)可知,添加Ti元素后,Ti1Li3-Al1-LDHs样品发生了团聚,晶体结构发生改变,六边形的层片结构变形,与图2中XRD的分析结果一致。

图5 Li3Al1-LDHs与Ti1Li3Al1-LDHs的SEM检测图
Fig 5 SEM images of Li3Al1-LDHs and Ti1Li3Al1-LDHs sample
2.3 TG分析
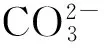
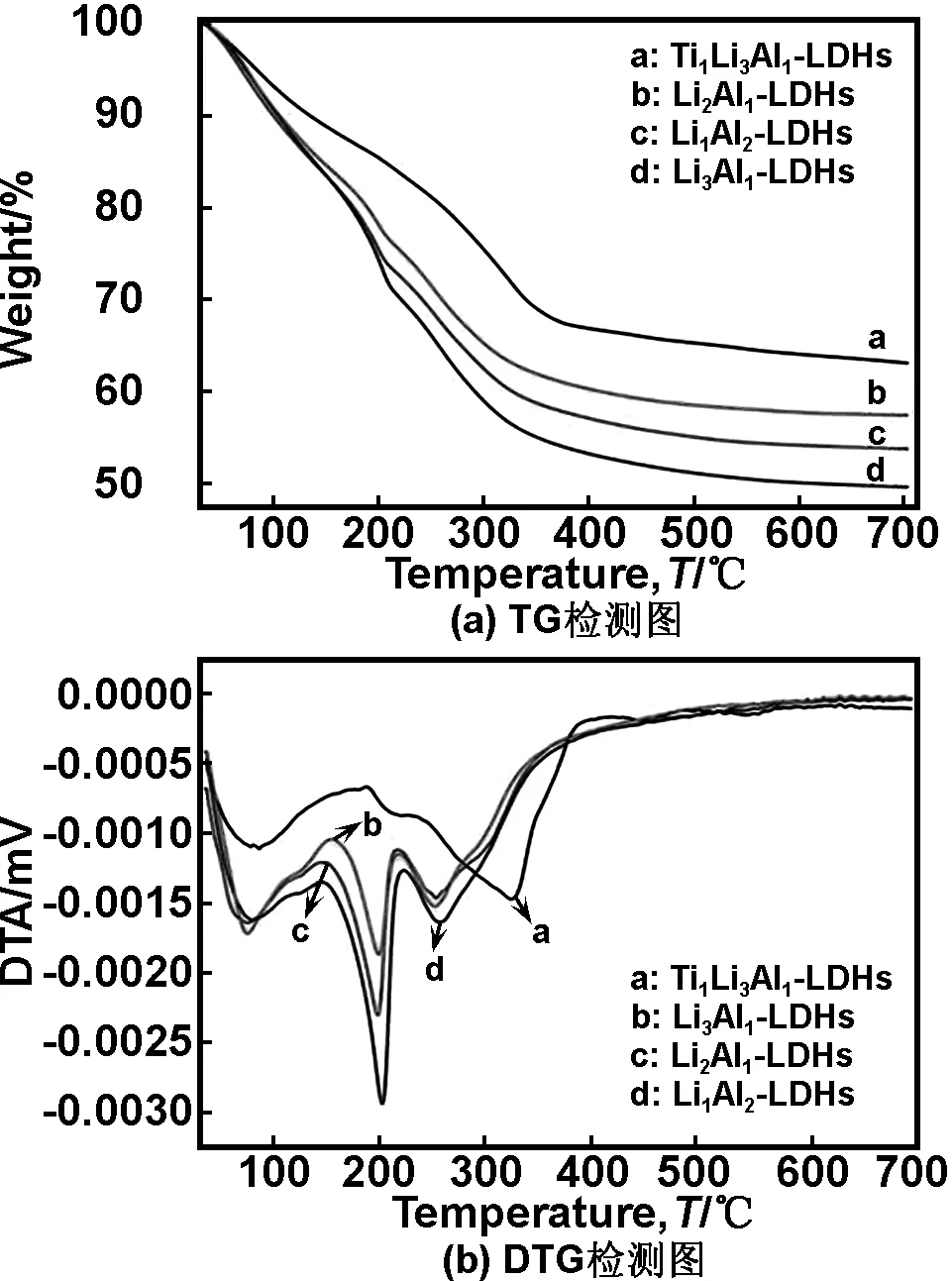
图6 (Ti)/Li/Al-LDHs的TG与DTG检测图
Fig 6 TG and DTG analysis of (Ti)/Li/Al-LDHs sample
2.4 UV分析
图7为Li/Al-LDHs及Ti1Li3Al1-LDHs类水滑石样品的UV-vis漫反射吸收光谱。由图7可知,所制备的类水滑石均呈现响应紫外光的半导体吸收特性,可以参与CO2光催化反应。图中7(a)-(d)的切线分别落在392、370、380和386 nm附近的位置,对应的半导体带隙分别为3.16、3.35、3.26和3.21 eV。比较图7(b)-(d)可以发现,随着Li/Al-LDHs中Li+含量的下降和Al3+含量的上升,对应的半导体带隙逐渐变窄,价带顶的电子更容易跃迁到导带底成为自由电子,同时在价带顶形成空穴,电导率增高。这是由于Al3+含量的增加,使类水滑石层板间的电荷密度增加,有利于光催化反应的进行,这与文献中[23]报导一致。从图7(a)中Ti1Li3Al1-LDHs的分析结果来看,Ti元素的添加,使紫外-漫反射吸收光谱吸收边红移更明显,进一步向可见光区偏移。因此,理论上Ti元素的添加将会进一步提高锂铝基类水滑石的光催化效率。
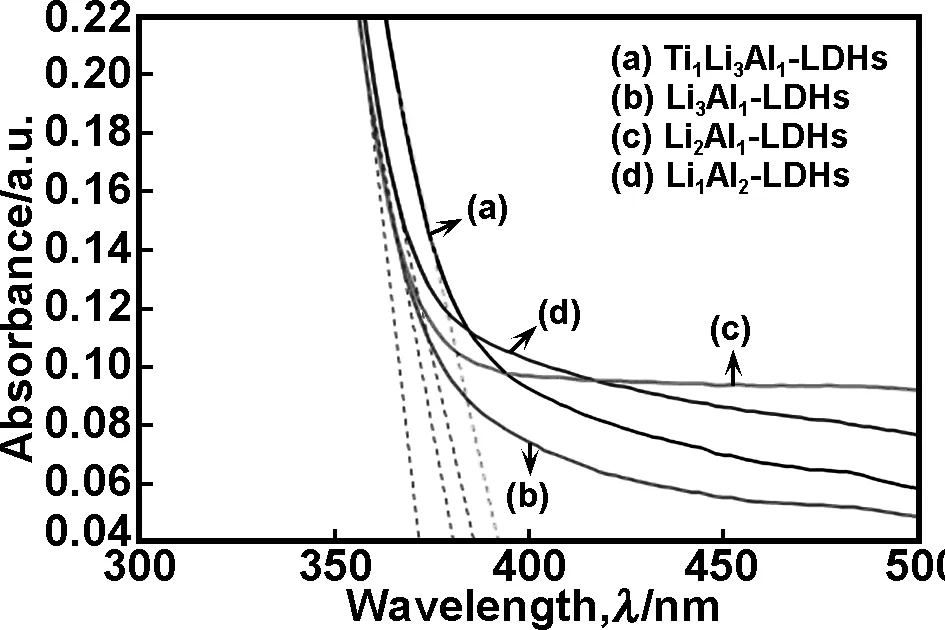
图7 (Ti)/Li/Al-LDHs的UV-Vis图
2.5 (Ti)/Li/Al-LDHs光催化活性的探讨
由图8中可以看出,所有样品的CH4产率随反应时间的增加而上升,进行到3.5 h后CH4产率基本稳定。这表明该反应中,充足的水蒸气和充足的光照可以促进CO2光催化还原反应的进行,H2O是光催化反应中唯一的氢源,光催化激发后产生的光生电子与H2O和CO2充分的碰撞和结合,产生·OH和·CO2-两种中间态物质,促进了甲烷的选择性生成[24]。比较图8(a)-(d)发现,随着Li/Al-LDHs中Li+含量的下降和Al3+含量的上升,CH4产率增加,类水滑石的光催化活性增加。其中,图8(a)中Ti1Li3Al1-LDHs的CH4产率最高为1.30 mmol/g,而Li3Al1-LDHs的CH4产率为0.74 mmol/g,这说明Ti元素是一种潜在的光催化元素,Ti4+的添加可以提高类水滑石的光催化性能[25]。
图8结合图2、6和7分析发现,锂铝基类水滑石具有层状结构半导体特性,其光催化还原CO2的反应与Cu/Fe/Al-LDHs的光催化反应原理类似[26],但CH4产率比Cu/Fe/Al-LDHs增加。该反应过程主要是通过光催化分解H2O获得·H,CO2结合光生电子生成·CO2-(CO2-为可以改变CO2的电子亲和性亚稳定态物质),·CO2-再通过与·H的多步反应生成CH4,整个过程需要8和H+及8个e-。因此,对中间产物·H和·CO2-进行调控,抑制逆反应的发生,减少空穴和电子复合的机率是该反应的关键。
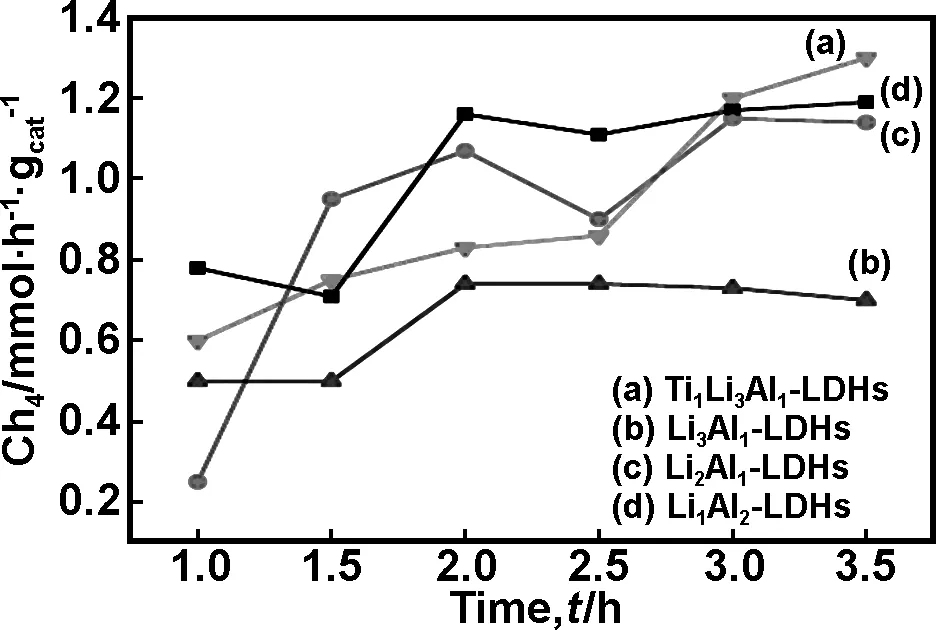
图8 不同物质量比的Ti4+、Li+、Al3+的(Ti)/Li/Al-LDHs的CH4产率
Fig 8 Yields of CH4for (Ti)/Li/Al-LDHs with different Ti4+,Li+、Al3+mole ratio
3 结 论
锂铝基类水滑石为典型的近似六边形的层状结构半导体材料,最佳合成条件为pH值为7~8,水浴时间为36 h。在锂铝基类水滑石光催化剂存在下,CO2的水蒸气还原的主要产物为CH4,且CH4产率随着Li/Al-LDHs中Al3+含量的增加。当Li/Al-LDHs层板间引入Ti4+时,类水滑石晶体结构和热稳定性均发生改变,紫外-漫反射吸收光谱向可见光区偏移,CH4产率明显增加。
[1] JiaWei Wang, Lee A. Stevens, Trevor C. Drage, et al. Preparation and CO2adsorption of amine modified Mg-Al LDH via exfoliation route[J]. Chemical Engineering Science, 2012, 68: 424-431.
[2] Aschenbrenner O, McGuire P, Alsamaq S, et al. Adsorption of carbon dioxide on hydrotalcite-like compounds of different compositions[J]. Chemical Engineering Research and Design, 2011, 89(9): 1711-1721.
[3] Hadnadjev-Kostic M, Vulic T, Ranogajec J, et al. Thermal and photocatalytic behavior of Ti/LDH nanocomposites[J]. J Therm Anal Calorim, 2013, 111:1155-1162.
[4] Khaled Hosni, OmarAbdelkarim, Najoua Frini-Srasra, et al. Synthesis, structure and photocatalytic activity of calcined Mg-Al-Ti-layered double hydroxides[J]. Korean J Chem Eng, 2015, 32(1), 104-112.
[5] Walspurger S, Cobden P D, Safonova O V, et al. High CO2storage capacity in alkali-promoted hydrotalcite-based material:Insitu detection of reversible formation of magnesium carbonate[J]. Chemistry A European Journal, 2010, 16: 12694 -12700.
[6] Yang X F,Zhao L F, Xiao Y H. Effect of NaNO3on MgO-CaCO3absorbent for CO2capture at warm temperature[J]. Energy & Fuels, 2013, 27: 7645-7653.
[7] Zhang K L, Li X H, Duan Y H, et al. Roles of double salt formation and NaNO3in Na2CO3-promoted MgO absorbent for intermediate temperature CO2removal[J]. International Greenhouse Gas Control, 2013, 12: 351-358.
[8] Halabi M H, De Croon M H J M, Vander S J, et al. High capacity potassium- promoted hydrotalcite for CO2capture in H2production[J]. International Journal of Hydrogen Energy, 2012, 37(5): 4516-4525.
[9] Lwin Y, Abdullah F. High temperature adsorption of carbon dioxide on Cu-Al hydrotalcite-derived mixed oxides: kinetics and equilibria by thermogravimetry[J]. Therm Anal Calorim,2009, 97: 885-889.
[10] Katsumata K, Sakai K, Ikeda K, et al. Preparation and photocatalytic reduction of CO2on noble metal(Pt, Pd, Au) loaded Zn-Cr layered double hydroxides[J]. Mater Lett, 2013, 107: 138.
[11] Olivares-Marín M, Maroto-Valer M M. Development of adsorbents for CO2capture from waste materials: a review[J]. Greenhouse Gases Sci Technol, 2012, (1)2: 20-35.
[12] IPCC. Special report on renewable energy sources and climate change mitigation [EB/OL]. http://www.ipcc.ch/report/srren/, 2011.
[13] Bhown A S, Freeman B C. Analysis and status of post-combustion carbon dioxide capture technologies[J]. Environ Sci Technol, 2011, 45: 8624-8632.
[14] Wang S L, Lin C H, Yan Y Y, et al. Synthesis of Li/Al LDH using aluminum and LiOH[J]. Appl Clay Sci, 2013, 72: 191-195.
[15] Hang L, Wang J, Gao Y, et al. Synthesis of LiAl2-layered double hydroxides for CO2capture over a wide temperature range[J]. J Mater Chem A, 2014, 43(2): 18454-18462.
[16] Cheng Ya, Zhou Jiabin, Wang Lei, etal. Adsorption of fluorion from aqueous solution by calcined layered lithium/aluminum hydroxides[J]. Environmental Pollution and control, 2012, 3(2):34-38. 成 娅, 周家斌, 王 磊,等. 焙烧态:锂铝水滑石对水中氟离子吸附性能研究[J]. 环境污染与防治, 2012, 3(2): 34-38.
[17] Tomohito Kameda, Testu Shinmyou, To Shioka. Kinetic and equilibrium studies on the uptake of Nd3+and Sr2+by Li-Al layered double hydroxide intercalated with 1- hydroxyethane -1, 1- diphonicacid[J]. Journal of Industrial and Engineering Chemistry, 2016, 36: 96-101.
[18] Azzou A, Arus V A, Platon N, et al. Polyol-modified layered double hydroxides with attenuated basicity for a truly reversible capture of CO2[J]. Adsorption, 2013, 19: 909-918.
[19] Shao M, Han J, Wei M, et al. The synthesis of hierarchical Zn-Ti layered double hydroxide for efficient visible-light photocatalysis[J]. Chem Eng J, 2011, 168: 519-524.
[20] Teruel L, Bouizi Y, Atienzar P. Hydrotalcities of zinc and titanium as precursors of finely dispersed mixed oxide semiconductors for dye-sensitized solar cells[J]. Energy Environ Sci, 2010, 3: 154-159.
[21] Jun Q, Xiaoman H, Bentao W. Synthesis of Li-Al Layered double hydroxides via a mechanochemical route[J]. Applid Clay Sci, 2016, 120: 24-27.
[22] Saber O,Tagaya H. New layered double hydroxide, Zn-Ti LDH: preparation and intercalation reactions[J]. Journal of Inclusion Phenomena and Macrocyclic Chemistry, 2003, 45 (1-2): 107-115.
[23] Iguchi S, Teramura K, Hosokawa S, et al. Photocatalytic conversion of CO2in an aqueous solution using variouskinds of layered double hydroxides[J]. Catalysis Today, 2015, 251: 140-144.
[24] Centi G,Perathoner S. Opportunities and prospects in the chemical recycling of carbon dioxide to fuels[J]. Catalysis Today, 2009, 148(3/4): 191-205.
[25] Hosni K, Abdelkarim O, Frini-Srasra N. Synthesis, structure and photocatalytic activity of calcined Mg-Al-Ti-layered doublehydroxides[J]. Korean J Chem Eng, 2015, 32(1): 104-112.
[26] Kong Tingting, Zhang Yingping, Zhou Anning. The preparation of Cu/Fe/Al-LDHs and photocatalytic reduction of CO2to prepare CH4[J]. Journal of Xi’an University of Science and Technology, 2015, 36(1):86-91. 孔婷婷, 张颖萍, 周安宁. Cu/Fe/Al-LDHs的制备及其光催化还原CO2制备CH4研究[J]. 西安科技大学学报, 2015, 36(1): 86-91.
Preparation and photocatalytic properties of hydrotalcite- like Li/Al-LDHs
KONG Tingting, ZHANG Yingping, ZHANG Yagang, ZHOU Anning,
(College of Chemistry and Chemical Engineering, Xi’an University of Science and Technology,Xi’an 710054, China)
CO2(Carbon dioxide) is the main greenhouse gases. The capture and photocatalysis is considered to be one of the effective approaches for reducing carbon dioxide emission. So, the preparation of CO2adsorption and photocatalysis materials is being a research hot spot, which is of high efficiency and low enregy consumption. A series of Hydrotalcite like Li/Al-LDHs catalytic materials were prepared by coprecipitation method and characterized by atoimc absorption spectrophotometer (AAS), X ray diffraction (XRD), scanning electron microscopy (SEM), thermal gravimetric analysis (TG) and ultraviolet visible spectrophotometer (UV), etc. The influence of preparation condition(contain ph and water bath time) and adding Ti4+on the structure, morphology and CO2photocatalytic properties of LDHs was discussed. The results showed that, the Li3Al1-LDHs displays the highest crystallinity when the ph in 7-8 and water bath time for 36 h. Meanwhile, all the moles ratios of Li/Al-LDHs were photocatalytic activities. The photocatalytic activity and the productivity of CH4were improved of Ti1Li3Al1-LDHs obtained by adding Ti4+.
carbon dioxide; photocatalysis; layered double hydroxides; Li/Al-LDHs; titanium; methane
1001-9731(2016)12-12255-06
国家自然科学基金资助项目(51074122)
2016-10-09
2016-11-25 通讯作者:周安宁,E-mail: psu564@139.com
孔婷婷 (1981-),女,湖南常德人,博士,师承周安宁教授,从事新型环保材料研究。
TQ424.1
A
10.3969/j.issn.1001-9731.2016.12.045

