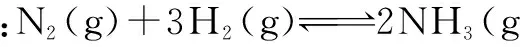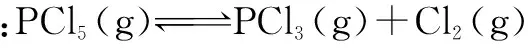增加反应物 反应物的转化率如何变化
张新中●
江苏省邗江中学(225012)
增加反应物 反应物的转化率如何变化
张新中●
江苏省邗江中学(225012)
化学平衡中,反应物的转化率会因为平衡移动而发生变化,其中比较难的是增加反应物而导致反应物的转化率的变化情况,文章通过实例讲解其变化情况,帮助学生理解掌握.
化学平衡;反应物;转化率;等效平衡
化学平衡移动中经常考查增加反应物,判断反应物转化率如何变化的试题,学生往往因知识掌握不透或没有掌握方法而出现错误.本文通过实例帮助学生理解掌握该方面知识.
一、增加固体或纯液体

①增加C的量 ②将容器的容积缩小一半 ③保持容积不变,充入Ar使体系压强增大 ④保持压强不变,充入Ar使容器容积增大
A.①② B.①③ C.②③ D.①④
解析 C是固体,所以增加C的量,平衡不移动,H2O(g)的转化率不变;容器的容积缩小一半,压强增大,平衡逆向移动,H2O(g)的转化率减小;保持容积不变,充入Ar,与反应有关的物质的物质的量浓度均未发生改变,所以平衡不移动,H2O(g)的转化率不变;保持压强不变,充入Ar使容器容积增大,反应体系的分压变小,平衡正向移动,H2O(g)的转化率增大.答案:B
例2 常温下,0.01mol·L-1的H2CO3溶液中加少量水稀释,下列数值减小的是( ).
A.Ka1B.H2CO3电离度
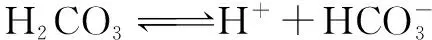

点拨 固体或纯液体的浓度是定值.在有气体参加的反应中,改变固体或纯液体的量,物质的浓度不发生改变,则反应速率不变,平衡不发生移动;在溶液中进行的反应,改变水的量,会导致其它物质的浓度发生改变,则电离平衡或水解平衡等会发生移动,一般来说,越稀越电离或越水解.
二、增加气体
1.有两种反应物
(1)恒温恒容条件下,增加一种反应物

A.0.9mol B.0.8mol
C.0.7mol D.0.6mol
解析 向平衡体系中再充入水蒸气,即增加了反应物的浓度,平衡向正反应方向移动,CO2大于0.6mol.又原平衡H2O的转化率为60%,再加入0.3mol水后,水的转化率小于60%,0.3mol水最多转化:0.3×60%=0.18mol,平衡时的CO2小于0.6+0.18=0.78mol.
答案:C
(2)恒温恒容条件下,等倍增加两种反应物
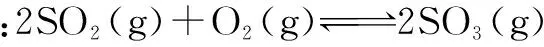
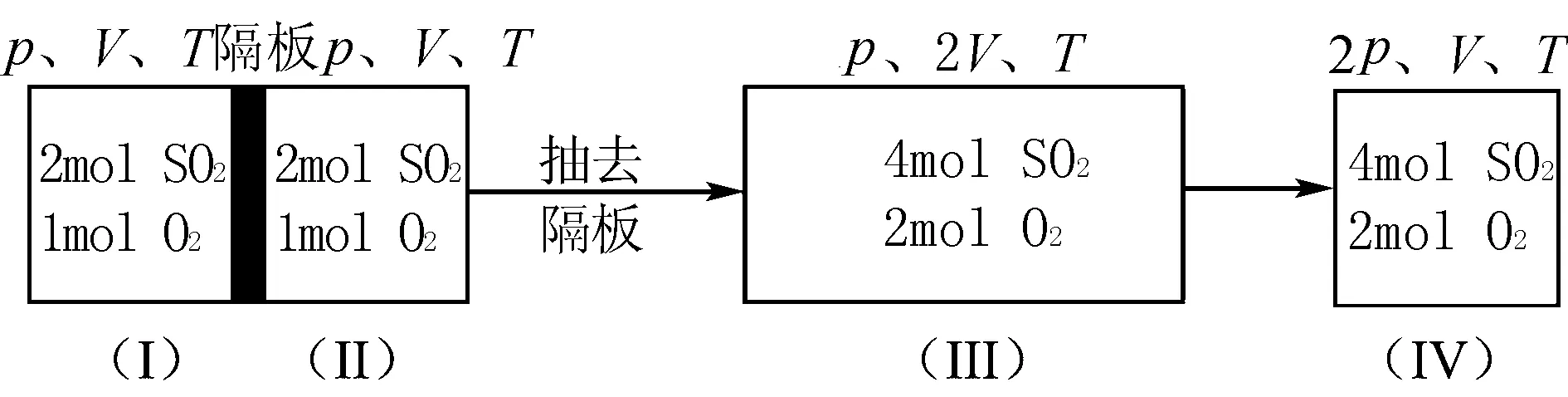
A.a>bB.a 解析 由题意知,两次投料后达平衡时并不等效,直接进行判断比较困难,故可以采取构建等效平衡的方法解决问题,确定中间状态,然后在等效平衡的基础上改变条件,看平衡向哪个方向移动,从而得到最终结果.设开始时在VL容器中盛有2 mol SO2和1mol O2,在同一温度同一容器中,最初投入4 mol SO2和2mol O2,则有: (Ⅰ)、(Ⅱ)具有完全相同的状态,当抽出隔板后,外界条件不变,所得状态(Ⅲ)中SO2的转化率与(Ⅰ)、(Ⅱ)相同,仍为a.状态(Ⅳ)是(Ⅲ)加压的结果,而增大压强,平衡将向气体体积缩小的方向移动.故SO2的转化率增大,则b>a.答案:B ①若a+b=c+d,增加A、B的浓度,A、B的转化率不变. ②若a+b>c+d,增加A、B的浓度,A、B的转化率变大. ③若a+b (3)恒温恒容条件下,不等倍增加两种反应物 A.升高温度 B.充入He(g),使体系压强增大 C.将H2O(g)从体系中分离 D.再充入1.20 mol CO和0.80 mol H2O (g) 解析 升高温度,平衡逆向移动,CO转化率减小,A项错误;充入He(g),体系压强增大,但浓度不变,平衡不移动,CO转化率不变,B项错误;将H2O(g)从体系中分离,平衡逆向移动,CO转化率减小,C项错误;若再充入1.20 mol CO和0.60 mol H2O (g),则与原平衡等效,CO转化率与原平衡相同,现多加了0.20mol H2O (g),平衡正向移动,CO转化率增大,D项正确.答案:D 点拨 对于不等倍增加反应物的情况,一般有两种方法:①先根据等效平衡原理,将题干中要求的物质用完,计算出与原反应等倍投入的另一种物质的量,若另一种物质过量,则所求物质的转化率增大;若另一种物质不足,则所求物质的转化率减小.②根据平衡常数用“三行式”计算出转化率,再与原平衡相比较. (4)恒温恒压条件下,等倍增加两种反应物 A.x=yB.x>yC.x 解析 恒温恒压条件下,第二次投料量是第一次的3倍,投料量成正比,故两平衡等效,平衡转化率相等.答案:A 点拨 恒温恒压条件下,等倍增加两种反应物,则构成等效平衡,反应物转化率与原平衡相同. 2.只有一种反应物 A.2P1>P2B.PCl5的分解率增大 C.2P1 解析 设开始时在VL容器中盛有amol PCl5,达到平衡时PCl5的分解率为α .在同一温度同一容器中,最初投入2amol PCl5,则有: (Ⅰ)、(Ⅱ)具有完全相同的状态,平衡时为等效平衡.当抽出隔板后,外界条件不变,所得状态(Ⅲ)中PCl5的分解率、Cl2的体积分数与(Ⅰ)、(Ⅱ)相同.状态(Ⅳ)是(Ⅲ)加压的结果,而增大压强,平衡将向气体体积缩小的方向移动,即向逆反应方向移动,故PCl5的分解率和Cl2的体积分数都减小,压强也减小,因此p2<2p1,答案为A. 特点示例又加入平衡移动方向压强变大对平衡的影响移动结果ⅠΔn>0PCl5(g)PCl3(g)+Cl2(g)PCl5正方向逆方向α(PCl5)减小,φ(PCl5)增大ⅡΔn=02HI(g)H2(g)+I2(g)HI不移动α(HI)不变,φ(HI)不变ⅢΔn<02NO2(g)N2O4(g)NO2正方向α(NO2)增大,φ(NO2)减小 [1]王祖浩主编.化学反应原理[M].南京:江苏凤凰教育出版社,2015:32-56 [2]王后雄主编.重难点手册[S].武汉:华中师范大学出版社 G632 B 1008-0333(2016)28-0084-02