青霉啤酒糟培养基配方优化研究
宾冬梅,戴丽丹,2,李玉中
(1.衡阳师范学院生命科学与环境学院,湖南衡阳421008;2.娄底市第一中学城南校区,湖南娄底417000)
青霉啤酒糟培养基配方优化研究
宾冬梅1,戴丽丹1,2,李玉中1
(1.衡阳师范学院生命科学与环境学院,湖南衡阳421008;2.娄底市第一中学城南校区,湖南娄底417000)
为了更好地利用啤酒糟,从富含纤维素的土壤中分离和筛选纤维素高效降解的青霉,在纯啤酒糟中加入不同比例的N源、C源配制不同的培养基,接种等量活化后的青霉孢子悬浮液,观察菌丝生长情况以及测定菌株的酶活力和产生的孢子数,筛选促进菌株生长的最优配方。结果表明,最优N源是胰蛋白胨,最适比例为25∶1;最优C源是乳糖,最适比例为25∶1;这2种化合物混合,N源、C源分别为25∶1,30∶1时,菌丝生长最旺盛,产孢子数最多,为7.80×109个/mL;N源、C源分别为30∶1,25∶1时,羧甲基纤维素钠(CMCNa)酶活力最高,达476 U/mL。表明啤酒糟可以作为青霉的优良培养基,对选育优良的啤酒糟纤维素分解菌具有一定的指导意义。
青霉1-4;啤酒糟;N源;C源;纤维素酶
啤酒糟是生产啤酒的主要原料大米、麦芽等经糊化、糖化工艺进行过滤或压滤之后残留的固体物质,主要成分包括蛋白质、纤维组分、维生素、脂肪、矿物质及淀粉[1]等,且含水量大,容易变质。啤酒企业直接将啤酒糟作为粗饲料销售,因纤维含量高、适口性差,养殖户不能完全接收[2-5],不少企业将其作为废弃物排放,不仅造成资源浪费,甚至产生严重的环境污染。针对啤酒糟粗纤维及粗蛋白高的营养特点,优选出纤维素酶高产菌,将纤维素分解成可供利用的糖类,再经酵母菌和枯草芽孢杆菌进行二次混菌发酵,生产出高微生物蛋白啤酒糟饲料或微生态制剂,达到立体开发啤酒糟的目的。
目前,国内外产纤维素酶的主要菌种有曲酶、木霉等[6-11],暂时无利用青霉菌种的报道。本试验从富含纤维素的土壤中分离和筛选纤维素高效降解青霉,以啤酒糟为主料,以加入不同C源、N源的比例来观察青霉生长数目与形态,从而得出青霉产纤维素酶活性最高的培养配方,为啤酒糟开发利用提供参考。
1 材料和方法
1.1 材料
1.1.1 试验材料试验所用啤酒糟取自衡阳燕京啤酒厂,经过干燥,过0.149 mm筛,储存备用;从富含纤维的土壤中提取活性菌种,在实验室鉴定为青霉。
1.1.2 富集培养基滤纸条液体培养基:NaCl 0.1 g,(NH4)2SO43.0 g,FeSO4·7H2O 0.005 g,KH2PO41.0 g,MnSO4·H2O 0.001 6 g,MgSO4·7H2O 0.5 g,ZnSO4· 7H2O 0.001 7 g,CaCl20.1 g,CoCl20.002 g,蒸馏水1 000 mL(将5 mL混合液加入试管,之后再放入1 cm×6 cm的滤纸条灭菌即是滤纸条液体培养基),pH值6.5。活化培养基(PDA培养基):马铃薯200 g,葡萄糖20 g,琼脂18 g,蒸馏水1 000 mL。参照方中达[12]方法配制。刚果红纤维素琼脂培养基[13]:KH2PO40.5 g,MgSO40.25 g,琼脂14 g,明胶2 g,纤维素粉1.88 g(纤维素粉预先经1 mmol/L盐酸冷处理12 h,以水清洗无盐酸后用来配制培养基),刚果红0.2 g,蒸馏水1 000 mL,pH值7.0。
1.1.3 试验仪器DHG-9240型电热恒温鼓风干燥箱,宁波江南仪器厂;722S可见分光光度计,上海精密科学仪器有限公司;FA2004N电子天平,河南兄弟仪器设备有限公司;HH-(S)6数显恒温水浴锅,金坛市安普实验仪器厂;SW-SJ-1F单人双面洁净工作台,上海博讯实业有限公司医疗设备厂;SPX-150BSH-Ⅲ生化培养箱,上海新苗医疗器械制造有限公司;BXM-30R立式压力蒸汽灭菌器,上海博讯实业有限公司医疗设备厂;移液枪,上海垒固仪器有限公司。
1.1.4 试验用品锥形瓶(若干),培养皿(若干),接种环,酒精灯,1 000 μL规格移液枪,1 mL规格移液枪头(若干),50~100 mL规格小烧杯(若干),滴管,血球计数板,酒精,无菌薄膜,脱脂棉,纱布,细线,标签纸,废报纸等。
1.1.5 试验药品葡萄糖、蔗糖、乳糖、淀粉、麦芽糖、胰蛋白胨、酵母粉、硫酸铵、牛肉膏、尿素、灭菌水、吐温-80、NaOH溶液,酒石酸钾钠、结晶酚、无水亚硫酸钠、磷酸氢二钠液、3,5-二硝基水杨酸、羧甲基纤维素钠(CMCNa)、1 g/mL标准葡萄糖液。
1.2 试验方法
1.2.1 青霉的分离与鉴定在衡阳市的郊区及祁东县采集稻田土壤样本,经无菌水混合,充分振荡,灭菌纱布过滤,静置,上清液接种于滤纸条液体培养基进行富集培养3 d,取富集后的培养液涂布接种到PDA培养基平板(倒平板之前加100 μL/mL的青霉液和硫酸链霉素)上,恒温培养,进行菌株分离,将分离纯化得到的菌株活化并配制成孢子悬浮液,分别点接到刚果红纤维素琼脂培养基中,3次重复,恒温培养,用十字交叉法测量菌落直径和透明圈直径。根据菌落生长状态、透明圈大小、透明圈清晰程度及菌落和透明圈的比值,筛选菌株。用显微镜观察菌丝及孢子梗形状,并用油镜观察其孢子形态,参阅《中国真菌志》[14]等鉴定为青霉,命名为青霉1-4。
1.2.2 C源、N源的最优配方
1.2.2.1 青霉1-4孢子液的制备将青霉1-4接种于活化培养基上,于25℃培养5~6 d进行活化后,取10 mL无菌生理盐水洗下孢子,加1滴吐温-80打散孢子团块,用血球计数板计数,调整孢子浓度至106个/mL,用于下面的接种试验。
1.2.2.2 最适N源的筛选与比例分别以酵母粉、硫酸铵、胰蛋白胨、牛肉膏、尿素为N源,使加入的总N量为5%,加入10 g啤酒糟中,每种N源3个重复,接种青霉1-4,用封口膜封口,置于25℃恒温箱中培养6 d,观察菌株长势,选出最优的N源。
根据试验结果,设定啤酒糟的量和最优N源的比例分别为5∶1,10∶1,15∶1,20∶1,25∶1,40∶1等6个处理,即往6个35 g灭菌的啤酒糟中分别加入7.0,3.5,2.3,1.8,1.4,0.9 g最优N源混匀,每处理各分装入已灭菌的3个培养皿(直径90 mm)中,然后接种青霉1-4,用封口膜封口,置于25℃恒温箱中培养6 d,观察结果。
1.2.2.3 最适C源的筛选与比例取C源分别为淀粉、葡萄糖、蔗糖、乳糖各0.5 g,加入10 g的啤酒糟中,每种C源3个重复,接种青霉1-4,用封口膜封口,置于25℃恒温箱中培养6 d,观察菌株长势,选出最优C源。
根据试验结果,设定啤酒糟的量和最优C源的比例分别为20∶1,25∶1,30∶1,35∶1,40∶1等5个处理,即往10 g灭菌的啤酒糟中分别加入0.5,0.4,0.33,0.29,0.25 g最优C源混匀,每处理各分装入已灭菌的3个培养皿(直径90 mm)中,然后接种青霉1-4,用封口膜封口,置于25℃恒温箱中培养6 d,观察结果。
1.2.2.4 C源、N源的最优配方根据试验结果,设定啤酒糟的量,最佳C源、N源同啤酒糟的质量比例分别设为(20∶1,20∶1),(20∶1,25∶1),(20∶1,30∶1),(25∶1,20∶1),(25∶1,25∶1),(25∶1,30∶1),(30∶1,20∶1),(30∶1,25∶1),(30∶1,30∶1)9组进行处理,另设置一个不加C源、N源的空白对照组,每处理3个重复。每处理根据比例分别加入30 g啤酒糟中混匀,各分装入已灭菌的3个培养皿(直径90 mm)中,然后接种青霉1-4,用封口膜封口,置于25℃恒温箱中培养6 d,观察试验。
1.2.3 酶活力与孢子数测定
1.2.3.1 试剂的配制DNS试剂:将6.3 g的3,5-二硝基水杨酸和2 mol/L NaOH溶液262 mL,加到500 mL含有185 g酒石酸钾钠的热水溶液中,再加5 g结晶酚和5 g亚硫酸钠,搅拌溶解,冷却后加蒸馏水定容至1 000 mL,贮于棕色瓶中保存,静置7 d后使用。
pH值为5.0的柠檬酸缓冲液:制取0.2 mol/L磷酸氢二钠液(称取7.16 g磷酸氢二钠溶解于蒸馏水中,定容至100 mL)和0.1 mol/L的柠檬酸液(称取2.1 g柠檬酸溶解于蒸馏水中定容至100 mL),取磷酸氢二钠液24.3 mL、柠檬酸液25.7 mL混匀。
羧甲基纤维素溶液:准确称取2.0 g羧甲基纤维素钠盐溶于200 mL水中,沸水浴中加热至溶化,过滤,取滤液100 mL,加柠檬酸缓冲液20 mL、蒸馏水40 mL,混匀,贮存于冰箱中备用。
1 mg/mL葡萄糖标准溶液:准确称取80℃烘至恒质量的葡萄糖(AR)100 mg,置于小烧杯中,加入少量蒸馏水溶解后,转移到100 mL容量瓶中,用蒸馏水定容至100 mL,混匀,4℃冰箱中保存备用。
1.2.3.2 葡萄糖标准曲线的制作取7支25 mL具塞刻度试管编号,分别加入质量浓度为1 mg/mL的葡萄糖标准液0,0.2,0.4,0.6,0.8,1.0,1.2 mL,蒸馏水2,1.8,1.6,1.4,1.2,1.0,0.8 mL和DNS试剂1.5 mL,摇匀并在水浴中准确加热5 min后取出,冰浴至室温,蒸馏水定容至25 mL,加塞后混匀,在波长540 nm处测定光密度值,以光密度值为纵坐标、葡萄糖含量为横坐标,绘制葡萄糖标准曲线。
1.2.3.3 羧甲基纤维素钠酶活力的测定[15-16]各培养基中的啤酒糟及空白对照的啤酒糟加蒸馏水100 mL,40℃水浴振荡浸提1 h,脱脂棉过滤,滤液于3500r/min下离心5min,上清液即粗酶液。25mL具塞试管中加入1.5 mL以pH值5.0柠檬酸缓冲液配制的1%羧甲基纤维素钠溶液,置于50℃水浴中预热5 min。加入0.5 mL粗酶液,摇匀,50℃准确反应40 min,之后加入DNS试剂1.5 mL,放入沸水浴显色5 min,取出后立即置于冰水中冷却至室温,定容至10 mL,摇匀。在波长540 nm条件下测定其吸光值。
酶活单位的定义:上述反应条件下,每分钟催化纤维素水解生成1 μg葡萄糖的酶量为1个酶活力单位,用U/mL表示。
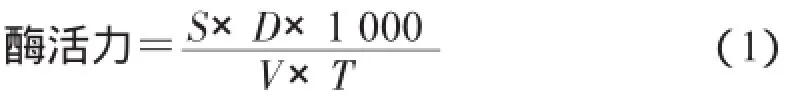
其中,S为样品平均吸光值在标准曲线上相对应的葡萄糖含量(mg);D为定容的体积(mL);V为参与反应的粗酶液体积(mL);T为反应时间(min)。1.2.3.4孢子数的测定用生理盐水洗脱下生长于啤酒糟培养基上(每皿1/8体积)的青霉孢子(每皿加入10 mL灭菌生理盐水,用三角玻璃涂棒在菌落上轻轻划动,使孢子洗下),加入一滴吐温-80将孢子打散,取一滴用血球计数板在显微镜下计数。
使用1 mm×1 mm方格计数,25×16型的血球计数板计数公式:酵母细胞数(个/mL)=80个小方格细胞总数/80×400×10 000×稀释倍数×8。
2 结果与分析
2.1 N源的筛选
2.1.1 最适N源在分别加有酵母粉、硫酸铵、胰蛋白胨、牛肉膏、尿素5种不同N源的啤酒糟培养基中,于恒温培养箱中25℃下培养5~6 d后,观察青霉菌株的长势发现,加入了硫酸铵、尿素、牛肉膏的啤酒糟比较湿润黏稠,表面未见菌丝和孢子生长。对加入了酵母粉和胰蛋白胨的培养基进行对比发现,加入了胰蛋白胨的培养皿中青霉1-4的菌丝覆盖啤酒糟的面积更加密集(图1)。因此,最优N源为胰蛋白胨。

2.1.2 最适N源的比例确定根据已得知的最优N源,将等量啤酒糟与所加N源的量设置成梯度分别为5∶1,10∶1,15∶1,20∶1,25∶1,40∶1的培养基,于25℃恒温培养箱中统一培养5~6 d,经观察,胰蛋白胨为25∶1的培养基中白色绒毛状的菌丝覆盖密集度大于其他比例,而5∶1和10∶1这2个处理中的菌丝生长非常稀疏,明显差于15∶1的处理,因而,将其中的4个生长较好的处理进行了拍照对比(图2)。

为减少试验误差,按上述方法重复试验,培养相同的时间,发现2次试验都是一致的,25∶1含氮培养基中的青霉1-4长势最好,所以,得出最适N源比例为25∶1。
2.2 C源的筛选
2.2.1 C源的筛选在分别加有葡萄糖、乳糖、淀粉、蔗糖4种不同C源的啤酒糟培养基中,于恒温培养箱中25℃下培养5~6 d后,观察青霉菌株的长势发现,加入了乳糖的啤酒糟中表面有覆盖灰绿色绒毛状的孢子,啤酒糟间还长有白色菌丝,其长势比加入淀粉、葡萄糖、蔗糖的啤酒糟要明显,所以,最优C源为乳糖,下一步将通过设定啤酒糟的量和最优C源的不同比例,来研究青霉1-4最适生长比例(图3)。

2.2.2 最适C源的比例确定根据已得知的最优C源,将等量啤酒糟与所加C源的量设置成梯度分别为20∶1,25∶1,30∶1,35∶1,40∶1的培养基,于25℃恒温培养箱中统一培养,经观察,乳糖比例为30∶1,35∶1,40∶1的3组培养基菌丝和孢子长势不明显,所以,将乳糖比例为20∶1,25∶1以及空白对照组进行了对比拍照,发现乳糖为25∶1的培养基中基本被灰绿色绒毛状的菌丝和孢子所覆盖,而且盖度大于乳糖20∶1以及空白对照组(图4)。

为减少试验误差,按上述方法重复试验,培养相同的时间,发现2次试验都是25∶1的含C培养基中的青霉1-4长势最好,所以,得出最适C源比例为25∶1。
2.3 N源、C源的最佳配比
根据筛选试验结果可知,最优N源胰蛋白胨产青霉菌丝最多,其比例为25∶1,最优C源乳糖产青霉孢子数最多,其比例也为25∶1,将N源20∶1,25∶1,30∶1的比例与C源20∶1,25∶1,30∶1的比例混合交叉于等量啤酒糟中,于25℃恒温培养箱中统一培养(图5),根据测定各比例的啤酒糟的酶活力以及孢子数目,可得出适宜青霉生长的最优条件为胰蛋白胨比例25∶1,乳糖比例25∶1。

2.4 羧甲基纤维素钠酶活力测定结果
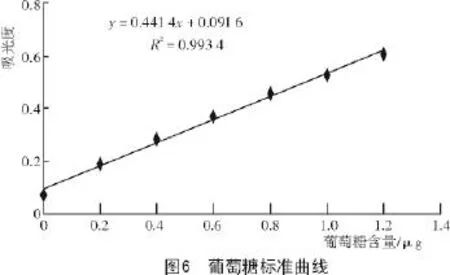
2.4.1 葡萄糖标准曲线通过测定不同含量葡萄糖的吸光值,制作出葡萄糖的标准曲线(图6),根据y=0.441 4x+0.091 6可以计算出待测液中的葡萄糖含量。
2.4.2 CMCNa酶活力测定在2.3试验的10组培养皿中,观察青霉的长势情况,挑出一个长势最好组(胰25∶1、乳30∶1),2个长势较好组(胰30∶ 1、乳25∶1和胰25∶1、乳25∶1),一个长势较差组(胰20∶1、乳25∶1)以及空白对照培养基,分别对其进行酶活力的测定。由表1可知,胰30∶1、乳25∶1组的酶活力最大,为476 U/mL,明显高于外观长势好的CMCNa酶活力,即胰蛋白胨30∶1、乳糖25∶1混合时酶活力最高。
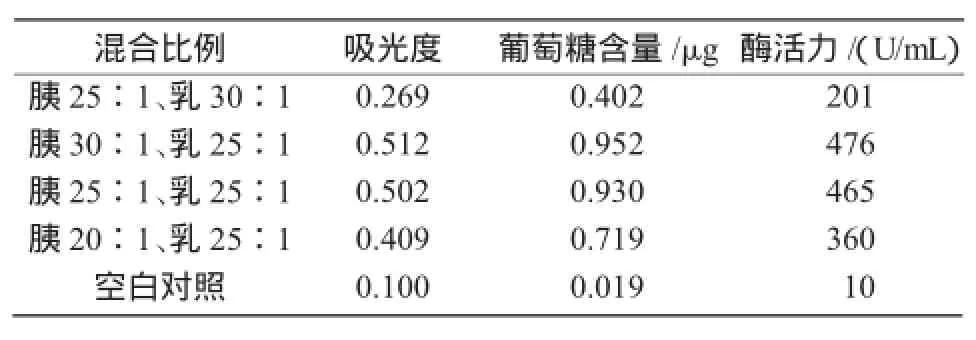
表1 酶活力的测定结果
2.5 不同培养基上青霉1-4产孢子数
通过血球计数板计数可知,外观长势最好组产孢子数量最多,为7.80×109个/mL,即胰蛋白胨为25∶1、乳糖为30∶1混合时孢子数最多(表2)。
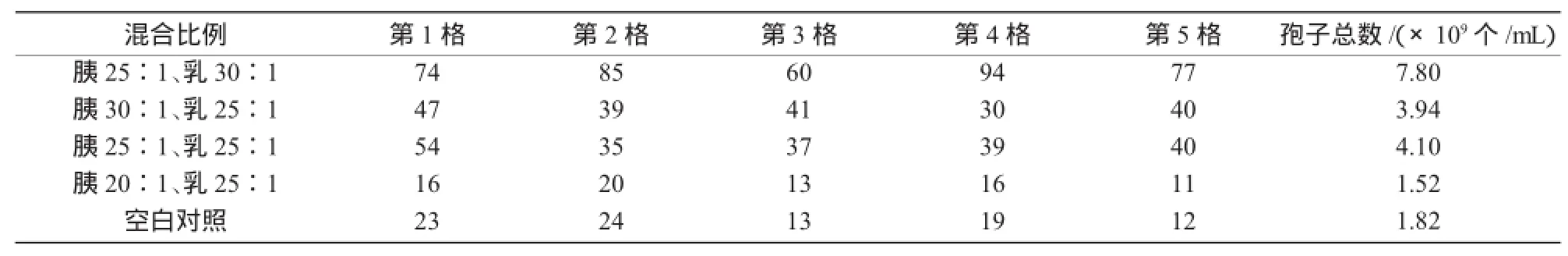
表2 孢子数的测定
3 结论与讨论
为提高青霉对啤酒糟的利用率,通过以啤酒糟为主料研究青霉的培养基配方,探究不同的N源、C源及其比例对青霉生长及酶活力的影响。本试验结果表明,适宜青霉生长的最佳N源是胰蛋白胨,最适比例是25∶1;最佳C源是乳糖,最适比例是25∶1;N源胰蛋白胨与C源乳糖混合比为25∶1,30∶1时,产孢子数最多,为7.80×109个/mL,菌丝生长也最茂盛,但是其酶活力不及胰蛋白胨30∶1、乳糖25∶1组,胰蛋白胨25∶1、乳糖25∶1组和胰蛋白胨20∶1、乳糖25∶1组;N源胰蛋白胨与C源乳糖混合比为30∶1,25∶1时,CMCNa酶活力达到476 U/mL。显示出菌丝生长的茂盛程度与其产生的孢子数成正比,但与酶活力并不成正比。表明青霉在基质条件适合下处于生长的旺盛时期,主要进行细胞的分裂与增生,因而,表现出分泌的酶类相对减少,可以根据使用目的选择不同的培养基质。
[1]邓启华,傅力,王德良,等.啤酒糟成分测定及饲料开发的研究——蛋白含量及纤维组分的分析[J].啤酒科技,2008(12):52-54.
[2]孙丹凤,王友炜,王聪.发酵啤酒糟营养价值评定及对肉鸡生长性能的影响[J].饲料工业,2009(17):26-28.
[3]王冰,方热军.酶解发酵啤酒糟在动物生产中的应用[J].广东饲料,2011(8):41-42.
[4]蔡俊.啤酒糟发酵生产蛋白饲料的研究[J].粮食与饲料工业,2001(3):30-31.
[5]郭素环,周碧君,文明,等.酒糟生物饲料对肉牛育肥及免疫功能的影响[J].广东农业科学,2013(14):126-129.
[6]杜先林,李辉,王义强,等.里氏木霉Rut-30产纤维素酶发酵条件的优化[J].中南林业科技大学学报,2010(9):112-119.
[7]刘小杰.康氏木霉ZJ5纤维素酶发酵培养基优化[J].浙江大学学报:工学版,2003(5):127-132.
[8]王仪明.绿色木霉固态发酵产纤维素酶活力的研究[J].草业科学,2009(5):123-127.
[9]李燕红,赵辅昆.纤维素酶的研究进展[J].生命科学,2005(5):20-25.
[10]王洪媛,范丙全.三株高效秸秆纤维素降解真菌的筛选及其降解效果[J].微生物学报,2010(7):870-875.
[11]魏亚琴,李红玉.纤维素酶高产菌选育研究进展及未来趋势[J].兰州大学学报:自然科学版,2008(1):107-115.
[12]方中达.植病研究方法[M].北京:中国农业出版社,1998:46.
[13]王淑军,杨从发,陈静.用于降解秸秆的纤维素酶产生菌的筛选研究[J].粮食与饲料工业,2001(12):21-23.
[14]孔华忠.中国真菌志[M].北京:科学出版社,2007:54-56.
[15]Coward-Kelly G,Aiello-Mazzari C,Kim S,et al.Suggested improvements to the standard filter paper assay used to measure cellulase activity[J].Biotechnology and Bioengineering,2003,82(6):745-749.
[16]许玉林,郑月霞,叶冰莹,等.一株纤维素降解真菌的筛选及鉴定[J].微生物学通报,2013(2):220-227.
Optimization Study of the Penicillium Medium Formula with Brewer's Grains
BIN Dong-mei1,DAI Li-dan1,2,LI Yu-zhong1
(1.College of Life Science and Environment,Hengyang Normal University,Hengyang421008,China;2.Loudi No.1 Middle School,Loudi 417000,China)
To better utilize the brewer's grain,Penicilliumwith efficient degradation of cellulose was separated and screened from soil rich in cellulose.The paper chose some factors including different N source,C source and different proportion of inoculation amount after the activation of spore suspension ofPenicillium,observed mycelium growth situation and determined the number of spores and enzyme activity of strains,screened the optimal formula to promote the growth of the strain.The results showed that the best medium compositions were as follows:the optimal N source was tryptone,the optimal ratio of25∶1;the optimal C source was lactose,the optimal ratio of 25∶1;N source and C source were 25∶1 and 30∶1,respectively,and the mycelium growth was the most vigorous,the maximum number of spore was 7.80×109cells/mL,CMCNa enzyme activity was the highest up to476 U/mL.It shows that brewer's grain can be used as a good medium formula of the Penicillium,and it has a certain guiding significance for the selection of the efficient degradation of cellulose bacteria.
Penicillium sp.1-4;brewer's grains;Nsource;Csoure;cellulase
TS262.5
A
1002-2481(2016)02-0164-06
10.3969/j.issn.1002-2481.2016.02.08
2015-11-03
湖南省自然科学基金省市联合基金项目(14JJ5001)
宾冬梅(1970-),女,湖南衡阳人,教授,主要从事农产品开发与利用的教学及研究工作。

