siRNA干扰血管生成素2基因表达抑制小鼠肝癌移植瘤生长
李 霞, 何攀文, 吴建红, 朱清静, 蔡艳萍, 韩晓群
1武汉市医疗救治中心肝病科,武汉 4300232华中科技大学同济医学院附属武汉中心医院检验科,武汉 4300143宜春学院医学院微生物与免疫学教研室,宜春 336000
#同为第一作者
siRNA干扰血管生成素2基因表达抑制小鼠肝癌移植瘤生长
李 霞1#, 何攀文2#, 吴建红1, 朱清静1, 蔡艳萍1, 韩晓群3△
1武汉市医疗救治中心肝病科,武汉 4300232华中科技大学同济医学院附属武汉中心医院检验科,武汉 430014
3宜春学院医学院微生物与免疫学教研室,宜春 336000
目的 探讨siRNA干扰血管生成素2(Ang-2)基因表达对小鼠肝癌移植瘤生长的抑制作用。方法 分别以转染pLVX-shRNA-Ang-2、pLVX-Ang-2的人肝癌HepG2细胞及未转染的HepG2细胞为来源,建立裸鼠皮下移植瘤模型。实验分3组:pLVX-shRNA-Ang-2组、pLVX-Ang-2组和对照组,每组10只。观察并测量瘤体体积,各组肿瘤组织分别行苏木精-伊红染色及透射电子显微镜下观察,对比病理改变。分别采用Real-timePCR和Westernblot检测肿瘤组织中Ang-2基因和蛋白表达,采用免疫荧光染色检测CD34表达。结果 与pLVX-Ang-2组和对照组比较,pLVX-shRNA-Ang-2组瘤体体积小,组织坏死不明显,肿瘤细胞超微结构基本正常,Ang-2基因及蛋白表达明显下降(均P<0.05),CD34表达明显下降。结论 采用siRNA干扰技术敲除Ang-2基因,能够减少肝癌组织新生血管的生成,抑制肿瘤的生长。
RNA干扰; 血管生成素2; 肝癌
原发性肝癌是世界上最常见的恶性肿瘤之一,我国每年约22万人死于该病。目前认为,对于不可切除的中、晚期肝癌,经肝动脉化疗栓塞(TACE)和经动脉灌注化疗(TAI)等介入治疗是主要治疗手段,在抑制肿瘤生长,提高患者生存率等方面取得了明显效果。TACE是通过栓塞肿瘤的供血动脉使得肿瘤缺血坏死,同时抗肿瘤药物可在肿瘤局部缓慢释放起到化疗作用。但现在已有研究表明:TACE后肿瘤和正常组织缺血、缺氧可使肿瘤细胞及瘤周正常细胞分泌促血管生成物质,如成纤维细胞生长因子(fibroblast growth factor,FGF)和血管内皮生长因子(vascular endothelial growth factor,VEGF)等,使肿瘤血管侧支循环形成,增加了再次TACE治疗的难度,是肝癌复发和转移及肝癌患者预后不良的主要影响因素。
新近发现血管生成素(angiopoietin,Ang)在血管新生中作用显著,尤其是血管生成素2(angiopoietin-2,Ang-2),特异表达于肿瘤边缘的血管重建区,参与肿瘤血管新生的起始及延续过程,影响肿瘤生长及转移,有望成为一种新的抗肿瘤血管新生的靶向因子。大量研究显示,通过阻断angiopoietin-Tie-2途径治疗肿瘤是可行的,例如Oliner等[1]的研究显示Ang-2抑制剂可以抑制裸鼠表皮肿瘤的内皮细胞及肿瘤细胞的增殖,抑制新血管的形成,抑制肿瘤生长,促进肿瘤消退。Ang-2抗体还可抑制鸡胚胎结肠癌移植模型的新生血管生成[2]。但抑制Ang-2是否也可以延缓肝癌组织新生血管的生成从而抑制肝癌细胞的生长,尚未见报道。
本研究拟通过小干扰RNA(small interfering RNA,siRNA)干扰Ang-2基因表达,观察其对肿瘤抑制的体内效果,为临床抗肿瘤血管生成治疗提供依据。
1 材料与方法
1.1 材料
1.1.1 实验动物及Ang-2基因沉默载体质粒的设计、合成和定量 雌性裸鼠(约5周龄,体重18~20 g)购于武汉大学动物实验中心。siRNA分子设计、合成及Ang-2基因沉默载体质粒构建由武汉巴菲尔生物公司完成,干扰Ang-2基因的体外效应由本课题组前期完成,并经过基因测序鉴定。
1.1.2 主要实验试剂及仪器 实时荧光定量PCR仪购自ABI公司;PCR仪购自东胜创新生物科技有限公司;水平电泳仪和紫外分析仪购自北京君意东方电泳设备有限公司;Ang-2购自Santa Cruz公司;Trizol购自Invitrogen公司;cDNA第1链合成试剂盒和SYBR Green/Flourescein qPCR Master Mix(2×)购自Fermentas公司;BCA蛋白浓度测定试剂盒购自碧云天生物技术公司;β-actin抗体购自武汉博士德生物工程有限公司;显影定影试剂盒购自武汉巴菲尔生物技术有限公司;CD34(种属:兔)购自Abcam公司。由金斯瑞公司完成引物合成。
1.2 实验方法
1.2.1 细胞转染 取细胞瓶内融合度达80%的HepG2细胞;用含EDTA的0.25%胰酶消化细胞,终止消化后收集,1 200 r/min离心5 min,去上清,加RPMI 1640培养液重悬,稀释至1×106/mL,每孔2 mL接种于6孔板,正常培养24 h;取6孔板更换新鲜培养液,每孔加入20 μL慢病毒,正常培养24 h;转染后荧光镜下照相,并收集细胞。
1.2.2 动物分组及模型制作 健康雌性裸鼠30只,分为3组,分别以转染pLVX-shRNA-Ang-2的HepG2细胞(pLVX-shRNA-Ang-2组)、转染pLVX-Ang-2的HepG2细胞(pLVX-Ang-2组)及未转染的HepG2细胞(对照组)注射接种,每组10只。将提前收集好的3种细胞,浓度约为2×108/mL,在背部皮下处接种,接种剂量为0.1 mL。在接种后12 d左右,裸鼠注射接种处出现可见肿瘤,每隔7 d裸鼠称重记录体重,并测量肿瘤大小。待移植瘤清晰可见(接种后42 d左右),麻醉处死裸鼠,剥取肿瘤,照相并测量肿瘤直径。
1.2.3 肿瘤组织苏木精-伊红染色观察 将肿瘤组织以4%甲醛溶液固定,继之通过脱水、透明、包埋,制成组织蜡块。4 μm切片后,组织切片脱蜡及水化,置于苏木精染液中染色,光学显微镜下观察组织病理学改变。
1.2.4 肿瘤组织透射电子显微镜下观察 将大小约为1 mm3的肿瘤组织在0~4℃下固定于2.5%戊二醛磷酸钠缓冲液(pH 7.2~7.3)中,PBS缓冲液漂洗,再以四氧化锇固定。随后进行脱水、浸透包埋,制成超薄切片(60 nm)。染色后,在透射电子显微镜下观察肝组织超微结构变化。
1.2.5 Real-time PCR检测肿瘤组织Ang-2基因表达 用Trizol试剂提取组织总RNA。用高效RNA-cDNA试剂盒合成第1条互补DNA链,方法按说明书进行。Real-time PCR检测Ang-2的基因表达。引物设计:β-actin上游引物5′-CACGATGGAGGGGCCGGACTCATC-3′,下游引物5′-GC-AACAGTGGGGTCCTTAGAG-3′;Ang-2上游引物5′-AGTGACTGCCACGGTGAATAA-3′,下游引物5′-GCAACAGTGGGGTCCTTAGAG-3′。mRNA水平用与β-actin表达的相对量进行标准化,结果用2-ΔΔCt方法分析。
1.2.6 Western blot检测肿瘤组织中Ang-2蛋白表达 按文献[3]提取肿瘤组织匀浆蛋白,使用10×Tris-HCl SDS-PAGE提取总蛋白并转移到PVDF膜上。先后加入一抗及由辣根过氧化物酶标记的二抗进行孵育。蛋白条带通过化学发光试剂显影。BandScan分析胶片吸光度值,目标蛋白表达量以Ang-2/β-actin吸光度比值表示。
1.2.7 免疫荧光染色检测肿瘤组织CD34表达 将脱蜡水化后的组织切片用微波进行抗原修复,用山羊血清封闭切片。加一抗后于4℃湿盒中孵育过夜。于暗室中加稀释好的荧光(Cy3)标记羊抗兔IgG,湿盒中20~37℃孵育1 h,PBST冲洗切片4次,每次3 min。滴加DAPI避光孵育5 min,对标本进行染核,PBST 5 min×4次洗去多余的DAPI。用含抗荧光淬灭剂的封片液封片,然后在荧光显微镜下观察采集图像。
1.3 统计学分析
数据用均数±标准差表示,组间均数比较采用t检验或ANOVA方法分析,以P<0.05为差异有统计学意义。
2 结果
2.1 质粒构建及测序鉴定
pLVX-shRNA-Ang-2的4个单菌落用XhoⅠ行酶切鉴定,如图1所示,4个克隆均可酶切到1 320 bp的条带,为阳性克隆。并与设计序列Ang2比对,比对结果表明测序结果与设计序列一致,证明干扰载体构建成功。

A:pLVX-shRNA-Ang-2酶切鉴定;B:pLVX-shRNA-Ang-2测序结果与设计序列Ang-2比对图图1 pLVX-shRNA-Ang-2的酶切鉴定及基因测序比对Fig.1 Enzymatic detectior of pLVX-shRNA-Ang-2 and geme sequencing
2.2 肿瘤大体形态比较
在相同的干预条件和相同的生长时间下,对照组、pLVX-Ang-2组、pLVX-shRNA-Ang-2组肿瘤体积分别为(0.32±0.02)cm3、(0.19±0.01)cm3、(0.06±0.02)cm3,重量分别为(0.24±0.03)g、(0.14±0.02)g、(0.04±0.01)g(图2)。pLVX-shRNA-Ang-2组肿瘤体积和重量明显低于其他两组(P<0.05)。
2.3 干扰质粒对肿瘤组织学影响
在光学显微镜下观察发现,3组均为恶性肿瘤组织学表现,pLVX-Ang-2组和对照组表现为大面积出血、坏死和广泛的气球样变,而pLVX-shRNA-Ang-2组细胞坏死不明显(图3)。
2.4 干扰质粒对肿瘤组织超微结构影响
pLVX-shRNA-Ang-2组肿瘤细胞超微结构基本正常。对照组和pLVX-Ang-2组细胞质中糖原颗粒减少,内质网膨胀及线粒体肿胀,染色质分布不均匀,细胞质广泛空泡化,凋亡小体形成(图4)。
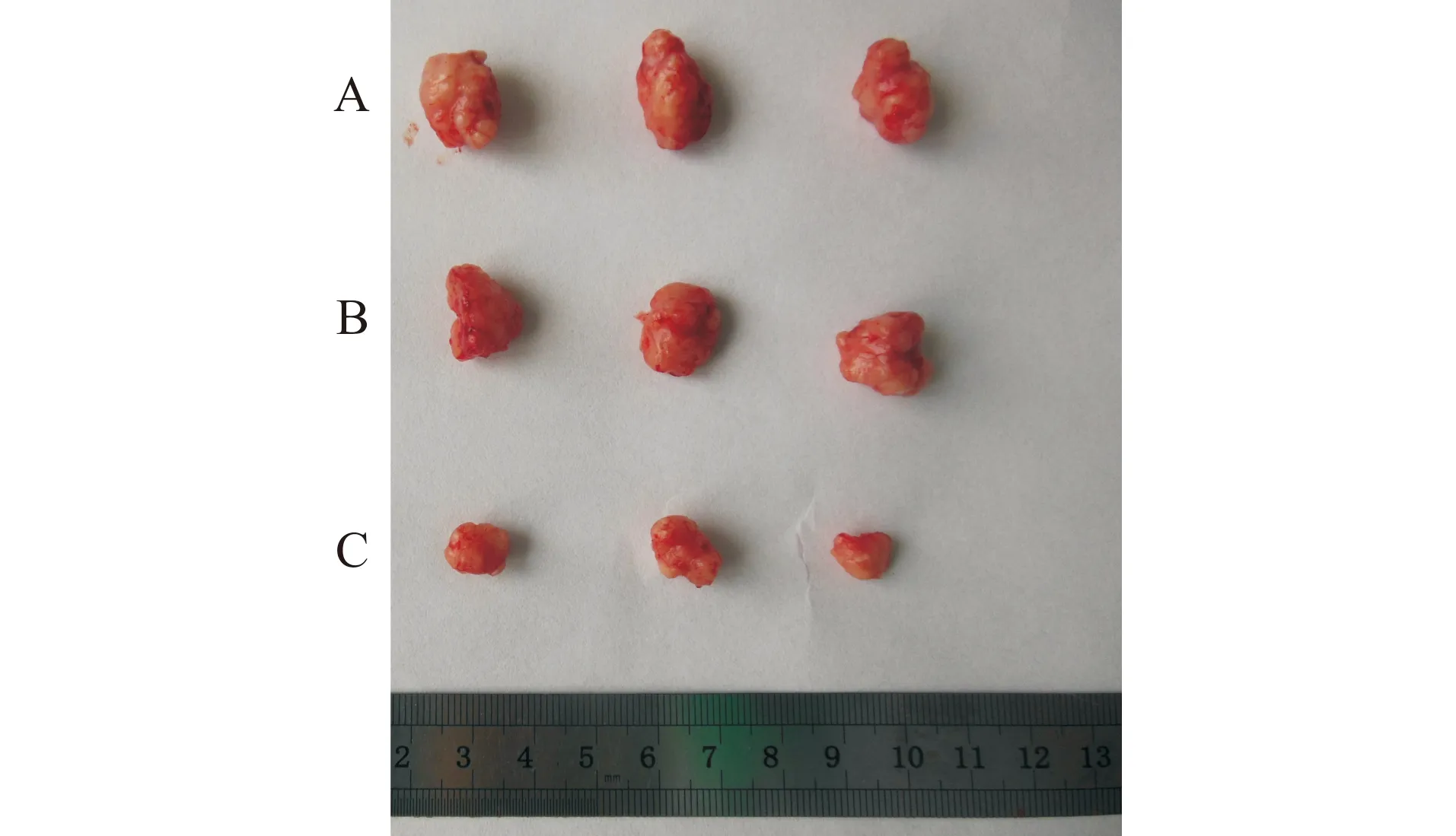
A:对照组;B:pLVX-Ang-2组;C:pLVX-shRNA-Ang-2组图2 3组肿瘤大体形态比较Fig.2 Comparison of gross tumor morphology in 3 groups
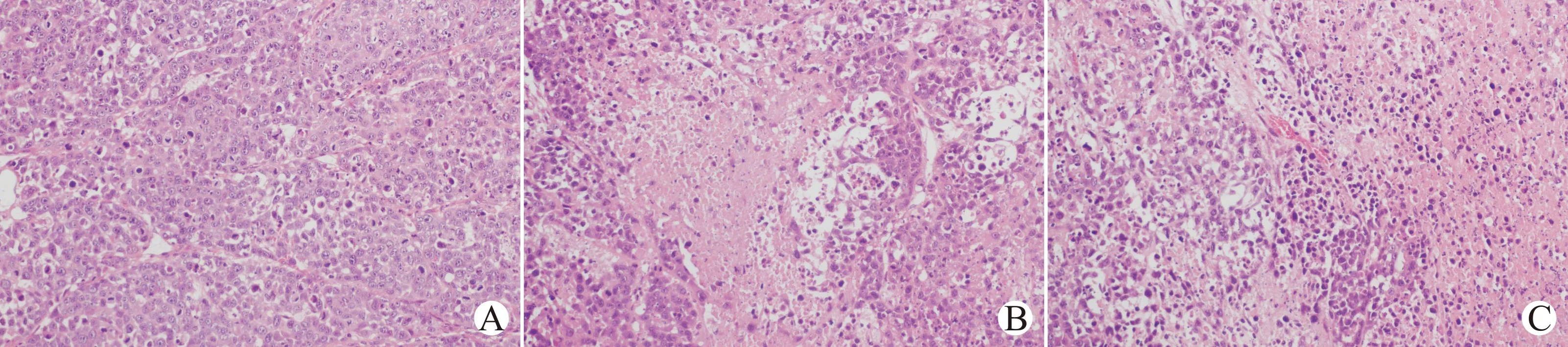
A:pLVX-shRNA-Ang-2组;B:对照组;C:pLVX-Ang-2组图3 干扰质粒对肿瘤组织学影响(苏木精-伊红染色,×200)Fig.3 The effect of interference plasmid on tumor histology(HE staining,×200)
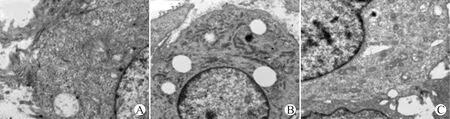
A:pLVX-shRNA-Ang-2组;B:对照组;C:pLVX-Ang-2组图4 干扰质粒对肿瘤组织超微结构影响(×4 000)Fig.4 The effect of interference plasmid on the ultrastructure of tumor(×4 000)
2.5 干扰质粒对HepG2细胞Ang-2基因表达的影响
Real-time PCR检测结果(图5)显示,对照组、pLVX-Ang-2组及pLVX-shRNA-Ang-2组HepG2细胞的Ang-2 mRNA相对表达量分别(0.620±0.03)、(0.625±0.02)、(0.213±0.02),与对照组和pLVX-Ang-2组比较,pLVX-shRNA-Ang-2组HepG2细胞的Ang-2 mRNA表达水平明显下降(P<0.05)。
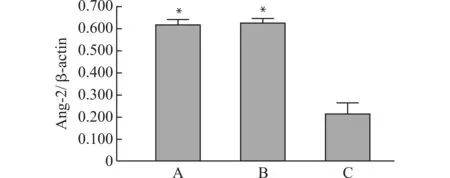
A:对照组;B:pLVX-Ang-2组;C:pLVX-shRNA-Ang-2组;与pLVX-shRNA-Ang-2组比较,*P<0.05图5 干扰质粒对HepG2细胞Ang-2基因表达的影响Fig.5 The effect of interference plasmid on the gene expression of Ang-2 in HepG2
2.6 干扰质粒对肿瘤组织中Ang-2蛋白表达的影响
与pLVX-Ang-2组和对照组相比较,pLVX-shRNA-Ang-2组的肿瘤组织中,Ang-2蛋白表达水平明显降低(P<0.05)(图6)。
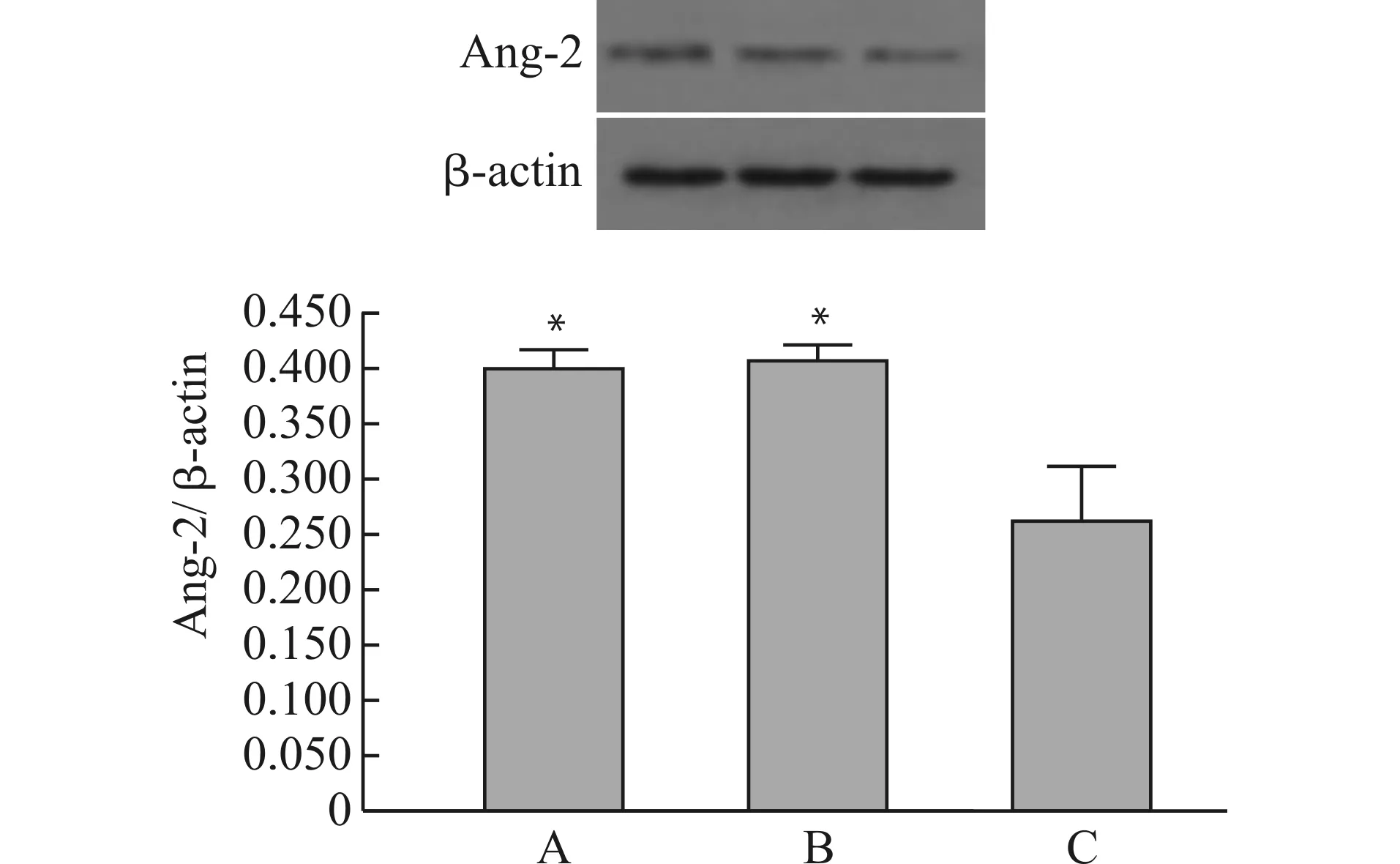
A:对照组;B:pLVX-Ang-2组;C:pLVX-shRNA-Ang-2组;与pLVX-shRNA-Ang-2组比较,*P<0.05图6 干扰质粒对肿瘤组织中Ang-2蛋白表达的影响Fig.6 The effect of interference plasmid on the protein expression of Ang-2 in tumor tissue
2.7 干扰质粒对肿瘤组织中CD34表达的影响
图7可见,pLVX-Ang-2组和对照组的肿瘤组织中,CD34表达较密集,而pLVX-shRNA-Ang-2组的肿瘤组织中CD34表达明显较少。
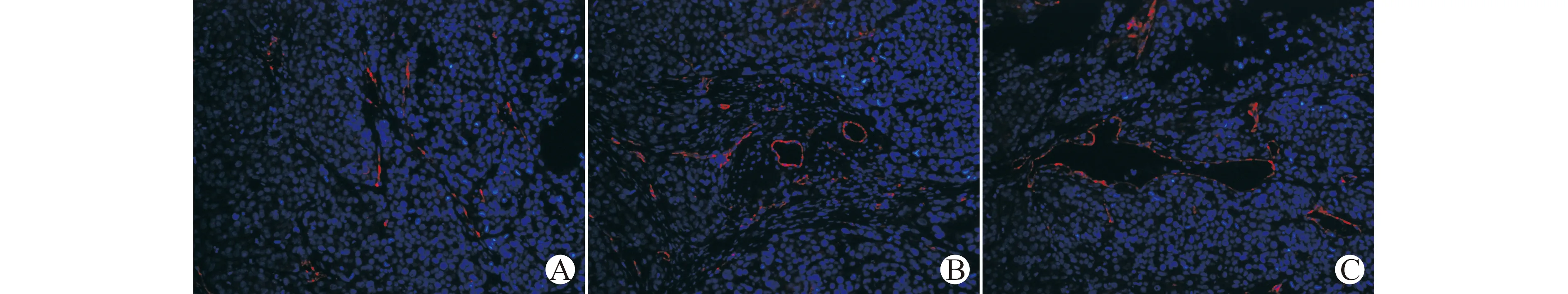
A:pLVX-shRNA-Ang-2组;B:对照组;C:pLVX-Ang-2组图7 免疫荧光染色检测干扰质粒对肿瘤组织中CD34表达影响(免疫荧光染色,×200)Fig.7 The effect of interference plasmid on the expression of CD34 in tumor tissue(immune fluorescence staining,×200)
3 讨论
Ang-2是血管生成素家族4个成员之一,Maisonpierre等[4]于1997年首先从人和小鼠的cDNA文库内克隆出来,其基因的开放阅读框编码496个氨基酸。研究表明,血管生成素特别是Ang-2于肿瘤组织的血管重建区特异表达,能够刺激肿瘤性血管新生,从而参与血管形成的初始和激发阶段,影响肿瘤的生长和转移[5]。
杨扬等[6]研究发现,Ang-2和VEGF可能通过协同作用促进新生血管形成,参与直肠癌的发生、发展。而通过阻断Ang-2受体Tie-2信号转导能够抑制胰腺癌血管生成[7]。刘新兰等[8]的实验发现,在恶性程度越高的胃癌病例,Ang-2表达越高,间质中的血管也越丰富,说明Ang-2表达能够诱导胃癌组织血管生成。Tanaka等[9]将Ang-2基因插入无Ang-2基因表达的肝细胞肝癌,然后接种小鼠,肿瘤生长明显较原肿瘤加快且伴有广泛出血。也有研究者[10]将Ang-2基因分别导入结肠癌细胞系中,以空白载体导入的癌细胞作对照,分别移植入裸鼠体内,结果显示Ang-2组肿瘤在体积、重量、细胞增殖率方面明显高于对照组。
本研究分别以转染pLVX-shRNA-Ang-2、pLVX-Ang-2的HepG2细胞以及未转染的HepG2细胞接种裸鼠制作移植瘤模型,结果显示pLVX-shRNA-Ang-2组移植瘤组织中,Ang-2基因和蛋白表达水平明显降低(P<0.05),且瘤体体积明显小于其他两组,光学显微镜下可见pLVX-Ang-2组和对照组表现为大面积出血、坏死和广泛的气球样变,而pLVX-shRNA-Ang-2组细胞坏死不明显。研究结果与Tanaka等[9]相符,进一步证实了Ang-2与肿瘤的生长有着密切的关系。
CD34是一种特异度较高的血管内皮细胞标记物,通过抗体与相应的内皮细胞结合,可以间接反映微血管密度(MVD)。有研究发现,CD34的表达与肿瘤发生、发展、浸润和转移有密切关系,CD34在许多恶性肿瘤中表达均呈上调趋势。王学军[11]研究发现,CD34阳性表达位于乳腺癌组织间质血管内皮细胞胞质中,说明乳腺癌癌组织MVD明显高于乳腺正常组织及癌旁组织。曹方等[12]研究表明,在胃癌组织中CD34阳性表达率和MVD明显高于癌旁组织,提示CD34表达水平与肿瘤血管生成有一定相关性。我们的研究结果显示,HepG2细胞及pLVX-Ang-2转染的HepG2细胞注射接种所形成的肿瘤组织中,CD34表达较密集,而pLVX-shRNA-Ang-2转染的HepG2细胞注射接种后形成的肿瘤组织中CD34表达明显较少,从另一个角度证明了Ang-2基因敲除后,肿瘤组织的血管生成明显减少。
综上所述,采用siRNA干扰技术敲除Ang-2基因,通过减少肝癌组织新血管的生成而抑制肿瘤的生长,可为临床以抑制Ang-2活性为靶点治疗肝癌提供依据。
[1] Oliner J,Min H,Leal J,et al.Suppression of angiogenesis and tumor growth by selective inhibition of angiopoietin-2[J].Cancer Cell,2004,6(5):507-516.
[2] 王红玲,邓长生,袁玉峰,等.促血管生成素-2抗体对人结肠癌鸡胚移植模型血管生成的影响[J].中华胃肠外科学杂志,2007,10(3):278-280.
[3] Lin J,Tang Y,Kang Q,et al.Curcumin inhibits gene expression of receptor for advanced glycation end-products(RAGE)in hepatic stellate cellsinvitroby elevating PPARγ activity and attenuating oxidative stress[J].Br J Pharmacol,2012,166(8):2212-2227.
[4] Maisonpierre P C,Suri C,Jones P F,et al.Angiopoietin-2,a natural antagonist for Tie2 that disruptsinvivoangiogenesis[J].Science,1997,277(5322):55-60.
[5] Tsutsui S,Inoue H,Yasuda K,et al.Angiopoietin-2 expression in invasive ductal carcinoma of the breast:its relationship to the VEGF expression and microvessel density[J].Breast Cancer Res Treat,2006,98(3):261-266.
[6] 杨扬,赵长林,袁俊波,等.直肠癌组织VEGF和Ang-2表达及其与肿瘤血管形成相关性的探讨[J].中华肿瘤防治杂志,2011,18(19):1532-1536.
[7] Chen H M,Tsai C H,Hung W C.Foretinib inhibits angiogenesis,lymphangiogenesis and tumor growth of pancreatic cancerinvivoby decreasing VEGFR-2/3 and TIE-2 signaling[J].Oncotarget,2015,6(17):4940-4952.
[8] 刘新兰,段瑜,魏建.Ang-2、Tie-2和VEGFR-2在胃癌中的表达与预后的关系[J].宁夏医科大学学报,2012,34(12):1279-1281.
[9] Tanaka S,Mori M,Sakamoto Y,et al.Biologic significance of angiopoietin-2 expression in human heaptocellular carcinoma[J].J Clin Invest,1999,103(3):341-345.
[10] Yoshida Y,Oshika Y,Fukushima Y,et al.Expression of angiostatic factors in colorectal cancer[J].Inter J Oncol,1999,15(6):1221-1225.
[11] 王学军.CD34表达与乳腺癌浸润和转移关系研究[J].中华实用诊断与治疗杂志,2013,27(3):260-261.
[12] 曹方,王阔,朱荣,等.胃癌中D2-40和CD34的表达及临床意义[J].临床肿瘤学杂志,2013,18(1):20-24.
(2016-04-18 收稿)
Small Interfering RNA against Angiopoietin-2 Inhibits Growth of Transplanted Hepatocellular Carcinoma in Nude Mice
Li Xia1#,He Panwen2#,Wu Jianhong1etal
1DepartmentofLiverDisease,WuhanMedicalTreatmentCenter,Wuhan430023,China2ClinicalLaboratory,TheCentralHospitalofWuhan,TongjiMedicalCollege,HuazhongUniverstiyofScienceandTechnology,Wuhan430014,China
Objective To explore the effect of small interfering RNA against angiopoietin-2(Ang-2)on the growth of transplanted hepatocellular carcinoma in nude mice.Methods Nude mice were subcutaneously transplanted with HepG2,HepG2 transfected by pLVX-shRNA-Ang-2 or pLVX-Ang-2,and then the mice were divided into 3 groups:control group,pLVX-shRNA-Ang-2 group and pLVX-Ang-2 group,10 mice in each group.The tumor size was measured.The tumor tissue slices of each group were detected by HE staining and transmission electron microscopy to compare the pathological changes.RNA and protein of Ang-2 was detected by real-time PCR and by Western blotting,respectively.CD34 was detected by immune fluorescence staining.Results As compared with pLVX-Ang-2 group and control group,the tumor size of pLVX-shRNA-Ang-2 group was small and tumor tissue necrosis was not obvious,Ang-2 gene and protein and CD34 expression was decreased significantly(allP<0.05).Conclusion Small interfering RNA against Angiopoietin-2 can reduce the generation of new blood vessels in the liver tissue and inhibit the growth of the tumor.
RNA interference; angiopoietin-2; hepatic carcinoma
R735.7
10.3870/j.issn.1672-0741.2016.06.005
李 霞,女,1980年生,主治医师,医学硕士,E-mail:316931725@qq.com
何攀文,男,1978年生,主治医师,医学硕士,E-mail:903155748@qq.com
△通讯作者,Correspondingauthor,E-mail:763633126@qq.com

