对高度可疑肺癌同时进行CT引导下肺穿刺活检和射频消融的临床研究*
刘宝东 李元博 胡 牧 钱 坤 刘 磊 王若天
(首都医科大学宣武医院胸外科,北京 100053)
·临床研究·
对高度可疑肺癌同时进行CT引导下肺穿刺活检和射频消融的临床研究*
刘宝东**李元博 胡 牧 钱 坤 刘 磊 王若天
(首都医科大学宣武医院胸外科,北京 100053)
目的 探讨对可疑肺癌同时进行CT引导下肺穿刺活检(transthoracic needle aspiration,TTNA)和射频消融(radiofrequency ablation,RFA)的可行性。 方法 回顾性分析2007年7月~2014年4月174例可疑肺癌患者行TTNA和RFA的临床资料,其中47例先行TTNA获得病理后行RFA(异时组),127例TTNA和RFA同时进行(同时组),观察安全性和有效性。 结果 所有病例均顺利完成TTNA和RFA。严重并发症10例,包括死亡2例,气胸引流8例,胸腔内出血引流1例;轻微并发症46例,包括少量气胸16例,胸痛16例,胸膜反应3例,胸腔积液2例,咳嗽4例,咯血7例,肺内出血2例。异时和同时组间操作相关并发症发生率和肿瘤无进展生存均无统计学差异(P>0.05)。 结论 同时进行CT引导下肺穿刺活检和射频消融安全可行,适用于不能或拒绝手术的可疑肺癌患者。
肺癌; CT; 活检; 射频消融
周围型肺肿物的初步诊断一般采用影像学手段如CT、正电子发射断层扫描(positron emission tomography,PET)或单光子发射断层扫描(single-photon emission computed tomography,SPECT)的初步筛查,而定性诊断或者获取标本进行基因检测一般首选经胸穿刺活检(transthoracic needle aspiration,TTNA)[1]。由于高龄、心肺功能差,或者存在寡转移和治疗后局部复发等原因,部分周围型肺癌失去了手术时机,需要射频消融(radiofrequency ablation,RFA)治疗[2,3]。通常TTNA与RFA异时进行,TTNA病理结果确定肺癌后再行RFA。为了减少重复CT扫描和麻醉等,我们针对临床高度可疑肺癌(典型影像学特征,结合临床表现和肿瘤标志物[4])的患者同时进行TTNA和RFA。本文回顾性分析2012年7月~2014年7月47例先行TTNA获得病理后行RFA(异时组)和127例TTNA、RFA同时进行(同时组)的临床资料,探讨TTNA、RFA同时进行的可行性。
1 临床资料与方法
1.1 一般资料
本组174例,男113例,女61例。年龄35~86岁,平均68.4岁。咳嗽69例,咳痰带血38例,气短呼吸困难27例,胸痛胸部不适22例,发热15例;无症状体检胸部CT发现10例,胸片发现9例。胸部CT显示肺周围型病灶,均为单发,位于右肺98例(上叶52例,中叶8例,下叶38例),左肺76例(上叶36例,下叶40例)。病灶直径1.5~10 cm,平均4.4 cm。174例均经PET/CT或SPECT检查显示有核素浓聚(标准化摄取比值SUV≥2.5)。合并症包括慢性阻塞性肺疾病(慢阻肺)10例,冠心病5例,高血压15例,糖尿病3例。有肺转移36例,骨转移26例,脑转移17例,肝转移5例,肾上腺转移2例,胸膜心包转移5例,5例术后局部复发。
胸外科医生根据检查结果判断可疑肺癌且适合RFA治疗者入组[5]:①原发性肺癌的早期周围型非小细胞肺癌,因心肺功能差、高龄或拒绝手术;②原发性肺癌肿瘤最大径>3 cm,进行多针、多点或多次治疗,或联合其他治疗方法;③原发性肺癌术后肺内孤立性复发;④周围型肺癌放化疗或分子靶向药物治疗后肺部肿瘤进展或复发;⑤周围型小细胞肺癌经过放化疗以后肿瘤进展或复发;⑥合并恶性胸腔积液的周围型肺癌在胸膜活检固定以后;⑦中晚期中心型非小细胞肺癌。术前讨论临床诊断肺癌[4](典型影像学特征,结合临床表现和肿瘤标志物)者,同时进行TTNA和RFA(同时组,n=127),否则先行TTNA,病理确诊肺癌后再行RFA(异时组,n=47),2组一般资料比较见表1,有可比性。

表1 2组一般资料比较
1.2 方法
1.2.1 术前准备和术中监测 术前常规检查包括血常规、肝肾功能、凝血酶原时间、活化部分凝血活酶时间、血小板计数、肺功能、心电图或超声心动图等。术前禁食水4~6 h,建立静脉通路。术中持续监测心率、血压和血氧饱和度等生命体征。
1.2.2 CT定位 根据病灶大小、部位和形态选择合适的体位,原则是穿刺距离最短和病人相对舒适。确定体表穿刺点和穿刺路径,穿刺点尽量选择在肿物长轴方向和距离胸膜最近,优先取垂直穿刺路径,并避开肋骨、肩胛骨、肺大疱、叶间裂、肺内大血管或坏死区。
1.2.3 TTNA 使用半自动活检针,穿刺方法同我们以前的报道[6]。标本从标本槽取出,迅速放于10%福尔马林标本瓶中。若切割组织条长度>5 mm,成形,肉色或肉色与黑色相连,能沉于固定液瓶底,则穿刺满意;若切割组织条长度<5 mm,置入固定液中易散开,为白色或红色液态物、黑色组织条,浮在固定液面上,则穿刺不满意,可以再次穿刺。标本做病理学和免疫组化检查[表皮生长因子受体基因突变分析或棘皮动物微管相关类蛋白4(echinoderm microtubule-associated protein-like 4,EML4)筛选融合基因]。
1.2.4 RFA 采用“四步穿刺进针法”[7]。理想的消融范围要包括肿瘤边缘外0.5~1 cm的组织。消融结束后再次CT平扫,观察肿瘤及周围组织结构变化,有无气胸、出血等并发症。确定无异常后,回病房静卧2 h。术后如出现发热、咳痰带血等症状,给予预防性抗生素和止血等对症处理。
1.2.5 术后处理 根据分期和病理基因检测结果,包括表皮生长因子受体(epithelial growth factor receptor,EGFR),如果存在突变,选择相应分子靶向药物。如果没有突变,选择化疗;如果存在纵隔淋巴结转移,需要进行放疗。术后1个月复查胸部增强CT,以后每隔3个月复查一次。以术后1个月胸部CT平扫为基线,以后每3个月评估一次。评估标准采用改良实体瘤疗效评价标准(Response Evaluation Criteria in Solid Tumors,RECIST)[8],包括完全消融(定义为肿瘤缩小或不变,CT无强化,PET无高代谢区),不完全消融(定义为肿瘤不变或增大,CT强化区无变化,PET高代谢区无变化),局部进展(定义为肿瘤增大大于10 mm,新出现CT强化区或原强化区增大,新出现PET高代谢区或原高代谢区增大)。
1.2.6 观察指标 观察指标包括操作成功率、安全性和有效性。操作成功是指完成TTNA和RFA;安全性主要为穿刺和消融相关并发症[9];有效性以肿瘤无进展生存(progression-free survival,PFS)表示。
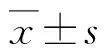
2 结果
2.1 操作成功率和并发症
所有病例均完成TTNA和RFA。
严重并发症10例,包括死亡2例(异时组1例,消融后3天肺部感染,经抗炎、呼吸机辅助呼吸治疗20天因呼吸衰竭死亡,同时组1例,术后第2天心功能不全,1周后气管插管,呼吸机辅助呼吸,术后2周死亡),气胸引流8例(均存在大量气胸,穿刺抽气无好转而行胸腔闭式引流,1~2天拔除引流管),胸腔内出血引流1例(消融术后1天因呼吸困难复查胸片发现存在中量以上积液,胸腔闭式引流出血性液体,引流2天后拔除引流管)。
轻微并发症46例,包括少量气胸16例(观察或抽气治愈),胸痛16例(穿刺点疼痛,持续1周),胸膜反应3例(分别为56岁男性、64岁男性、67岁女性,消融时血压心率降低,消融停止后症状消失),胸腔积液2例(胸片或胸部CT表现为少量积液,患者无症状),咳嗽4例(术中出现刺激性咳嗽,消融停止后症状消失),咯血7例(穿刺时出现咯血或痰中带血),肺内出血2例(术后胸部CT扫描提示肺内出血,患者无咯血)。
2组并发症比较见表2,均无统计学差异(P>0.05),但咳嗽、咯血和肺内出血均发生在同时组。
*Fisher检验
2.2 穿刺病理和后续治疗
异时组47例均在TTNA病理诊断为肺癌后进行RFA,包括腺癌24例,鳞癌18例,小细胞肺癌2例,不能分型3例。同时组127例中除12例外,115例TTNA均获得肺癌病理诊断,其中腺癌74例,鳞癌32例,小细胞肺癌3例,大细胞肺癌2例,不能分型4例;TTNA病理未能明确诊断为肺癌的12例中,因组织少、无法确诊5例,轻中度异型性4例,坏死组织3例,但定期随访后,5例在6个月时出现远处转移(肺内转移2例,骨转移2例,脑转移1例),4例在8个月时出现远处转移(肺内转移2例,骨转移1例,脑转移1例),3例在10个月时出现远处转移(肝转移1例,脑转移1例,骨转移1例),结合其他诊断依据均临床明确诊断为肺癌。
5例TTNA病理诊断小细胞肺癌者术后化疗(依托泊苷联合卡铂,4~6个疗程)。非小细胞肺癌中47例存在EGFR基因突变而给予分子靶向药物治疗,其他患者选择化疗(鳞癌为吉西他滨联合卡铂,腺癌为培美曲塞联合卡铂)。
2.3 RFA的局部疗效
174例RFA后补充放化疗或分子靶向药物治疗,平均随访12.6月(1~49个月),完全消融74例(42.5%),不完全消融51例(29.3%),局部进展49例(28.2%)。
2.4 肿瘤无进展生存率
肿瘤无进展生存异时组和同时组分别为(12.5±2.1)月和(12.6±1.5)月,2组无统计学差异(P>0.05)(图1)。

图1 异时和同时进行TTNA和RFA的肿瘤无进展生存(log-rank χ2=0.021,P=0.885)
3 讨论
TTNA是周围型肺肿物定性诊断或获取标本进行基因检测的重要手段之一。TTNA主要并发症是气胸、肺内出血、咯血、血胸等,极少数严重并发症可以致命,如空气栓塞和心脏压塞。Rivera等[1]报道,TTNA诊断肺癌的敏感性为90%(95%CI:88%~91%);在15 865例肺结节的TTNA中,出血1%(95%CI:0.9%~1.2%),其中18%(95%CI:12%~24%)需要输血;气胸15%(95%CI:14%~16%),其中7%(95%CI:6%~7.2%)需要胸腔闭式引流;发生这两种并发症需要放置引流管者住院时间明显延长(P<0.001),并且容易发展成需要机械通气的呼吸衰竭(P=0.02);高龄、吸烟、合并慢阻肺者容易出现并发症。半自动活检枪根据针的切割方向分前切割和后切割两种,尽管前切割活检针的前进距离可测,但是前进过程穿刺的组织不可测,因此前者的安全性不如后者;另外,考虑到半自动活检枪手柄的重量问题,出现了同轴穿刺系统,但是由于套管的密封问题,可能在穿刺过程中发生空气栓塞。我们曾遇到2例肺穿刺活检后出现脑梗死,CT扫描可见主动脉内气体,所以我们建议TTNA尽量使用后切割的非同轴半自动活检枪。
RFA是不能接受手术切除的周围型肺癌的局部治疗选择之一。RFA治疗肺部肿瘤目前多用于高龄或有心肺合并症者,因此,RFA除了可能使业已存在的心肺并发症如心力衰竭、呼吸衰竭、肺炎、间质性肺炎恶化外,还存在穿刺相关并发症和消融相关并发症(如胸痛、胸膜反应、咳嗽、皮肤灼伤等)。我们以前报道,RFA治疗不能手术Ⅰ期非小细胞肺癌的1、2、3年总生存率分别为90%、76%和65%,1、2、3年肿瘤特异性生存率分别为95%、86%和74%[2];在400例444次RFA中,严重并发症发生率2.7%,轻微并发症7.2%,副反应27.7%[9]。所以,尽管RFA没有放疗的周围组织损伤,也没有化疗的全身性副作用,并且具备定位准确、微创安全、效果可靠、可重复进行等优点,但是由于操作复杂、有致死并发症等原因,学习曲线时间较长[10]。射频电极针根据形态可分为多针伸展型和单针,考虑到患者存在自主呼吸,肺活动度较大,建议选择多针伸展型电极针,以便出针后覆盖肿瘤,减少射频电极针移动对肺的副损伤。对邻近心脏大血管或气管支气管等重要结构的肿瘤,射频消融时选择与之平行的单针(非多针伸展型)穿刺比较安全。
针对高度可疑肺癌患者选择同时进行TTNA和RFA是否增加操作风险和影响治疗效果,仅见个别文献报道。Schneider等[11]报道33例TTNA,术后发生肺内出血8例(24%),少量气胸4例(12%),没有增加RFA操作难度;RFA后发生需要引流的气胸7例(21%),肿瘤局部控制率在随访12个月时为77%。本研究也显示同时进行TTNA和RFA不影响操作成功率,不影响治疗的近远期效果,与异时进行TTNA和RFA组比较也不增加操作风险。但是需要强调的是,同时进行TTNA和RFA组的咳嗽、咯血和肺内出血没有出现在异时TTNA和RFA组,说明多次穿刺增加了肺损伤的可能。
本研究中有12例TTNA病理未能诊断肺癌,原因可能是:①病灶小(2 cm以下),定位不准;②肿物较大,中心坏死;③将高分化的肿瘤细胞误认为良性细胞。穿刺时应注意:①穿刺应选择肿物最大径,并避开肋骨、肩胛骨、大血管或坏死区;②反复CT扫描,调整进针位置、深度、角度;③穿刺应采用切割针,以取得更大的组织块,便于病理学和免疫组化检查。除此以外,针对这部分患者应该密切随访,结合其他诊断依据、病情变化和治疗反应等最后给予明确诊断。
本研究2例死亡。1例(异时组)62岁,术前CT提示存在间质肺纤维化,术中操作顺利,术后肺部感染,1周后呼吸衰竭,气管插管,呼吸机辅助呼吸,术后20天死亡。另1例(同时组)82岁,术前有心房纤颤,术中操作顺利,术后第2天心功能不全,1周后气管插管,呼吸机辅助呼吸,术后2周死亡。因此,术前有严重合并症者应该慎重进行TTNA和RFA。
TTNA后出现的气胸可能影响RFA射频电极针的定位。本研究中1例TTNA后发生气胸,需要助手协助抽气,术者布针消融成功。RFA后的少量气胸(肺压缩距离胸膜<2 cm)一般不需要处理,中等量气胸(肺压缩距离胸膜2~4 cm)穿刺抽气后观察,而大量气胸(肺压缩距离胸膜>4 cm)需要放置胸腔闭式引流。本研究同时组1例术后1天因咳嗽出现大量气胸而引流,所以应该注意迟发性气胸的可能。出血是另一个常见的并发症,包括肺内出血、术中咯血和术后血痰等。穿刺过程中可出现大咯血,应用止血药或立即消融,出血很快好转;肺内出血可自行吸收;大部分患者有术后痰中带血,对症处理后1周内好转。
总之,为减少重复CT扫描和麻醉等,针对高度可疑肺癌患者选择同时进行TTNA和RFA安全可行,适用于高龄、存在心肺合并症或拒绝手术的周围型肺癌患者。
1 Rivera MP,Mehta AC,Wahidi MM.Establishing the diagnosis of lung cancer:diagnosis and management of lung cancer,3rd ed:American College of Chest Physicians evidence-based clinical practice guidelines.Chest,2013,143(5 Suppl):e142S-e165S.
2 Liu BD,Liu L,Hu M,et al.Percutaneous radiofrequency ablation for medically inoperable patients with clinical stage I non-small cell lung cancer.Thorac Cancer,2015,6(3):327-333.
3 刘宝东,刘 磊,胡 牧,等.肺癌切除术后肺内孤立性转移复发灶的射频消融治疗.中国肺癌杂志,2014,17(6):460-464.
4 支修益,石远凯,于金明.中国原发性肺癌诊疗规范(2015年版).中华肿瘤杂志,2015,37(1):67-78.
5 刘宝东,支修益.影像引导射频消融治疗肺部肿瘤专家共识(2015年版).中国肺癌杂志,2015,18(5):251-259.
6 刘宝东,支修益,刘 磊,等.比较CT引导下两种穿刺针在经皮肺穿刺活检术中的临床应用.中国医学影像学杂志,2009,17(5):375-376,400.
7 刘宝东,刘 磊,胡 牧,等.CT引导下射频消融治疗肺内特殊部位恶性肿瘤的临床评价.结核病与肺部健康杂志,2013,2(1):7-10.
8 刘宝东,支修益.影像引导下热消融治疗肺部肿瘤的局部疗效评价.中国医学前沿杂志(电子版),2015,7(2):11-14.
9 刘宝东,刘 磊,胡 牧,等.CT引导下射频消融治疗400例不能手术肺部肿瘤的安全性分析.中华临床医师杂志(电子版),2013,7(16):154-156.
10 刘宝东,刘 磊,李 岩,等.CT引导下射频消融治疗肺癌的学习曲线.中国微创外科杂志,2012,12(2):160-163.
11 Schneider T,Puderbach M,Kunz J,et al.Simultaneous computed tomography-guided biopsy and radiofrequency ablation of solitary pulmonary malignancy in high-risk patients.Respiration,2012,84(6):501-508.
(修回日期:2016-12-27)
(责任编辑:王惠群)
A Clinical Study of Computed Tomography Guided Biopsy Followed by Radiofrequency Ablation for Suspicious Lesions in Lung Cancer
LiuBaodong,LiYuanbo,HuMu,etal.
DepartmentofThoracicSurgery,XuanwuHospitalofCapitalMedicalUniversity,Beijing100053,China
LiuBaodong,E-mail:xwliubaodong@aliyun.com
Objective To discuss and analyze the probability of transthoracic needle aspiration (TTNA) followed immediately by radiofrequency ablation (RFA) of suspicious lung cancer. Methods From July 2007 to April 2014, 174 cases received TTNA and underwent RFA subsequently for suspicious lung cancer. Among them, 47 cases were given TTNA followed by RFA with pathologic diagnosis, and the rest of 127 cases underwent TTNA and RFA simultaneously. Operation-related complications and clinical results were analyzed. Results The CT-guided biopsy and RFA was successfully completed in all the patients. There were 10 cases of major complications, including death in 2 cases, drainage of pneumothorax in 8 cases and drainage of hemothorax in 1 case. Forty-six patients had developed minor complications without further interventions, including mild pneumothorax in 16 cases, chest pain in 16 cases, pleural reaction in 3 cases, pleural effusion in 2 cases, cough in 4 cases, hemoptysis in 7 cases and pulmonary hemorrhage in 2 cases. The procedure-related morbidity and progression free survival were not statistically different (P>0.05) between the two groups. Conclusion Simultaneous application of TTNA and RFA is a safe and feasible procedure for suspicious lung cancer patients who are unable to undergo or refuse surgery.
Lung cancer; CT; Biopsy; Radiofrequency ablation
北京市科委首都临床特色应用研究(Z131107002213180)
A
1009-6604(2017)01-0007-05
10.3969/j.issn.1009-6604.2017.01.003
2016-10-12)
**通讯作者,E-mail:xwliubaodong@aliyun.com

