胸腔镜肺段切除术治疗60岁以上ⅠA期非小细胞肺癌的近期疗效*
武国栋 张 毅 钱 坤 苏 雷
(首都医科大学宣武医院胸外科 首都医科大学肺癌诊疗中心,北京 100053)
·临床研究·
胸腔镜肺段切除术治疗60岁以上ⅠA期非小细胞肺癌的近期疗效*
武国栋 张 毅**钱 坤 苏 雷
(首都医科大学宣武医院胸外科 首都医科大学肺癌诊疗中心,北京 100053)
目的 探讨胸腔镜下肺段切除术治疗60岁以上早期非小细胞肺癌(non-small cell lung cancer,NSCLC)的近期疗效。 方法 回顾性分析2011年10月~2014年12月我科64例60岁以上ⅠA期NSCLC的临床资料,分别行胸腔镜下肺段切除术(肺段切除组,n=32)和胸腔镜下肺叶切除术(肺叶切除组,n=32),比较2组手术时间、术中出血量、淋巴结清扫数目、术后引流管放置时间、住院时间、围术期并发症和随访情况。 结果 肺段切除组与肺叶切除组术中出血量中位数分别为100 (20~900 ml)、150(50~500 ml)ml,无统计学差异(Z=-1.509,P=0.131);术后并发症发生率分别为6.3%(2/32)、9.4%(3/32),无统计学差异(χ2=0.000,P=1.000);术后胸腔引流管留置时间分别为(5.4±1.2)、(5.5±1.1)d,无统计学差异(t=0.218,P=0.828);住院时间分别为(6.4±1.2)、(6.5±1.1)d,无统计学差异(t=0.218,P=0.828)。肺段切除组手术时间(136.8±65.2)min,明显短于肺叶切除组(189.2±74.2)min(t=2.999,P=0.004)。肺段切除组淋巴结切除中位数6.5枚(3~45枚),明显少于肺叶切除组中位数12.0枚(4~30枚)(Z=-4.750,P=0.000);肺段切除组切除N1淋巴结中位数3.0枚(2~9枚),明显少于肺叶切除组中位数5.0枚(2~11枚)(Z=-3.294,P=0.001);切除N2淋巴结中位数3.5枚(0~36枚),明显少于肺叶切除组中位数8.5枚(1~29枚)(Z=-4.814,P=0.000)。肺段切除组32例中位随访时间18个月(12~42个月),肺叶切除组32例中位随访时间16个月(12~19个月),均无复发和转移。 结论 胸腔镜下肺段切除术可以作为60岁以上老年ⅠA期NSCLC的治疗选择,近期效果不差于胸腔镜肺叶切除术。
非小细胞肺癌; 电视辅助胸腔镜手术; 肺段切除术; 肺叶切除术
近年来,肺癌的发病率呈明显上升趋势。北京市2013年男性恶性肿瘤新发病例中,肺癌发病居第1位,女性中肺癌发病居第2位,肺癌总发病率居于各肿瘤之首,由肺癌导致的相关死亡率均为第1位[1]。在年龄分层上,60岁以上老年人罹患肺癌比例最大。胸腔镜肺叶切除和淋巴结清扫术已经成为肺癌治疗的标准术式[2]。近年来,国内外许多研究[3~6]显示,对于早期肺癌,特别是临床诊断为T1aN0M0的周围型非小细胞肺癌(non-small cell lung cancer,NSCLC)的老年患者,采用胸腔镜肺段切除术以保留更多健康的肺组织也可以获得良好的疗效。2011年10月~2014年12月我科收治64例60岁以上的ⅠA期NSCLC,其中32例实施胸腔镜解剖性肺段切除术(肺段切除术组),32例实施胸腔镜肺叶切除术(肺叶切除术组),本文回顾性比较2种术式的安全性和有效性,为手术选择提供参考。
1 临床资料与方法
1.1 一般资料
本研究为回顾性研究,2011年10月~2014年12月我科共完成32例胸腔镜肺段切除术,术后病理证实为 pTlaNOM0期、原发性周围型NSCLC,排除术前曾行放化疗,肺内双原发或多原发癌,以及合并其他恶性肿瘤病史者,排除随访时间<1年的患者。选择同期非同一手术组或非同一术者胸腔镜肺叶切除术32例,术后病理证实为 pTlaNOM0期、原发性周围型NSCLC。2组中53例为体检发现肺部结节,无不适,11例有胸部不适、咳嗽、咳痰等非特异性症状。术前均行血常规、血型、尿常规、肝肾功能、血糖、血脂、血电解质、凝血、输血八项和肿瘤标志物等实验室检查,以及心电图、心脏超声、血气分析、腹部超声、薄层CT、肺功能等检查,9例行PET-CT检查,排除远处转移。
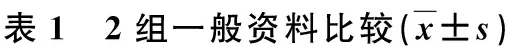

组别年龄(岁)性别部位男女左侧右侧肿瘤最大径(mm)病理合并症鳞癌原位腺癌微浸润腺癌浸润腺癌原发性高血压糖尿病慢阻肺*肺段切除组(n=32)68.5±5.81616122015.7±4.91851816411肺叶切除组(n=32)66.7±5.71715112116.4±4.2155211454t(χ2)值t=-1.266χ2=0.063χ2=0.068t=0.659χ2=0.923χ2=0.251χ2=0.000χ2=4.267P值0.2100.8020.7940.5130.8200.6161.0000.039
*慢阻肺:慢性阻塞性肺疾病
1.2 方法
1.2.1 术前准备 术前护士训练患者积极进行呼吸功能锻炼,让患者学会腹式呼吸要领,从而减轻术后由于手术切口所引起的疼痛,同时还可加深呼吸运动的幅度。积极控制术前基础疾病,有感染者术前积极应用抗生素。呼吸道准备采用雾化吸入,特别是痰多、痰稠的患者,引导其进行咳嗽和体位引流,促进痰液的排出,防止感染。血糖高或糖尿病者,积极行降糖治疗及控制饮食,高血压者控制血压平稳。术前对患者宣教,心理疏导。
1.2.2 手术体位 2种术式体位和操作孔相同。全身麻醉双腔气管插管,超细纤维支气管镜定位确认,保证术中患侧肺塌陷,健侧肺通气。健侧卧位,腋下垫枕。术侧上肢上举并抱小枕妥善固定。手术切口采用三孔法[7],腋中线第7或第8肋间做长1~1.5 cm切口作为胸腔镜观察孔,腋前线第3或第4肋间做长3~4 cm切口作为主操作孔,腋后线第7或第8肋间做长1~1.5 cm切口作为副操作孔。
1.2.3 胸腔镜解剖性肺段切除术 先行肺楔形切除,切除后送快速冰冻病理检查,如果冰冻病理回报为恶性,按预定计划实施手术。依照术前CT片上定位及判断,不同肺段,肺裂发育情况不同,手术步骤不同。一般从肺段的根部开始解剖,在一个方向上层次递进,逐渐深入,依次解剖暴露于术野最浅面的结构(段血管、段支气管),最后切开肺段间的连接。在夹闭支气管后要求麻醉医师膨肺,观察夹闭支气管是否为目标支气管,此时目标肺段不充气而其周围肺组织充气膨胀,它们之间的界线即可显示,极少数不能明确判断肺段界限需要结合肺段血管及肺段支气管的走行来确定。原发性肺癌患者,术中还要淋巴结取样送快速冰冻病理检查,明确淋巴结分期。若有淋巴结转移则改行肺叶切除术[8]。
1.2.4 胸腔镜解剖性肺叶切除术 考虑术中难以触摸到的肿瘤结节,术前先行CT引导下瘤旁注射化学胶定位,术中手指触摸定位后行肿物楔形切除。切除的结节送冰冻切片检查。冰冻结果考虑恶性再行肺叶切除。采用先易后难的原则,充分游离解剖肺门,视肺裂发育情况,如果肺裂发育好,则先游离肺叶静脉各分支,分别游离,直线切割缝合器处理切断,再分离和处理肺叶动脉,最后处理支气管;如果肺裂发育不好,首先分离并处理肺叶静脉。肺叶静脉切断后,再处理肺叶支气管,分别切断后,再游离并处理肺叶动脉各分支,分别游离,直线切割缝合器处理切断,最后处理肺裂。常规系统清扫肺门、纵隔淋巴结。
1.3 观察指标
手术时间(从切皮开始到缝皮结束)、出血量(吸引瓶吸引量-术中冲洗液量)、术后引流管放置时间(拔管标准是引流量<100 ml/d)、住院时间(出院标准为患者生命体征平稳,引流管已拔除,肺部无感染,血常规白细胞正常)、围术期并发症(包括肺感染、肺漏气、心律失常等)。
1.4 统计学处理
2 结果
2组术中出血量、术后引流管留置时间和住院时间均无显著差异(P>0.05),但肺叶切除术组手术时间明显长于肺段切除术组(P<0.05),淋巴结清扫数目明显多于肺段切除术组(P<0.05),见表2。肺段切除情况:右上叶后段8例,右上叶前段8例,右下叶背段2例,右下叶后基底段2例;左上叶固有段2例,左上叶舌段6例,左下叶背段4例。肺叶切除情况:右上叶10例,右中叶3例,右下叶8例,左上叶2例,左下叶9例。肺段切除组1例术后肺漏气,经保守治疗10d后愈合,1例心房颤动,应用胺碘酮等药物治疗转复;肺叶切除组1例术后胸腔感染,抗炎14d后出院,2例心房颤动,药物治疗好转。无围手术期死亡。术后病理分期均为ⅠA期,淋巴结均无转移。2组各有1例鳞状细胞癌,其余均为早期腺癌。按2011肺腺癌多学科新分类,肺段切除组原位癌8例,微浸润腺癌5例,浸润腺癌18例;肺叶切除组原位癌5例,微浸润腺癌5例,浸润腺癌21例。通过电话随访或门诊定期复查,肺段切除组32例中位随访时间18个月(12~42个月),肺叶切除组32例中位随访时间16个月(12~19个月),均无复发和转移。


组别手术时间(min)术中出血量(ml)*淋巴结总数(枚)*淋巴结分组(枚)*N1N2引流管留置时间(d)住院时间(d)并发症肺段切除组(n=32)136.8±65.2100(20~900)6.5(3~45)3.0(2~9)3.5(0~36)5.4±1.26.4±1.22(6.3%)肺叶切除组(n=32)189.2±74.2150(50~500)12.0(4~30)5.0(2~11)8.5(1~29)5.5±1.16.5±1.13(9.4%)t(χ2、Z)值t=2.999Z=-1.509Z=-4.750Z=-3.294Z=-4.814t=0.218t=0.218χ2=0.000P值0.0040.1310.0000.0010.0000.8280.8281.000
*数据用中位数(最小值~最大值)表示
3 讨论
1995年北美肺癌研究组发表的一项前瞻性随机对照临床研究奠定肺叶切除在早期非小细胞肺癌手术治疗中的金标准地位[2]。2006年美国NCCN肺癌治疗指南中明确指出:胸腔镜肺叶切除对于可切除的肺癌是一种可行的选择[9],明确了全胸腔镜在肺癌治疗中的地位。2015年NCCN指南又指出:对大多数NSCLC患者,解剖性肺叶切除是首选。肺段切除(首选)或楔形切除适用于部分特定患者[10]。
虽然目前早期肺癌标准术式是肺叶切除+淋巴结清扫,但对于60岁以上老年患者,由于患者的机体功能减退,合并症多,手术方式存在争议[11,12]。近年来的研究显示:肺段切除联合淋巴结清扫术的选择倾向越来越多,安全性得到越来越多人认可[13~17]。Hwang等[18]采用倾向性匹配方法选取94例肺段切除和94例肺叶切除进行研究,2组患者在手术时间、住院时间上无统计学差异,术后并发症发生率及术后死亡率均无统计学差异。本研究结果表明:胸腔镜肺段切除术与肺叶切除术在术中出血量、术后胸腔引流管留置时间和术后住院时间方面差异均无统计学意义(P>0.05),表明2种术式的安全性无差异;2种术式术后并发症发生率无统计学差异(6.3% vs.9.4%,P=1.000)。
肺段切除组手术时间明显短于肺叶切除组(t=2.999,P=0.004),分析原因为胸腔镜肺段切除是按患者的身体状况和术前检查特别是胸部CT综合判断后实施有计划性的肺段切除术,目的是减少创伤,减少手术时间,更有利于患者术后恢复;肺叶切除术的选择很多情况下是肿瘤位置深或需要预先做楔形切除明确病理诊断的,手术时间上比肺段切除组要长。另外,肺叶切除组淋巴结切除总数明显多于肺段切除组(Z=-4.750,P=0.000),客观上也延长了手术时间。
肺段切除组淋巴结切除数量明显少于肺叶切除组(Z=-4.750,P=0.000),2组N1(Z=-3.294,P=0.001)和N2淋巴结清扫数目(Z=-4.814,P=0.000)均有明显差异。肺癌手术中纵隔淋巴结的切除有2种方式:系统性淋巴结清扫和淋巴结采样,不同临床分期的肺癌采取不同的淋巴结切除方式是存在争议的,肺癌的标准术式是肺叶切除联合淋巴结清扫术,对于早期NSCLC,特别是老年NSCLC淋巴结的切除方式存在争议最大。1995年Sugi等[19]对115例直径<2 cm的周围型肺癌随机分别行系统性淋巴结清扫和淋巴结采样(59例 vs. 56例),结果显示2种术式5年总生存期比较无统计学差异,进一步证实系统性淋巴结采样的生存期优于系统性纵隔淋巴结清扫术,认为对于直径<2 cm的周围型NSCLC可以不需要行彻底系统性淋巴结清扫。Darling等[20]选择无肺门淋巴结转移的T1或T2NSCLC行淋巴结采样和淋巴结清扫,5年生存率无明显差异。本研究显示2组N1和N2淋巴结数量有明显差异(P<0.05),原因在于肺段切除术中对纵隔淋巴结进行采样切除,肺叶切除术中采用系统清扫纵隔淋巴结, 但2组术后短期随访均无复发和转移。
本研究显示胸腔镜肺段切除术手术时间明显短于胸腔镜肺叶切除术(t=2.999,P=0.004),减少患者的创伤;淋巴结切除数量虽然明显少于肺叶切除组(P<0.05),但对患者的肿瘤分期和近期疗效没有影响。可见,胸腔镜下肺段切除术可以作为60岁以上老年ⅠA期非小细胞肺癌的治疗选择,其安全性和效果不差于胸腔镜肺叶切除,值得临床应用。本研究的不足之处在于样本量小,随访时间短,我们将对肺段切除组病例继续跟踪随访,以评价远期手术疗效。
1 北京市人民政府.2013年度北京市卫生与人群健康状况报告.北京:人民卫生出版社,2014.12-15.
2 Ginsberg RJ, Rubinstein LV. Randomized trial of lobectomy versus limited resection for T1N0 non small cell lung cancer. Lung Cancer Study Group. Ann Thorac Surg,1995,60(3):615-622.
3 Watanabe A, Ohori S, Nakashima S, et al. Feasibility of video-assisted thoracoscopic surgery segmentectomy for selected peripheral lung carcinomas. Eur J Cardiothorac Surg,2009,35(5):775-780.
4 Yamashita S, Tokuishi K, Anami K, et al. Thoracoscopic segmentectomy for T1 classification of non-small cell lung cancer: a single center experience. Eur J Cardiothorac Surg, 2012, 42(1):83-88.
5 Tsutani Y, Miyata Y, Nakayama H, et al. Oncologic outcomes of segmentectomy compared with lobectomy for clinical stage IA lung adenocarcinoma: propensity score-matched analysis in a multicenter study. J Thorac Cardiovasc Surg,2013,146(2):358-364.
6 Okada M, Mimae T, Tsutani Y, et al. Segmentectomy versus lobectomy for clinical stage IA lung adenocarcinoma. Ann Cardiothorac Surg,2014,3(2):153-159.
7 李 运,王 俊,隋锡朝,等.全胸腔镜肺叶切除手术操作流程及技巧的优化:北京大学人民医院经验.中华胸心血管外科杂志,2010,26(5):300-306.
8 蒲 强,梅建东,廖 虎,等.全胸腔镜解剖性肺段切除治疗肺部疾病的早期结果.中华外科杂志,2012,50(9):823-826.
9 Ettinger DS, Bepler G, Bueno R, et al. National Comprehensive Cancer Network (NCCN). Non-small cell lung cancer clinical practice guidelines in oncology. J Natl Compr Canc Netw,2006,4(6):548-582.
10 Ettinger DS, Ettinger DS, Wood DE, et al. National comprehensive cancer network. Non-Small Cell Lung Cancer, Version 6.2015. J Natl Compr Canc Netw, 2015,13(5):515-524.
11 Liu Y, Huang C, Liu H, et al. Sublobectomy versus lobectomy for stage ⅠA (T1a) non-small-cell lung cancer: a meta-analysis study. World J Surg Oncol,2014,12(1):1-6.
12 Zhang Y, Sun Y, Wang R, et al. Meta-analysis of lobectomy, segmentectomy, and wedge resection for stage Ⅰ non-small cell lung cancer. J Surg Oncol,2015,111(3):334-340.
13 Schuchert MJ, Pettiford BL, Keeley S, et al. Anatomic segmentectomy in the treatment of stage Ⅰ non-small cell lung cancer. Ann Thorac Surg,2007,84(3):926-932.
14 Ghaly G, Kamel M, Nasar A, et al. Video-assisted thoracoscopic surgery is a safe and effective alternative to thoracotomy for anatomical segmentectomy in patients with clinical stageⅠnon-small cell lung cancer. Ann Thorac Surg,2016 ,101(2):465-472.
15 Ren M, Meng Q, Zhou W, et al. Comparison of short-term effect of thoracoscopic segmentectomy and thoracoscopic lobectomy for the solitary pulmonary nodule and early-stage lung cancer. Oncol Targets Ther,2014,7(3):1343-1347.
16 Zhang L, Ma W, Li Y, et al. Comparative study of the anatomic segmentectomy versus lobectomy for clinical stage ⅠA peripheral lung cancer by video assistant thoracoscopic surgery. J Cancer Res Ther,2013,9 (5):S106-S109.
17 杜佳辉,袁五营,张光照,等.ⅠA期非小细胞肺癌行胸腔镜肺叶切除术与肺段切除术的疗效分析.医药论坛杂志,2015,36(2):85-87.
18 Hwang Y, Kang CH, Kim HS, et al. Comparison of thoracoscopic segmentectomy and thoracoscopic lobectomy on the patients with non-small cell lung cancer: a propensity score matching study. Eur J Cardiothorac Surg,2015,48(2):273-278.
19 Sugi K, Nawata K, Fujita N, et al. Systematic lymph node dissection for clinically diagnosed peripheral non-small-cell lung cancer less than 2cm in diameter. World J Surg,1998,22(3):290-295.
20 Darling GE, Allen MS, Decker PA, et al. Randomized trial of mediastinal lymph node sampling versus complete lymphadenectomy during pulmonary resection in the patient with N0 or N1(less than hilar) non-small-cell carcinoma: results of the American College of Surgery Oncology Group Z0030 Trail. J Thorac Cardiovasc Surg,2011,141(3):662-670.
(修回日期:2016-12-20)
(责任编辑:李贺琼)
Short-term Effect of Complete Video-assisted Thoracoscopic Anatomic Segmentectomy in Stage ⅠA Non-small Cell Lung Cancer Patients Above 60 Years Old
WuGuodong,ZhangYi,QianKun,etal.
DepartmentofThoracicSurgery,XuanwuHospitalofCapitalMedicalUniversity,Beijing100053,China
ZhangYi,E-mail:steven9130@sina.com
Objective To evaluate the short-term outcomes of video-assisted thoracoscopic surgery (VATS) of segmentectomy in the treatment of pathological stage ⅠA non-small cell lung cancer (NSCLC) in patients above sixty years old. Methods Clinical data of 64 patients with pathological stage ⅠA NSCLC who underwent VATS segmentectomy (n=32) and VATS lobectomy (n=32) from June 2011 to December 2014 in our hospital were retrospectively analyzed. The operation time, blood loss, number of dissected lymph nodes (including N1 and N2), chest tube duration, postoperative hospital stay, morbidity of postoperative complications and follow-up after operation were compared between the two groups. Results There were no significant differences in blood loss [100 (20-900) ml vs. 150 (50-500) ml,Z=-1.509,P=0.131], morbidity of postoperative complications [6.3%(2/32) vs. 9.4%(3/32),χ2=0.000,P=1.000], chest tube duration [(5.4±1.2) d vs. (5.5±1.1) d,t=0.218,P=0.828], and postoperative hospital stay [(6.4±1.2) d vs. (6.5±1.1) d,t=0.218,P=0.828] between the segmentectomy group and the lobectomy group. The operation time of VATS segmentectomy was significantly shorter than that of VATS lobectomy [(136.8±65.2) min vs. (189.2±74.2) min,t=2.999,P=0.004]. The total number of dissected lymph nodes of VATS segmentectomy was less than that of VATS lobectomy [6.5 (3-45) vs. 12 (4-30),Z=-4.750,P=0.000]. There were significant differences in the segmentectomy group and the lobectomy group in the number of N1 lymph nodes [3 (2-9) vs. 5 (2-11),Z=-3.294,P=0.001] and N2 lymph nodes [3.5 (0-36) vs. 8.5 (1-29),Z=-4.814,P=0.000], respectively. There were no recurrence and metastasis during follow-ups for 12-42 months (median, 18 months) in 32 cases of segmentectomy and for 12-19 months (median, 16 months) in 32 cases of lobectomy. Conclusions VATS segmentectomy is a choice in treatment of pathological stage ⅠA NSCLC in patients above sixty years old. The short-term outcomes are not worse than VATS lobectomy.
Non-small cell lung cancer; Video-assisted thoracoscopic surgery; Segmentectomy; Lobectomy
北京市自然科学基金(项目编号:7132106);北京市科委重大项目(项目编号:D141100000214002)
A
1009-6604(2017)01-0015-04
10.3969/j.issn.1009-6604.2017.01.005
2016-10-12)
**通讯作者,E-mail:steven9130@sina.com

