磁共振弥散峰度成像在腮腺肿瘤诊断与鉴别诊断的临床价值
*
磁共振弥散峰度成像在腮腺肿瘤诊断与鉴别诊断的临床价值
于金芬①②王祥生②曹广亮②王光彬①李传亭①*

目的:探讨磁共振弥散峰度成像在鉴别腮腺肿瘤良性和恶性的应用价值。方法:选取32例腮腺肿瘤患者,术前行常规磁共振成像(MRI)及弥散峰度成像(DKI)扫描,应用弥散峰度评估软件测定平均峰度(MK)值、各向异性(FA)值和平均扩散率(MD)值,应用ROC曲线分析获得MK值、FA值和MD值,鉴别腮腺肿瘤良性和恶性的敏感度、特异度及曲线下面积等诊断效能指标。结果:腮腺良性肿瘤的平均MK值明显低于恶性腮腺肿瘤,差异有统计学意义(Z=2.934,P=0.003);腮腺良性肿瘤FA值低于恶性肿瘤,差异有统计学意义(Z=2.348,P=0.019);腮腺良性肿瘤MD值明显高于恶性肿瘤腮腺,差异有统计学意义(Z=2.077,P=0.047)。腮腺良性和恶性肿瘤MK值、FA值和MD值的诊断临界值分别是1.0528、0.2396和0.6472(×10-3mm2/s);MK值鉴别腮腺肿瘤良恶性的诊断效能优于MD值和FA值。结论:DKI相比传统弥散(DWI)和弥散张量成像(DTI)在腮腺肿瘤良性和恶性鉴别方面有更好的特异度和敏感度。MK值可以显示腮腺肿瘤病理特性并提供定量信息,有助于肿瘤的鉴别诊断。
腮腺肿瘤;弥散峰度成像;磁共振成像
[First-author’s address] Department of Ultrasound, Beijing Friendship Hospital, Capital Medical University, Beijing 100050, China.
腮腺肿瘤约占头颈部肿瘤的3%左右,全身各器官除了女性生殖系统肿瘤外,腮腺肿瘤组织成分最复杂多样化[1-2]。腮腺肿瘤中良性占80%,而良性腮腺肿瘤中约85%为多行性腺瘤,其次是腺淋巴瘤,手术切除是腮腺肿瘤最有效的治疗方法,术前组织学定性诊断有助于手术方式及计划的制定[3]。多形性腺瘤进行单纯的肿瘤摘除术会导致局部复发率高达20%~45%[4-7]。如果采用保留面神经的病侧腮腺切除术,局部复发率可降低至1.5%~6%[3,8-9]。二次手术容易导致面神经麻痹和恶性肿瘤的转移[10]。因此,术前组织学定性定量诊断至关重要。本研究尝试应用弥散峰度成像(diffusional kurtosis imaging,DKI)鉴别腮腺肿瘤,目的在于检验此技术用于鉴别腮腺肿瘤的价值及术前定性诊断的能力。
1 资料与方法
1.1一般资料
选取2014年12月至2015年11月山东省立医院口腔外科及影像研究所就诊的32例腮腺肿瘤患者(均经术后病理证实),其中男性15例,女性17例;年龄18~76岁,平均年龄47.7岁;临床病程3个月至15年。所有患者术前行常规磁共振成像(magnetic resonance imaging,MRI)及DKI扫描,应用弥散峰度评估软件测定平均峰度(mean kurtosis,MK)值、各向异性(fractional anisotropy,FA)值和平均扩散率(mean diffusivity,MD)值,应用ROC曲线分析获得MK值、FA值和MD值,鉴别腮腺肿瘤良恶性的敏感度、特异度及曲线下面积(area under the curve,AUC)等诊断效能指标。
1.2纳入与排除标准
(1)纳入标准:①术前未行活检检查及手术;②术前行MRI及DKI,检查前未行任何有创性检查,包括放射治疗及药物化疗;③无移动伪影影响的高清晰图像;④病灶直径>1 cm。
(2)排除标准:①图像质量欠佳;②患者有固定义齿(义齿不可以移除);③MRI检查前进行过任何有创治疗或检查:④活检及粒子植入等。
1.3仪器设备
采用Skyra 3.0T超导型磁共振扫描仪(德国西门子),专用头颈部8通道线圈进行图像采集。
1.4检查方法
患者取仰卧位,头部用海绵垫固定,双侧外耳道内置入耳塞以减少机器噪声对患者造成的不适。扫描范围基本对称,扫描过程中头颈部制动,尽量减少吞咽动作。先行常规MRI扫描,包括横轴位扫描T1WI、T2WI脂肪抑制序列。冠状位及矢状位扫描T2WI压脂序列,再行DKI扫描。
1.4.1 常规MRI扫描
所有患者均进行常规MRI平扫。常规扫描序列:横轴位、冠状位及矢状位。横轴位扫描T1WI、T2WI脂肪抑制序列;冠状位及矢状位扫描T2WI压脂序列。扫描参数:T1WI脂肪抑制序列。TR 2 000 ms、TE 11 ms、TI 899 ms,层厚3 mm,间隔0.5 mm,视野(FOV)为230 mm×230 mm,扫描时间172 s;T2WI脂肪抑制序列。TR 4731 ms、TE 99 ms、层厚3 mm,间隔0.5 mm,FOV为230 mm×230 mm,扫描时间为175 s。
1.4.2 DKI扫描
DKI行横轴位扫描,扫描层面的选取及层数的设置与常规MRI扫描相同。DKI扫描采用多次激发紫萱平面回波成像(SE-EPI),扫描参数:TR 3700 ms,TE 95 ms,FOV为210 mm×210 mm,层厚3 mm,层间隔0 mm,b值采用0,1 000和2 000 mm2/s,20正交扩散敏感梯度方向,扫描时间为819 s。
1.5图像分析
由2名10年以上工作经验的主治医师以上的影像诊断医师采用双盲法进行图像分析和评估,同时记录所有病变的部位、形态、大小、信号强度、边界及毗邻关系以及颈部淋巴结情况。DKI扫描结束后,以数字影像和通信(digital imaging and communication of medicine,DICOM)标准格式导出。将DKI资料传入弥散和峰度评估软件Matlab(2012 a /7.14)。
对原始数据首先进行分组和格式转换(DICOM格式转换为NII格式),应用DKE对原始数据进行高强度滤波处理,梯度向量设置为20个方向,b=0,阈值设置为50,b值设置为0,1 000和2 000,获得弥散峰度图(MK图)、表观弥散图(MD图)和FA图。运用mricron软件显示平均峰度图(MK图)、平均扩散图(MD图)和各项异性图(FA图),选定病变最大层面,在病变实质部分手动划定感兴趣区域(ROI),ROI大小约为20体素左右,ROI划定尽量避开出血、坏死、囊变和钙化区,随机选取3个感兴趣区,测量后取平均值。
1.6统计学方法
使用Medcalc15.6统计学软件,运用秩和检验,比较良性和恶性肿瘤间MK值、MD值和FA值差异性,所有MK值、FA值和MD值的平均值均采用均数±标准差(x-±s)表示。采用参数检验数据是否符合正态分布、秩和检验方法比较两组间各参数值有无差异,对差异具有统计学意义的参数以病理结果为金标准,做ROC曲线分析获得DKI对腮腺肿瘤的诊断效能,并用Z检验比较ROC曲线下面积,比较MK值、FA值和MD值诊断及鉴别诊断腮腺肿瘤的能力。以灵敏度和特异度之和做最佳诊断临界点,以P<0.05为差异有统计学意义。
2 结果
2.1病理、MRI和DKI检测结果
在32例患者中共有34枚腮腺肿瘤,1例腺淋巴瘤患者两侧腮腺各有1枚肿瘤,另1例黏液表皮样癌一侧腮腺有两枚肿瘤。34例腮腺肿瘤中良性病变23例,包括多形性腺瘤10例,腺淋巴瘤9例,基底细胞腺瘤2例,多结节性嗜酸细胞腺瘤1例,肌上皮瘤1例;恶性病变11例,其中黏液表皮样癌4例,腺泡细胞癌3例,基底细胞癌2例,腺样囊性癌1例,多形性腺瘤恶变1例。
良性肿瘤中多形性腺瘤均呈圆形或椭圆形,其中8例有包膜,3例有分叶,有包膜的病变边界清楚,T1WI均呈略低于正常腮腺信号,信号较均匀,T2WI信号均高于正常腮腺组织,其中4例肿瘤内出现特殊高信号区,组织学证实为黏液区;MK图信号明显降低且较均质;MD图上呈高信号,FA图呈低信号。2例肿瘤出现特征性纤维化、钙化区,T2WI均呈低信号,如图1所示。
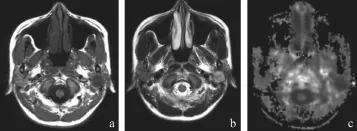
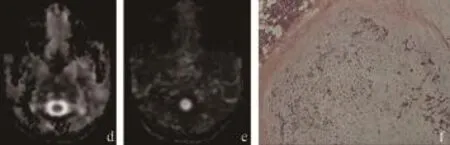
图1 多形性腺瘤的MRI、DKI影像及病理图
多形性腺瘤恶变均表现为腮腺巨大肿块,体积均在3~4 cm或>4 cm,包膜不完整,信号不均匀;MK图信号增高且明显不均质;MD图呈低信号,FA图呈低信号及周围正常腺体呈FA图高信号;恶性成分组织类型高度变异,如图2所示。


图2 多形性腺瘤恶变的MRI、DKI影像和病理图
2.2腮腺肿瘤的DKI表现
2.2.1 腮腺肿瘤良性与恶性MK值、FA值和MD值比较
腮腺肿瘤良性和恶性的平均M K值分别为(0.728±0.263)和(1.091±0.253),二者比较差异有统计学意义(Z=2.934,P<0.05);平均FA值分别为(0.1979±0.0465)和(0.2509±0.0427),二者比较差异有统计学意义(Z=2.348,P<0.05);平均MD值分别为(1.048±0.323)和(0.738±0.330)(10-3mm2/s),二者比较差异具有统计学意义(Z=2.077,P<0.05),见表1。
表1 32例患者腮腺良性和恶性肿瘤的MK值、FA值和MD值(±s)
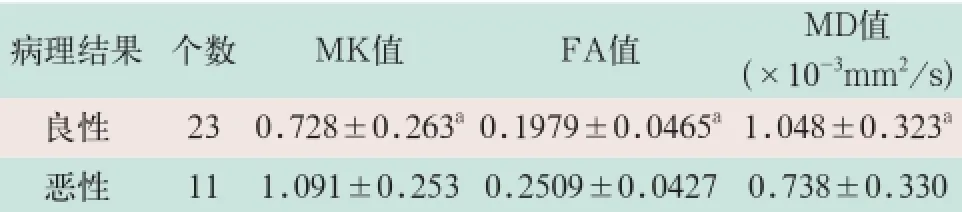
表1 32例患者腮腺良性和恶性肿瘤的MK值、FA值和MD值(±s)
病理结果个数MK值FA值MD值(×10-3mm2/s)良性 230.728±0.263a0.1979±0.0465a1.048±0.323a恶性 111.091±0.253 0.2509±0.04270.738±0.330
2.2.2 ROC曲线分析
MK值、FA值和MD值鉴别腮腺肿瘤良性和恶性的能力。以术后病理为金标准对MK值、FA值和MD值做鉴别肿瘤良恶性的ROC曲线分析,得出MK值为1.0528,为腮腺良性和恶性病变的诊断临界值,当MK值>1.0528时,可诊断为恶性,对应的灵敏度、特异度及AUC分别为75.00%、91.30%和0.853;FA值为0.2396,为腮腺良性和恶性病变的诊断临界值,当FA值>0.2396时,可诊断为恶性,对应的灵敏度、特异度及AUC分别为75.00%、82.61%和0.783;MD值为0.6472(10-3mm2/s),为腮腺良性和恶性病变的诊断临界值,当MD值<0.6472(10-3mm2/s)时,可诊断为恶性,对应的灵敏度、特异度及AUC分别为50.00%、92.65%和0.739,见表2、如图3所示。
腮腺肿瘤实质区ROI的MK值、FA值和MD值的ROC曲线,MK诊断截点为1.0528,AUC为0.853;FA值诊断截点为0.2396,AUC为0.783;MD值诊断截点为0.647210-3mm2/s,AUC为0.739。
3 讨论
应用超声、CT及MRI评估腮腺肿瘤,其传统性检查可以提供肿瘤的病理学特征,然而这些检查在鉴别腮腺肿瘤时缺乏特异性和准确性[11-14]。
DKI是近年来国际众学者关注的前沿焦点,其临床研究发展迅速,是一种新兴的磁共振扩散成像技术和DTI技术的延伸,可准确衡量组织内水分子的非高斯扩散运动,反映组织结构的复杂程度更为敏感。
近年来,磁共振DKI已广泛应用于脑、肝脏、肺及前列腺等各器官病变,且表现出传统弥散及张力成像无法比拟的优势,能够真实的反映非高斯分布的弥散运动情况并提供定量信息[15-22]。在本研究中发现腮腺良性和恶性肿瘤的MK值存在显著的统计学差异,故DKI有助于腮腺肿瘤的诊断及鉴别诊断。
传统的弥散成像(包括DWI和DTI)假设生物体内的水分子的布朗运动(扩散运动)符合高斯分布(正态分布)[23-24]。然而有研究表明,活体组织内的水分子扩散运动由于受到组织细胞类型、细胞膜及生化特性等的影响偏离正态分布[25-26]。这种偏离信息能够被DKI检测并用超值峰度对其量化[15]。DKI通过提高b值到2 000 s/mm2以上增加短分子距离的敏感性,DKI的采集至少需要3个b值和15个以上正交方向弥散梯度场的施加。因此,DKI比传统弥散成像(DWI和DTI)更适合检测和反映组织的微观变化[27]。DKI扫描可以同时得到DTI参数FA值、MD值和DKI参数:MK值、轴向峰度(Ka)和径向峰度(Kr)值。Ka值类似DTI中的FA值,Ka值越小越趋于各向同性扩散,越大表示组织结构越紧密规则,MK值是所有方向上峰度的平均值,反映的是ROI内组织结构的复杂程度,MK值与结构复杂程度成正比[28]。因此,MK值是DKI最具有代表意义的参数,是组织微结构复杂程度的指标。

表2 32例患者MK值、FA值和MD值鉴别腮腺肿瘤良性和恶性ROC曲线分析

图3 腮腺良恶性肿瘤MK值、FA值和MD值ROC曲线图
本研究结果显示,腮腺良性肿瘤和恶性肿瘤实质区的MK值、FA值和MD值差异均有统计学意义。腮腺恶性肿瘤的MK值明显高于良性,MK值与肿瘤的恶性程度成正比,这与Raab等[29]的研究结果一致。此外,Jensen等[15]及Raab等[29]研究团队认为,MK值和肿瘤细胞密度和新生血管等呈正比。MK值采用高b值,多个b值和15个以上正交方向梯度场的平均值(本研究使用的是20个方向),反映的是ROI区域内组织结构的复杂程度,体现了因为受到肿瘤细胞密度、细胞膜屏障、细胞内外间隔以及新生血管和生化环境等因素影响的水分子非高斯扩散运动。腮腺良性和恶性肿瘤MK值、FA值和MD值的ROC曲线结果显示,MK值的AUC(0.859)明显大于FA值和MD值的AUC(0.783和0.789),鉴别腮腺肿瘤的良性和恶性更加敏感,特异度也更高,表明DKI相比传统弥散成像(DWI和DTI)对于腮腺肿瘤良性和恶性的诊断及鉴别诊断能力更高。
本研究中尚存在一些不足之处:①样本数量比较少,病理类型较分散,尤其是恶性组病例,可能会造成统计学的偏差,因此需要大样本数据研究对此进行研究考证;②ROI的选取和参数值的测量等受测试者主观因素影响较大,因此研究结果可能存在偏差,需要进一步的深入研究。
综上所述,腮腺良性和恶性肿瘤MK存在显著差异;相比传统弥散成像(DWI和DTI)技术,DKI技术对于腮腺肿瘤良性和恶性的诊断及鉴别诊断效能更高。
参考文献
[1]Pinkston JA,Cole P.Incidence rates of salivary gland tumors:results from a population-based study[J].Otolaryngol Head Neck Surg,1999,120(6):834-840.
[2]Seifert G.Histoligical Typing of Salivary Gland Tumors[M].2nd ed.Berlin,Germany:Springer-Verlag,1991:24-54.
[3]Donald T,Donovan MD,Houston TX.Capsular significance in parotid tumor surgery: reality andmyths of lateral lobectomy[J].Laryngosco pe,1984,94(3):324-329.
[4]Woods J,Chong G,Beahrs O.Experience with 1360 primary parotid tumors[J]Am J Surg,1975,130:460-462.
[5]Heller KS,Attie JN.Treatment of Warthin’s tumor by enucleation[J].Am J Surg,1988,156(4):294-296.
[6]Witt RL.The significance of the margin in parotid surgery for pleomorphic adenoma[J].Lar yngoscope,2002,112(12):2141-2154.
[7]Myssiorek D,Ruah C,Hybels R.Recurrent pleomorphic adenomas of the parotid gland[J]. Head Neck,1990,12(4):332-336.
[8]Brieger J,Duesterhoeft A,Brochhausen C,et al. Recurrence of pleomorphic adenoma of the parotid gland--predictive value of cadherin-11 and fascin[J].APMIS,2008,116(12):1050-1057.
[9]Wennmo C,Spandow O,Emga°rd P,et al. Pleomorphic adenomas of the parotid gland:superficial parotidecpriatectomy or limited excision?[J].Laryngol Otol,1988,102(7):603-605.
[10]Henriksson G,Westrin KM,Carlsöö B,et al. Recurrent primary pleomorphic adenomas of salivary gland origin:intrasurgical rup ture,histopathologic features and pseudopodia[J]. Cancer,1998,82(4):617-620.
[11]Bialek EJ,Jakubowski W,Zajkowski P,et al.US of the major salivary glands:anatomy and spatial relationships,pathologic conditions,and pitfalls[J].RadioGraphics,2006,26(3):745-763.
[12]Habermann CR,Arndt C,Graessner J,et al. Diffusion-Weighted Echo-Planar MR Imaging of Primary Parotid Gland Tumors:Is a Prediction of Different Histologic Subtypes Possible?[J]. AJNR Am J Neuroradiol,2009,30(3):591-596.
[13]Bozzato A,Zenk J,Greess H,et al.Potential of ultrasound diagnosis for parotid tumours: analysis of qualitative and quantitative parameters[J]. Otolaryngol Head Neck Surg,2007,137(4):642-646.
[14]Bhatia KS,Rasalkar DD,Lee YP,et al.Evaluation of real-time qualitative sonoelastography of focal lesions in the parotid and submandibular glands:applications and limitations[J].Eur Radiol,2010,20(8):1958-1964.
[15]Jensen JH,Helpern JA,Ramani A,Lu H,Kaczynski K.Diffusional kurtosis imaging:The quantification of non-gaussian water diffusion by means of magnetic resonance imaging[J]. Magn Reson Med,2005,53(6):1432-1440.
[16]Masutani Y,Aoki S.Fast and Robust Estimation of Diffusional Kurtosis Imaging (DKI)Parameters by General Closed-form Expressions and their Extensions[J].Magn Reson Med Sci,2014,13(2):97-115.
[17]Assaf Y,Ben-Bashat D,Cohen T,et al.High b value q-space analyzed diffusion-weighted MRI:application to multiple sclerosis[J].Magn Reson Med,2002,47(1):115-126.
[18]Jensen JH,FalangolaMF,Hu C,et al.Preliminary observations of increased diffusional kurtosis in human brain following recent cerebral infarction[J].NMR Biomed,2011,24(5):452-457.
[19]Yuan J,Yeung DKW,Mok GSP,et al.Non-Gaussian analysis of diffusion weighted imaging in head and neck at 3T:A pilot study in patients with nasopharyngeal carcinoma[J].PLoS One,2014,9(1):1-8.
[20]Jansen JF,Stambuk HE,Koutcher J,et al.Nongaussian analysisof diffusion-weighted MR imaging in head and neck squamous cell carcinoma:A feasibility study[J].Am J Neurora diol,2010,31(4):741-748.
[21]Heusch P,Köhler J,Wittsack H-J,et al.Hybrid [18F]-FDG PET/MRI including non-Gaussian diffusion-weighted imaging(DWI):Preliminary results in non-small cell lung cancer(NSCLC)[J]. Eur J Radiol,2013,82(11):2055-2060.
[22]Sigmund EE,Johnson G,Babb JS,et al.Prostate Cancer :Feasibility and Preliminary Experience of a Diffusional Kurtosis Model for Detection and Assessment of Aggressiveness of Peripheral Zone Cancer[J].Radiology,2012,264(1):126-135.
[23]Le Bihan D,Turner R,Douek P,et al.Diffusion MR imaging:clinical applications[J].Am J Roentgenol,1992,159(3):591-599.
[24]Yablonskiy DA,Bretthorst GL,Acker-man JJ.Statistical model for diffusion attenuated MR signal[J].Magn Reson Med,2003,50(4):664-669.
[25]Lu H,Jensen JH,Ramani A,et al.Three-dimensional characterization of non-gaussian water diffusion in humans using diffusion kurtosis imaging[J].NMR in Biomedicine,2006,19:236.
[26]Fieremans E,De Deem Y,Lemahieu I.Validation methods for diffusion weighted magnetic resonance imaging in brain white matter[J]. Biomedical Imaging,2008,5:915.
[27]Hui ES,Cheung MM,Qi L,et al.Towards better MR characterization of neural tissues using directional diffusion kurtosis analysis[J]. Neuroimage,2008,42(1):122-134.
[28]曾丁巳.扩散峰度成像(DKI)在中枢神经系统的应用[J].临床放射学杂志,2011,30(9):1400-1402.
[29]Raab P,Hattingen E,Franz K,et al.Cerebral gliomas:diffusional kurtosis imaging analysis of microstructural differences[J].Radiology,2010,254(3):876-881.
The clinical value of diagnosis and differential diagnosis of magnetic resonance diffusion kurtosis imaging for parotid tumors
/
YU Jin-fen, WANG Xiang-sheng, CAO Guang-liang, et al//China Medical Equipment,2017,14(1):62-66.
Objective: This study aimed to explore the application values of diffusion kurtosis imaging (DKI) in differential diagnosis of benign and malignant parotid tumors. Methods: 32 patients with parotid tumor were examined preoperative with conventional magnetic resonance imaging (MRI) and DKI, respectively. The data of DKI were analyzed with diffusion kurtosis estimator to calculate mean kurtosis (MK), mean diffusivity (MD) and fractional anisotropy (FA). And the MK, MD and FA can be got by ROC curve. The diagnostic accuracy of MK, MD and FA values was evaluated with series of diagnosis effectiveness indicators, such as sensitivity, specificity, and area under receiver operating characteristic (ROC) curve. Results: There was a significant difference between benign and malignant parotid tumors in the values of MK, FA and MD (P=0.003, 0.019 and 0.047, respectively). The mean MK value of benign parotid tumors was significantly lower than malignant parotid tumors; The mean FA value of benign parotid tumors was significantly lower than malignant parotid tumors; and the mean MD value of benign tumors was significantly higher than malignant tumors. The diagnosis of cut-off point between benign and malignant parotid tumors for MK, FA and MD was 1.0528, 0.2396 and 0.6472(×10-3mm2/s), respectively. The sensitivity, specificity and AUC for MK, FA and MD in differentiating benign and malignant parotid tumor were 0.853, 75.00%, 91.30%; 0.783, 75%, 82.61%; 0.739, 50%, 95.65%; respectively. Conclusion: DKI showed higher specificity and sensitivity than did conventional diffusion-weighted and diffusion-tensor imaging for assessment and differential diagnosis of benign and malignant parotid tumors. MK enables differentiation and characterisation of parotid tumors, and provides quantitative information for the parotid tumors.
Parotid tumor; Diffusion kurtosis imaging; Magnetic resonance imaging
10.3969/J.ISSN.1672-8270.2017.01.020
1672-8270(2017)01-0062-05
R739.8
A
2016-09-25
①山东大学附属山东省医学影像学研究所 山东 济南 250022
②章丘市中医医院医学影像中心 山东 章丘 250200
*通讯作者:lichuanting@yeah.net
于金芬,女,(1979- ),博士研究生,主治医师。山东大学附属山东省医学影像学研究所、章丘市中医医院医学影像学中心,从事磁共振影像诊断工作。

