巴斯德杆菌属CODEHOP PCR检测方法的建立与初步应用
邢 进,冯育芳,岳秉飞,贺争鸣*,孙晓梅,代解杰
(1. 中国食品药品检定研究院实验动物资源研究所,北京 100050; 2. 中国医学科学院/北京协和医学院医学生物学研究所树鼩种质资源中心,昆明 650118)
巴斯德杆菌属CODEHOP PCR检测方法的建立与初步应用
邢 进1,冯育芳1,岳秉飞1,贺争鸣1*,孙晓梅2,代解杰2
(1. 中国食品药品检定研究院实验动物资源研究所,北京 100050; 2. 中国医学科学院/北京协和医学院医学生物学研究所树鼩种质资源中心,昆明 650118)
目的 建立巴斯德杆菌的CODEHOP PCR快速检测方法,为实验动物的呼吸道细菌的控制提供参考。 方法 应用CODEHOP在线简并引物设计工具,比对Genbank中13株巴斯德杆菌的RNA聚合酶β亚基(rpoB)氨基酸序列设计简并引物。对建立CODEHOP PCR方法用21株参考菌株进行特异性和敏感性评价,并应用于实验动物中的巴斯德杆菌检测。 结果 简并引物PastF6/PastR5扩增标准菌株的目的片段为200 bp左右。能够区分受试的巴斯德杆菌和主要的实验动物呼吸道病原菌。敏感性为0.2 pg/μL~2 pg/μL。在受试的609只实验动物中呼吸道样品中检测出巴斯德杆菌阳性率为19.1%。样品阳性片段经测序验证,准确率为100%。 结论 所建立的方法具有良好的特异性和敏感性,可用于动物样品中巴斯德杆菌的检测。
巴斯德杆菌;共有序列简并杂合寡核苷酸引物;PCR检测;实验动物
巴斯德杆菌属(Pasteurellaspp.)是一群革兰氏阴性,不抗酸、不运动、无芽孢的短杆菌或球杆菌,绝大部分存在于动物呼吸道粘膜,特别是在啮齿类实验动物呼吸道中普遍存在。本属菌株表型特征相近[1],大部分菌株为条件致病菌,以嗜肺巴斯德杆菌和多杀巴斯德杆菌较为常见,为实验动物微生物国家标准中SPF级动物需排除的病原菌[2]。感染发病时,以呼吸系统症状为主,根据具体感染部位的不同可引起各种炎症,如肺炎、皮炎、眼炎、结膜炎、乳腺炎、关节炎等[3]。与仙台病毒、腺病毒、支原体、支气管鲍特杆菌等合并感染,更会加重感染症状,对动物实验造成不可忽视的影响[4-5]。
与我国标准不同,欧盟实验动物联合会(FELASA)的检测标准中需要检测巴斯德菌科(Pasteurellaceae)中的所有菌株。在巴斯德菌科中,除巴斯德杆菌属外,放线杆菌属(Actinobacillus)、嗜血杆菌属(Haemophilus)、曼海姆菌属(Mannheimia)等菌属的菌株在实验动物中也比较常见,其形态和基因组序列相似度高,不易区分。根据我国的实验动物微生物控制现状,短期内排除所有巴斯德菌科菌株并不现实,因此首先从排除影响大、感染率最高的巴斯德杆菌属着手,建立有效的菌属检测方法。本研究旨在采用共有序列简并杂合寡核苷酸引物(consensus degenerate hybrid oligonucleotide primers,CODEHOP)PCR方法[6,7],建立针对巴斯德杆菌属的快速检测方法。
1 材料和方法
1.1 实验材料
1.1.1 菌株
本研究共采用21株参考菌株,依据伯杰氏系统细菌学手册[8]和美国标准生物品收藏中心(ATCC)的分类,其中巴斯德菌科菌株16株,5株巴斯德杆菌(表1)。
1.1.2 实验动物呼吸道样本
小鼠、大鼠、豚鼠、地鼠呼吸道样品取自2015年北京市会检,沙鼠呼吸道样品采自普通环境生长的长爪沙鼠,由浙江省实验动物中心[SCXK(浙)2014-0034]和首都医科大学[SCXK(京)2015-0009]提供。树鼩呼吸道样品采自昆明滇西亚种野生驯化树鼩咽拭子及气管,由中国医学科学院医学生物学研究所提供[SCXK(滇)K2013-0001]。

表1 参考菌株
注:(ATCC)美国标准物质保藏中心;(CMCC)中国医学细菌保藏管理中心。
Note.(ATCC)American Type Culture Collection.(CMCC)National Center for Medical Culture Collection.
1.2 主要试剂与仪器
哥伦比亚血琼脂(OXIOD);无菌脱纤维羊血(北京路桥生物技术有限公司);GC琼脂(BD),肺炎支原体肉汤(北京三药科技开发有限公司);DNA提取试剂盒(Qiagen);PCR试剂(TAKARA);,琼脂糖(TAKARA)。
恒温培养箱(美国Thermo IGS180);冷冻离心机(美国Thermo X1R);超微量分光光度计(德国NanoPhotometer);PCR仪(美国ABI veriti96);电泳仪(美国伯乐Powerpac HC);紫外凝胶成像系统(美国Kodak GL212pro)。
1.3 实验方法
1.3.1 菌种复苏与DNA提取
巴斯德杆菌及其他参考菌种接种于哥伦比亚血琼脂平皿,至36℃培养24 h;嗜血杆菌接种于GC培养基,36℃微需氧培养48 h;肺炎支原体接种于肺炎支原体肉汤培养基36℃厌氧培养5 d;根据试剂盒说明提取各参考菌株的基因组DNA,冻存与-20℃备用。
1.3.2 引物的设计与合成
将13株Genbank中获得的巴斯德杆菌rpoB氨基酸序列(表2)通过CODEHOP在线引物设计工具(http://blocks.fhcrc.org/codehop.html)[10]设计简并引物。巴斯德杆菌rpoB氨基酸序列经分析后,被分为了三个保守的区域,从中选择高分、低简并度的引物,最终筛选出上游引物PastF6:5’-GGTGAACGGCCAGGTGacngargarat-3’和下游引物PastR5:5’-CTGGGTGGACACGTCCatrtartgdat-3’(图1)。由生工生物工程(上海)股份有限公司合成。
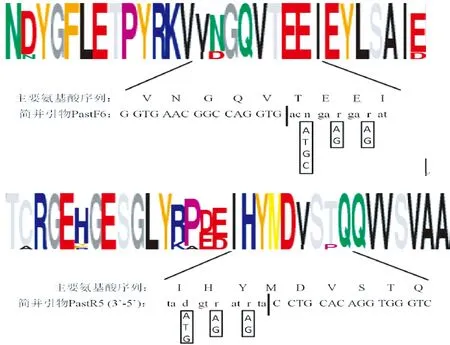
图1 P-选简并引物PastF6和PastR5Fig.1 CODEHOP primer pair PastF6 and PastR5
1.3.3 PCR体系及条件
PCR体系为20 μL:10×PCR Buffer(含Mg2+)2 μL,dNTP(10 μM)1.6 μL,1 U的Taq HS DNA聚合酶(5 U/μL),PastF6/R5(10 μM)各0.5 μL,模板DNA 1 μL,灭菌水14.2 μL。反应条件经优化后确定:94℃ 3 min;94℃ 30 s,55℃ 30 s,72℃ 45 s,共35个循环;最后72℃延伸7 min。产物经1.5%琼脂糖在0.5%TBE中120 V电泳40 min,并将阳性片段送生工生物工程(上海)股份有限公司测序。
1.3.4 特异性检测
对5株巴斯德杆菌及16株它属菌株基因组DNA进行扩增,检测非巴斯德菌有无目的片段产生,特异性条带进行测序和Blast比对验证。
1.3.5 敏感性检测
提取5株巴斯德杆菌的DNA,核酸浓度均调整至20 ng/μL,分别做10倍系列稀释至10-6,共7个稀释度(20 ng/μL~20 fg/μL),对本PCR方法进行敏感性检测。
1.3.6 方法应用检测
用DNA提取试剂盒提取呼吸道样品的DNA,进行PCR扩增。部分PCR阳性产物进行测序和Blast比对,验证结果的准确性。同时对相同样品进行血琼脂分离培养,将结果进行比较。树鼩取样操作在中国医学科学院北京协和医学院医学生物学研究所树鼩种属资源中心进行[SYXK(滇)K2013-0001],其他实验动物操作在中国食品药品检定研究院进行[SYXK(京)2011-0008]。
2 结果
2.1 方法的建立与特异性结果
根据引物的配对组合结果,PastF6/R5引物对能够较特异性的扩增出5株巴斯德杆菌标准菌株。而且均扩增出单一的200 bp左右目的条带(图2)。目的片段经测序和 Blast比对(http://blast.ncbi.nlm.nih.gov/Blast.cgi),结果相符(表3)。

注:(1、23)100 bp DNA Marker; (2)嗜肺巴斯德杆菌ATCC12555;(3)嗜肺巴斯德杆菌ATCC35149;(4)多杀巴斯德杆菌ATCC43137;(5)产气巴斯德杆菌ATCC27883;(6)达科马巴斯德杆菌ATCC43325;(7)鸡禽杆菌ATCC13361;(8)脲放线杆菌ATCC25976;(9)副鸡禽杆菌ATCC29545;(10)鸟禽杆菌ATCC29546;(11)溶血曼海姆杆菌ATCC33369;(12)溶血嗜血杆菌ATCC33390;(13)流感嗜血杆菌ATCC33391;(14)副流感嗜血杆菌ATCC33392;(15)杜克雷嗜血杆菌ATCC33940;(16)肉芽肿曼海姆菌ATCC49244;(17)小鼠放线杆菌ATCC49577;(18)支气管鲍特杆菌ATCC19395;(19)肺炎链球菌CMCC36001;(20)乙型溶血性链球菌CMCC32210;(21)鼠棒状杆菌CMCC65013;(22)肺炎支原体ATCC15531。图2 P-选引物PastF6/R5特异性试验结果Note.(1、23)100 bp DNA Marker. (2) P.neumotropica ATCC12555. (3) P.pneumotropica ATCC35149. (4)P.multocida ATCC43137. (5)P.aerogenes ATCC27883. (6) P.dagmatis ATCC43325. (7)A.gallinarum ATCC13361. (8) A.ureae ATCC25976. (9) A. paragallinarum ATCC29545. (10)P.avium ATCC29546. (11) M.haemolytica ATCC33369. (12) H.haemolyticus ATCC33390. (13) H. influenza ATCC33391. (14) H.parainfluenzae ATCC33392. (15) H.ducreyi . (16) M.granulomatis ATCC49244. (17) A.muris ATCC49577. (18) B.bronchiseptica ATCC19395. (19) S.pneumoniae CMCC36001. (20) S.hemolytis-β CMCC32210. A.faecalis ATCC8750, S.pullorum CMCC50047, P.mirabilis DJ150030, B.cereus CMCC63301. (21) C.Kutscheri CMCC65013. (22) M.pneumoniae ATCC15531.Fig.2 Specific result of primers PastF6/R5 amplified reference strains
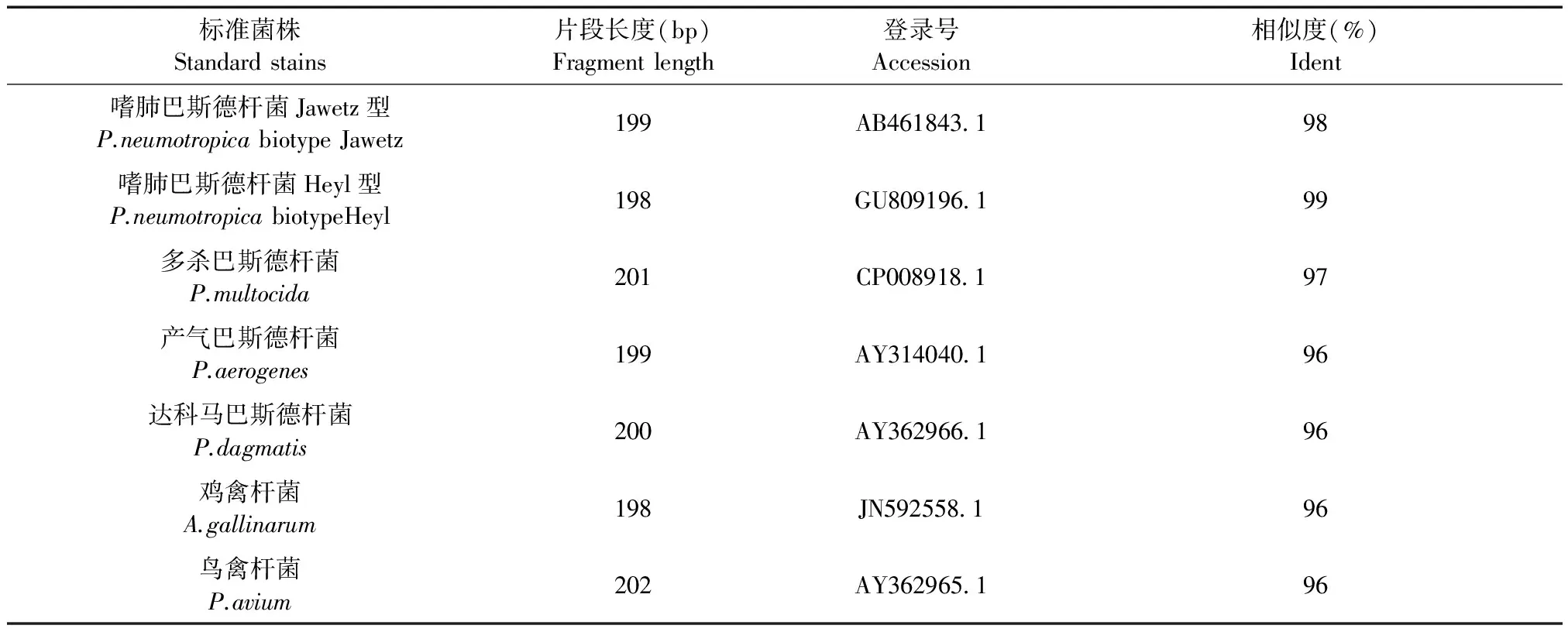
标准菌株Standardstains片段长度(bp)Fragmentlength登录号Accession相似度(%)Ident嗜肺巴斯德杆菌Jawetz型P.neumotropicabiotypeJawetz199AB461843198嗜肺巴斯德杆菌Heyl型P.neumotropicabiotypeHeyl198GU809196199多杀巴斯德杆菌P.multocida201CP008918197产气巴斯德杆菌P.aerogenes199AY314040196达科马巴斯德杆菌P.dagmatis200AY362966196鸡禽杆菌A.gallinarum198JN592558196鸟禽杆菌P.avium202AY362965196
2.2 敏感性结果
用引物PastF6/R5分别扩增5株巴斯德杆菌参考菌株DNA,不同菌株的敏感性结果有所不同(图3)。检测嗜肺巴斯德杆菌和产气巴斯德杆菌的检测限可达0.2 pg/μL;多杀巴斯德杆菌和达科马巴斯德杆菌的检测限为2 pg/μL。
2.3 应用检测
用本方法检测609只动物呼吸道样品,共有116份产生目的片段,巴斯德杆菌属阳性率为19%,分离培养法鉴定出77份存在巴斯德杆菌,阳性率为12.6%(表4)。用统计分析软件SPSS19.0对结果进行NcNemar检验,P< 0.001,两种方法差异显著;一致性检验Kappa值=0.725,结果比较一致。对树鼩的58份阳性片段(图4)进行测序和序列比对,结果中多杀巴斯德杆菌感染率为32/58,嗜肺巴斯德杆菌、达科马巴斯德杆菌和产气巴斯德杆菌各为1/58,其他未知巴斯德菌科菌株为23/58。除25份样本为未知的巴斯德菌科菌株外,阳性结果准确率100%。
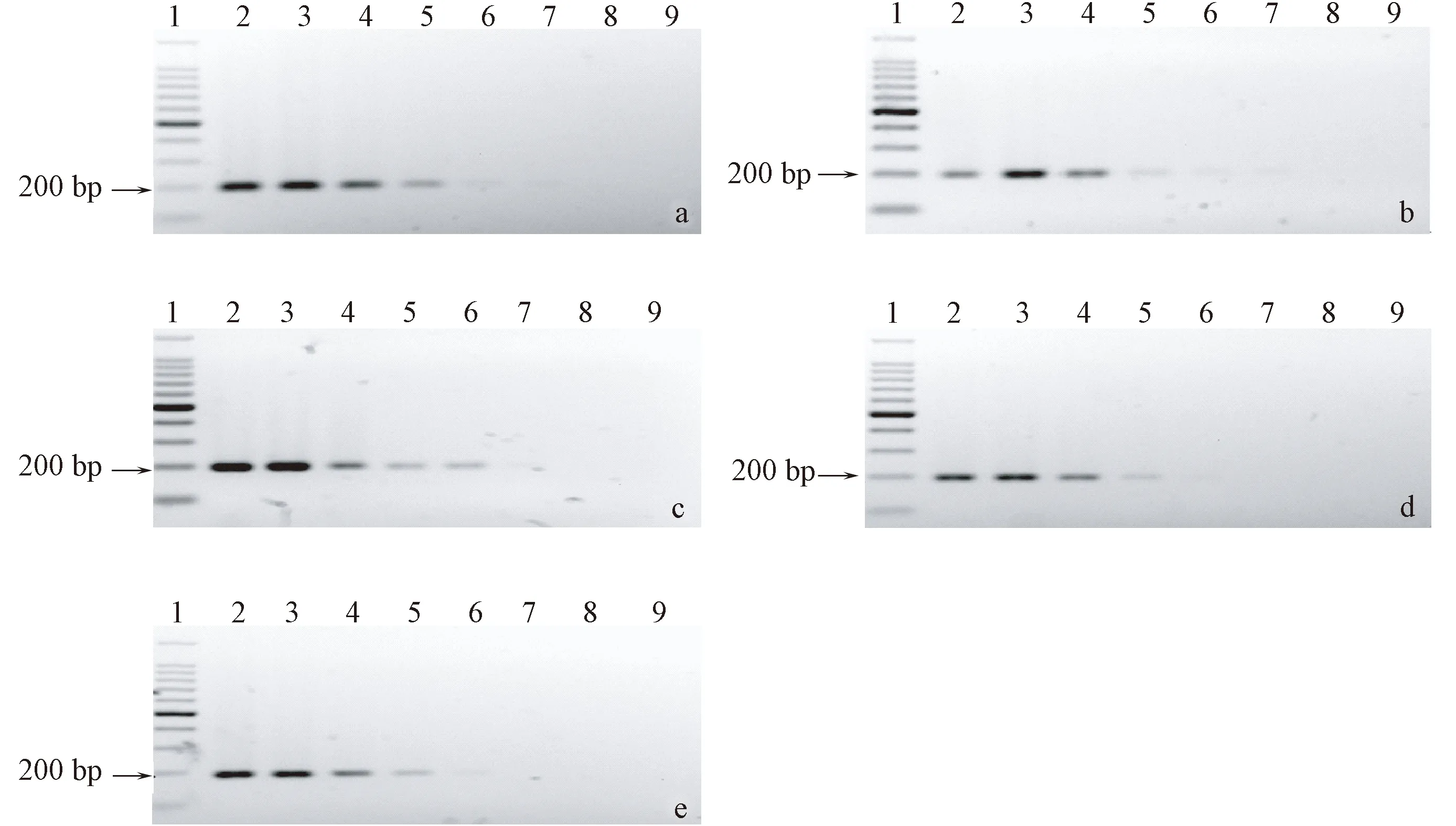
注:(a)菌株ATCC12555;(b)菌株ATCC27883;(c)菌株ATCC25149;(d)菌株ATCC43137;(e)菌株ATCC43325;(1)100bp DNA Marker;(2~8)模板浓度分别为20 ng/μL~20 fg/μL;(9)空白对照。图3 引物PastF6/R5敏感性检测结果Note.(a)Strain ATCC12555.(b)Strain ATCC27883.(c)Strain ATCC25149.(d)Strain ATCC43137.(e)Strain ATCC43325.(1)100bp DNA Marker.(2~8)Template concentration of 20 ng/μL~20 fg/μL respectively.(9)Blank control.Fig.3 Sensibility results of primers PastF6/R5 amplified Pasteurella spp.
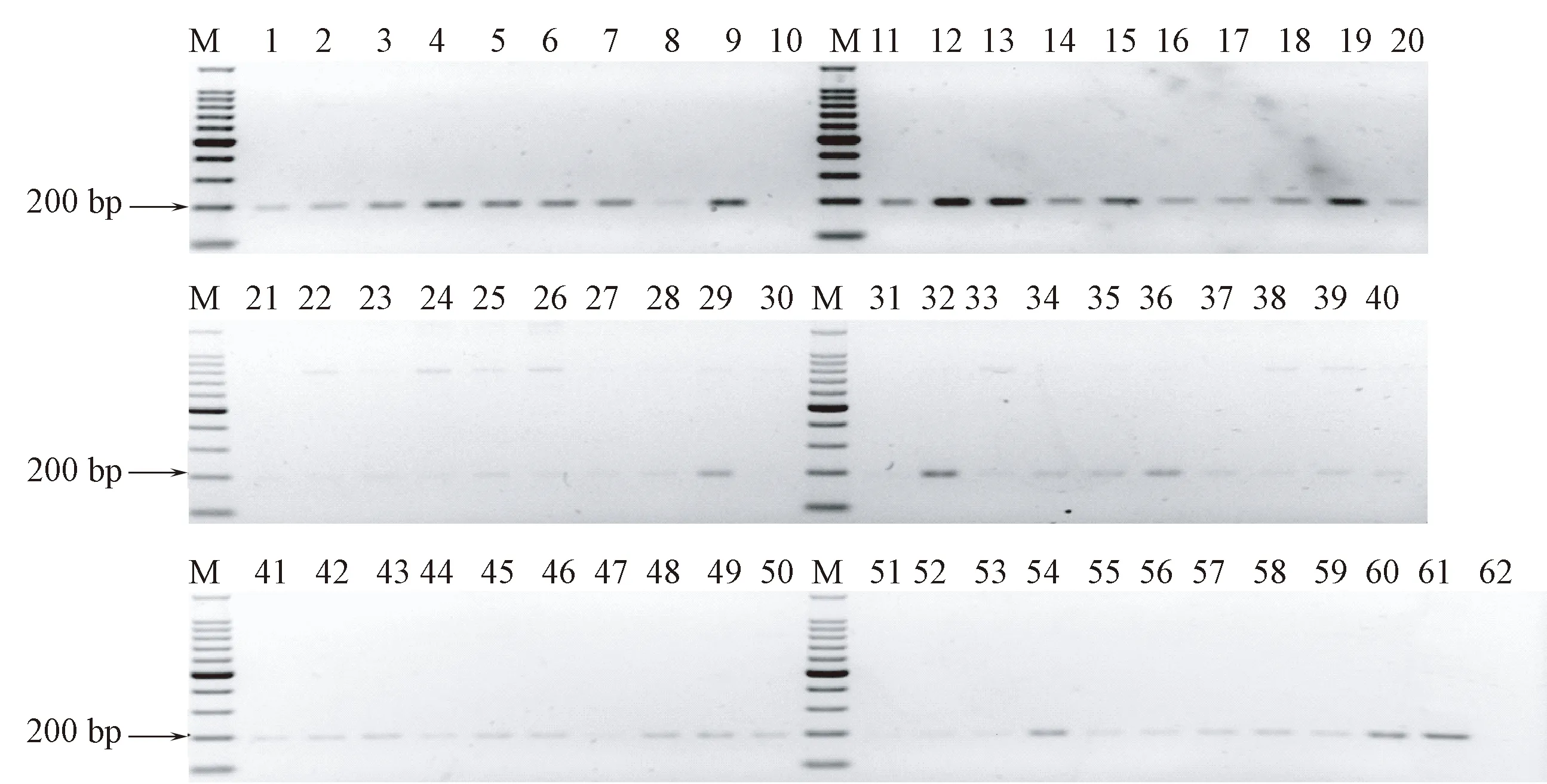
注:(M)100bp DNA Marker;(1~60)树鼩呼吸道样本;(61)多杀巴斯德杆菌阳性对照;(62)空白对照。图4 树鼩呼吸道样品巴斯德杆菌检测结果Note. (M)100bp DNA Marker. (1~60)Tree shrew respiratory tract samples. (61)P.multocida positive control. (62)Blank control.Fig.4 The results of Tree shrews Pasteurella test
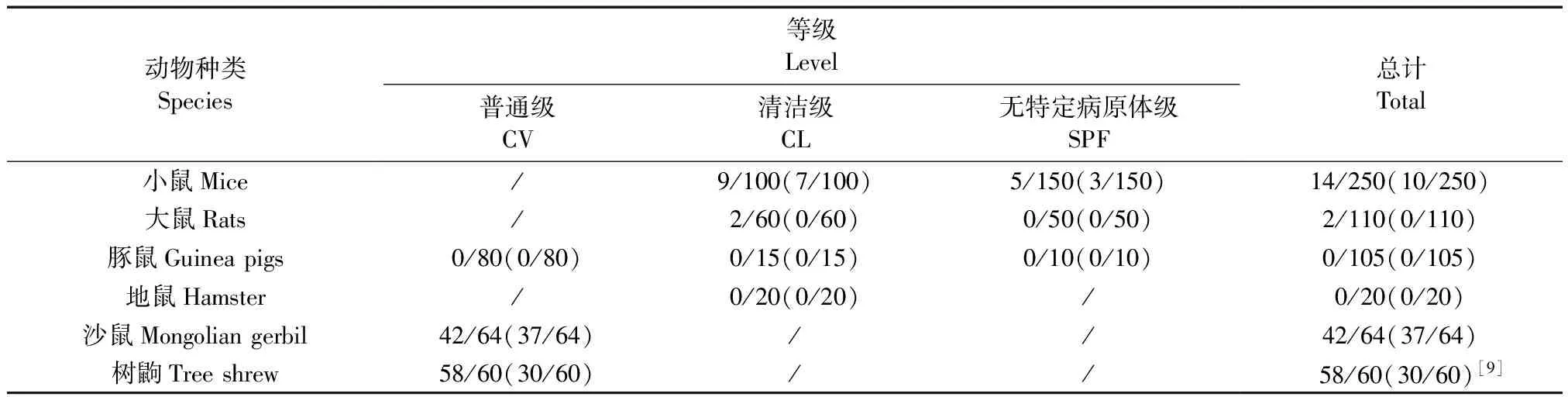
动物种类Species等级Level普通级CV清洁级CL无特定病原体级SPF总计Total小鼠Mice/9/100(7/100)5/150(3/150)14/250(10/250)大鼠Rats/2/60(0/60)0/50(0/50)2/110(0/110)豚鼠Guineapigs0/80(0/80)0/15(0/15)0/10(0/10)0/105(0/105)地鼠Hamster/0/20(0/20)/0/20(0/20)沙鼠Mongoliangerbil42/64(37/64)//42/64(37/64)树鼩Treeshrew58/60(30/60)// 58/60(30/60)[9]
注:括号中为分离培养法阳性率。
Note. The content in round brackets is the positive rate of culture method.
3 讨论
本研究利用CODEHOP 方法设计了巴斯德杆菌属的简并引物,在巴斯德菌科内能够排除绝大部分非巴斯德杆菌属菌株。巴斯德杆菌属、放线杆菌属和嗜血杆菌属仅通过16SrRNA很难进行区分,根据此前的报道,rpoB蛋白能够识别16SrRNA不能区分的巴斯德菌科菌株[10],因此我们将RNA聚合酶的β亚基(rpoB)作为了目标基因。所建立的PCR方法与传统分离培养法相比较,具有更高的敏感性,被检样品的阳性率从12.6%提高到19.1%,不同种类动物的检出率均有提高。通过对目的片段的测序和序列比对,能够快速的获取目标菌的种类,相比培养后进行生化鉴定具有更高的效率和可靠性。
虽然本方法能够比较好的区分出巴斯德杆菌属的菌株,但与禽杆菌属菌株仍存在交叉反应,与Christensen等[10]所报道的结果一致。伯杰氏系统细菌学手册(2004年第二版)中将狭义的巴斯德杆菌限制为多杀巴斯德杆菌、达科马巴斯德杆菌、犬巴斯德杆菌和口腔巴斯德杆菌。禽类菌株曾经归属于巴斯德杆菌属,但在系统进化上分属于不同的分支[8]。在随后的基因型和表型研究进一步证实了禽类菌株的不同,对禽巴斯德杆菌P.gallinarum和鸡巴斯德杆菌P.avium等4株菌重新进行了分类,均归属于禽杆菌属(Avibacteriumspp.),并更名为A.gallinarum和鸟禽杆菌A.avium[11]。因此寻找巴斯德杆菌属与禽杆菌菌株的之间的特异性差异片段仍需进一步研究。
[1] 邢进,冯育芳,岳秉飞,等. 北京地区实验动物中嗜肺巴斯德杆菌的表型分析[J]. 中国比较医学杂志, 2014,24(6):54-57.
[2] GB/T 14922.2-2010,实验动物微生物学等级及监测[S]. 2011.
[3] Bootz F, Kirschnek S, Nicklas W,etal. Detection ofPasteurellaceaein rodents by polymerase chain reaction analysis[J]. Lab Anim Sci, 1998, 48(5):542-546.
[4] Waggie K, Kagiyama N, Allen AM,etal. Manual of microbiologic monitoring of laboratory animals, Second Edition[M]. 1994, 145-150.
[5] Pintore MD, Corbellini D, Chieppa MN,etal. Canine adenovirus type 1 andPasteurellapneumotropicaco-infection in a puppy[J]. Vet Ital, 2016, 52(1):57-62.
[6] Rose TM, Schultz ER, Henikoff JG,etal. Consensus-degenerate hybrid oligonucleotide primers for amplification of distantly related sequences[J]. Nucleic Acids Res, 1998, 26(7): 1628-1635.
[7] Rose TM, Henikoff JG, Henikoff S. CODEHOP (COnsensus-DEgenerate Hybrid Oligonucleotide Primer) PCR primer design[J]. Nucleic Acids Res, 2003, 31(13): 3763-3766.
[8] Brenner DJ, Krieg NR, Staley JT,etal. Bergey’s Manual of Systematic Bacteriology, Second Edition, Volume Two, The Proteobacteria, Part B, The Gammaproteobacteria[M]. 2005.
[9] 邢进,冯育芳,付瑞等.野生树鼩可培养细菌和真菌携带情况的调查[J]. 实验动物科学,2012,29(3):34-38.
[10] Christensen H, Kuhnert P, Olsen JE,etal. Comparative phylogenies of the housekeeping genesatpD,infBandrpoBand the 16S rRNA gene within thePasteurellaceae[J]. Int J Syst Evol Microbiol,2004, 54(Pt 5):1601-1609.
[11] Blackall PJ, Christensen H, Beckenham T,etal. Reclassification of Pasteurella gallinarum, [Haemophilus]paragallinarum,PasteurellaaviumandPasteurellavolantiumasAvibacteriumgallinarumgen. nov., comb. nov.,Avibacteriumparagallinarumcomb. nov.,Avibacteriumaviumcomb. nov. andAvibacteriumvolantiumcomb. nov.[J].Int J Syst Evol Microbiol,2005, 55(Pt 1):353-362.
Establishment and application of CODEHOP PCR assay for detection ofPasteurellaspp. in laboratory animals
XING Jin1, FENG Yu-fang1, YUE Bing-fei1, HE Zheng-ming1*, SUN Xiao-mei2, DAI Jie-jie2
(1. National Institute of Food and Drug Control, Institute of Laboratory Animal Resources, Beijing 100050, China; 2. Center of Tree Shrews Germplasm Resources,Institute of Medical Biology,CAMS and PUMC,Kunming 650118,China)
Objective We established a rapid detection method ofPasteurellaspp. and provided a reference for microbiological quality control of laboratory animal. Methods According to the β subunit of bacterial RNA polymerase (rpoB) protein multiple alignments of 13 differentPasteurellaspp. published in NCBI. The degenerate primers were designed by CODEHOP designer online. CODEHOP PCR method was applied to detectingPasteurellaspp. after the specificity and sensitivity of the method had been evaluated by 21 reference strains. Results Standard strain amplified fragment were about 200 bp by degenerate primers PastF6/PastR5. The primers are able to distinguish betweenPasteurellaspp. and the other pathognic organisms of laboratory animal respiratory tracts. Sensitivity of this method were 0.2 pg/μL~2 pg/μL to differentPasteurella. ThePasteurellapositive rate was 19.1% in 609 animal’s respiratory samples. The accuracy of positive results was 100% through verifying by sequenced and blast. Conclusions The established method has good specificity and sensitivity. It can be used to detectPasteurellaspp. in animal samples.
Pasteurellaspp.; CODEHOP; PCR detection; Laboratory animals
国家科技支撑计划项目(2014BAI01B01)。
邢进(1979-),男,副研究员。研究方向:实验动物微生物检测。E-mail:xjvet@nifdc.org.cn
贺争鸣(1957-),男,研究员。研究方向:实验动物微生物学。E-mail:zhengminghe57@163.com
技术方法
R-332
A
1671-7856(2017) 01-0085-06
10.3969.j.issn.1671-7856.2017.01.017
2016-06-28

