黄芪多糖对腹腔注射大肠杆菌小鼠TLR信号通路MyD88、ERK及细胞因子的影响
刘 灿,王 婵,左之才*,王正中,李学伟,马继登
(1.四川农业大学动物医学院环境公害与动物疾病四川省高校重点实验室,四川雅安 625014;2.四川农业大学动物科技学院动物遗传育种研究所,四川成都 611130)
黄芪多糖对腹腔注射大肠杆菌小鼠TLR信号通路MyD88、ERK及细胞因子的影响
刘 灿1,王 婵1,左之才1*,王正中1,李学伟2,马继登2
(1.四川农业大学动物医学院环境公害与动物疾病四川省高校重点实验室,四川雅安 625014;2.四川农业大学动物科技学院动物遗传育种研究所,四川成都 611130)
研究黄芪多糖调节动物机体的基本免疫应答的机理。试验选取了132只健康小鼠饲养并采样,其中6只为初始对照记为感染前72 h(-72 h),其余小鼠分为3组。Ⅰ组为黄芪多糖组(66 mg·kg-1灌胃黄芪多糖),Ⅱ组为模型组(66 mg·kg-1蒸馏水灌胃),Ⅲ组为健康对照组(66 mg·kg-1蒸馏水灌胃),每日1次,连用3 d;试验第4天,Ⅰ、Ⅱ组小鼠腹腔注射大肠杆菌液(0.1 mL·只-1),Ⅲ组小鼠腹腔注射等体积生理盐水。在注射后0、3、6、12、24、48、168 h,每组随机选取6只小鼠眼球采血分离血清,采用ELISA试剂盒检测MyD88、ERK、TNF-α、IL-6指标。与Ⅲ组比较,Ⅱ组小鼠在0~48 h的MyD88、ERK、TNF-α、IL-6均升高。与Ⅱ组比较,Ⅰ组小鼠在0 h的MyD88、ERK、TNF-α均升高,在3~24 h的MyD88、ERK,在3~12 h的IL-6均显著下降(P<0.05),TNF-α在168 h显著升高(P<0.05)。感染大肠杆菌会明显激活小鼠MyD88-ERK通路,但当预防用黄芪多糖激活小鼠MyD88-ERK通路后,再感染大肠杆菌时则并不能引起MyD88-ERK通路的进一步激活。预防用黄芪多糖可减轻大肠杆菌感染引起的应激反应,缓解其引起的MyD88-ERK通路激活,进而达到调节机体免疫平衡的作用。
黄芪多糖;大肠杆菌;ERK通路;炎症
Toll受体(Toll-ike receptor,TLR)信号通路在自身免疫中有着非常重要的作用[1],内毒素(lipopolysaccharide,LPS)为大肠杆菌的致病因子之一,主要激活机体TLR信号通路,引起机体炎症反应。LPS与LBP(脂多糖结合蛋白)结合后,通过CD14传递给TLR4/MD2复合体,形成异源二聚体,通过两种不同的接头蛋白启动两条信号通路:TIRAP-MyD88[髓样分化因子(myeloid differentiation factor 88,MyD88)]通路(MyD88依赖性途径)及TRIF-TRAM通路(非MyD88依赖性途径)。在MyD88依赖性途径中,通过一系列胞内信号转导因子的信息传递可激活IKK/NF-κB及丝裂原活化的蛋白激酶(MAPKs)途径,MAPKs包括ERK(细胞外信号调节激酶)、P38、JNK,当他们被激活后可诱导核转录因子AP-1进入胞核,启动一系列与应激相关的炎性介质如TNF-α(肿瘤坏死因子-α)、IL-1(白细胞介素-1)、IL-6(白细胞介素-6)等合成[2]。ERK,称为细胞外信号调节激酶。当其被激活时可进入核内,磷酸化AP-1,调控基因的表达[3-5]。TNF-α是由巨噬细胞和单核细胞产生的炎性细胞因子,有免疫调节、参与发热和炎症发生的功能[6]。IL-6主要由T细胞、B细胞等细胞产生,是参与免疫调节和炎性反应的重要细胞因子之一[7]。另一方面,非MyD88依赖性途径主要通过TRIF/IRF3诱导IFN-β(干扰素-β)的产生[8-10]。
黄芪多糖作为一种具有多重功效的天然提取物质,对机体免疫系统具有非常广泛的调节作用,能全面提高机体的免疫监视和免疫防御功能,增强免疫力,抵抗外界不良因素的侵害[11]。为进一步探讨黄芪多糖作为感染性疾病预防用药的科学性与合理性,试验研究预防用黄芪多糖对腹腔注射大肠杆菌小鼠MyD88依赖性途径ERK以及下游细胞因子的影响。
1 材料与方法
1.1 试验动物
清洁级昆明小鼠132只,6~8周龄,体重18~22 g,雌雄各半,购自四川大学华西医学中心实验动物中心。
1.2 试验药物
黄芪多糖注射液(质量体积比10 mg·m L-1),成都乾坤动物药业有限公司,批号:20150601。
1.3 试验菌株及菌液配制
大肠杆菌(E.coli)从患水肿病竹鼠腹腔积液中分离,由四川农业大学兽医内科实验室保存。对该菌的前期研究表明,该大肠杆菌对昆明小鼠的LD0为1.7×107,LD50为9.9×107,LD100为4.3× 108。本试验参照此菌对昆明小鼠的最大耐受量作为注射浓度。
将E.coli复苏并接种于5 m L MH肉汤培养基37℃培养16~18 h,用平板菌落计数法,估算其菌液浓度,再将菌液浓度稀释至约为1.7×108m L-1,备用。
1.4 主要试剂及仪器
全自动荧光酶标分析仪(PR-521)。小鼠MyD88、ERK、TNF-α和IL-6的ELISA检测试剂盒,均购自武汉基因美生物科技有限公司(Lot. 201601)。
1.5 试验动物分组及处理
待小鼠适应饲养后,按照性别、体重选取6只未作任何处理的健康小鼠直接采样,作为各组小鼠的初始对照,记为-72 h;另将精神、体况接近的126只小鼠按照性别、体重分为3组。其中Ⅰ组为黄芪多糖组;Ⅱ组为模型组;Ⅲ组为健康对照组。Ⅰ组于每日8:00,将制备的黄芪多糖按66 mg· kg-1灌胃,每日1次,连用3 d,Ⅱ、Ⅲ组灌胃同体积蒸馏水。在试验第4天上午8:00,Ⅰ、Ⅱ组小鼠腹腔注射大肠杆菌液(0.1 m L·只-1),Ⅲ组小鼠腹腔注射0.1 m L生理盐水。在注射后0、3、6、12、24、48、168 h,每组随机处死6只小鼠,通过眼球采血法获取血液分离血清,进行试验。各组按常规饲养管理。
1.6 样本采集与检测指标
1.6.1 临床观察
观察小鼠自主活动、体重变化、皮毛、呼吸、摄食、饮水、排泄、死亡等情况。
1.6.2 检测指标及方法
于试验各个时间点,每组随机选取6只小鼠,摘除眼球采血0.7 mL,4℃3 000 r·min-1离心20 min,分离血清,-20℃保存备用。按照试剂盒说明书测定血清中MyD88、ERK、TNF-α、IL-6的含量。
1.7 数据处理
用SPSS 11.0软件进行方差分析和多重比较,数据用平均值±标准差表示。P<0.05表示差异显著,P<0.01表示差异极显著,P>0.05表示差异不显著。
2 结果和分析
2.1 各组小鼠腹腔注射大肠杆菌前后的临床表现
腹腔注射大肠杆菌前各组小鼠精神状况良好,饮、食欲正常。腹腔注射大肠杆菌后,小鼠相继出现患病症状,其中Ⅰ组仅有部分小鼠在注射后3~12 h有精神稍差、活动减少的表现;24 h后小鼠的行为表现及精神状态基本恢复正常。Ⅱ组在注射后3 h,多数小鼠的饮、食欲显著下降,并出现蜷缩现象;6 h左右,部分小鼠精神高度沉郁、呼吸急促,部分小鼠眼周出现分泌物等症状;12 h左右,小鼠病情基本稳定,与6 h时观察到的症状相似,且可见被毛无光泽;24 h左右,小鼠逐渐恢复正常,较上次观察时活泼,饮、食欲有所增加;注射48 h及1周(168 h)后,小鼠精神状况良好,饮、食欲正常。Ⅲ组小鼠精神状况良好,饮、食欲正常。各组小鼠均无死亡。
2.2 小鼠血清中M yD88的变化
与Ⅲ组相比,Ⅱ组小鼠血清MyD88含量在6~24 h均极显著或显著升高(表1)。组内相比,Ⅱ组小鼠在6和12 h的MyD88含量极显著高于-72、0、48和168 h,呈先升高后下降的变化趋势,在12 h达到峰值;Ⅲ组小鼠各时间点的指标间变化不显著。
Ⅰ组小鼠在0 h血清中的MyD88含量极显著高于Ⅱ组,与Ⅲ组差异不显著。Ⅱ组在3 h的MyD88含量极显著高于Ⅰ组;Ⅱ组在6、12、24 h的MyD88含量均显著或极显著高于Ⅰ组。从总体上看,Ⅰ组小鼠在感染后的MyD88含量呈下降、升高、下降、升高的变化趋势,但整体幅度变化较小,差异不显著。
上述结果表明,单独腹腔注射大肠杆菌可使小鼠血清中的MyD88含量显著升高;但当用黄芪多糖预防3 d,小鼠血清中的MyD88升高后,再腹腔注射大肠杆菌并不引起血清中MyD88的进一步增高。
2.3 小鼠血清中ERK的变化
由表2可见,Ⅱ组小鼠在3~12 h血清ERK含量均极显著高于Ⅲ组,其余时间点差异不显著。Ⅱ组小鼠的ERK含量,在3 h达到峰值并极显著高于其他各时间点;在6 h、12 h极显著高于-72、0、24、48、168 h。Ⅲ组小鼠在各时间点的ERK含量差异不显著。

表1 小鼠血清中MyD88含量的变化ng·m L-1
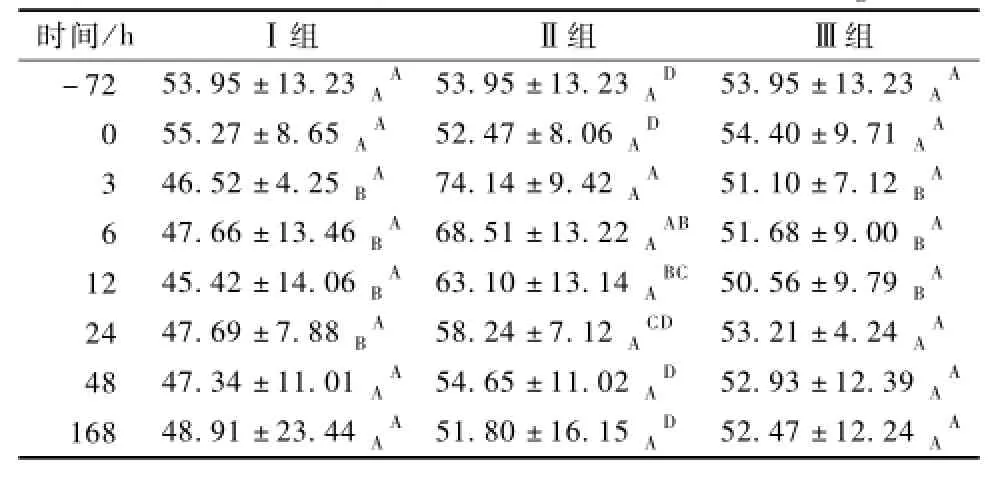
表2 小鼠血清中ERK含量的变化ng·m L-1
Ⅱ组小鼠在3、6、12、24 h的ERK含量极显著高于Ⅰ组。Ⅰ组小鼠各时间点的ERK含量差异不显著。
结果显示,使用3 d黄芪多糖后,可有效减缓感染大肠杆菌引起的小鼠ERK的升高。
2.4 小鼠血清中TNF-α的变化
与Ⅲ组相比,Ⅱ组小鼠血清中TNF-α含量在3~24 h均极显著升高(表3)。组内相比,Ⅱ组在3 h的TNF-α含量极显著高于-72、0、48、168 h,呈先升高后下降的变化趋势,在3 h达到峰值;Ⅲ组小鼠各时间点的指标间变化不显著。
Ⅰ组小鼠在0 h的TNF-α含量均极显著高于Ⅱ、Ⅲ组。Ⅰ组在感染3、6、12、24、48 h的 TNF-α含量与Ⅱ组无明显差异,而在感染168 h的TNF-α含量极显著高于Ⅱ组。Ⅰ组小鼠在感染后TNF-α含量呈先下降、后升高的变化趋势,但整体幅度变化较小,差异不显著。
结果显示,使用3 d预防用黄芪多糖后,可升高TNF-α水平,而感染大肠杆菌后并不进一步升高TNF-α水平。单独感染大肠杆菌可明显升高TNF-α水平。
2.5 小鼠血清中IL-6的变化
与Ⅲ组相比,Ⅱ组小鼠血清中IL-6含量在各时间点均无显著差异(表4)。组内相比,Ⅱ组在3 h的IL-6含量极显著高于-72、0、12、24、48、168 h,呈升高、下降、升高的趋势变化,IL-6在3 h达到峰值。Ⅲ组小鼠各时间点的指标间变化不显著。

表3 小鼠血清中TNF-α含量的变化ng·L-1
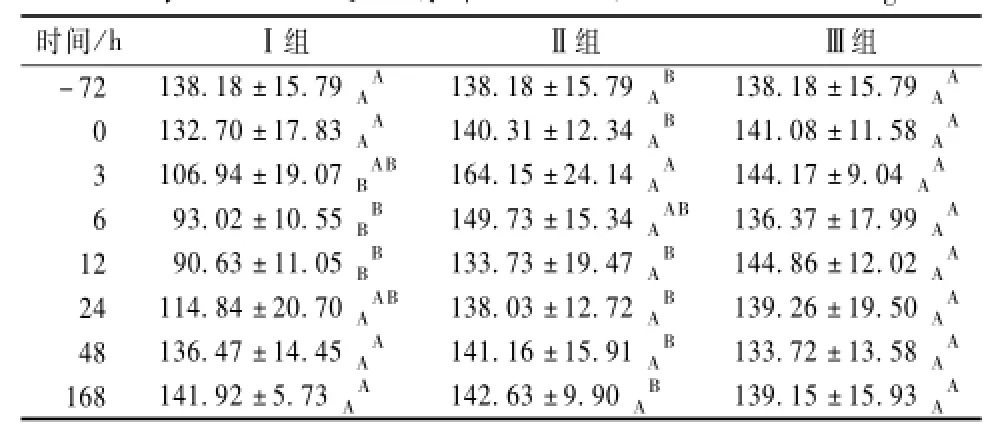
表4 小鼠血清中IL-6的变化ng·L-1
在使用黄芪多糖3 d(0 h)后,各组小鼠的IL-6含量均无显著差异。Ⅰ组小鼠在感染3、6、12 h的IL-6含量极显著低于Ⅱ组;感染24、48、168 h,各组无显著差异。总的来看,Ⅰ组小鼠在感染后IL-6含量呈下降、升高的变化趋势。
结果显示,使用3 d预防用黄芪多糖后,可轻度抑制小鼠IL-6水平,而感染大肠杆菌后继续抑制IL-6。单独感染大肠杆菌可升高IL-6水平。
3 讨论
3.1 腹腔注射大肠杆菌对小鼠M yD88依赖途径ERK及下游细胞因子IL-6、TNF-α的影响革兰氏阴性菌侵入机体后释放出LPS,引起机体炎症应答。小鼠腹腔内注射大肠杆菌会诱发急性腹膜炎,引起严重的内毒素血症,致使小鼠出现感染性休克症状,最终死亡。而内毒素血症可激活各类免疫细胞释放多种炎性介质和细胞因子,如TNF-α、lL-6等[12]。
本试验中,当小鼠腹腔注射大肠杆菌后,Ⅱ组小鼠血清中MyD88含量在12 h达到峰值,ERK含量在3 h达到峰值,而细胞因子IL-6、TNF-α含量也在3 h达到高峰,随后呈下降趋势。表明细菌侵入机体后,激活MyD88依赖途径,在0~3 h激活ERK通路,持续至12 h。ERK通路在0~3 h的强力激活使得细胞因子IL-6、TNF-α大量释放,引起强烈炎症反应。
3.2 黄芪多糖对腹腔注射大肠杆菌小鼠M yD88依赖途径ERK及下游细胞因子IL-6、TNF-α的影响
从各组小鼠MyD88的变化可以看出,黄芪多糖组小鼠MyD88在6 h显著降低后又逐渐升高,且整体表现为MyD88水平低于模型组。由此推测黄芪多糖可能通过抑制感染大肠杆菌小鼠的TLR4通路中MyD88接头蛋白的水平,从而减轻机体受到的炎症损害。有研究指出,单味中药其有效成分或中药复方可通过阻断或抑制TLR4信号通路中MyD88的表达,从而减轻炎症损害[8]。
邵晓轶等[13]指出在LPS诱导大鼠雪旺氏细胞TNF-α表达中,ERK信号通路的激活可能是LPS诱导TNF-α表达的前提,从而诱导TNF-α、IL-6等细胞因子的释放,诱导炎症损伤。试验中,黄芪多糖组小鼠ERK在3 h急剧下降,极显著低于模型组和对照组,TNF-α、IL-6也出现显著下降,整体均表现为黄芪多糖组显著低于模型组。张蕴颖[14]、李冬方[15]在研究黄芪多糖对炎症模型细胞所释放的炎症因子中发现,黄芪多糖能够显著下调IL-6、TNF-α表达。小鼠灌胃黄芪多糖3 d,MyD88、ERK、TNF-α均升高,而对IL-6轻度抑制,表明预防用黄芪多糖可激活MyD88-ERK通路。当腹腔注射大肠杆菌后,黄芪多糖组在0~48 h MyD88、ERK、TNF-α、IL-6水平较感染组低,表明感染会激活MyD88-ERK通路,而预防用黄芪多糖可减轻或适度抑制感染引起的MyD88-ERK通路的进一步激活。可见,预防用黄芪多糖可减轻感染所致的应激反应,调节机体免疫平衡,进而达到增强机体免疫功能的目的。
综上所述,感染大肠杆菌会明显激活小鼠MyD88-ERK通路,但当预防用黄芪多糖激活小鼠MyD88-ERK通路后,再感染大肠杆菌时则并不引起MyD88-ERK通路的进一步激活。预防用黄芪多糖可减轻大肠杆菌感染引起的应激反应,缓解其引起的MyD88-ERK通路激活,进而达到调节机体免疫平衡的作用。
[1] 方居正.活血化瘀法对急性心肌梗死病人血清前胶原蛋白Ⅲ的影响[J].中国中医药现代远程教育,2009,7(7):9-10.
[2] AKIRA S.Mammalian Toll-like receptors[J].Current Opinion in Immunology,2003,15(1):5-11.
[3] 刘启,赵志英.ERK和JNK信号转导通路与疾病关系的研究进展[J].医学综述,2011,17(11):1637-1639.
[4] EBLEN S T,SLACK J K,WEBER M J,et al.Rac-PAK signaling stimulates extracellular signal-regulated kinase(ERK)activation by regulating formation of MEK1-ERK complexes[J].Molecular and cellular biology,2002,22(17):6023-6033.
[5] CHEN J W,CHEN Y H,LIN S J.Long-term exposure to oxidized low density lipoprotein enhances tumor necrosis fctoralphm stimulated endothelial adhesiveness of monocytes by activating superoxide generation and redox-senative pathways[J].Free Radic Biology and Medicine,2006,40(5):817-826.
[6] 郑铭,张幼怡,韩启德.肾上腺素受体的丝裂原活化蛋白激酶信号途径[J].生理科学进展,2002,33(2):l11-1 l4.
[7] LUPPIP,LICATA A,HALUSZCZAK C,et al.Analysis of TCR Vbeta repertoire and cytokine gene expression in patients with idiopathic dilated cardiomyopathy[J].Journal of Autoimmunity,2001,16(1):3-13.
[8] 王海坤,韩代书.Toll样受体(TLRs)的信号转导与免疫调节[J].生物化学与生物物理进展,2006,33(9):820-827.
[9] JIANG Z,MAK T W,SEN G,et al.Toll-like receptor 3-mediated activation of NF-κB and IRF3 diverges at Toll-IL-1 receptor domain-containing adapter inducing IFN-β[J]. Proceedings of the National Academy of Sciences of the United States of America,2004,101(10):3533-3538.
[10] HäCKER H,REDECKE V,BLAGOEV B,et al.Specificity in Toll-like receptor signalling through distinct effector functions of TRAF3 and TRAF6[J].Nature,2005,439(7073):204-207.
[11] 扬金明.黄芪对S180荷瘤小鼠的免疫增强及抑瘤作用[J].中国临床免疫学杂志,1995,7(1):41-44.
[12] 公衍玲,王宏波,孟林,等.胆必清颗粒治疗大鼠急性细菌性腹膜炎的实验研究[J].中国中西医结合杂志,2003,23(S1):203-205.
[13] 邵晓轶,秦永伟,王海波,等.ERK在LPS诱导大鼠雪旺氏细胞TNF-α表达中的作用[J].中华微生物学和免疫学杂志,2007,27(6):485-489.
[14] 张蕴颖,鲍黎明.黄芪多糖对冠心病患者血清TNF-α、IL-6、P-选择素、VCAM-1以及VEGF水平的影响[J].中国生化药物杂志,2016(2):142-144.
[15] 李冬方,顾宁,黄伟.黄芪多糖对THP-1巨噬细胞HSP60诱导下IL-6、TNF-α表达的影响[J].时珍国医国药,2015(12):2830-2832.
(责任编辑:卢福庄)
S856.3
A
0528-9017(2017)01-0143-04
文献著录格式:刘灿,王婵,左之才,等.黄芪多糖对腹腔注射大肠杆菌小鼠TLR信号通路MyD88、ERK及细胞因子的影响[J].浙江农业科学,2017,58(1):143-147.
10.16178/j.issn.0528-9017.20170146
2016-08-21
四川省科技支撑计划项目(2013NZ0032)
刘 灿(1993-),女,四川郫县人,本科,从事中西兽医与临床工作,E-mail:1107486614@qq.com。
左之才,E-mail:zzcjl@126.com。

