24-表油菜素内酯对盐碱胁迫下大豆生育、生理及细胞超微结构的影响
吴杨,高慧纯,张必弦,张海玲,王全伟,刘鑫磊,栾晓燕,马岩松
24-表油菜素内酯对盐碱胁迫下大豆生育、生理及细胞超微结构的影响
吴杨1,高慧纯1,张必弦3,张海玲2,王全伟1,刘鑫磊3,栾晓燕3,马岩松3
(1哈尔滨师范大学生命科学与技术学院/黑龙江省分子细胞遗传与遗传育种重点实验室,哈尔滨 150025;2黑龙江省农业科学院草业研究所, 哈尔滨 150086;3黑龙江省农业科学院大豆研究所,哈尔滨 150086)
【目的】探讨外源EBR(24-表油菜素内酯)对盐碱复合胁迫下大豆的生长指标、生理特性及超微结构的影响,为改善大豆生长、保障粮食安全、实现农业可持续发展奠定基础。【方法】以大豆品种黑农44号为试材,分别在110 mmol·L-1的盐碱复合胁迫条件下培养3 d和7 d进行取材,研究1.2 mg·L-1外源EBR对大豆株高、根系生长,叶片3种抗氧化酶超氧化物歧化酶(superoxide dismutase,SOD)、过氧化物酶(peroxidase,POD)及抗坏血酸过氧化物酶(ascorbate peroxidase,APX)活性,相对电导率、超氧阴离子(O2-)产生速率、过氧化氢(H2O2)和丙二醛(malondialdehyde,MDA)含量、游离脯氨酸和叶绿素含量以及叶片和根尖细胞超微结构的影响。【结果】盐碱胁迫处理3 d和7 d时,与对照组相比,3种抗氧化酶(SOD、POD、APX)的活性、游离脯氨酸含量、相对电导率、O2-产生速率、H2O2和MDA含量均升高;各项生长指标、叶绿素含量均降低;叶片细胞结构中叶绿体和线粒体遭到严重破坏;根尖细胞中线粒体、内质网结构破坏较重,液泡破裂。盐碱胁迫条件下,施加外源EBR使大豆的株高、根长和根鲜重分别提高了6.45%、9.60%和19.85%;使大豆叶片SOD、POD、APX的活性显著升高,在3 d和7 d时分别增加了16.92%和9.68%、48.85%和61.44%、19.05%和20.36%;相对电导率、O2-产生速率、H2O2和MDA的含量显著降低,分别降低了19.58%和28.26%、28.06%和40.92%、28.62%和31.21%、31.03%和37.17%;脯氨酸和叶绿素含量显著升高,分别升高了3.67%和15.96%、13.34%和16.87%;同时维护了大豆叶片和根尖细胞超微结构的稳定性,延缓了细胞的衰老、解体。【结论】在盐碱胁迫下,施加外源EBR通过提高抗氧化酶活性和脯氨酸及叶绿素含量,降低了活性氧(ROS)的积累,维护了细胞结构的完整,促进了幼苗生长,增强了大豆幼苗耐盐碱胁迫的能力。
大豆;盐碱胁迫;24-表油菜素内酯;生育;生理特性;超微结构
0 引言
【研究意义】由于气候的不稳定,以及不合理的灌溉,全球盐碱地的面积正在日益扩大,不仅包括以NaCl为主的中性盐,也包括以Na2CO3为主的碱性盐[1]。盐碱胁迫是一个主要的非生物胁迫,会导致渗透胁迫,离子毒害,妨碍植物对矿物质营养素的吸收和摄取,损伤细胞的结构,扰乱细胞的生理代谢,严重影响植物的生长、发育和生产力。植物根系最早感知盐碱胁迫信号,导致根系生长受阻并引发一系列生理反应,从而影响地上部生长状态。短期盐碱胁迫下,植物的光合作用、蛋白质合成以及能量和脂质代谢都会受到影响;长期暴露在盐碱胁迫下会引起离子毒害,从而引起成熟叶片的早衰、变黄、坏死等[2]。大豆()是植物蛋白和油脂的主要来源,但由于近些年来农田土壤和水体盐碱累积超标问题日益严重,导致大豆的产量和品质明显下降。油菜素内酯(brassinolide,BL)俗称芸苔素内酯,是一种广泛存在于植物中的类似动物甾醇类激素的天然化合物[3],现已发现40余种BL类似物,统称为油菜素甾类物质(brassinosteroids,BRs)。现已被确定为调控植物生长发育的第六大关键激素,参与植物根和叶的细胞分裂和细胞伸长、光合作用、生殖发育、叶片的衰老等生理过程,能有效的减缓胁迫对植株的损伤[4]。因此,研究外源24-表油菜素内酯(24-epibrassinolide,EBR)对盐碱胁迫下大豆幼苗生理调节的作用以及对细胞超微结构的影响具有重要的意义。【前人研究进展】BR的生理活性远远高于现有的5种激素,逆境胁迫下的植株经低浓度的BR处理伤害便可以起到缓解作用。许多研究表明,BR在农业上的潜在应用是为了缓解多种生物和非生物胁迫对植株造成的氧化损伤,如干旱[5]、盐[6]、极端温度[6-7]、重金属[8]和病菌侵染[9]等,改善植物的生长发育和提高产量,增强植株对逆境条件的耐受力。束红梅等[10]研究表明,施加外源EBR可以提高棉花幼苗根和叶片在NaCl胁迫下根系活力及光合速率、增强抗氧化酶的活性,降低丙二醛(MDA)含量,减轻了膜脂过氧化程度。陆晓民等[11]研究发现,低氧胁迫下喷施EBR后黄瓜幼苗根系的线粒体抗氧化酶活性升高,超氧阴离子(O2-)产生速率、过氧化氢(H2O2)含量、丙二醛含量降低,根尖细胞受损害程度降低,从而减轻了盐胁迫对植物造成的伤害。【本研究切入点】盐碱环境不利于作物的生长和繁殖,EBR对逆境胁迫下植物生长发育调节的研究越来越被关注,而EBR对盐碱胁迫下大豆的生育、生理特性及其细胞超微结构的影响鲜有报道。【拟解决的关键问题】本研究以黑农44为试材,探讨外源EBR在大豆响应盐碱胁迫中的生理调节功能和在维持细胞结构稳定性中的作用,对提高大豆的盐碱抗性具有重要的理论和实际意义,为改善大豆生长、保障粮食安全、实现农业可持续发展奠定基础。
1 材料与方法
1.1 试验材料与试验设计
试验在哈尔滨师范大学日光温室及中心实验室进行,选取黑龙江省农科院大豆育种所提供的黑农44号作为试验材料。挑选籽粒饱满,均匀一致的种子,经5%的次氯酸钠消毒后,用无菌水冲洗干净。2016年4月18日将种子播种于蛭石中。子叶展平后每隔1天浇灌1次1/2Hoagland营养液。待幼苗生长至第三对三出复叶时,选取长势基本一致的幼苗72株进行试验。试验设置如下4组处理:
(A)CK:1/2Hoagland营养液(pH=7.74±0.087)+喷施蒸馏水;
(B)CK+EBR:1/2Hoagland营养液(pH=7.74± 0.087)+喷施1.2 mg·L-1EBR;
(C)XP:1/2Hoagland营养液+110 mmol·L-1的盐碱混合溶液(NaCl﹕Na2SO4﹕NaHCO3﹕Na2CO3=9﹕1﹕9﹕1,pH=8.42±0.043)+喷施蒸馏水;
(D)XP+EBR:1/2Hoagland营养液+110 mmol·L-1的盐碱混合溶液(NaCl﹕Na2SO4﹕NaHCO3﹕Na2CO3= 9﹕1﹕9﹕1,pH=8.42±0.043)+喷施1.2 mg·L-1EBR。
每个处理3盆,每盆6株,处理期间每隔1天更换营养液和喷施等量的蒸馏水或EBR,喷洒时要加入体积分数为0.1%的吐温-20作为展开剂(含CK和XP)。按照试验设计将1.2 mg·L-1EBR溶液及蒸馏水分别喷施于叶片正反面,以叶面湿润不流滴为准。
1.2 指标的测定与方法
生长指标的测定:取处理7 d的大豆幼苗,每种处理取样18株,进行生长指标的测定,取其平均值。
生理指标的测定:分别选取处理3 d后和7 d后的叶片进行各项指标的测定,试验重复3次,测定超氧化物歧化酶(superoxide dismutase,SOD)活性、过氧化物酶(peroxidase,POD)活性、抗坏血酸过氧化物酶(ascorbate peroxidase,APX)活性、相对电导率、超氧阴离子(O2-)产生速率、过氧化氢(H2O2)和丙二醛(malondialdehyde,MDA)含量、游离脯氨酸含量、叶绿素含量的具体方法根据文献[12]进行。
1.3 电镜样品处理方法
处理7 d后,选取各处理新鲜成熟的叶片和根尖相同的部位,切取1—2 mm2的样品,用2.5%戊二醛(pH7.5)冷固定液进行固定并抽气致使材料下沉为止,固定24 h,然后用磷酸缓冲液充分冲洗3次后,再用1.5%锇酸固定4 h,然后用30%—100%梯度乙醇、丙酮脱水各15 min,用Epon812环氧树脂进行浸透包埋,然后加热聚合,切片后用铀和铅双重染色,在日立H-7650型透射电镜下观察叶片和根尖的超微结构。
1.4 数据处理与结果分析
数据处理用SPSS软件的Duncan’s多重比对法对数据进行统计分析,用Excel软件进行绘图,并用不同的字母标注差异显著性。
2 结果
2.1 盐碱胁迫下施加外源EBR对大豆幼苗生长指标的影响
由表1可知,与对照CK相比,CK+EBR处理组的各项生长指标变化均不显著。盐碱胁迫处理后,大豆的株高、根长、根鲜重分别比CK降低了7.67%、13.12%和26.56%。说明在盐碱胁迫条件下大豆幼苗的生长发育受到了严重的影响。与盐碱胁迫处理相比,盐碱胁迫+EBR处理能够提高大豆的生长指标,株高、根长、根鲜重分别增加了6.45%、9.60%和19.85%。说明外源EBR能够缓解盐碱胁迫对大豆幼苗生长的抑制,促进大豆植株茁壮生长。
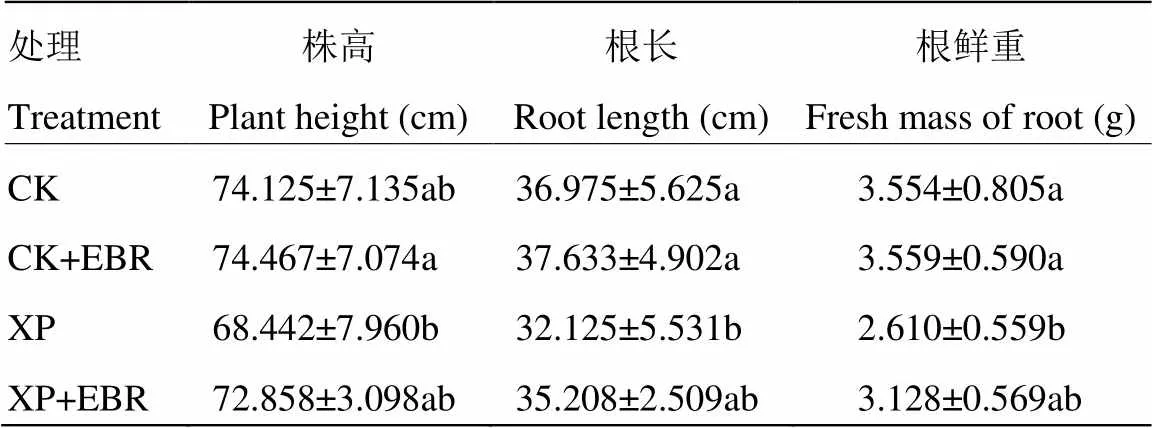
表1 盐碱胁迫下施加外源 EBR 对大豆幼苗生长的影响
同列不同小写字母表示处理间在 0.05水平差异显著
Different small letters in the same column mean significant difference among treatment at the 0.05 level
2.2 盐碱胁迫下施加外源EBR对大豆叶片SOD、POD和APX活性的影响
由图1可知,与对照CK相比,CK+EBR在处理3 d和7 d时3种酶活性变化均不显著。盐碱胁迫处理后,大豆叶片SOD、POD、APX活性均较CK显著升高,在盐碱胁迫处理3 d和7 d时,SOD、POD、APX活性分别比CK升高27.80%和35.25%、14.58%和23.78%、110.01%和137.32%,这是植物对胁迫的适应性反应;与盐碱胁迫处理相比,盐碱胁迫+EBR处理显著提高了3种抗氧化酶活性,在3 d和7 d分别增加了16.92%和9.68%、48.85%和61.44%、19.05%和20.36%。说明盐碱胁迫下施加外源EBR可以显著提高大豆的抗氧化酶活性,以增强大豆对逆境胁迫的耐受性。
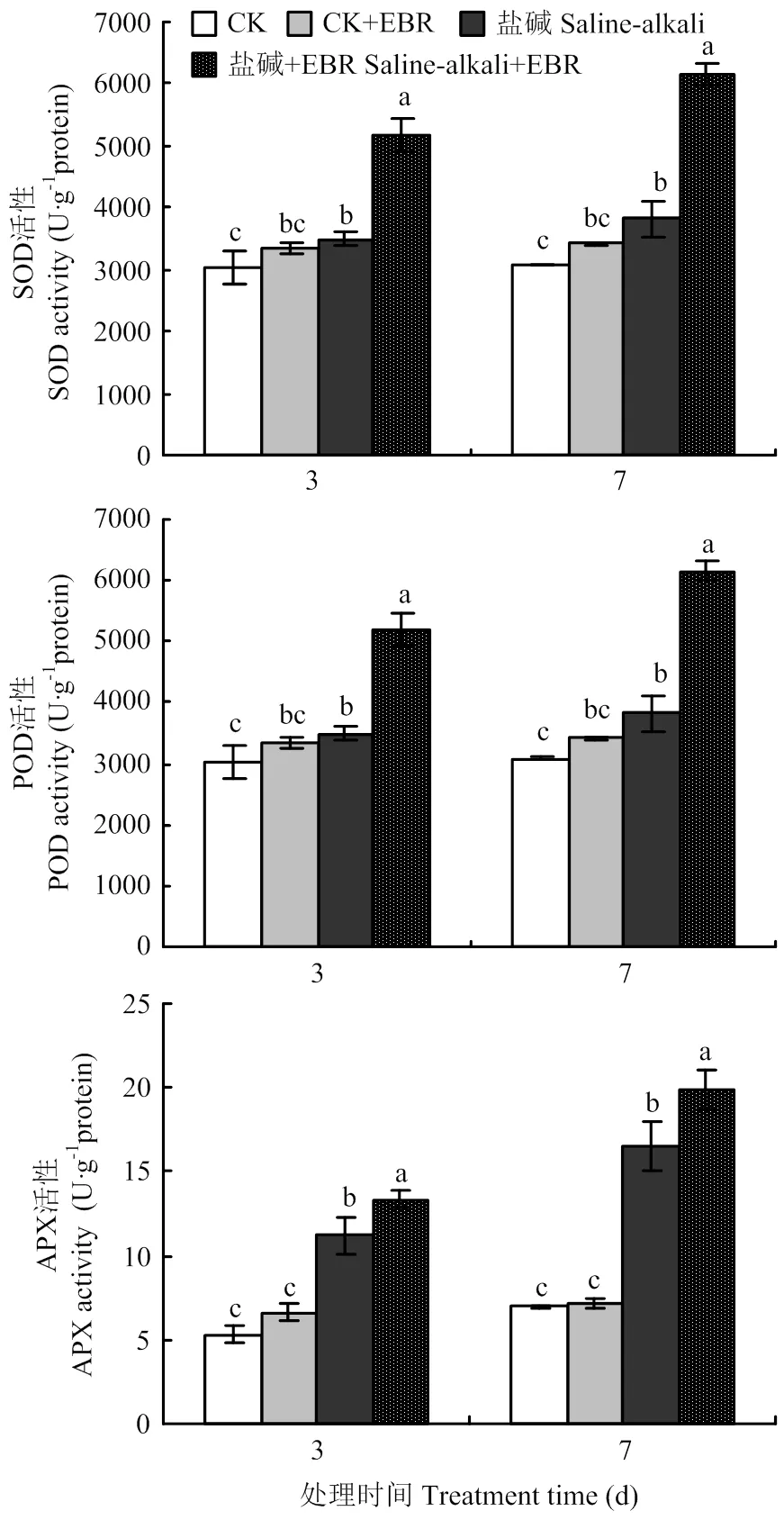
不同小写字母表示处理间在 0.05水平差异显著,短线代表标准误。下同
2.3 盐碱胁迫下施加外源EBR对大豆叶片相对电导率、O2-产生速率、H2O2和MDA含量的影响
由图2可知,与对照CK相比,CK+EBR在处理3 d和7 d时4种生理指标变化均不显著。盐碱胁迫处理后,大豆叶片相对电导率、O2-产生速率、H2O2和MDA含量与CK相比显著升高,处理3 d和7 d时,分别比CK增加了281.32%和340.65%、71.62%和214.06%、103.63和878.86%、101.87%和127.84%。与盐碱处理相比,施加外源EBR可以降低大豆叶片相对电导率、O2-产生速率、H2O2和MDA含量在胁迫3 d和7 d时分别降低了19.58%和28.26%、28.06和40.92%、28.62%和31.21%、31.03%和37.17%。说明EBR能显著降低盐碱胁迫下活性氧对大豆膜脂的氧化损伤。
2.4 盐碱胁迫下施加外源EBR对大豆叶片游离脯氨酸含量的影响
由图3-A可知,与对照CK相比,CK+EBR在处理3 d和7 d时脯氨酸含量变化均不显著。盐碱胁迫处理使大豆叶片脯氨酸含量显著升高,处理3 d和7 d时,分别较CK增加了18.28%和10.22%;与盐碱胁迫处理相比,施加外源EBR均显著提高了叶片游离脯氨酸含量,在3 d和7 d时分别提高3.67%和15.96%,说明EBR能够促进大豆体内游离脯氨酸的合成。
2.5 外源EBR对盐碱胁迫下大豆叶片叶绿素含量的影响
由图3-B可知,与对照CK相比,CK+EBR在处理3 d和7 d时均无显著差异。随着时间延长,盐碱和盐碱+EBR处理的大豆幼苗叶片中叶绿素含量均呈下降的趋势。盐碱胁迫处理后,大豆叶片的叶绿素含量与CK相比显著下降,处理3 d和7 d时,分别下降了9.60%和15.86%,说明盐碱胁迫对大豆的光合系统会造成了损伤。与盐碱胁迫处理相比,施加外源EBR能显著提高大豆叶片叶绿素含量,在3 d和7 d分别增加了13.34%和16.87%,说明外源EBR可有效缓解盐碱胁迫条件下叶绿素含量的降低,促进植物进行正常的光合作用。
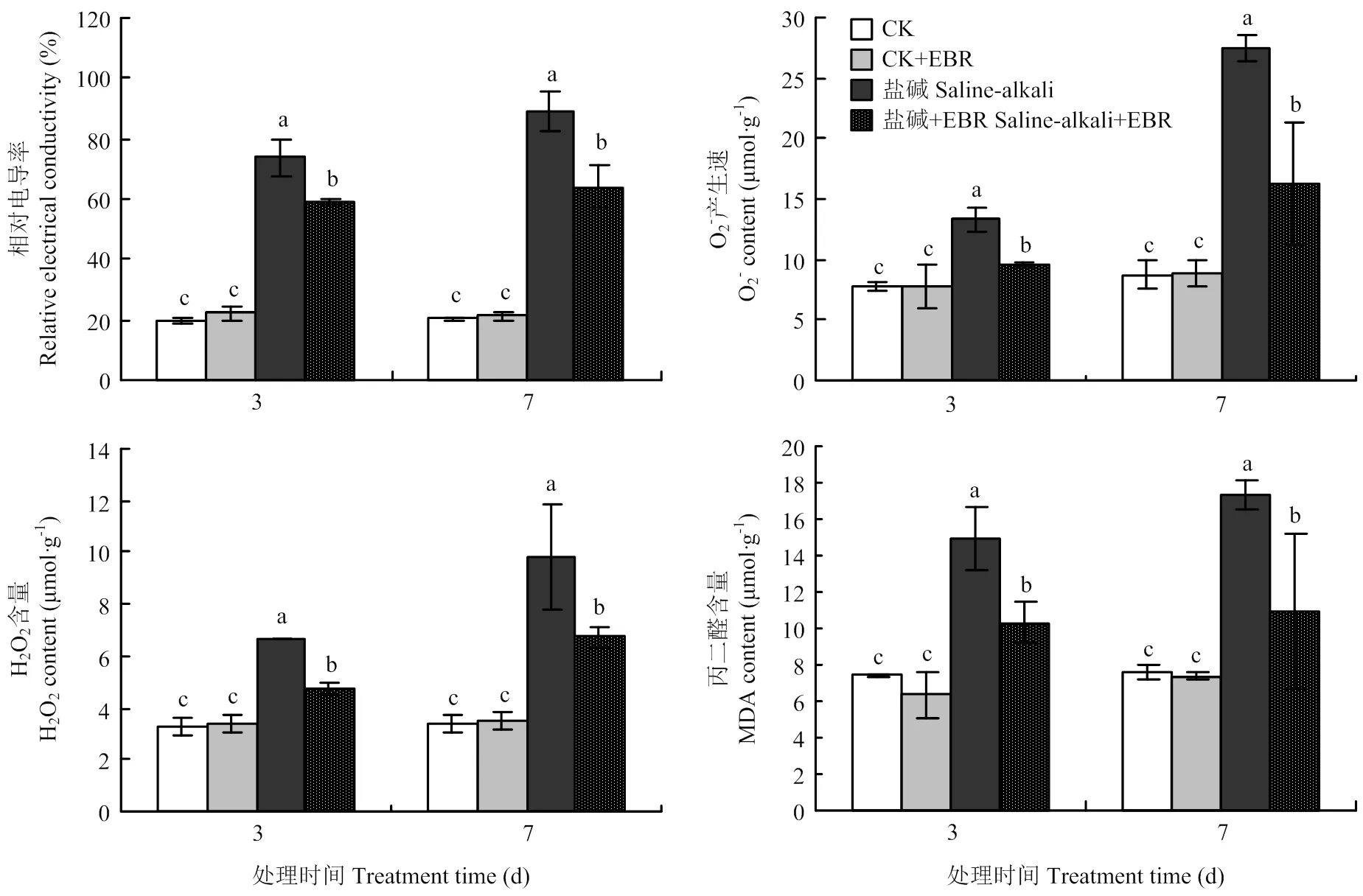
图2 盐碱胁迫下施加外源EBR对大豆叶片相对电导率、O2-产生速率、H2O2和MDA含量的影响

图3 盐碱胁迫下施加外源EBR对大豆叶片脯氨酸和叶绿素含量的影响
2.6 透射电镜观察结果
2.6.1 盐碱胁迫下施加外源EBR对大豆叶片细胞超微结构的影响 对照CK和CK+EBR处理的大豆叶细胞超微结构几乎没有差别(图4-1A—图4-8A),叶片细胞内含有大量的叶绿体,这些叶绿体呈梭形紧贴于细胞壁的内侧,叶绿体双层膜结构完整且清晰,叶绿体基粒片层整齐有序,与叶绿体长轴近似平行,类囊体紧密排列而整齐;细胞核明显,双层核膜结构清晰,核基质、染色质丰富;细胞中线粒体分布在叶绿体周围,呈椭圆形或肾形,双层膜结构清晰,外膜平滑,内膜向内折叠成嵴,内嵴丰富且清晰,内含物多,说明细胞正处在生长旺盛阶段。在盐碱胁迫下,大豆叶细胞超微结构发生了很大变化(图4-9A—图4-12A)。叶绿体明显膨胀,叶绿体膜局部破裂,基粒片层膨胀、松散、模糊不清、排列扭曲、分布混乱;核仁变小,异染色质增多;线粒体受到盐碱胁迫损伤,内嵴变少并且模糊不清,内含物明显减少。与盐碱胁迫处理相比(图4-13A—图4-16A),施加外源EBR能有效缓解盐碱胁迫对大豆细胞结构的破坏,使叶绿体、线粒体和细胞核的形态结构保持完整,与对照CK相比变化不大。
2.6.2 盐碱胁迫下施加外源EBR对大豆根尖细胞超微结构的影响 对照CK和CK+EBR处理的大豆根尖细胞超微结构几乎没有差别(图5-1B—图5-6B),根尖细胞膜结构完整,细胞质丰富,线粒体多且内嵴清晰,内含物多。盐碱胁迫处理的根尖细胞结构异常(图5-7B—图5-9B),个别大液泡消失,细胞质紊乱,内质网结构松散膨胀并最终解体,个别线粒体外膜模糊不清,内嵴减少,内含物减少。与盐碱胁迫处理相比,施加外源EBR处理的大豆根尖细胞细胞器的损伤明显得到了缓解,内质网、线粒体和大液泡结构完整,与对照组相比变化不大(图5-10B—图5-12B)。
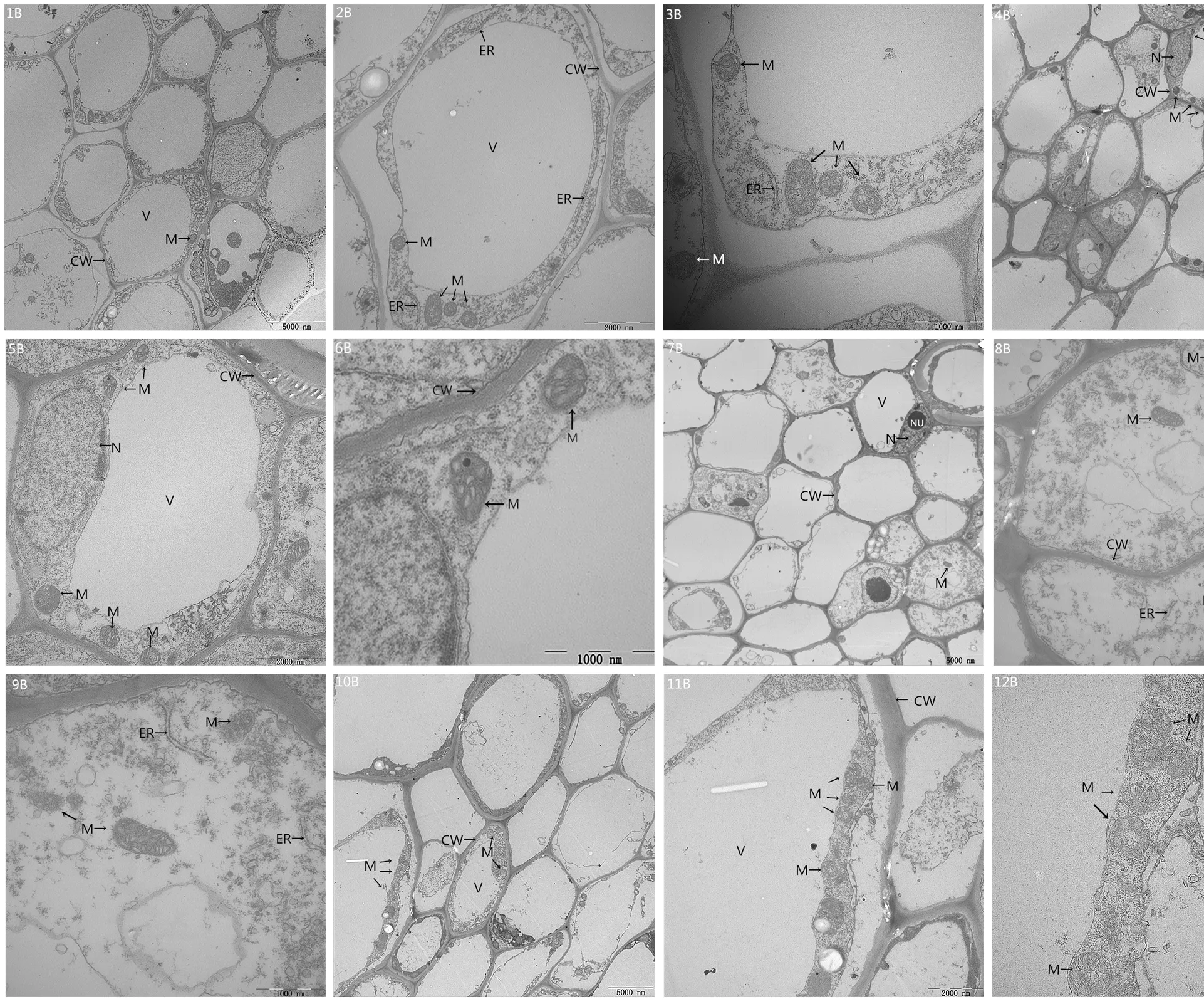
CW:细胞壁;M:线粒体;V:液泡;ER:内质网。1B—3B:根细胞CK组;4B—6B:根细胞CK+EBR组;7B—9B:根细胞XP组;10B—12B:根细胞XP+EBR组
3 讨论
土壤盐害能够限制植物的生长和发育,是因为过多的Na+和Cl-打破了渗透势的平衡,从而干扰营养物质的积累、酶的结构和活性,破坏细胞器和脂膜的完整,影响光合作用、呼吸作用以及蛋白质的合成[13]。BR是一类甾醇类植物激素,能够激发植物的内在潜能,改善植物代谢,使作物的耐逆性增强,从而促进作物的生长和产量的提高。由于BR具有多种生理效应,因此,目前认为它可能存在不止一个分子响应机制,其中有2个重要的机制:(1)BR通过调节基因的表达来控制不同酶的合成;(2)BR影响膜的特性。本研究表明,喷施EBR能够缓解盐碱胁迫对大豆生长的抑制,使大豆幼苗的株高、根长和根鲜重等较单纯盐碱胁迫时有所提高,说明EBR能够促进大豆植株生物量的积累,在大豆响应逆境胁迫中起到了正向调节的作用,这与前人研究结果一致[9,11,14]。施加外源EBR减缓了盐碱胁迫对大豆生长的抑制,可能是由于EBR调控了细胞分裂[15]、组织分化[16]、木质部发育[17]及激素合成[18]过程中相关基因的表达、刺激光合作用[14]、增加植物对营养的吸收[19]等。
植物在正常的呼吸作用、光合作用和固氮作用过程中会产生有害的活性氧(ROS)[20],如超氧化物自由基(O2-)、羟基自由基(OH-)、过氧化氢(H2O2)等。SOD、POD和APX是植物体内ROS自由基清除系统的保护酶,能够及时的清除机体内有害的ROS,以解除其对作物造成的伤害[21]。逆境胁迫会损伤植物的抗氧化系统,打破ROS产生和清除的动态平衡,造成活性氧在细胞内大量积累,启动膜脂过氧化作用[22],导致MDA含量升高,膜通透性增大,电解质外渗,细胞器结构破坏,尤其是导致线粒体和叶绿体结构的异常,进而影响植物的光合作用和有氧呼吸,严重抑制植物的生长发育。BR能够激活植物抗氧化系统的活性,降低逆境对细胞质膜及亚显微结构的损伤,缓解逆境对植物的伤害[23-25]。本试验结果表明,对盐碱胁迫下的大豆幼苗施加EBR可以显著降低相对电导率、O2-产生速率、H2O2和MDA的含量,同时显著的提高了SOD、POD和APX的活性。这与前人研究结果一致[26-27]。这说明外源EBR可以激活大豆的抗氧化酶活性,来抑制膜脂过氧化,防止离子渗漏,提高植物的氧化应激性,降低活性氧对植物的损伤。BR介导植物对氧化胁迫的响应可能是由于BR调控抗氧化防御系统相关基因的表达,如Xia等[28]研究表明EBR诱导了RBOH、MAPK1和MAPK3的表达,从而激活了抗氧化酶合成的代谢途径,缓解了胁迫对植物的氧化损伤。Ding等[29]研究发现,EBR可以通过增加WRKY转录因子和防御相关基因的转录水平,有效缓解枯萎病对植株的伤害。
盐碱胁迫会改变植物的渗透平衡,导致细胞失水和渗透势下降,植物体可通过自身的代谢活动积累渗透调节物质来维持细胞膨压。脯氨酸是一种重要的渗透调节物质,盐碱胁迫下植物体内脯氨酸含量会迅速积累以提高植物的适应性反应[30-31]。脯氨酸除作为渗透调节物之外,还可通过清除活性氧自由基[32]、稳定膜结构[33]来提高植物对盐碱胁迫的抵御能力。本试验发现,喷施EBR能使脯氨酸含量较单纯盐碱胁迫时显著升高,与螺旋藻[23]和绿豆[34]中的研究结果一致。在盐碱胁迫下,脯氨酸含量的积累与其生物合成的限速酶吡咯啉-5-羧酸合成酶(pyrroline-5-carboxylate synthetase,P5CS)和降解酶脯氨酸脱氢酶(proline dehydrogenase,PDH)有关[35],推测EBR的作用机制可能是通过提高P5CS的活性或抑制PDH的活性,以提高细胞内脯氨酸的积累量,缓解盐碱胁迫对生物膜造成的损害。
叶绿素是植物的光合色素,存在于叶绿体类囊体薄膜上,在光合作用中参与光能的吸收、传递和转换作用。盐碱胁迫会通过加速叶绿素的降解或抑制其生物合成而导致植物叶绿素含量下降[36]。本研究发现,与对照相比,盐碱胁迫会造成大豆叶片的叶绿素含量显著下降,这说明盐碱胁迫可能改变了作用于叶绿素生物合成途径酶的正常构型。从而抑制了酶的活性,阻碍了叶绿素的合成。BR能够提高多种逆境胁迫下植物的叶绿素含量,如冷[28]、高盐[37]、干旱[37]、重金属[37]等,从而调节光合作用,本试验也得到了相似的结果,在盐碱胁迫下,喷施EBR能够显著提高叶绿素含量,说明外源EBR能使盐碱胁迫下大豆叶绿素含量维持较高水平,从而保证了植株的光合活性,加大了植株的生物量合成,使植株的株高、根长和根鲜重较单纯盐碱胁迫均有所增加。BR提高叶绿素含量的机制可能是由于诱导了决定叶绿素生物合成和光合酶活性的特定基因的表达[38]。
盐碱胁迫对大豆细胞超微结构产生的影响是多方面的,膜系统是植物盐害的主要部位,最终会导致细胞相应的生理功能降低[39-40]。本试验通过对叶片和根尖超微结构的观察,发现盐碱胁迫对叶绿体和线粒体的伤害最为明显。本试验结果显示,盐碱胁迫导致了叶片细胞中叶绿体膜破裂,基粒片层膨胀、排列紊乱,这必将干扰光合色素的含量,影响电子传递和卡尔文循环,降低了光合性能。同时还发现,盐碱胁迫导致叶片细胞异染色质增多、核仁变小,这可能会抑制某些基因的表达,影响了相关蛋白的合成速率,这些都与盐碱胁迫造成的生物量下降密切相关。线粒体是活性氧产生和清除的主要场所,本试验结果显示,盐碱胁迫导致了叶片和根尖细胞线粒体结构的破坏,这必将损伤大豆的抗氧化系统,从而造成了细胞内ROS的大量积累,膜透性增大,这与前人研究结果相一致[11,40-42]。本试验中,喷施外源EBR减轻了盐碱胁迫对大豆叶片和根尖细胞超微结构的破坏,维护了细胞器膜系统的相对稳定。这正可以用EBR促进了盐碱胁迫下大豆抗氧化系统酶活性的升高,减轻了活性氧对膜脂的伤害来解释。这与陆晓民等[11]在低氧胁迫黄瓜幼苗施用EBR后,其幼苗根系线粒体抗氧化系统及其细胞超微结构均比单纯处理有所缓解的研究结果相似。
4 结论
盐碱胁迫会限制植物的生长,影响植物的正常代谢,导致活性氧的积累和脂质过氧化,破坏细胞的结构。喷施EBR能显著促进大豆叶片游离脯氨酸的积累,提高叶绿素的含量,激活SOD、POD和APX 3种抗氧化酶的活性,降低叶片相对电导率、O2-产生速率、H2O2和MDA的含量,有效缓解细胞结构,特别是叶绿体和线粒体膜系统的受损程度。
References
[1] 李文誉, 李德明. 盐碱及重金属对植物生长发育的影响. 北方园艺, 2010(8): 221-224.
[2] Gianpiero M, Roberta P, Alessandra T, Lorenzo R, Stanley L, Marialuisa C, Marcello G, Mario F, Paolo B, Emidio A. Use of MSAP markers to analyse the effects of salt stress on DNA methylation in rapeseed (var. oleifera)., 2013, 8(9): e75597.
[3] 张红. 硝普钠、24 -表油菜素内酯/水杨酸浸种对盐胁迫下玉米种子萌发及幼苗生长的影响. 核农学报, 2012, 26(1): 164-169.
Zhang H. Effects of priming with sodium nitroprusside and 24- epibrassinolide or salylic acid on seed germination and growth of maize under salt stress., 2012, 26(1): 164-169. (in Chinese)
[4] Choudhary S P, Yu J Q, Yamaguchi-Shinozaki K, Shinozaki K, Lam-Son P T. Benefits of brassinosteroid crosstalk., 2012, 17: 594-605.
[5] 阮英慧, 董守坤, 刘丽君, 孙聪姝, 郭茜茜, 王利彬, 盖志佳. 干旱胁迫下油菜素内酯对大豆花期生理特性的影响. 作物杂志, 2011(6): 33-37.
Ruan Y H, Dong S K, Liu L J, Sun C S, Guo Q Q, Wang L B, Gai Z J. Effects of brassinosteroid on physiological characteristics at flowering stage of soybean under drought stress., 2011(6): 33-37. (in Chinese)
[6] 耶兴元, 仝胜利, 张燕. 油菜素内酯对高温胁迫下猕猴桃苗耐热性相关生理指标的影响. 西北农业学报, 2011, 20(9): 113-116.
大豆类全体成员都有丰富的蛋白质、膳食纤维、维生素B1和铁。其中大豆营养尤其高,含有让皮肤毛发漂亮的蛋白质,脂肪也较低。大豆异黄酮也有类似女性荷尔蒙的作用,可美白、抗老化、改善更年期症状。
Ye X Y, Tong S L, Zhang Y. Effects of brassinolide on physiological indicators related to thermo-tolerance of kiwifruit seedlings under high temperature stress., 2011, 20(9): 113-116. (in Chinese)
[7] 惠竹梅, 王智真, 胡勇, 邓敏敏, 张振文. 24 -表油菜素内酯对低温胁迫下葡萄幼苗抗氧化系统及渗透调节物质的影响. 中国农业科学, 2013, 46(5): 1005-1013.
HUI Z M, Wang Z Z, Hu Y, Deng M M, Zhang Z W. Effects of 24-epibrassinolide on the antioxidant system and osmotic adjustment substance in grape seedlings (L.) under chilling stress., 2013, 46(5): 1005-1013. (in Chinese)
[8] 赵宇, 梁志英, 杨艳君. 油菜素内酯对龙葵幼苗Cd毒害耐受性的影响. 中国生态农业学报, 2013, 21(7): 872-876.
Zhao Y, Liang Z Y, Yang Y J. Effects of exogenous brassinosteroid on Cd tolerance inseedlings., 2013, 21(7): 872-876. (in Chinese)
[9] Nakashita H, Yasuda M, Nitta T, Asami1 T, Fujioka S, Arai Y, Sekimata K, Takatsuto S, Yamaguchi I, Yoshida S. Brassinosteroid functions in a broad range of disease resistance in tobacco and rice., 2003, 33(5): 887-898.
[10] 束红梅, 郭书巧, 沈新莲, 倪万潮. 油菜素内酯对NaCl胁迫下棉花幼苗生理特性的影响. 江苏农业学报, 2011, 27(6): 1198-1202.
Shu H M, Guo S Q, Shen X L, Ni W C. Cotton physiology affected by brassinosteroid under NaCl stress., 2011, 27(6): 1198-1202. (in Chinese)
[11] 陆晓民, 孙锦, 郭世荣, 何立中. 油菜素内酯对低氧胁迫黄瓜幼苗根系线粒体抗氧化系统及其细胞超微结构的影响. 园艺学报, 2012, 39(5): 888-896.
Lu X M, Sun J, Guo S R, He L Z, Effects of brassinolide on the mitochondria antioxidant system and cellular ultrastructure of cucumber seedling roots under hypoxic stress., 2012, 39(5): 888-896. (in Chinese)
[12] 赵世杰, 刘华山, 董新纯. 植物生理学实验指导. 北京: 中国农业科技出版社, 1998: 149-161.
Zhao S J, Liu H S, Dong X C.. Beijing: Chinese Agricultural Science and Technology Press, 1998: 149-161. (in Chinese)
[13] Feng G, Zhang F S, Li X L. Improved tolerance of maize plants to salt stress by arbuscular mycorrhiza is related to higher accumulation of soluble sugars in roots., 2002, 12: 185-190.
[14] Shahbaz M, Ashraf M, Athar H R. Does exogenous application of 24-epibrassinolide ameliorate salt induced growth inhibition in wheat (L.)., 2008, 55: 51-64.
[15] Hu Y, Bao F, Li J. Promotive effect of brassinosteroids on cell division involves a distinct CycD3-induction pathway in., 2000, 24: 693-701.
[16] Ashraf M, Akram N A, Arteca R N, Foolad M R. The physiological, biochemical and molecular roles of brassinosteroids and salicylic acid in plant processes and salt tolerance., 2010, 29: 162-190.
[17] Zurek D M, Rayle D L, McMorris T C, Clouse S D. Investigation of gene expression, growth kinetics, and wall extensibility during brassinosteroid regulated stem elongation., 1994, 104: 503-513.
[18] Vert G, Nemhauser J L, Geldner N, Hong F, Chory J. Molecular mechanisms of steroid hormone signaling in plants., 2005, 21: 177-201.
[19] Talaat N B, Shawky B T. 24-Epibrassinolide alleviates salt-induced inhibition of productivity by increasing nutrients and compatible solutes accumulation and enhancing antioxidant system in wheat (L.)., 2013, 35: 729-740.
[20] Mittler R, Vanderauwera S, Suzuki N, Miller G, Tognetti V B, Vandepoele K, Gollery M, Shulaev V, Van B F. ROS signaling: the new wave?,2011, 16(6): 300-309.
[21] Blokhina O, Virolainen E, Fagerstedt K V. Antioxidants, oxidative damage and oxygen deprivation stress., 2003, 91: 179-194.
[22] Yang T, Poovaiah B W. Hydrogen peroxide homeostasis: Activation of plant catalase by calcium/calmodulin., 2002, 99: 4097-4102.
[23] Saygideger S, Deniz F. Effect of 24-epibrassinolide on biomass, growth and free proline concentration in Spirulina platensis (Cyanophyta) under NaCl stress., 2008, 56: 219-223.
[24] Fariduddin Q, Yusuf M, Chalkoo S, HAYAT S, AHMAD A. 28-homo-brassinolode improves growth and photosynthesis inL. through an enhanced antioxidant system in the presence of chilling stress., 2011, 49: 55-64.
[25] Almeida J M, Fidalgo F, Confraria A, SANTOS A, PIRES H, SANTOS I. Effect of hydrogen peroxide on catalase gene expression ,isoform activities and levels in leaves of potato sprayed with homobrassinolide and ultrastrucyural changes in mesophyllcells., 2005, 32: 707-720.
[26] 康云艳, 郭世荣, 李娟, 段九菊. 24-表油菜素内酯对低氧胁迫下黄瓜幼苗根系抗氧化系统的影响. 中国农业科学, 2008, 41(1): 153-161.
Kang Y Y, Guo S R, Li J, Duan J J. Effects of 24-epibrassinolide on antioxidant system in cucumber seedlings roots under hypoxia stress., 2008, 41(1): 153-161. (in Chinese)
[27] Zhang M, Zhai Z, Tian X, Duan L, Li Z. Brassinolide alleviated the adverse effect of water deficits on photo-synthesis and the antioxidant of soybean (L.)., 2008, 56: 257-264.
[28] Xia X J, Huang L F, Zhou Y H, Mao W H, Shi K, Wu J X, Asami T, Chen Z, Yu J Q. Brassinosteroids promote photosynthesis and growth by enhancing activation of Rubisco and expression of photosynthetic genes in., 2009, 230: 1185-1196.
[29] Ding J, Shi K, Zhou Y H, Yu J Q. Effects of root and foliar applications of 24-epibrassinolide on fusarium wilt and antioxidant metabolism in cucumber roots., 2009, 44: 1340-1345.
[30] Ashraf M, Foolad M R. Roles of glycinebetaine and proline in improving plant abiotic stress resistance., 2007, 59: 206-216.
[31] 王娟, 李德全. 逆境条件下植物体内渗透调节物质的积累与活性氧代谢. 植物学通报, 2001, 18(4): 459-465.
Wang J, Li D Q, The accumulation of plant osmoticum and activated oxygen metabolism under stress., 2001, 18(4): 459-465. (in Chinese)
[32] Jain M, Mathur G, Koul S, Sarin N B. Ameliorative effects of proline on salt stress-induced lipid peroxidation in cell lines of groundnut (L.)., 2001, 20: 463-468.
[33] Samaras Y, Bressan R A, Csonka L N, Garcia R M G, Durzo M P, Rhodes D. Proline accumulation during drought and salinity//Smirnoff N (ed).. Bios Scientific Press, Oxford, 1995: 161-187.
[34] Hayat S, Hasan S A, Yusuf M, Hayat Q, Ahmad A. Effect of 28-homobrassinolide on photosynthesis, fluorescence and antioxidant system in the presence or absence of salinity and temperature in., 2010, 69: 105-112.
[35] Fariduddin Q, Yusuf M, Ahmad I, Ahmad A. Brassinosteroids and their role in response of plants to abiotic stresses.,2014, 58(1): 9-17.
[36] Xu X M, Ye H C, Li G F. Progress in research of plant tolerance to saline stress, 2000, 6: 379-387.
[37] 李涛涛, 高永峰, 马瑄, 陈永富, 王阳, 马金彪. 外源油菜素内酯对三种杨树在干旱、盐和铜胁迫下光合生理的影响. 基因组学与应用生物学, 2016, 35(1): 218-226.
Li T T, Gao Y F, Ma X, Chen Y F, Wang Y, Ma J B. Effects of exogenous brassinosteroid on photosynthesis of three spesies of populus under drought, salt and copper stress., 2016, 35(1): 218-226. (in Chinese)
[38] Zhang M C, Zhai Z X, Tian X L, and Duan L S, L Z H. Brassinolide alleviated the adverse effect of water deficits on photosynthesis and the antioxidant of soybean (L.)., 2008, 56(3): 257-264.
[39] Shao H B, Chu L Y, Jaleel C A, Zhao C X. Water-deficit stress-induced anatomical changes in higher plants., 2008, 331(3): 215-225.
[40] Geissler N, Hussin S, Koyro H W. Interactive effects of NaCl salinity and elevated atmospheric CO2concentration on growth, photosynthesis, water relations and chemical composition of the potential cash crop halophyteL.., 2009, 65: 220-231.
[41] 贾恢先, 赵曼容. 盐性细胞原生质体的超微结构和生理特性. 甘肃农业大学学报, 1990, 25(1): 36-42.
JIA H X, ZHAO M R. The ultrastructure and physiological characteristics of protoplast of saline cell., 1990, 25(1): 36-42. (in Chinese)
[42] 郑文菊, 王勋陵, 沈禹颖. 几种盐地生植物同化器官的超微结构研究. 电子显微学报, 1999, 5(18): 507-512.
Zheng W J, Wang X L, Shen Y Y. A study on the ultrastructure of assimilative organs of some plants in saline habitate., 1999, 5(18): 507-512. (in Chinese)
(责任编辑 李莉)
Effects of 24-Brassinolide on the Fertility, PhysiologicalCharacteristics and Cell Ultra-Structure of Soybean under Saline-alkali Stress
WU Yang1, GAO HuiChun1, ZHANG BiXian3, ZHANG HaiLing2, WANG QuanWei1, LIU XinLei3, LUAN XiaoYan3, MA YanSong3
(1College of Life Science and Technology, Harbin Normal University/Key Laboratory of Molecular Cytogenetics and Genetic Breeding of Heilongjiang Province, Harbin150025;2Institute of Grass Research, Heilongjiang Academy of Agriculture Sciences, Harbin150086;3Soybean Research Institute of Heilongjiang Academy of Agricultural Sciences, Harbin 150086)
【Objective】The aim of this experiment was to study the effects of exogenous EBR (24-epibrassinolide) on the growth indices, physiological characteristics and cellular ultrastructure of soybean under saline-alkali stress. 【Method】Soybean variety Heinong 44 was employed as the test material, and cultivated in 110 mmol·L-1nutrient solution saline-alkali stress treatments for 3 d and 7 d to investigate the effects of 1.2 mg·L-1exogenous EBR on the height and root growth, SOD, POD, and APX three kinds of antioxidant enzyme activities, relative electrical conductivity, superoxide anion (O2-) production rate, contents of hydrogen peroxide (H2O2) and malondialdehyde (MDA), free proline concentration content, chlorophyll content of soybean leaves and the responses of cellular ultrastructure of soybean leaves and root tips under saline-alkali stress. 【Result】Under the condition of saline-alkali stress dealing with 3 d and 7 d, compared to the control, the three kinds of antioxidant enzyme activities of SOD, POD, and APX, free proline content, relative electrical conductivity, O2-production rate, contents of H2O2and MDA all increased, the growth indices and chlorophyll content all decreased; the chloroplast and mitochondria cellular ultrastructure of soybean leaves suffered severe damages. The mitochondria and endoplasmic reticulum cellular ultrastructure of soybean root tips suffered severe damages, and vacuole was ruptured. Application of EBR under saline-alkali stress increased soybean plant height, root length, fresh mass of root by 6.45%, 9.60% and 19.85%, respectively. Application of EBR the activities of SOD, POD, and APX of soybean leaves in 3 d and 7 d treatments increased by 16.92% and 9.68%, 48.85% and 61.44%, 19.05% and 20.36%, respectively, relative electrical conductivity, O2-production rate, H2O2and MDA contents significantly decreased by 19.58% and 28.26%, 28.06% and 40.92%, 28.62% and 31.21%, 31.03% and 37.17%, respectively, free proline content and chlorophyll content significantly increased by 3.67% and 15.96%, 13.34% and 16.87%, respectively. At the same time, the stability of soybean leaves and root tip cell ultrastructure were maintained and the aging of cells and disintegration were delayed.【Conclusion】The results suggested that application of exogenous EBR under saline-alkali stress could increase the antioxidant enzyme activities, free proline concentration and chlorophyll content, reduce the accumulation of reactive oxygen species(ROS), maintain the cell structure integrity, promote seedling growth and resulting in improving the tolerance of soybean seedlings to saline-alkali stress.
soybean; saline-alkali stress; 24-epibrassinolide; fertility; physiological characteristics; cell ultra-structure
2016-08-01;接受日期:2016-10-31
哈尔滨市科技创新人才研究专项(RC2013QN002103)、黑龙江省教育厅科学技术研究项目(12511154)、哈尔滨师范大学博士科研启动基金(KGB200903)
吴杨,Tel:15645178212;E-mail:m15645178212@163.com。通信作者王全伟,Tel:13845057803;E-mail:wqw125@126.com

