中国11种野生葡萄果皮中黄烷-3-醇类物质的组成及含量
严静,江雨,樊秀彩,姜建福,张颖,孙海生,刘崇怀
中国11种野生葡萄果皮中黄烷-3-醇类物质的组成及含量
严静,江雨,樊秀彩,姜建福,张颖,孙海生,刘崇怀
(中国农业科学院郑州果树研究所,郑州 450009)
【目的】探讨中国野生葡萄果皮中黄烷-3-醇类物质的组成及含量的差异,为中国野生葡萄的加工利用及种质资源的评价提供依据。【方法】以变叶葡萄、刺葡萄、华东葡萄、桦叶葡萄、毛葡萄、秋葡萄、桑叶葡萄、山葡萄、腺枝葡萄、燕山葡萄和蘡薁等11个野生种98个株系的葡萄果实为试材,以欧亚种品种‘赤霞珠’为对照,利用超高效液相色谱(UPLC)对不同野生种成熟葡萄果皮中的黄烷-3-醇类物质进行检测分析。【结果】不同野生种葡萄果皮中黄烷-3-醇含量存在较大差异,桑叶葡萄果皮中黄烷-3-醇类物质的含量高于对照,其余野生种葡萄果皮中黄烷-3-醇含量低于对照,其中桦叶葡萄和变叶葡萄最低,仅为对照的64%。供试野生葡萄果皮中黄烷-3-醇类物质的组成与对照相似,均由儿茶素、表儿茶素、表棓儿茶素和表儿茶素没食子酸酯组成,并以表棓儿茶素和表儿茶素为主;这4种组成单元均可以末端单元和延伸单元的形式参与聚合黄烷-3-醇的形成。11个野生种葡萄果皮中90%以上的黄烷-3-醇类物质以聚合体的形式存在;不同野生种葡萄果皮中聚合黄烷-3-醇的平均聚合度存在较大差异,其中山葡萄果皮聚合黄烷-3-醇的平均聚合度高达50,而桦叶葡萄果皮中聚合黄烷-3-醇的平均聚合度仅为25左右,而其余野生种则介于25—45。对不同野生种葡萄果皮中黄烷-3-醇的代谢路径分析结果表明,毛葡萄和秋葡萄果皮中黄烷-3-醇的积累更偏向于F3′5′H代谢路径。主成分分析结果表明,不同野生种之间有一定的差异,而刺葡萄与其他野生种之间的差异更为明显。【结论】刺葡萄、桦叶葡萄、桑叶葡萄、山葡萄和腺枝葡萄均有黄烷-3-醇含量高于‘赤霞珠’的株系,这些株系均可作为提高黄烷-3-醇的育种材料。此外,不同野生种葡萄果皮中黄烷-3-醇的含量存在较大差异,这对中国野生葡萄种质资源的评价具有重要意义。
中国野生葡萄;株系;果皮;黄烷-3-醇
0 引言
【研究意义】黄烷-3-醇类物质是葡萄果实中重要的次级代谢产物之一,具有诸多的生物活性,对人体健康有广泛的药理学作用,如清除自由基和抗氧化、抗感染、抑制动脉粥样硬化、预防胃溃疡与降低冠心病的风险等[1-3],葡萄皮提取物或葡萄籽提取物等保健品含有丰富的黄烷-3-醇类物质,已经成为欧美人民的日常膳食补充品[1,4]。此外,黄烷-3-醇是决定葡萄酒品质的一个重要因子,使葡萄酒呈现出一定的涩味和苦味[4-6],这种苦涩味与黄烷-3-醇类物质的结构组成[2,7-8]、聚合度及聚合过程中连键的方式密切相关[9-11],并且具有辅色效应和抗氧化作用,从而稳定葡萄酒的色泽[12],黄烷-3-醇类物质还能与引起还原味的硫醇和其他硫化合物结合,从而去除还原味等不良气味[13-14]。因此,研究中国野生葡萄果实中的黄烷-3-醇类物质的含量及组成,对于中国野生葡萄果实中黄烷-3-醇类物质的加工利用、野生葡萄种质资源评价及其在葡萄育种中的利用都具有重要意义。【前人研究进展】黄烷-3-醇是多酚类物质的一种,聚合的黄烷-3-醇又被称为原花色素(Proanthocyanidins,PAs),也被称作缩合单宁(condensed tannins),是葡萄果实中含量最为丰富的多酚类物质之一[15]。葡萄果实中黄烷-3-醇类物质的积累主要是在葡萄进入转色期前,尤其是在葡萄果实发育的早期阶段,而后伴随着葡萄果实的成熟,其呈现下降趋势[16-17],在葡萄果皮中常见的黄烷-3-醇结构单元有儿茶素(Catechin,C)、表儿茶素(Epicatechin,EC)、表棓儿茶素(Epigallocatechin,EGC)和表儿茶素没食子酸酯(Epicatechin-3-O- gallate,ECG)4种[18];葡萄果皮中的黄烷-3-醇类物质以C、EC和EGC为主,而葡萄种子中的黄烷-3-醇类物质以EC和ECG为主[19-20],并且葡萄果皮中黄烷-3-醇类物质的平均聚合度显著高于葡萄籽[21]。前人研究发现,没食子化的黄烷-3-醇(如ECG)使得葡萄酒变得粗硬,而表棓儿茶素(EGC)则可降低这种效应,使得葡萄酒的口感变得柔和圆润,通常将ECG等使葡萄酒口感变得粗硬的称之为劣质单宁,而将能够使葡萄酒产生圆润、丰满口感的C、EC和EGC等称之为优质单宁[10],相对于葡萄籽,葡萄果皮中含有相对较高的优质单宁,对葡萄果皮中黄烷-3-醇类物质的分析对于酿造优质葡萄酒具有重要意义。葡萄果实中黄烷-3-醇类物质的含量及结构组成,不仅受地域[22]、光照[23-26]、温度[23,27]等环境条件以及整形方式[28]、套袋[29]、摘叶[30]、灌溉[31-33]等栽培管理措施的影响,与品种有更为直接的关系,基因型直接决定了黄烷-3-醇的含量及组成的差异[34-36]。Pantelić等[37]对塞尔维亚地区13个葡萄品种的葡萄果皮和种子中的酚类物质进行检测分析发现,在葡萄果皮中的酚类物质以黄酮醇为主,而葡萄籽中的酚类物质以黄烷-3-醇类物质为主。以上述研究集中于欧亚种及其他国家的葡萄品种,对于中国野生葡萄果实中黄烷-3-醇类物质的研究相对较少。XU等[38]利用分光光度法对5个中国野生种共10个株系的葡萄果实中的黄烷-3-醇含量进行分析,山葡萄果皮中的黄烷-3-醇含量显著高于其他所检测的野生种,但此方法并没有对黄烷-3-醇的结构组成进行分析;LIANG等[39]选取了刺葡萄和毛葡萄等共3个株系,利用HPLC-MS对其葡萄果皮中酚类物质如花色苷、黄酮醇、酚酸及黄烷-3-醇类物质的含量及结构组成进行了详细分析,但选取的野生种有限,对于中国丰富的野生葡萄资源的评价利用存在一定的局限性。【本研究切入点】中国是葡萄属植物的起源中心之一,也是葡萄属植物遗传资源最为丰富的国家之一[40],已知中国野生葡萄有38种、1个亚种和13个变种[41],绝大多数中国野生种葡萄果粒较小,果皮较厚且呈现紫色或紫黑色,具有酿造葡萄酒的潜质[42],小果粒的葡萄所酿葡萄酒含有更高的酚类物质,酿酒品质更好[43]。并且,葡萄果皮中富含优质单宁,对于酿造优质葡萄酒有着重要意义,而目前对中国野生葡萄果皮中的黄烷-3-醇类物质的研究相对较少。【拟解决的关键问题】利用超高效液相色谱(UPLC)对11个中国野生葡萄种共98个株系葡萄果皮中的黄烷-3-醇类物质含量及结构组成进行检测分析,以期为葡萄加工原料的选择、野生葡萄果实中黄烷-3-醇类物质的开发利用及野生葡萄种质资源评价等提供参考依据。
1 材料与方法
试验于2015年在国家果树种质郑州葡萄圃进行。
1.1 材料与试剂
对国家果树种质郑州葡萄圃的野生葡萄果皮中的黄烷-3-醇类物质进行检测分析,在野生葡萄果实完全转色后,每隔3 d进行葡萄果实可溶性固形物的测定,连续5次的测定结果保持不变后,进行成熟葡萄果实采集,最终采集到果实的有变叶葡萄、刺葡萄、华东葡萄、桦叶葡萄、毛葡萄、秋葡萄、桑叶葡萄、山葡萄、腺枝葡萄、燕山葡萄、蘡薁等11个野生种共98个株系。每个株系采样300粒,其中随机选取100粒用于果实理化指标的测定,其余用液氮速冻后,手工将果皮与果肉分离,将分离的果皮置于液氮速冻,用真空冷冻干燥机冻干后,用研磨机将其研磨为细粉,并储藏于-80℃冰箱备用。
儿茶素[(+)-Catechin,C]、表儿茶素[(-)-Epicatechin,EC]、表棓儿茶素[(-)-Epigallocatechin,EGC]和表儿茶素没食子酸酯[(-)-Epicatechin-3-O-gallate,ECG]均购于Sigma(St. Louis,MO,USA)公司,纯度均98%以上;色谱级的乙腈(Acetonitrile)、甲醇(Methanol)、丙酮(Acetone)和磷酸(Phosphoric acid)均购于Fisher(Fairlawn,NJ,USA)公司,纯度均达99.9%以上;分析纯的间苯三酚(phloroglucinol)、乙酸钠(sodium acetate)和抗坏血酸(Ascorbate)购于索莱宝生物科技有限公司,纯度达99%;HCl试剂购买于北京北化精细化学品有限公司,纯度36.0%—38.0%;试验用水由Milli-Q(Millipore,Bedford,MA)纯化制得。
1.2 仪器与设备
Waters UPLC超高效液相色谱,包括TUV检测器、四元溶剂管理器、样品管理器,ACQUITY UPLC BEH HILIC C18柱(100 mm×2.1 mm,1.7 μm),上海安亭科学仪器厂的GL-20G-11离心机,HW-SY11-K电热恒温水浴锅,0.22 μm孔径有机相滤膜。
1.3 方法
1.3.1 葡萄果实理化指标测定方法 每个野生种的每个株系随机选取100粒果实,称取果实鲜重。将果实用液氮速冻后,手动去皮,并称取果皮鲜重,将新鲜的果皮用液氮速冻后用真空冷冻干燥机进行冷冻干燥,称取果皮冷冻干燥后的干重,计算葡萄果皮的比重及葡萄果皮的含水率。
1.3.2 葡萄果实理化指标测定方法 葡萄果皮黄烷-3-醇的提取方法参考Downey等[21]的研究,并进行了优化。准确称取0.1 g葡萄果皮干粉于2 mL离心管中,加入1 mL 70%丙酮水溶液,加入0.005 g Vc避免氧化,置于-4℃冰箱,避光低温浸渍24 h,随后用低温离心机离心(1 500 r/min,15 min,4℃),取上清液两份,每份300 μL,均在常温下进行氮气吹干。其中一份用150 μL含1% HCl的酸化甲醇溶解,再加入150 μL乙酸钠(200 mmol·L-1)中和后,于-80℃冰箱保存,用于游离态黄烷-3-醇的检测;另一份加入150 μL间苯三酚缓冲液(0.3 N HCl,50 g·L-1间苯三酚和0.005 g Vc),在50℃下静止裂解20 min后,加入150 μL乙酸钠(200 mmol·L-1)终止反应,随后于-80℃冰箱保存,用于聚合态黄烷-3-醇的检测,每个提取重复3次。
1.3.3 UPLC检测黄烷-3-醇的条件 试验采用Waters UPLC超高效液相色谱进行标准样品及实际样品的UPLC-TUV检测分析。色谱柱采用ACQUITY UPLC BEH HILIC C18柱。流动相A:0.2%磷酸水溶液,流动相B:乙腈﹕0.2%磷酸水溶液(4﹕1,v/v)。梯度洗脱程序:0—6 min,10% B;6—9 min,10%—15% B;9—12 min,15%—20% B;12—15 min,20%—33% B;15—16.5 min,33%—40% B;16.5—17.4 min,40%—100% B;17.4—18.9 min,100% B;18.9—19.2 min,10% B。流速0.3 mL·min-1;柱温:25℃;样品温:4℃;检测波长:280 nm;进样量:10 μL。
1.3.4 黄烷-3-醇的定性定量分析 待检测的样品经0.22 μm孔径的有机相滤膜过滤后直接进入UPLC-TUV检测分析。游离黄烷-3-醇以标样的保留时间为主,根据所购买的标样通过外标法得到标准曲线(表1)进行定量。聚合黄烷-3-醇经酸催化裂解反应后,末端单元以游离黄烷-3-醇单体的形式释放出来,延伸单元会与间苯三酚结合形成新的复合物,定性参考KENNEDY等[44]的方法,黄烷-3-醇与间苯三酚的复合物分别用相应的标准曲线定量。末端单元和延伸单元总物质的量与末端单元物质的量的比值得到聚合黄烷-3-醇的平均聚合度(mean degree of polymerization,mDP),其计算公式mDP=(末端单元物质的量+延伸单元物质的量)/末端单元物质的量。
1.4 统计分析
利用Microsoft Excel 2007软件对试验结果进行初步分析;用Origin 8.5软件进行图形绘制;用SPSS 20.0进行单因素方差分析及主成分分析。
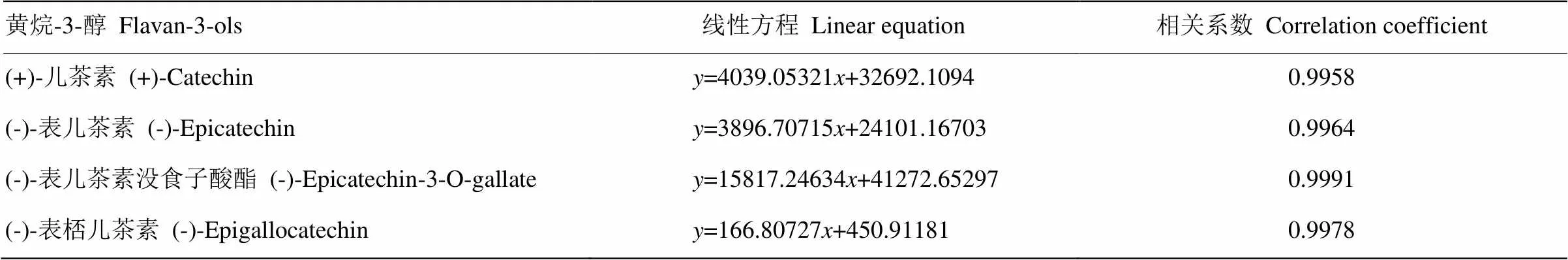
表1 4种黄烷-3-醇类物质的线性方程及相关系数
-峰面积;-黄烷-3-醇浓度(mg·L-1)
-Peak area;-Concentration of flavan-3-ols (mg·L-1)
2 结果
2.1 葡萄果实理化指标
对11个中国野生种共98个株系的葡萄果实鲜重、果皮比重及果皮含水率等果实理化指标进行了统计,结果如表2所示。刺葡萄的果实鲜重显著高于其他野生种,并显著高于对照‘赤霞珠’;秋葡萄和燕山葡萄果实鲜重显著低于其他野生种及‘赤霞珠’。山葡萄和蘡薁的果皮比重显著高于其他野生种,并显著高于‘赤霞珠’;刺葡萄的果皮比重则显著低于其他野生种及对照。变叶葡萄、华东葡萄、桦叶葡萄、山葡萄和蘡薁果皮中含水率与对照无显著性差异,但均显著高于毛葡萄和腺枝葡萄(表2)。
2.2 中国野生种葡萄果皮中黄烷-3-醇含量
利用UPLC对11个野生种98个株系的葡萄果皮中黄烷-3-醇类物质进行检测,果皮中黄烷-3-醇的含量参照文献中常见的mg·g-1和mg/berry两种表示方法呈现[21],结果见电子附表1和图1。
从电子附表1可以看出,对于同一野生种,不同株系之间也存在较大差异,如变叶葡萄中‘灵宝变叶’果皮黄烷-3-醇含量高于同种其他株系,而‘龙峪湾2号’则较低;刺葡萄中‘福安刺葡萄’果皮黄烷-3-醇含量高于同种其他株系,而‘刺葡萄洪江-09’低于同种其余株系,仅为‘福安刺葡萄’的27.4%;华东葡萄中‘湖北浠水华东’果皮中黄烷-3-醇含量较高,高出含量最低的‘华东双溪-03’约183.5%;桑叶葡萄中‘青要山-4’果皮中黄烷-3-醇含量高达1.288 mg·g-1,高于同种其余株系和所检测的其余野生种,而‘信阳-09’含量最低,仅为‘青要山-4’的29.7%;腺枝葡萄中‘洪江双溪-03’高于同种其余株系,而‘广西罗城腺’低于同种其余株系;蘡薁中‘蘡薁林县-1’略高于同种其余株系,而‘蘡薁青要山-10’略低于同种其余株系。
供试野生葡萄果皮中黄烷-3-醇含量平均为0.674 mg·g-1或0.581 mg/berry,略低于对照品种‘赤霞珠’。在检测的11个中国野生种中,变叶葡萄、桦叶葡萄、毛葡萄、秋葡萄、燕山葡萄和蘡薁的所有株系的葡萄果皮中黄烷-3-醇含量(以mg·g-1果实鲜重计)均低于‘赤霞珠’,而刺葡萄、华东葡萄、桑叶葡萄、山葡萄和腺枝葡萄均存在高于‘赤霞珠’的株系,其中桑叶葡萄中有19个株系的葡萄果皮中黄烷-3-醇含量高于‘赤霞珠’,以‘青要山-4’株系含量最高,高出对照赤霞珠66.6%。
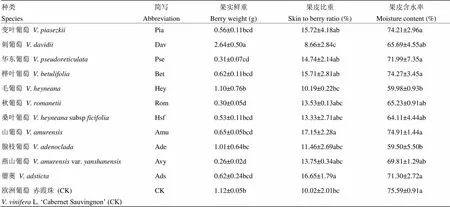
表2 不同种葡萄果实理化指标的比较
同列不同字母表示存在显著性差异(<0.05)Different letters in the same column are significantly different (<0.05)
图1为不同野生种不同株系的葡萄果皮中黄烷-3-醇类物质含量的箱线图,可以直观地看出,同一野生种不同株系的黄烷-3-醇含量变化幅度。其中A图为以mg·g-1计的结果,可以看到刺葡萄、华东葡萄、山葡萄和腺枝葡萄处于相对较高的水平,而变叶葡萄和桦叶葡萄处于相对较低的水平,这与电子附表1展示的结果一致。B图为以mg/berry计的结果,可以看到刺葡萄处于很高的水平,显著高于其余野生种及对照,这与刺葡萄果实较大,单果粒果皮相对较重有密切的关系。综合A图和B图可以看到,桑叶葡萄的变化范围较大,这与株系的数量具有很大关系,通过选取尽可能多的株系进行检测分析,对于野生种的评价更为准确。

A图为mg·g-1表示的黄烷-3-醇含量;B图为mg/berry表示的黄烷-3-醇的含量。横坐标缩写指代同表1。下同
2.3 中国野生种葡萄果皮中黄烷-3-醇类物质的结构组成
2.3.1 按照黄烷-3-醇类物质的结构组成进行分类分析 对不同野生种葡萄果皮中黄烷-3-醇类物质组成进行分析,结果如图2所示。这11种野生葡萄果皮中黄烷-3-醇由EGC、C、EC和ECG组成,其中EGC和EC为葡萄果皮中黄烷-3-醇类物质的主要组成成份,并且在同一种葡萄果皮中EGC的含量均高于EC。秋葡萄果皮中EGC的含量高于其他野生种,其次是毛葡萄、桑叶葡萄和山葡萄,其果皮中EGC的含量也高于‘赤霞珠’,余下的7个野生种之间没有明显差异;桑叶葡萄果皮中EC的含量高于腺枝葡萄,腺枝葡萄果皮中EC的含量与‘赤霞珠’之间无明显差异,均高于其他野生种(图2-A)。刺葡萄果皮中EGC和EC的含量均高于对照和其他野生种,燕山葡萄果皮中EGC和EC的含量低于其他野生种;毛葡萄果皮中EGC的含量与对照组没有明显差异,EC的含量低于对照(图2-B)。
野生葡萄和对照葡萄果皮中黄烷-3-醇类物质均以EGC和EC为主,C和ECG所占比例相对较低;不同野生种之间比较发现,毛葡萄和秋葡萄果皮中EGC所占比例较高,高于对照和其余野生种,而其余野生种葡萄果皮中黄烷-3-醇类物质的组成比例与对照相似(图2-C、D)。
从图2可以看出,野生葡萄果皮中黄烷-3-醇类物质的组成与对照相似,均由EGC、C、EC和ECG组成,并且均以EGC和EC为主;这两种不同的表示方法呈现的黄烷-3-醇的含量存在较大差异,这与不同种葡萄果实鲜重及果皮比重的差异有较大关系;葡萄果皮中黄烷-3-醇类物质组成单元的比例与黄烷-3-醇含量所用何种表示方法无关。

C图为mg·g-1计量的各组成单元所占百分比;D图为mg/berry计量的各组成单元所占百分比
2.3.2 按照黄烷-3-醇类物质的代谢路径进行分类分析 根据黄烷-3-醇合成分支路径可以把黄烷-3-醇类物质分为两大类:一类是由F3′H途径催化产生的儿茶素、表儿茶素和表儿茶素没食子酸酯(C+EC+ECG);另一类是由F3′5′H途径催化产生的表棓儿茶素(EGC)。不同野生种葡萄果皮中黄烷-3-醇类物质按照代谢路径分类结果如图3所示。不同野生种葡萄果皮中黄烷-3-醇类物质代谢路径有一定的差异,毛葡萄和秋葡萄F3′5′H代谢路径产生的3′4′5′端取代的黄烷-3-醇所占比例高于对照和其余野生种;其次是山葡萄,其3′4′5′端取代的黄烷-3-醇所占比例低于毛葡萄和秋葡萄,高于对照和其他野生种;其他野生种和对照之间均无明显差异。
2.3.3 按照黄烷-3-醇类物质的存在状态进行分类分析 在欧亚种葡萄果皮中黄烷-3-醇类物质不仅以聚合态的形式存在,同时也以游离单体的形式存在,中国野生葡萄果皮中黄烷-3-醇类物质的存在形式如图4所示。野生种和‘赤霞珠’的葡萄果皮中,黄烷-3-醇类物质的存在状态相似(图4-A),主要以聚合体的形式存在,并且聚合黄烷-3-醇所占比例在90%以上。不同种葡萄果皮中聚合黄烷-3-醇的平均聚合度存在较大差异(图4-B),山葡萄果皮中黄烷-3-醇的平均聚合度高达50,高于对照和其他野生种;桦叶葡萄果皮中聚合黄烷-3-醇的平均聚合度低于对照和其余野生种,其平均聚合度在25左右,其余野生种葡萄果皮中聚合黄烷-3-醇的平均聚合度介于25—45。

图3 不同种葡萄果皮中F3′H和F3′5′H代谢产生的黄烷-3-醇类物质的相对比例
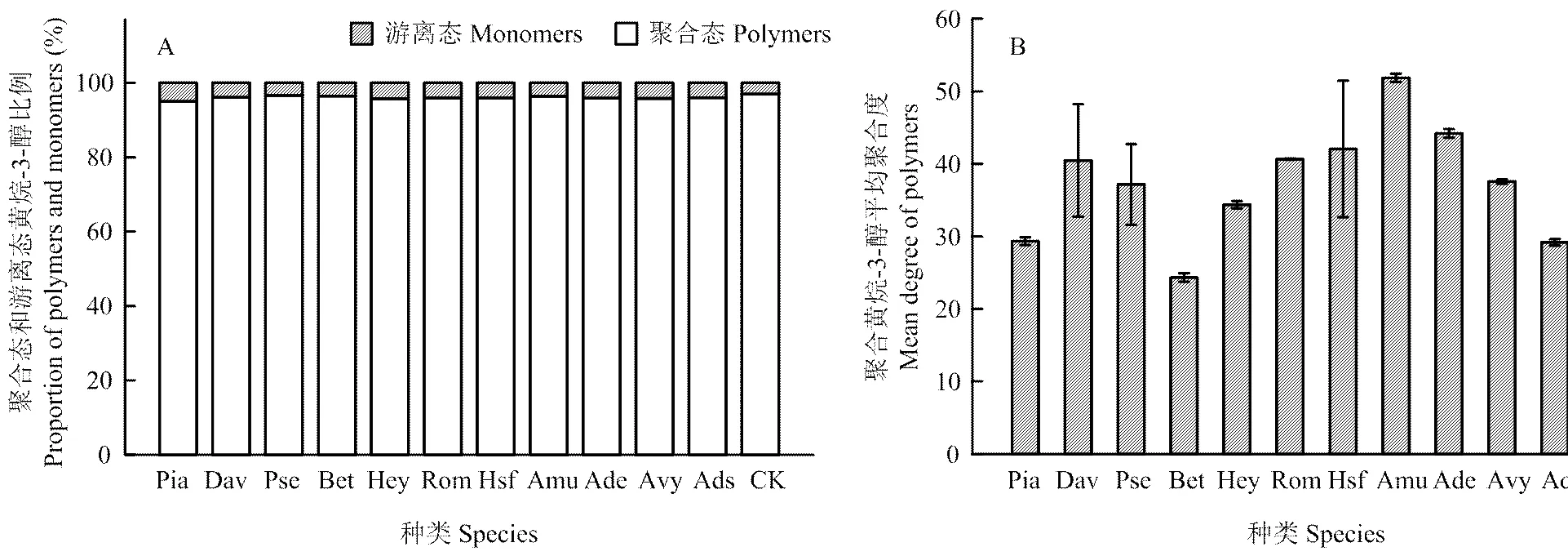
图4 不同种葡萄果皮中聚合黄烷-3-醇和游离黄烷-3-醇在黄烷-3-醇总量所占比例(A)及聚合黄烷-3-醇的平均聚合度(B)
2.4 中国野生种葡萄果皮中聚合黄烷-3-醇类物质的结构组成
从图4可以看出,野生葡萄果皮中的黄烷-3-醇主要以聚合体的形式存在,并且不同种葡萄果皮中黄烷-3-醇类物质的存在状态相似,而聚合态的黄烷-3-醇由末端单元和延伸单元组成,因此对其末端单元和延伸单元进行详细分析,以探寻差异。
2.4.1 不同野生种葡萄果皮中聚合黄烷-3-醇末端单元组成及含量比较分析 在末端单元中检测到EGC、C、EC和ECG这4种组分(图5),表明这4种组分均可以作为末端单元参与聚合黄烷-3-醇的形成;不同种葡萄果皮中聚合黄烷-3-醇末端单元主要由儿茶素和表儿茶素组成,并且对于同一个野生种聚合黄烷-3-醇末端单元中C的含量高于EC。
桦叶葡萄中作为末端单元C的含量高于桑叶葡萄和蘡薁(图5-A),并高于对照和其余野生种;对于EC组分,不同种葡萄C组分表现相似;而EGC和ECG在不同野生种之间没有明显差异,也均与对照没有明显差异。
刺葡萄果皮中作为末端单元的C和EC的含量高于其余野生种和对照(图5-B),毛葡萄果皮中作为末端单元的C和EC与对照赤霞珠没有明显差异,高于其余野生种;而华东葡萄、秋葡萄和燕山葡萄果皮中末端单元中各组分的含量低于其他野生种。
2.4.2 不同野生种葡萄果皮中聚合黄烷-3-醇延伸单元组成及含量比较分析 在延伸单元中同样检测到C、EC、ECG和EGC这4种组分(图6),表明这4种组分均可以延伸单元的形式参与聚合形成聚合黄烷-3-醇。不同种葡萄果皮中聚合黄烷-3-醇延伸单元主要由EGC和EC组成,并且对于同一个野生种,聚合黄烷-3-醇延伸单元中EGC的含量高于EC。
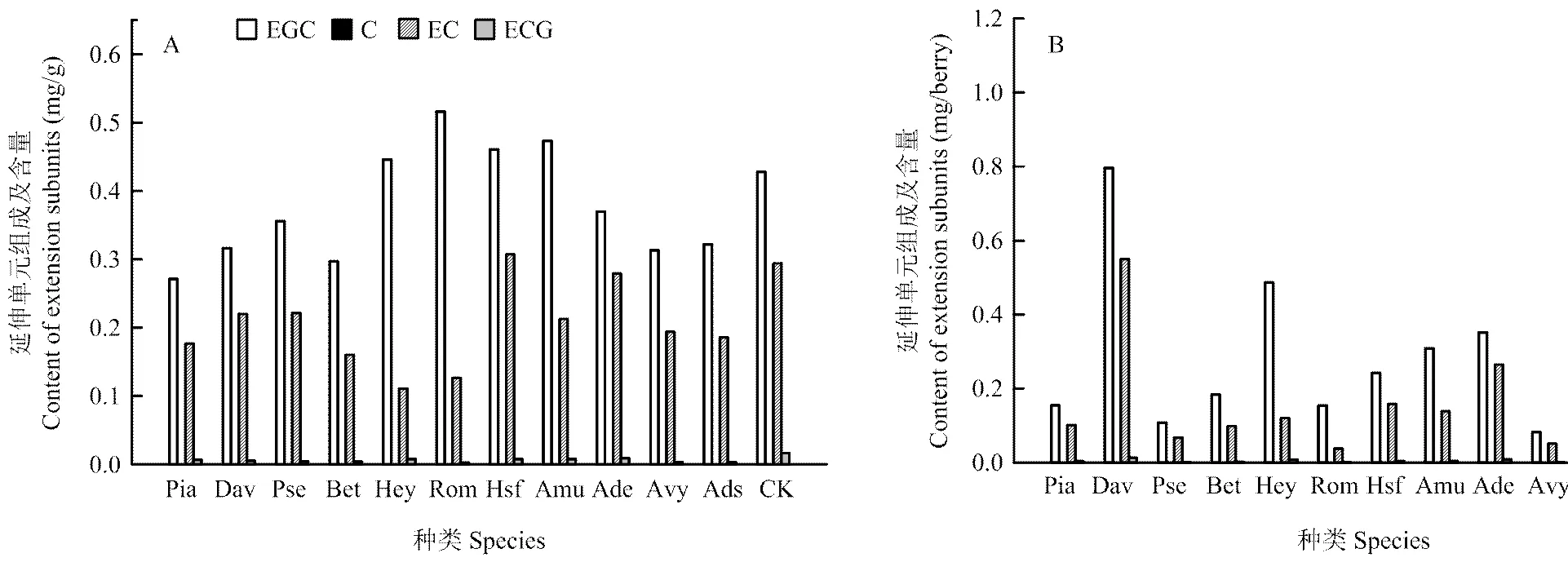
A图为mg·g-1果实鲜重表示的延伸单元含量;B图为mg/berry表示的延伸单元的含量
秋葡萄延伸单元中EGC的含量高于对照和 其余野生种(图6-A)。对于同一种葡萄,EGC的含量高于EC;桑叶葡萄和腺枝葡萄果皮延伸单元中EC含量与对照无明显差异,但均高于其余野生种。
刺葡萄果皮延伸单元中EGC和EC的含量高于对照和其余野生种(图6-B),对于同一种葡萄,EGC的含量高于EC;毛葡萄果皮延伸单元中EGC的含量与对照无明显差异,但EC的含量却低于对照。燕山葡萄果皮中EGC的含量低于其余野生种,秋葡萄的EC含量低于其余野生种。
2.5 主成份分析
对11个野生种的98个株系基于其果皮中黄烷-3-醇的含量(mg·g-1)及理化指标进行主成份分析,结果如图7所示(图7-A:载荷图,展示的是各变量所占的比重;图7-B:得分图,展示的是不同种之间的差异性)。可以看出,刺葡萄与其余野生种有较大的差异,这种差异与刺葡萄果实大小有密切的关系;桑叶葡萄大部分株系都集中在第三象限,结合图7-A可知,桑叶葡萄果皮中黄烷-3-醇含量高于‘赤霞珠’和刺葡萄,这与前面的分析结果一致。

图7 不同野生种基于葡萄果皮中黄烷-3-醇类物质的含量及理化指标的主成份分析
3 讨论
黄烷-3-醇类物质,是葡萄果实内在品质的重要特征之一,具有明显的药理学作用,是葡萄及葡萄酒中的保健功能成分。此外,黄烷-3-醇类物质对葡萄酒的许多感官品质如色泽、风味、澄清度、收敛性、褐变等具有决定性作用[1]。不同组成单元对葡萄酒感官品质的影响不同,与儿茶素相比,表儿茶素更为苦涩,并且时间也更持久,在相同条件下,含有较多的表儿茶素的分子会更涩[8],没食子化的黄烷-3-醇使葡萄酒变得粗硬,而表棓儿茶素则可降低这种效应,使葡萄酒的口感变得柔和圆润。另外,随着黄烷-3-醇类物质聚合度的增大,其涩味增强[10-11]。‘赤霞珠’作为经典的酿酒葡萄品种之一,其葡萄果实及所酿造的葡萄酒中的黄烷-3-醇类物质的结构组成、在葡萄果实中的分布及其合成的影响因素等研究较为深入[9,45-51],因此,本研究选择同一资源圃中的‘赤霞珠’作为对照。在本研究中检测的变叶葡萄、刺葡萄、华东葡萄、桦叶葡萄、毛葡萄、秋葡萄、桑叶葡萄、山葡萄、腺枝葡萄、燕山葡萄和蘡薁这11个野生种葡萄果皮中黄烷-3-醇的组成相似,均是由儿茶素、表儿茶素、表棓儿茶素和表儿茶素没食子酸酯组成,并且以表棓儿茶素和表儿茶素为主,而不同种葡萄果皮中黄烷-3-醇含量均存在较大差异。以mg·g-1果实鲜重表示的结果中,桑叶葡萄果皮中黄烷-3-醇含量高于‘赤霞珠’,高出6.5%,其余野生种葡萄果皮中黄烷-3-醇含量均低于‘赤霞珠’,按照黄烷-3-醇含量从高到底依次为桑叶葡萄、赤霞珠、山葡萄、腺枝葡萄、秋葡萄、毛葡萄、华东葡萄、刺葡萄、燕山葡萄、蘡薁和变叶葡萄,与文献报道毛葡萄果皮中黄烷-3-醇总量显著高于刺葡萄的结果一致[39],同样与研究报道中桑叶葡萄果皮黄烷-3-醇含量显著高于刺葡萄、毛葡萄、山葡萄及‘赤霞珠’的结果一致[38]。不同的表示方法所得的结果有所差异,以mg/berry计的结果中,刺葡萄果皮黄烷-3-醇含量高于‘赤霞珠’,高出65.5%,其余野生种葡萄果皮中黄烷-3-醇含量低于‘赤霞珠’,按照黄烷-3-醇含量由高到底顺序依次为刺葡萄、赤霞珠、腺枝葡萄、山葡萄、桑叶葡萄、蘡薁、桦叶葡萄、变叶葡萄、秋葡萄、华东葡萄和燕山葡萄,这与mg·g-1果实鲜重表示的结果有很大的不同,尤其是刺葡萄,用mg/berry表示的结果,消除了果粒大小、果实鲜重对葡萄果皮中黄烷-3-醇类物质的“稀释”作用,使得黄烷-3-醇含量有极大的提高。不同的表示方法呈现出不同的结果,这与文献中的相关报道一致[21]。
研究指出毛葡萄酒中儿茶素的含量高于‘赤霞珠’[52],而在本研究中同样观察到了毛葡萄果皮中儿茶素的含量高于‘赤霞珠’。按照黄烷-3-醇合成的分支路径,把黄烷-3-醇类物质分成两大类:一类是由F3′5′H代谢路径产生的3′4′5′端取代的黄烷-3-醇(EGC);另一类是由F3′H催化产生的3′4′端取代的黄烷-3-醇(C、EC和ECG)。本研究中,毛葡萄和秋葡萄果皮中3′4′5′端取代的黄烷-3-醇所占比例高于对照和其余野生种,这与文献报道的结果一致[39]。由此看出,毛葡萄和秋葡萄果皮中黄烷-3-醇类物质的合成更偏向于F3′5′H路径。
本研究对部分野生葡萄果实酚类物质中的黄烷-3-醇类物质进行了详细的比较分析,除黄烷-3-醇类物质外,还有葡萄果皮中的花色苷、黄酮醇、白藜芦醇,葡萄果肉中的酚酸以及葡萄种子中的单宁等酚类物质,均具有较高的生物活性,对人体健康具有重要意义,同时也对葡萄酒的品质有重要作用[6,39],这些组分在葡萄果实中的存在位置、存在形式及含量有待更详细的研究。此外,与酿酒特性相关的可溶性固形物含量、酸度、香气及酿造工艺等共同决定酿酒品质[6],因此,中国野生葡萄的酿造利用还需进一步研究。同时,不同种野生葡萄果皮中黄烷-3-醇含量的差异可能与其合成代谢路径及相关酶活性等相关[16],也需进一步研究。
4 结论
不同种野生葡萄果皮中黄烷-3-醇类物质均由儿茶素、表儿茶素、表棓儿茶素和表儿茶素没食子酸酯组成,其中以表棓儿茶素和表儿茶素为主。不同表示方法所得的黄烷-3-醇含量有较大的差异,以mg·g-1果实鲜重表示的结果,桑叶葡萄高于对照和其他野生种,而桦叶葡萄则低于其他野生种;以mg/berry表示的结果中,刺葡萄高于其他野生种,而燕山葡萄则低于其他野生种。相对于其他野生种,毛葡萄和秋葡萄果皮中黄烷-3-醇的积累更偏向于F3′5′H代谢路径;所检测的中国野生种葡萄果皮中的黄烷-3-醇类物质90%以上以聚合体的形式存在,不同种葡萄果皮中聚合黄烷-3-醇的平均聚合度存在较大差异,其中山葡萄的平均聚合度高达50,而桦叶葡萄果皮中聚合黄烷-3-醇的平均聚合度仅为25左右,而其余野生种则介于25—45;C、EC、ECG和EGC四种组分均以末端单元和延伸单元的形式参与聚合黄烷-3-醇的形成,其中末端单元以C和EC为主,而延伸单元以EGC和EC为主。总体来说,刺葡萄、桦叶葡萄、桑叶葡萄、山葡萄和腺枝葡萄均有黄烷-3-醇含量高于‘赤霞珠’的株系,这些株系均可以作为提高黄烷-3-醇的育种材料。不同野生种葡萄果皮中黄烷-3-醇含量存在较大差异,对于中国野生葡萄种质资源的评价具有重要意义,对进一步深入研究野生葡萄果实中的其他功能性成分代谢奠定了基础。
References
[1] ARON P M, KENNEDY J A. Flavan-3-ols: nature, occurrence and biological activity., 2008, 52(1): 79-104.
[2] GROTEWOLD E.. Springer, 2006.
[3] JORDÃO A M, CORREIRA A C, GONÇALVES F J. Evolution of antioxidant capacity in seeds and skins during grape maturation and their association with proanthocyanidin and anthocyanin content., 2015, 51(3): 137.
[4] KENNEDY J A, SAUCIER C, GLORIES Y. Grape and wine phenolics: history and perspective., 2006, 57(3): 239-248.
[5] KOVAC V, ALONSO E, REVILLA E. The effect of adding supplementary quantities of seeds during fermentation on the phenolic composition of wines., 1995, 46(3): 363-367.
[6] CONDE C, SILVA P, FONTES N, PIRES DIAS A C, TAVARES R M, SOUSA M J, AGASSE A, Delrot S, GERÓS H. Biochemical changes throughout grape berry development and fruit and wine quality., 2007, 1(1): 1-22.
[7] HERDERICH M J, SMITH P A. Analysis of grape and wine tannins: Methods, applications and challenges., 2005, 11(2): 205-214.
[8] THORNGATE J H, NOBLE A C. Sensory evaluation of bitterness and astringency of 3R (−)‐epicatechin and 3S (+)‐catechin., 1995, 67(4): 531-535.
[9] CHIRA K, JOURDES M, TEISSEDRE P L. Cabernet sauvignon red wine astringency quality control by tannin characterization and polymerization during storage., 2012, 234(2): 253-261.
[10] VIDAL S, FRANCIS L, GUYOT S, MARNET N, KWIATKOWSKI M, GAWEL R, CHEYNIER V, WATERS E J. The mouth‐feel properties of grape and apple proanthocyanidins in a wine‐like medium., 2003, 83(6): 564-573.
[11] ELEG H, GACON K, SCHLICH P, NOBLE A C. Bitterness and astringency of flavan‐3‐ol monomers, dimers and trimers., 1999, 79(8): 1123-1128.
[12] DRINKINE J, LOPES P, KENNEDY J A, TEISSEDRE P L, SAUCIER C. Ethylidene-bridged flavan-3-ols in red wine and correlation with wine age., 2007, 55(15): 6292-6299.
[13] 李华, 王华, 袁春龙, 王树生. 葡萄酒化学. 北京: 科学出版社, 2005.
LI H, WANG H, YUAN C L, WANG S S.. Beijing: Science Press, 2005. (in Chinese)
[14] POZO-BAYÓN M Á, MONAGAS M, BARTOLOMÉ B, MORENO- ARRIBAS M V. Wine features related to safety and consumer health: an integrated perspective., 2012, 52(1): 31-54.
[15] SOUQUET J M, CHEYNIER V, BROSSAUD F, MOUTOUNET M. Polymeric proanthocyanidins from grape skins., 1996, 43(2): 509-512.
[16] FUJITA A, SOMA N, YAMAMOTO N G, SHINDO H, KAKUTA T, KOIZUMI T, HASHIZUME K. Anthocyanidin reductase gene expression and accumulation of flavan-3-ols in grape berry., 2005, 56(4): 336-342.
[17] CADOT Y, CASTELLÓ M M, CHEVALIER M. Flavan-3-ol compositional changes in grape berries (L. cv Cabernet Franc) before veraison, using two complementary analytical approaches, HPLC reversed phase and histochemistry., 2006, 563(1): 65-75.
[18] FOURNAND D, VICENS A, SIDHOUM L, SOUQUET J M, MOUTOUNET M, CHEYNIER V. Accumulation and extractability of grape skin tannins and anthocyanins at different advanced physiological stages., 2006, 54(19): 7331-7338.
[19] MATTIVI F, VRHOVSEK U, MASUERO D, TRAINOTTI D. Differences in the amount and structure of extractable skin and seed tannins amongst red grape varieties., 2009, 15(1): 27-35.
[20] CERPA-CALDERÓN F K, KENNEDY J A. Berry integrity and extraction of skin and seed proanthocyanidins during red wine fermentation., 2008, 56(19): 9006-9014.
[21] DOWNEY M O, HARVEY J S, ROBINSON S P. Analysis of tannins in seeds and skins of Shiraz grapes throughout berry development., 2003, 9(1): 15-27.
[22] CADOT Y, CHEVALIER M, BARBEAU G. Evolution of the localisation and composition of phenolics in grape skin between veraison and maturity in relation to water availability and some climatic conditions., 2011, 91(11): 1963-76.
[23] COHEN S D, TARARA J M, KENNEDY J A. Assessing the impact of temperature on grape phenolic metabolism., 2008, 621(1): 57-67.
[24] KOYAMA K, IKEDA H, POUDEL P R, GOTO-YAMAMOTO N. Light quality affects flavonoid biosynthesis in young berries of Cabernet Sauvignon grape., 2012, 78: 54-64.
[25] AZUMA A, YAKUSHIJI H, KOSHITA Y, KOBAYASHI S. Flavonoid biosynthesis-related genes in grape skin are differentially regulated by temperature and light conditions., 2012, 236(4): 1067-1080.
[26] 温鹏飞, 邢延富, 牛铁泉, 高美英, 牛兴艳. UV-C对葡萄果实发育过程中黄烷醇类积累及隐色花色素还原酶表达的影响. 中国农业科学, 2012, 45(21): 4428-4436.
WEN P F, XING Y F, NIU T Q, GAO M Y, NIU X Y. Accumulation of flavanols, expression of leucoanthocyanidin reductase induced by UV-C irradiation during grape berry development., 2012, 45(21): 4428-4436. (in Chinese)
[27] SPAYD S E, TARARA J M, MEE D L, FERGUSON J C. Separation of sunlight and temperature effects on the composition ofcv. Merlot berries., 2002, 53(3): 171-182.
[28] SABBATINI P S, WIERBA K, CLEARWATER L, HOWELL G S. Impact of training system and pruning severity on yield, fruit composition, and vegetative growth of ‘Niagara’ grapevines in Michigan., 2015, 15(3): 237-250.
[29] SCAFIDI P, PISCIOTAA A, PATII D, TAMBORRA P, LORENZO R D, BARBAGALLO M G. Effect of artificial shading on the tannin accumulation and aromatic composition of the Grillo cultivar (L.)., 2013, 13(1): 175.
[30] KEMP B. S, HARRISON R,GREASY G. L. Effect of mechanical leaf removal and its timing on flavan-3-ol composition and concentrations inL. cv. Pinot Noir wine., 2011, 17(2): 270-279.
[31] STEVENS R M, PECH J M, TAYLOR J, CLINGELEFFER P, WALKER R R, NICHOLAS P R. Effects of irrigation and rootstock on(L.) cv. Shiraz berry composition and shrivel, and wine composition and wine score., 2016, 22(1): 124-136.
[32] FILIPPETTI I, MOVAHED N, ALLEGRO G, VALENTINI G, PASTORE C, COLUCCI E, INTRIERI C. Effect of post-veraison source limitation on the accumulation of sugar, anthocyanins and seed tannins incv. Sangiovese berries and seed tannins incv. Sangiovese berries., 2015, 21(1): 90-100.
[33] NOORDWYK M V. Interaction of water deficit, canopy modification and ripening: effect on the phenolic and colour composition of Shiraz grapes & subsequent wine [D]. Stellenbosch: Stellenbosch University, 2012.
[34] HERNANDEZ M M, SONG S, MENENDEZ C M. Influence of genetic and vintage factors in flavan-3-ol composition of grape seeds of a segregatingpopulation., 2017, 97(1): 236-243.
[35] PIÑEIRO Z, CANEPA D, PALMA M, BARROSO C G. Evolution of grape seed flavan-3-ols during ripening of different grape cultivars., 2012, 47(1): 40-46.
[36] BUELGA C S, ARICHA E F, BAILÓN M E. Comparative flavan-3-ol composition of seeds from different grape varieties., 1995, 53(2): 197-201.
[37] PANTELIĆ M M, ZAGORAC D D, DAVIDOVIĆ S M, TODIĆ S R, BEŠLIĆ Z S, GAŠIĆ U M, TEŠIĆ Ž L, NATIĆ M M. Identification and quantification of phenolic compounds in berry skin, pulp, and seeds in 13 grapevine varieties grown in Serbia., 2016, 211: 243-252.
[38] XU C M, ZHANG Y L, CAO L, LU J. Phenolic compounds and antioxidant properties of different grape cultivars grown in China., 2010, 119(4): 1557-1565.
[39] LIANG N N, PAN Q H, HE F, WANG J, REEVES M J, DUAN C Q. Phenolic profiles ofandspecies native to China., 2013, 61(25): 6016-6027.
[40] JAING J F, KELL S, FAN X C, ZHANG Y, WEI W, KANG D, MAXTED N, LIOYD B F, LIU C H. The wild relatives of grape in China: Diversity, conservation gaps and impact of climate change.,, 2015, 209: 155-163.
[41] 孔庆山. 中国葡萄志. 北京: 中国农业科学技术出版社, 2004: 28-53.
KONG Q S.. Beijing: Chinese Agricultural Science and Technique Publishing Company, 2004: 28-53. (in Chinese)
[42] 刘崇怀, 姜建福, 樊秀彩, 张颖. 中国野生葡萄资源在生产和育种中利用的概况. 植物遗传资源学报, 2014, 15(4): 720-727.
LIU C H, JIANG J F, FAN X C, ZHANG Y. The utilization of Chinese wild grape species in production and breeding., 2014, 15(4): 720-727. (in Chinese)
[43] GIL M, PASCUAL O, ALONSO S G, ROMERO E G, GUTIÉRREZ I H, ZAMORA F, CANALS J M. Influence of berry size on red wine colour and composition., 2015, 21(2): 200-212.
[44] KENNEDY J A, JONES G P. Analysis of proanthocyanidin cleavage products following acid-catalysis in the presence of excess phloroglucinol., 2001, 49(4): 1740-1746.
[45] HARBERTSON J F, KENNEDY J A, ADAMS D O. Tannin in skins and seeds of Cabernet Sauvignon, Syrah, and Pinot noir berries during ripening., 2002, 53(1): 54-59.
[46] Li Z, PAN Q H, JIN Z M, MU L, DUAN C Q. Comparison on phenolic compounds incv. Cabernet Sauvignon wines from five wine-growing regions in China., 2011, 125(1): 77-83.
[47] GAGNÉ S, SAUCIER C, GÉNY L. Composition and cellular localization of tannins in Cabernet Sauvignon skins during growth., 2006, 54(25): 9465-9471.
[48] HANLIN R L, KELM M A, WILKINSON K L, DOWNEY M O. Detailed characterization of proanthocyanidins in skin, seeds, and wine of Shiraz and Cabernet Sauvignon wine grapes ()., 2011, 59(24): 13265-13276.
[49] MONAGAS M, GÓMEZ-CORDOVÉS C, BARTOLOMÉ B, LAUREANO O, SILVA J M R. Monomeric, oligomeric, and polymeric flavan-3-ol composition of wines and grapes fromL. cv. Graciano, Tempranillo, and Cabernet Sauvignon., 2003, 51(22): 6475-6481.
[50] KOYAMA K, GOTO-YAMAMOTO N. Bunch shading during different developmental stages affects the phenolic biosynthesis in berry skins of ‘Cabernet Sauvignon’grapes., 2008, 133(6): 743-753.
[51] LIU Y X, PAN Q H, YAN G L, HE J J, DUAN C Q. Changes of flavan-3-ols with different degrees of polymerization in seeds of ‘Shiraz’, ‘Cabernet Sauvignon’ and ‘Marselan’ Grapes after Veraison., 2010, 15(11): 7763-7774.
[52] 吴莹, 李华. 广西都安野生毛葡萄酒中单体酚的测定. 中国酿造, 2010, 220 (7): 168-170.
WU Y, LI H. Determination of mono-phenols in wild Vitis quinquangularisris wine in Guangxi Du'an., 2010, 220(7):168-170. (in Chinese)
(责任编辑 赵伶俐)
附表1 98个株系的野生葡萄果皮中黄烷-3-醇含量
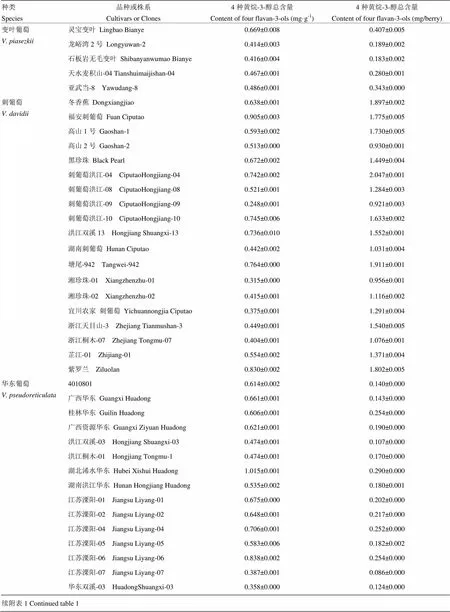
Table 1 Content of flavan-3-ols in berry peel of 98 cultivars or clones
Composition and Concentration of Flavan-3-ols in Berry Peel of 11 Chinese Wild Grape species
YAN Jing, JIANG Yu, FAN XiuCai, JIANG JianFu, ZHANG Ying, Sun HaiSheng, LIU ChongHuai
(Zhengzhou Fruit Research Institute, Chinese Academy of Agricultural Sciences, Zhengzhou 450009)
【Objective】China is one of the countries rich in resources ofgermplasm in the world, most of their berries are little in size, with thick dark-red peels, thus they are expected to be utilized for high quality wine production. While as a critical component to wine quality, flavan-3-ols in peel of Chinese wild grapes seldomly has been researched. In the present paper, the difference of the composition and concentration of flavan-3-ols in berry peel of different Chinese wild grape species was evaluated, with the aim of leading to better choice of raw materials for wine making and evaluation of Chinese wild grape germplasm.【Method】 Ninety-eight cultivars or clones of eleven Chinese wild species were selected, includingsubsp.varand.L.‘Cabernet Sauvignon’ was chosen as control. Mature berries were collected from the National Grape Germplasm Repository in Zhengzhou Fruit Research Institute, Chinese Academy of Agricultural Sciences in 2015. The composition and concentration of flavan-3-ols in berry peel of selected samples were determined by reversed-phase UPLC after acetone extraction and acid-catalysis in the presence of excessive phloroglucinol. 【Result】 The results are as follows: The contents of flavan-3-ols from different species were different. Among the eleven species, the contents of flavar-3-ols insubsp.were much higher in berry peel than the control and the other detected species, while that inandwere the lowest in berry peel, only 64% of the control. The compositions of falvan-3-ols in berry peel of Chinese wild grapes was similar to that of the control, and composed by catechin (C), epicatechin (EC), epigallocatechin (EGC) and epicatechin-3-O-gallate (ECG). In berry peel, EGC was the major constituent representing around 60% of total flavan-3-ols, with EC accounting for around 35% of total flvan-3-ols, while C and ECG represented less than 5%. These four constitutional units can not only being as terminal subunits but also as extension subunits of polymeric flavan-3-ols. The flavan-3-ols in berry peel of Chinese wild species was mainly existed as polymers, and representing above 90% of total flavan-3-ols. The mean degree of polymerization (mDP) of different species was different, among the detected species,had the highest level of mDP above 50, whilewas only 25 and the other species were between 25 and 45. Of these flavan-3-ol compounds, EGC is synthesized from the F3′5′H-mediated branch pathway and so is grouped into the 3′,4′,5′-substituted flavan-3-ols, whereas C, EC and ECG are from the F3′H-mediated branch and are grouped into 3′,4′-substitued flavan-3-ols. Compared with the other species,andhad a much lower percentage of total 3′,4′-substituted flavan-3-ols (C, EC and ECG) and a significantly higher percentage of 3′,4′,5′-substituted flavan-3-ols (EGC). Principle component analysis revealed that there was a certain distinction among the wild species, whilewas notably from the other species.【Conclusion】 Compared with theL.‘Cabernet Sauvignon’, some special cultivars or clones of the,,subsp.,andpossess much higher flavan-3-ols content in berry peel, which hold a great potential be used for breeding new materials with high level of flavan-3-ols. Besides, the content of flavan-3-ols varied among different species, which would act as an additional index to evaluate the quality of Chinese wild grape germplasm.
Chinese wild grapes; cultivars or clones; berry skin; flavan-3-ols
2016-07-19;接受日期:2016-12-19
国家葡萄产业技术体系(CARS-30)、中国农业科学院科技创新工程专项经费项目(CAAS-ASTIP-2015-ZFRI)
严静,E-mail:hnnyzzyj@163.com。 通信作者刘崇怀,Tel:0371-55906986;E-mail:liuchonghuai@caas.cn

