藏族和汉族健康人群血浆miRNA表达谱的差异*
时永辉,王成,闫岩,郭鹏涛,张辰宇,汪俊军,张春妮
(1.南京总医院临床检验科,南京 210002;2.中国人民解放军第41医院检验科,西藏乃东 856000;3.南京大学生命科学学院,南京 210093)
藏族和汉族健康人群血浆miRNA表达谱的差异*
时永辉1,王成1,闫岩1,郭鹏涛2,张辰宇3,汪俊军1,张春妮1
(1.南京总医院临床检验科,南京 210002;2.中国人民解放军第41医院检验科,西藏乃东 856000;3.南京大学生命科学学院,南京 210093)
目的 检测并比较藏族和汉族健康人群血浆miRNA表达谱。方法 分别采集246例藏族健康人和128例汉族健康人血浆样本,用TaqMan低密度芯片技术对50例藏族和50例汉族组成的2组人混合血浆中的754种miRNA进行检测,随机选取存在miR-130a-3p和miR-629-5p表达差异的样本,用qRT-PCR法进行验证。结果 低密度芯片结果显示,藏族和汉族健康人群血浆中miRNA表达谱的相关系数(r)为0.592。与汉族组相比,藏族组血浆中139种miRNA的表达水平发生明显改变,其中62种miRNA表达上调,77种miRNA表达下调。qRT-PCR进一步证实miR-130a-3p 和 miR-629-5p在藏族组血浆中的含量明显高于汉族组[(467±27.30) ×10-5vs(236±9.69) ×10-5和(14.67±0.94)×10-5vs(7.58±0.52)×10-5,P均<0.01]。结论 藏族人群血浆miRNA的表达谱与汉族人群存在明显差异,临床检测miRNA时应考虑民族因素的影响。
藏族;汉族;血浆微小核糖核酸; 表达谱
微小核糖核酸(microRNA,miRNA)是一类长度为22个核苷酸的非编码RNA,其在转录后水平通过降低或阻断信使RNA的翻译,从而调节基因的表达,参与多种生理、病理过程[1]。miRNA能够稳定存在于人血液循环中,并且是多种肿瘤或非肿瘤性疾病的潜在生物学标志物[2-4]。人循环miRNA表达水平受年龄、性别等因素的影响[5],但不同种族、民族间循环miRNA表达谱是否存在差异目前的报道较为少见。本研究采用高通量的miRNA低密度芯片结合实时荧光定量PCR(qRT-PCR)法,对我国西藏地区藏族和汉族健康人群血浆miRNA表达谱进行比较分析。报道如下。
1 材料与方法
1.1 研究对象 于2013年6-12月,中国人民解放军第41医院检验科采集的体检健康的藏族人血浆样本246例(男149例,女97例;年龄36.5±13.2岁)。以同时间段到南京总医院进行体检健康的南京及周边地区汉族人128例(男76例;女52例;年龄34.7±9.7岁)血浆样本为对照。所有入选对象均经病史询问、影像学检查和实验室检查,且排除血液系统疾病、恶性肿瘤、高血压、心脏病、全身免疫性疾病、急慢性感染性疾病等干扰性疾病。本研究经医院伦理学委员会批准,研究对象知情同意。
1.2 样本采集 用EDTA-K2抗凝真空采血管采集各研究对象禁食12 h以上静脉血,迅速在室温下以1 500×g离心10 min。用Eppendorf(EP)管收集分离的血浆,置于-80 ℃保存。
1.3 主要仪器及试剂 5418高速冷冻离心机(德国Eppendorf公司),ABI 7300实时荧光PCR仪(美国Applied Biosystem公司),XE-2100全自动血液分析仪(日本Sysmex公司);Trizol试剂(美国Invitrogen公司),人工合成peu-MIR2911、microRNA引物和探针 (美国Applied Biosystem公司);逆转录反应体系、qRT-PCR反应体系(日本TaKaRa公司)。
1.4 血浆RNA提取
1.4.1 低密度芯片所用RNA的提取 随机选取藏族和汉族血浆样本各50例,分别混合得到2组混合血浆(每例标本取250 μL,每组总体积12.5 mL)。按文献[3]并作适当改进,用Trizol试剂分别提取2份血浆总RNA。步骤:按照混合血浆体积1∶2的比例加入Trizol试剂,混匀,室温静置15 min。加入1/5 Trizol体积的氯仿溶液,混匀,室温静置15 min,4℃、10 000×g离心15 min。取上清,加入等体积的水饱和酚,混匀,4 ℃、10 000×g,离心15 min。取上清,分别加入上清液体积1/2的水饱和酚和氯仿、等体积的氯仿、等体积的异丙醇,每次加入前均混匀,4 ℃、10 000×g离心15 min。然后冰上沉淀60 min, 4 ℃、10 000×g离心30 min。每管加入1 mL Trizol试剂洗涤沉淀,4 ℃、12 000×g离心15 min。取沉淀,分别用氯仿、异丙醇、乙醇洗涤沉淀。最后加入20 μL的DEPC处理的ddH2O溶解沉淀,测定并记录RNA浓度。委托上海英潍捷基公司对上述2组混合血浆的RNA样本进行低密度芯片检测,共检测人类基因组中的754种miRNA。
1.4.2 qRT-PCR所用RNA的提取 取上述混合血浆参照文献[3]并作适当改进,采用苯酚氯仿抽提法进行。在RNA提取过程中加入外源性向日葵属的植物miRNA(MIR-2911序列:5′-GGCCGGGGGACGGGCUGGGA-3′)以控制样本提取纯化过程中的差异。步骤:100 μL血浆中加入300 μL焦碳酸二乙酯DEPC处理的ddH2O混匀,加入200 μL水饱和酚剧烈震荡,室温静置2 min,加入20 μL 103pmol/L外源MIR-2911(最终浓度106fmol/L),再加入200 μL 氯仿,剧烈震荡,室温静置5 min后于4 ℃、12 000×g离心5 min。取上清,加入上清1/10体积的醋酸钠溶液(3 mol/L,pH=5.3),再加入上清2倍体积的异丙醇,涡旋混匀后置-20 ℃静置1 h,4 ℃、12 000×g离心20 min。留取RNA沉淀,加入1 mL 75%乙醇,涡旋混匀,洗涤RNA沉淀,4 ℃、12 000×g离心20 min。去上清,留沉淀,室温晾干10 min后加入20 μL DEPC处理的ddH2O溶解RNA沉淀。待RNA完全溶解后置-80 ℃保存。
1.5 qRT-PCR 用基于TaqMan探针的qRT-PCR法检测246例藏族血浆标本和119例汉族血浆样本中miR-130a-3p和miR-629-5p表达水平。参照文献[3]进行逆转录反应。qRT-PCR所用引物及探针由美国ABI公司设计并合成。qRT-PCR总反应体系为20 μL,包括ddH2O 14.77 μL、10×PCR缓冲液2 μL、25 mmol/L MgCl21.2 μL、10 mmol/L dNTP 0.4 μL、Taq酶0.3 μL、探针及上、下游引物0.33 μL,cDNA 1 μL。循环参数:95 ℃ 5 min;95 ℃ 15 s,60 ℃ 1 min,共40个循环。每个样本设3个复孔,以DEPC处理的ddH2O作为阴性对照。血浆中miRNA的含量采用相对定量方法(2-ΔCt)进行计算。低密度芯片检测结果用 Ct值表示,以U6作为内参照,藏族标本相对于汉族标本中miRNA的变化倍数用2-ΔΔCt法计算(△Ct=CtmiRNA-CtU6snRNA;ΔΔCt=△Ct藏族-△Ct汉族)。
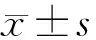
2 实验与结果
2.1 血浆miRNA低密度芯片检测结果 Pearson相关性分析显示,藏族和汉族血浆中miRNA表达谱的相关系数r=0.592(P<0.01)。参照文献[6], 以Ct值<35,变化倍数>2为筛选标准,低密度芯片结果显示与汉族相比,藏族血浆中有62种miRNA表达上调,77种miRNA表达下调。
2.2 MIR2911作为血浆miRNA外参照的评价
2.2.1 MIR2911检测限、线性范围及检测重复性评价 将人工合成的MIR2911成熟体(原液为1 μmol/L)稀释成不同的浓度梯度(0.1至106fmol/L)。用qRT-PCR方法检测不同浓度下的MIR2911的含量,绘制曲线并分析MIR2911的检测限及线性范围。结果显示,MIR2911的最低检测限为1 fmol/L。qRT-PCR检测MIR2911浓度为102~106fmol/L时的线性方程为Y=-3.131X+34.81,R2=0.999,P<0.01。提示在102~106fmol/L范围内Ct值与MIR2911浓度之间的线性关系良好。
2.2.2 MIR2911的检测重复性 取10例健康人对照血浆样本进行等量(每例100 μL)混合,混匀后,将混合血浆平均分成10份。然后将10份血浆按上前述方法进行RNA提取,提取过程中每份血浆中加入20 μL浓度为106fmol/L的MIR2911。按照上述方法进行逆转录及qRT-PCR检测样本中MIR2911的含量以测定检测重复性。结果显示10份混合血浆中MIR2911的Ct值差异无统计学意义(F=0.943,P=0.516),见图1。提示MIR2911的提取及检测的重复性良好,可作为血浆 miRNA的外参照。

图1 MIR2911的重复性
2.3 血浆miRNA的qRT-PCR验证结果 从62种在藏族血浆中表达上调的miRNA中选取2种miRNA: miR-130a-3p 和 miR-629-5p(Ct值分别为汉族的1 021倍和505倍),用 qRT-PCR法在246例藏族和119例汉族血浆样本中进行验证,结果表明与汉族相比,miR-130a-3p [(467±27.30)×10-5vs(236±9.69)×10-5](t=9 257,P<0.01)和 miR-629-5p [(14.67±0.94)×10-5vs(7.58±0.52)×10-5](t=8 189,P<0.01)在藏族血浆中的含量明显增加。与低密度芯片验证结果相符。
3 讨论
越来越多的研究显示,miRNA是潜在的非侵入性分子标志物。然而其是否受种族、民族以及环境等影响因素不甚了解。本研究分析比较了藏族和汉族人血浆miRNA表达谱的异同。首先利用低密度芯片技术对2个民族健康人群血浆中754种miRNA的表达进行初筛,发现2个民族间血浆miRNA的表达谱存在较大差异,两者相关性较低。与汉族相比,藏族血浆中有62种miRNA表达上调,77种miRNA表达下调。进一步用qRT-PCR法对其中的miR-130a-3p和 miR-629-5p进行验证,结果与低密度芯片相符,该2个miRNA在藏族血浆中的含量显著高于汉族。以上结果提示,藏汉族之间血浆miRNA的表达谱存在明显差异。
以往研究发现,在缺氧情况下机体、细胞中的一些miRNA的表达水平会发生变化,除此之外,在与缺氧相关的疾病中一些miRNA的表达水平也会发生改变。然而以上研究多集中在组织或细胞中的miRNA的表达水平上。考虑到miRNA是应对缺氧的关键因素,笔者推测高原低氧环境可能对人循环miRNA的表达也存在影响。本研究发现的在藏族血浆中含量升高的miR-130a-3p已被证实缺氧情况下,其在细胞内的表达水平升高[7]。此外,我们还通过生物信息学技术分析预测miR-130a-3p的某些靶基因与氧敏感性及氧代谢有关。而miR-130a-3p能够通过靶向调节DDX6进而增强缺氧诱导因子1α(HIF-1α)的作用来调节细胞对缺氧的反应[6]。miR-629-5p的某些靶基因也与氧敏感性及氧代谢有关。例如,缺氧诱导因子3(HIF-3)作为miR-629-5p的靶基因,能在缺氧情况下激活特异的转录过程以应对低氧环境[8]。此外,本研究通过低密度芯片发现的在藏族血浆中表达变化的一些miRNA(如miR-21、miR-24、miR-30b和miR-224)也有文献证实与哺乳动物内细胞缺氧反应有关[9-10]。由此推测,藏族与汉族人血浆miRNA表达谱的不同,不仅与民族差异有关,还可能与2个民族所处环境条件有关,藏族人所处的高原缺氧环境对血浆miRNA的表达情况有一定的影响。此外,饮食生活习惯的差异可能也具有一定的作用。以上推测这些都需要深入研究加以证实。然而,由于实验条件受限,本研究未对西藏地区的汉族人群进行分析,今后研究中将进一步证实。
综上所述,本研究发现藏族和汉族人血浆miRNA表达谱存在明显差异。在将来miRNA的临床应用时,应充分考虑民族、环境等因素的影响。
[1]Bartel DP. MicroRNAs: genomics, biogenesis, mechanism, and function[J]. Cell, 2004,116(2):281-297.
[2]管晓翠, 张春妮, 王成. 脑恶性星形细胞瘤患者癌组织和血清miR-497表达下降与临床意义[J].临床检验杂志,2013,31(2):127-130.
[3]温淑娴,温旺容.结直肠癌患者血清miR-92a-3p表达水平及其临床意义[J].临床检验杂志,2015,33(10):756-759.
[4]蔡加炉,王成,牛冬梅,等. 2型糖尿病及其微血管并发症患者血清miR-342-5p和miR-423-5p水平测定及临床意义[J].临床检验杂志,2015,33(1):24-28.
[5]Meder B, Backes C, Haas J,etal. Influence of the confounding factors age and sex on microRNA profiles from peripheral blood[J]. Clin Chem, 2014, 60(9): 1200-1208.
[6]Luo Y, Wang C, Chen X,etal. Increased serum and urinary microRNAs in children with idiopathic nephrotic syndrome [J]. Clin Chem, 2013, 59(4):658-666.
[7]Saito K, Kondo E, Matsushita M. MicroRNA 130 family regulates the hypoxia response signal through the P-body protein DDX6[J]. Nucleic Acids Res, 2011, 39(14):6086-6099.
[8]Zhang P, Yao Q, Lu L,etal. Hypoxia-inducible factor 3 is an oxygen-dependent transcription activator and regulates a distinct transcriptional response to hypoxia [J]. Cell Rep, 2014, 6(6):1110-1121.
[9]Jiang S, Wang R, Yan H,etal. MicroRNA-21 modulates radiation resistance through upregulation of hypoxia-inducible factor-1α-promoted glycolysis in non-small cell lung cancer cells[J]. Mol Med Rep, 2016,13(5):4101-4107.
[10]Camps C, Saini HK, Mole DR,etal. Integrated analysis of microRNA and mRNA expression and association with HIF binding reveals the complexity of microRNA expression regulation under hypoxia[J]. Mol Cancer, 2014,13(28):1-21.
(本文编辑:许晓蒙)
Difference of miRNA expression profile in plasma between Tibetan and Han nationality
SHIYong-hui1,WANGCheng1,YANYan1,GUOPeng-tao2,ZHANGChen-yu3,WANGJun-jun1,ZHANGChun-ni1
(1.DepartmentofClinicalLaboratory,JinlingHospital,StateKeyLaboratoryofAnalyticalChemistryforLifeScience,NanjingUniversitySchoolofMedicine,NanjingUniversity,Nanjing210002,Jiangsu; 2.DepartmentofClinicalLaboratory,theForty-FirstHospitalofPLA,Nêdong856000,Tibet; 3.JiangsuEngineeringResearchCenterformicroRNABiologyandBiotechnology,AdvanceResearchInstituteofLifeSciences,NanjingUniversity,Nanjing210093,Jiangsu,China)
Objective To measure and compare the expression profiles of plasma miRNA between Tibetan and Han nationality. Methods Plasma samples were taken from 246 healthy Tibetans and 128 Han individuals. The randomly selected 50 Tibetan and Han plasma samples were pooled respectively and the levels of 754 miRNAs were examined using a TaqMan Low Density Array. Two markedly differentially expressed miRNAs,miR-130a-3p and miR-629-5p,were verified in all the plasma samples by individual qRT-PCR. Results The Low Density Array results showed that the correlation coefficient of expression profiles of plasma miRNA for the Tibetan and Han population was 0.592. Compared with Han population, the expression levels of 139 miRNAs were distinctly different, in Tibetan(62 up-regulated and 77 down-regulated). The levels of miR-130a-3p and miR-629-5p were further verified to be significantly higher in the plasma from Tibetans than those in the plasma from Han population [(467±27.30)×10-5vs(236±9.69)×10-5,P<0.01;(14.67±0.94)×10-5vs(7.58±0.52)×10-5,P<0.01] by qRT-PCR assay. Conclusion There may be marked difference of plasma miRNA expression profile between Tibetan and Han nationality. The influence of the nationality factors on miRNA profiles should be taken into account in the application of miRNAs in clinical detection in the future.
Tibetan nationality; Han nationality; plasma microRNA; profile
10.13602/j.cnki.jcls.2017.03.05
国家自然科学基金(81472021);南京总医院基金(2012041)。
时永辉,1972年生,男,副主任技师,大学本科,主要从事临床检验工作。
张春妮,主任技师,博士,E-mail: zchunni27@hotmail.com。
R446.5
A
2016-11-29)

