人降钙素原的原核表达、纯化和鉴定
付涛,苏丹华,刘原,刘卿,吴亮,陈盛霞,姜旭淦
(江苏大学医学院,江苏镇江 212013)
人降钙素原的原核表达、纯化和鉴定
付涛,苏丹华,刘原,刘卿,吴亮,陈盛霞,姜旭淦
(江苏大学医学院,江苏镇江 212013)
目的 构建人降钙素原(procalcitonin,PCT)原核表达载体,获得高纯度PCT重组蛋白。方法 根据NCBI上PCT基因序列设计引物,利用PCR技术扩增PCT基因,构建PCT/pET-22b(+)重组表达载体,转化至大肠埃希菌(E.coli)BL21中诱导表达;采用镍柱亲和层析法纯化重组蛋白,用western blot和胶体金法对其进行鉴定。结果 琼脂糖凝胶电泳结果显示PCR扩增产物约为350 bp。同源性比对分析结果表明,PCT基因片段(348 bp)成功插入pTG19-T载体,未出现碱基突变。用BamHⅠ和HindⅢ对重组表达载体双酶切,得到约为350 bp和5 500 bp片段。SDS-PAGE电泳显示PCT重组蛋白以可溶性形式存在,Mr约14 000,经镍柱亲和层析法纯化后即可获得。western blot和PCT胶体金法结果呈阳性,显示融合蛋白含组氨酸标签(His-tag),成功表达出PCT重组蛋白。结论 应用重组DNA技术成功构建PCT基因融合重组表达载体,通过蛋白质表达纯化技术获得PCT融合蛋白。
降钙素原;原核表达;纯化
降钙素原(procalcitonin,PCT)是人11号染色体中降钙素原基因表达的产物,由甲状腺滤泡旁C细胞分泌产生,含有116个氨基酸,相对分子质量(Mr)约为1 3000[1-2]。目前关于PCT的研究主要集中于PCT基因结构、功能以及导致其升高的机制和临床表现等,关于PCT检测方法的研究较少[3]。研制PCT试剂盒所需要的高纯度抗原和特异性抗体多数来自于国外公司,价格昂贵,并且因原料来源和质量不一致导致不同厂家产品检测结果相差较大,不利于检测结果的临床应用和质量控制。因此,获得高纯度PCT抗原,为建立免疫学检测方法提供原材料,具有重要意义[4]。本研究通过构建人PCT重组表达载体,得到了高纯度的PCT融合蛋白,为研制PCT检测试剂盒提供了试验依据。
1 材料和方法
1.1 材料
1.1.1 质粒和菌株 pET-22b(+)原核表达质粒、pTG19-T质粒、大肠埃希菌DH5α和BL21菌株均由本实验保存。
1.1.2 主要试剂和仪器 Taq Mater Mix PCR预混液、western blot化学发光检测试剂盒(南京诺唯赞公司),5 000 bp DNA Ladder、琼脂糖凝胶DNA回收试剂盒、质粒提取试剂盒、异丙基-β-D-硫代半乳糖苷(上海捷瑞公司),限制性内切酶BamHⅠ、HindⅢ(美国Thermo Fisher Scientific公司),T4连接酶(日本TaKaRa公司),辣根过氧化物酶标记羊抗兔IgG、硝酸纤维素膜(武汉Boster公司);4TC-20恒温振荡器(上海金怡公司),C5612超声粉碎仪(宁波新芝公司),FCQ凝胶成像仪及垂直电泳仪(美国Bio-Rad公司)。
1.2 方法
1.2.1 引物设计与基因扩增 用Primer Premier 6.0软件,根据NCBI基因库PCT基因全长序列(NM_001732.1)设计引物,PCT上游引物(F):5′ -GGCGGATCCGCACCATTCAGGTCTGCCC-3′(下划线为BamHⅠ酶切位点), 下游引物(R):5′-GGCAAGCTTGTTGGCATTCTGGGGCATG-3′(下划线为HindⅢ 酶切位点),产物长度为348 bp,退火温度为56 ℃,引物由苏州泓迅公司设计并合成。PCR反应总体系25 μL,包括2×PCR Green Mix 12.5 μL,10 μmol/L上、下游引物各1 μL,模板cDNA 1 μL,灭菌ddH2O 9.5 μL。PCR反应条件:94 ℃ 1 min; 95 ℃ 10 s,56 ℃ 20 s,72 ℃ 20 s,30个循环;72 ℃延伸10 min。PCR产物经10 g/L琼脂糖凝胶电泳鉴定产物片段大小,按照DNA胶回收试剂盒说明书操作回收目的片段。
1.2.2 表达载体的构建与鉴定 将目的片段与pTG19-T克隆载体连接,构建PCT/pTG19-T重组克隆载体,将其转化至大肠埃希菌感受态DH5α中,经氨苄筛选、PCR扩增及BamHⅠ酶切鉴定[5],阳性克隆送苏州泓迅公司测序。测序正确的阳性质粒分别用限制性内切酶BamHⅠ和HindⅢ酶切,按照胶回收试剂盒说明书操作回收目的片段,通过T4连接酶与同样双酶切后的pET-22b(+)载体,连接反应总体系为20 μL,包括PCT基因片段 11 μL, pET22b载体片段 6 μL, 10×连接缓冲液 2 μL, T4连接酶1 μL。构建PCT/pET-22b(+)表达载体,转化至大肠埃希菌感受态DH5α中,接种至含100 mg/L 氨苄西林的LB平板上筛选阳性克隆菌落,用LB液体培养基扩增培养阳性菌落,按照质粒小量制备试剂盒说明书操作提取质粒,并用限制性内切酶BamHⅠ和HindⅢ酶切鉴定,酶切反应总体系为20 μL,包括BamHⅠ 0.5 μL,Hind Ⅲ 0.5 μL,BamHⅠ Buffer 2 μL,灭菌ddH2O 13 μL。酶切产物经10 g/L琼脂糖凝胶电泳鉴定。
1.2.3 重组蛋白质表达与可溶性分析 阳性菌落接种于含氨苄西林的LB液体培养基中37 ℃培养12 h,次日以1∶100稀释接种于20 mL LB培养基中,当菌液吸光度(A600 nm)达到0.6时,加入诱导剂IPTG至菌液终浓度为0.4 mmol/L,于37 ℃分别培养4 h、16 h终止,4 ℃、12 000 r/min离心10 min收集菌体,菌体用PBS重悬,取等体积重悬液与1×上样缓冲液混匀,沸水中煮10 min,4 ℃、16 400 r/min离心10 min,取上清液进行SDS-PAGE电泳,垂直电泳仪电压110 V,电泳时间120 min,1 g/L考马斯亮兰染色液染色3 h,脱色液脱色2 h,FCQ凝胶成像仪观察蛋白质条带结果。另取1.5 mL菌液于EP管中,室温、12 000 r/min离心1 min,收集菌体沉淀;用500 μL PBS(pH 7.4)重悬菌体沉淀,超声破碎后离心,吸取上清液至新EP管中,沉淀用500 μL PBS重悬。分别吸取30 μL的上清液和沉淀,进行蛋白质可溶性分析。
1.2.4 重组PCT蛋白的纯化 用200 mL含氨苄西林LB液体培养基增菌。收集菌体,超声破碎后,4 ℃、16 400 r/min离心30 min,收集上清液。依据镍柱蛋白结合能力,将上清液和镍柱颗粒以5∶1比例混合,于4 ℃结合4 h,用洗涤缓冲液(10 mmol/L咪唑)洗去杂蛋白,然后用洗脱缓冲液(250 mmol/L咪唑)洗脱,收集目的蛋白质。
1.2.5 重组PCT蛋白的鉴定 取10 μL 纯化蛋白与等体积1×SDS-PAGE上样缓冲液混合,进行SDS-PAGE电泳,将目的蛋白以150 mA、 80 min电泳条件转印至NC膜上,用50 g/L脱脂奶粉封闭30 min,以兔抗His标签抗体(1∶2 000稀释)作为一抗,室温温育2 h,TBST缓冲液洗涤3次;以HRP标记羊抗兔IgG(1∶5 000稀释)作为二抗,室温温育1 h,TBST缓冲液洗涤3次后加入ECL显色,化学发光成像仪观察显影结果。将纯化蛋白用PBS 1∶1 000稀释,取10 μL加入胶体金法板条上样孔中,观察结果。
2 结果
2.1 PCR扩增PCT基因结果 用PCR法扩增PCT基因后,产物经10 g/L琼脂糖凝胶电泳检测,约在350 bp处出现条带,与PCT基因片段理论扩增大小(348 bp)相符。见图1。
2.2 重组克隆载体PCT/pTG19-T的鉴定 结合pTG19-T克隆载体多克隆位点的特点,用限制性内切酶BamHⅠ对重组克隆载体PCT/pTG19-T进行单酶切,产物经10 g/L琼脂糖凝胶电泳结果显示约在350 bp处出现条带,与理论大小相符(图2)。外送公司测序结果显示PCT片段成功插入pTG19-T载体,未出现碱基突变(图3)。
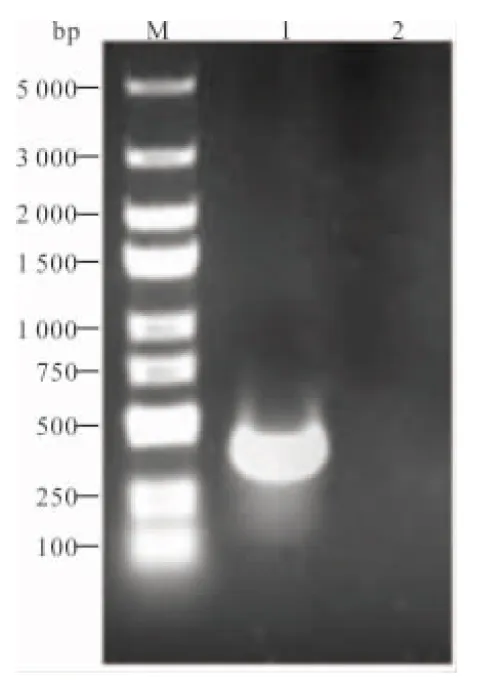
注:M,DL 5000 DNA marker;1,目的基因PCR扩增产物;2,阴性对照。
图1 目的基因PCR扩增产物
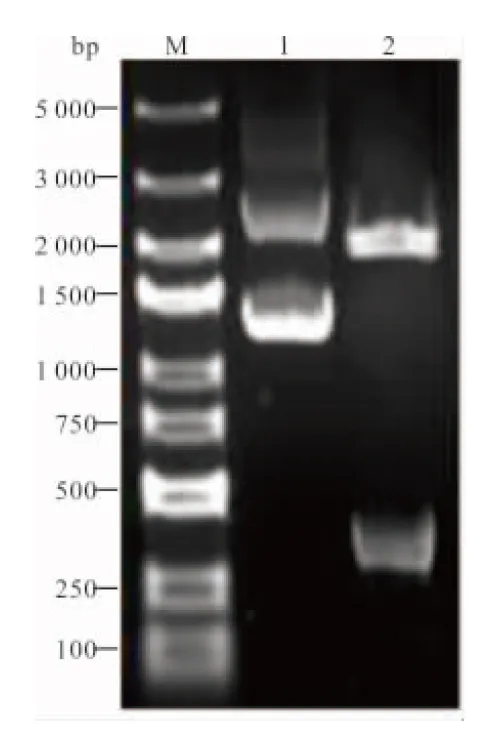
注:M,DL 5000 DNA marker;1,重组质粒PCT/pTG19-T;2,BamHⅠ酶切产物。
图2 重组质粒PCT/pTG19-T酶切鉴定

注:A,测序所得碱基序列;B,PCT目的基因序列。
图3 测序结果同源性比对分析
2.3 重组表达质粒PCT/pET-22b(+)的鉴定 用BamHⅠ和HindⅢ对重组表达质粒PCT/pET-22b(+)进行双酶切后,得到大小约为350 bp和5 500 bp的2个片段,与目的条带和载体大小一致,表明PCT基因被完整插入到表达载体pET-22b(+)中。见图4。
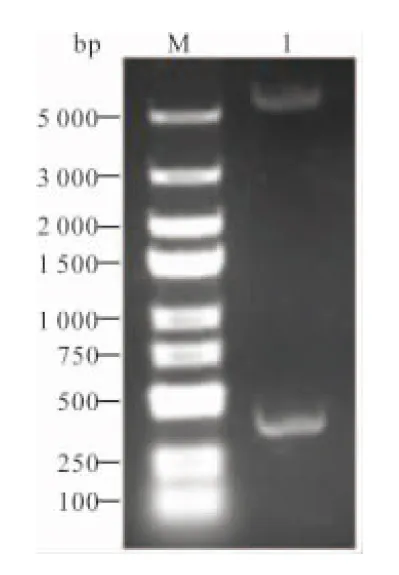
注:M,DL 5000 DNA marker; 1,重组质粒PCT/pET22b(+)双酶切产物。
图4 PCT/pET22b(+)重组质粒的鉴定
2.4 重组PCT蛋白的诱导表达及可溶性分析 诱导表达产物经SDS-PAGE电泳,在Mr约为14 000处出现目的蛋白质条带;另经超声处理菌体进行可溶性分析,发现该融合蛋白以可溶性形式存在于上清液中。见图5。
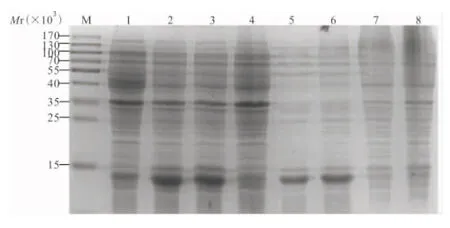
注:M,蛋白质Marker;1,带有pET22b的E.coliBL21菌株;2~3,PCT/pET22b经IPTG分别诱导4、16 h;4,PCT/pET22b未诱导; 5~6,可溶性分析(上清液);7~8,可溶性分析(沉淀)。
图5 重组质粒PCT/pET22b蛋白质表达
2.5 重组PCT蛋白的纯化 表达产物经镍柱亲和层析纯化后,得到单一的纯化蛋白质条带。见图6。
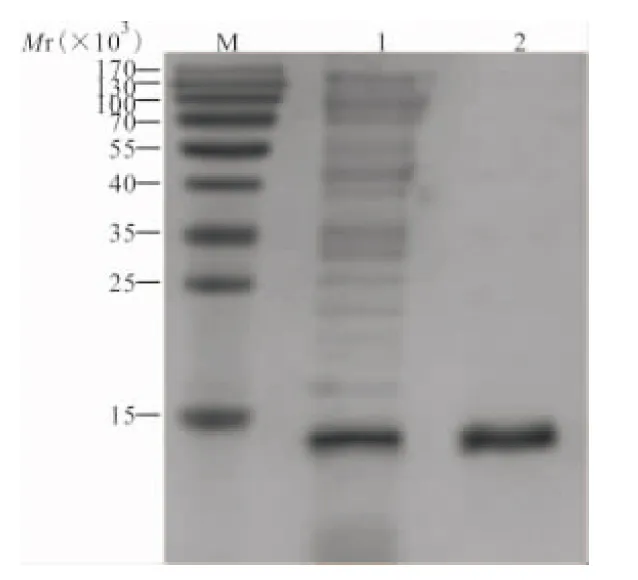
注:M,蛋白质Marker;1,未纯化蛋白;2,纯化蛋白。
图6 亲和层析纯化后的重组PCT蛋白
2.6 western blot和胶体金法的鉴定 western blot结果显示在Mr约为14 000处的条带可与抗His标签抗体发生抗原抗体结合反应,与重组PCT蛋白大小相符(Mr为13 600)。将纯化PCT蛋白加入胶体金法板条上样孔,可见质控线(C)和检测线(T)均为红色,PBS对照仅质控线(C)为红色,可知该纯化蛋白为PCT(图7)。
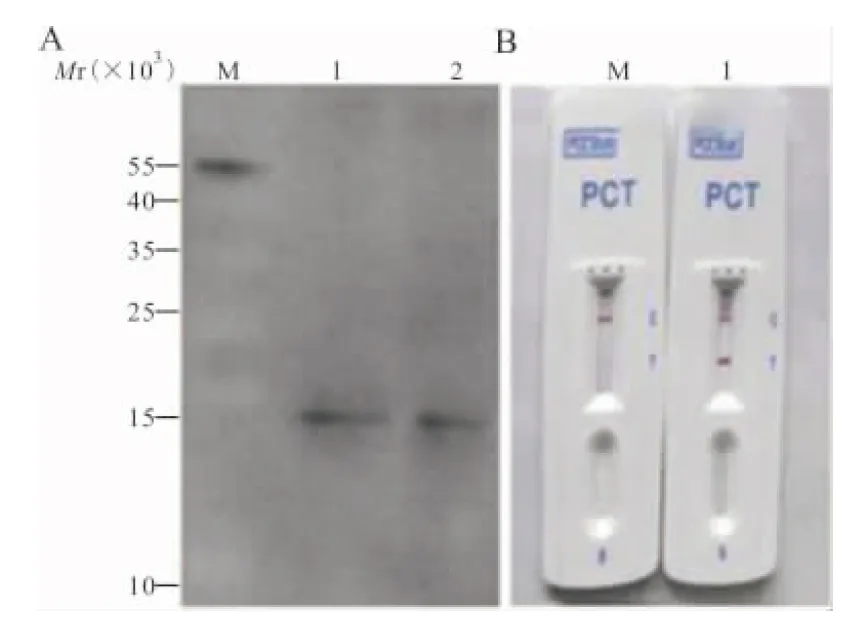
注: A,western blot结果;1,未纯化PCT蛋白;2,纯化的重组PCT蛋白; B,胶体金法检测结果;1,PBS对照;2,纯化的重组PCT蛋白。
图7 western blot和胶体金法鉴定重组PCT蛋白
3 讨论
本研究应用PCR技术扩增PCT基因片段,并用pTG19-T载体克隆功能插入原核表达载体pET22b(+)上的多克隆位点,成功构建重组表达载体;目的片段经PCR扩增后,在其3′端加上碱基A,利用3′端带有碱基T的pTG19-T载体,先构建含有目的基因的重组T载体,限制性内切酶酶切后得到带有粘性末端的目的片段,即可克隆至带有粘性末端的pET22b(+)表达载体。
本研究所选的pET22b(+)表达载体的优势在于氨基末端带有6个His标签,该标签与镍柱颗粒结合实现目的蛋白亲和层析纯化,对蛋白质的分泌、折叠和功能基本上无影响[6],并且因其免疫原性小,不会对后续免疫动物制备抗体产生影响,实验后期无需切除标签,简化了实验步骤。
外源蛋白在大肠埃希菌中表达形式分为两种:存在于上清液中可溶性蛋白质和不可溶性包涵体沉淀。在目的蛋白诱导表达过程中,不同的诱导表达条件可导致不同的蛋白质表达量以及蛋白质表达形式;诱导温度为37 ℃时,蛋白质以包涵体形式为主,诱导温度为16 ℃时,目的蛋白以可溶性蛋白质为主;采用低温诱导表达条件能有效的增加可溶性蛋白质的比例,有利于蛋白质纯化[7]。
PCT定量检测结果的准确性依赖于稳定的PCT标准品[8-9],临床实验室或检验科使用的PCT标准品都是进口试剂,如何制备稳定的PCT标准品国内尚未见文献报道,在获取了外源性PCT蛋白,本课题组后续将对PCT蛋白的稳定性及最佳保存方法作进一步的研究,探讨PCT蛋白的最佳贮存方式以及PCT标准品的制备和临床初步应用。
[1]Foushee JA, Hope NH, Grace EE. Applying biomarkers to clinical practice: a guide for utilizing procalcitonin assays[J]. J Antimicrob Chemother,2012,67(11):2560-2569.
[2]Kettner J, Holek M, Franekova J,etal. Procalcitonin dynamics after long-term ventricular assist device implantation[J]. Heart Lung Circ,2016.pii:S1443-9506(16)31658-4.
[3]Kutz A, Hausfater P, Oppert M,etal. Comparison between B.R.A.H.M.S PCT direct, a new sensitive point-of-care testing device for rapid quantification of procalcitonin in emergency department patients and established reference methods - a prospective multinational trial[J]. Clin Chem Lab Med,2016,54(4):577-584.
[4]郑怡麟,何莹,陈安,等. 抗人降钙素原特异性单克隆抗体的制备鉴定及初步应用[J]. 第三军医大学学报,2013,35(6):523-526.
[5]苏丹华. 刚地弓形虫Prx体外抗氧化机制研究[D].镇江:江苏大学,2016.
[6]原飞,刘转转,张波,等. 刚地弓形虫抑制蛋白的原核表达与免疫反应性分析[J]. 中国寄生虫学与寄生虫病杂志,2015,33(1):21-24.
[7]张国勇,刘倩,李芳秋,等. 烟曲霉果胶裂解酶A重组蛋白的原核表达及抗原性分析[J]. 临床检验杂志,2015,33(2):108-110.
[8]Meisner M. Update on procalcitonin measurements[J]. Ann Lab Med,2014,34(4):263-273.
[9]Yan ST, Sun LC, Jia HB,etal. Procalcitonin levels in bloodstream infections caused by different sources and species of bacteria[J]. Am J Emerg Med,2016. pii: S0735-6757(16)30916-0.
(本文编辑:许晓蒙)
Prokaryotic expression, purification and identification of human procalcitonin
FUTao,SUDan-hua,LIUYuan,LIUQing,WULiang,CHENGSheng-xia,JIANGXu-gan
(SchoolofMedicine,JiangsuUniversity,Zhenjiang212013,Jiangsu,China)
Objective To construct the prokaryotic expression vector of human procalcitonin(PCT) and obtain the highly purified recombinant PCT protein. Methods PCT primers were designed based on the sequence ofPCTgene from NCBI, andPCTgene was amplified by PCR. Then, the recombinant vector PCT/pET-22b(+) was constructed and transferred intoE.coliBL21 to induce the expression of recombinant PCT protein. Last, the recombinant PCT protein was purified by the nickel column affinity chromatography and identified by Western blot and the colloidal gold method, respectively. Results The results of agarose gel electrophoresis showed that the product of PCR amplification was about 350 bp. The homology comparison analysis revealed that thePCTgene fragment(348 bp) was successfully inserted into pTG19-T vector, and that no any base mutation was found. When the recombinant plasmid of PCT/pET-22b(+) was digested withBamH I andHindⅢ, two pieces of about 350 bp and 5 500 bp were obtained. SDS-PAGE showed that the recombinant PCT protein with about 14 000 ofMr was existed in soluble form, and was easily obtained by the nickel column affinity chromatography. Moreover, western blot and the colloidal gold method demonstrated that the recombinant PCT protein was successfully expressed and contained histidine label(His-tag). Conclusion The recombinant vector PCT/pET-22b(+) is successfully constructed by the recombinant DNA technology, and the recombinant PCT fusion protein is successfully obtained by the nickel column affinity chromatography.
procalcitonin; prokaryotic expression; purification
10.13602/j.cnki.jcls.2017.03.19
付涛,1986年生,男,硕士研究生,研究方向为临床生化诊断试剂的研发。
姜旭淦,副教授,博士,E-mail:jiangxugan1962@163.com。
R446.1
A
2016-12-31)

