川芎嗪对急性脊髓损伤大鼠模型GFAP、cPLA2表达的影响
陈星,丁永利,李现林,赵明明
(河南中医药大学第一附属医院,河南 郑州 450000)
川芎嗪对急性脊髓损伤大鼠模型GFAP、cPLA2表达的影响
陈星,丁永利,李现林,赵明明
(河南中医药大学第一附属医院,河南 郑州 450000)
目的 研究川芎嗪对SD大鼠急性脊髓损伤模型的保护作用及其对损伤段脊髓胶质纤维酸蛋白(GFAP)及胞浆型磷脂酶A2(cPLA2)表达的影响。方法SD大鼠87只,随机分成假手术组(n=9)、生理盐水组(n=39)、川芎嗪组(n=39)。其中,假手术组行椎板切除术,生理盐水组及川芎嗪组采用改良Allen打击法复制大鼠急性脊髓损伤模型,以BBB(Basso,Beattie,Bresnahan)评分评价各组大鼠脊髓功能;术后川芎嗪组按200mg/kg注射川芎嗪,假手术组、生理盐水组注射等量生理盐水,并于术后1、3、7、14和21 d处死部分大鼠获取脊髓损伤标本,采用免疫组织化学比较GFAP、cPLA2表达情况,采用苏木精-伊红染色法(HE)染色观察组织受损情况,并对GFAP、cPLA2进行相关性分析。结果术后第7天起,川芎嗪组BBB评分均高于生理盐水组,差异具有统计学意义(P<0.05);术后各时间段川芎嗪组GFAP及cPLA2表达阳性面积均低于生理盐水组,差异具有统计学意义,且GFAP与cPLA2表达阳性面积呈正相关(r=0.826,P=0.043),而从HE染色可知,脊髓损伤21 d,生理盐水组已经出现胶质瘢痕,川芎嗪组仅为缺血性改变。结论川芎嗪可通过下调GFAP、cPLA2表达,并对急性脊髓损伤起到一定保护作用。
川芎嗪;急性脊髓损伤;胶质纤维酸蛋白;组织胞浆型磷脂酶A2
长久以来,促进中枢神经损伤后的神经再生一直是治疗脊髓继发性损伤的主要方向,胶质瘢痕的形成作为阻碍神经再生的重要因素,对于其发生机制的研究也获得了一定成果[1]。如星形胶质细胞(Astrocyte,AS)的增殖及肥大即是引起胶质瘢痕形成的因素之一[2]。川芎嗪(Tetramethylpyrazine,TMP)是中药川芎中提取有活性单体,有研究指出川芎嗪具有抗缺血、改善微循环等作用,可应用于脊髓损伤治疗[3],但人们对于其具体作用机制尚不清楚。而胶质纤维酸蛋白(glial fibrillary acidic protein,GFAP)作为AS骨架蛋白,研究其表达量变化,有助于更好地了解川芎嗪的作用机制。此外,有研究指出[4],炎症反应中关键酶胞浆型磷脂酶A2(cytosolic phospholipase A2,cPLA2)可通过水解包膜磷脂酸来释放花生四烯酸,进而促进炎症级联反应的发生,而炎症反应、缺血、缺氧等因素本身即可促进脊髓损伤的加剧发生。因此,本文通过复制大鼠急性脊髓损伤模型,通过监测给药后不同时间点各组GFAP及cPLA2表达水平差异,从而更好地了解川芎嗪在治疗脊髓损伤中的临床机制。
1 材料与方法
1.1 实验仪器及试剂
盐酸川芎嗪氯化钠注射液购自珠海联邦制药股份有限公司中山分公司,GFAP、cPLA2兔抗鼠多克隆抗体、生物素标记羊抗兔二抗购自英国Abcam公司,链霉亲和素-生物素复合物试剂盒购自武汉博士德公司,其余所用常规试剂均购自广州鼎国生物技术有限公司。
1.2 模型复制及分组
将87只SD大鼠随机分成假手术组(n=9)、生理盐水组(n=39)和川芎嗪组(n=39)。其中,生理盐水组及川芎嗪组模型依照改良Allen重物打击法[5]复制大鼠脊髓损伤模型,方法如下:按30mg/kg剂量腹腔注射3%戊巴比妥钠,待大鼠麻痹后,固定于手术操作台,提起背部毛发消毒后,从T10棘突处切出约2~3 cm切口,剥离椎盘肌肉,暴露棘突及椎板,将长×宽×厚为3mm×2mm×1mm塑料垫片弯曲至符合大鼠背侧脊髓屈曲度,并将此放置在T10处,以自制打击装置,采用7 g打击棒从4 cm处以自由落体的方式撞击垫片,并对脊髓造成损伤,以大鼠出现尾部痉挛摆动、下肢及躯体回缩为复制模型成功,随后按顺序逐层缝合、消毒。假手术组仅进行椎板切除术且不对脊髓造成损伤,随后缝合伤口。为预防大鼠感染,术后常规大腿内侧肌注4万u青霉素,连续给药3 d。
按照以上分组,川芎嗪组术后30 min即按200mg/kg注射川芎嗪,假手术组及生理盐水组则注射等量生理盐水,随后每天给药1次,持续5 d。
1.3 评估标准
1.3.1 行为学评分 按照BBB(Basso-Beattie-Bresnahan)行为学评分标准,即从后肢关节活动情况、运动协同情况及承重情况等,对术后1、3、7、14和21 d处死大鼠进行评分[6]。总分21分,分值越高,提示大鼠行为能力越正常。本评分由2名非本实验参与人员进行独立评分后,所得平均值为大鼠最终BBB评分结果。
1.3.2 GFAP、cPLA2免疫组织化学实验 分别于术后1、3、7、14和21 d取处死后大鼠的脊髓损伤中心组织,经切片脱蜡水化处理后,以3%过氧化氢H2O2孵育10min,羊血清封闭20min后,加入1∶100兔抗鼠GFAP多抗或1∶200兔抗鼠cPLA2,4℃过夜。磷酸缓冲盐溶液(phosphate buffer saline,PBS)洗涤3次,加入生物素二抗,室温孵育20min,PBS洗涤,二氨基联苯胺显色,PBS冲洗终止显色反应、苏木素复染、二甲苯透明、中性树胶封片。随机采用Motic image Advanced软件对以上切片进行分析,其方法为选取5个在×200下不重叠区域,将呈棕黄色细胞作为阳性细胞,计算总的阳性染色面积。
1.3.3 苏木精 -伊红染色法(hematoxylin-eosin staining,HE)染色 采取标本,脱水、透明、包埋,切成厚度为5μm石蜡切片,随后按照HE染色步骤,依次放入二甲苯及不同浓度乙醇中,并经PBS漂洗,加入苏木精染色,自来水清洗、盐酸乙醇分化、再次清洗后使用伊红染色,清洗,经不同浓度乙醇处理至无水乙醇中,二甲苯透明,树脂封片,并在尼康显微镜下观察,采集图片。
1.4 统计学方法
采用SPSS22.0软件进行统计学分析,计数资料采用χ2检验,计量资料以均数±标准差(±s)表示,进行成组t检验、重复测量方差分析或LSD-t检验,并采用Pearson相关性分析GFAP、cPLA2的相关性。P<0.05为差异有统计学意义。
2 结果
2.1 BBB评分结果
术后,生理盐水组及川芎嗪组大鼠均出现脊髓休克现象,表现为双后肢功能丧失,无肌力,并以俯卧行走、尿潴留。但随着术后恢复时间增加,脊髓休克现象有所缓解。以BBB评分可知,川芎嗪组大鼠恢复速度快于生理盐水组,从术后7 d起,两组间差异具有统计学意义。见表1。
2.2 cPLA2表达情况
术后1 d,生理盐水组及川芎嗪组的cPLA2阳性面积同样均高于假手术组(185.4±14.3)μm2,且差异具有统计学意义(t生理盐水组vs假手术组=4.353,P<0.05;t川芎嗪组vs假手术组=3.952,P<0.05),且随着治疗时间的延长,生理盐水组cPLA2阳性面积逐渐增大,而川芎嗪组cPLA2阳性面积则逐渐减小(F组别=5.535,P<0.05;F时间点=4.453,P<0.05;F组别*时间点=3.745,P<0.05),且在同一检测时点,两组间差异均有统计学意义。见图1、表2。
2.3 GFAP表达情况
术后第1天,生理盐水组及川芎嗪组的GFAP阳性面积均高于假手术组(249.8±9.8)μm2,且差异具有统计学意义(t生理盐水组vs假手术组=3.743,P<0.05;t川芎嗪组vs假手术组=3.321,P<0.05),而随着治疗时间的延长,生理盐水组GFAP阳性面积逐渐增大,而川芎嗪组GFAP阳性面积则逐渐减小(F组别=4.976,P<0.05;F时间点=4.134,P<0.05;F组别*时间点=3.663,P<0.05),且在同一检测时点,两组间差异均有统计学意义。见图2、表3。
表1 两组术后不同时间点BBB评分比较 (n=39,分,±s)
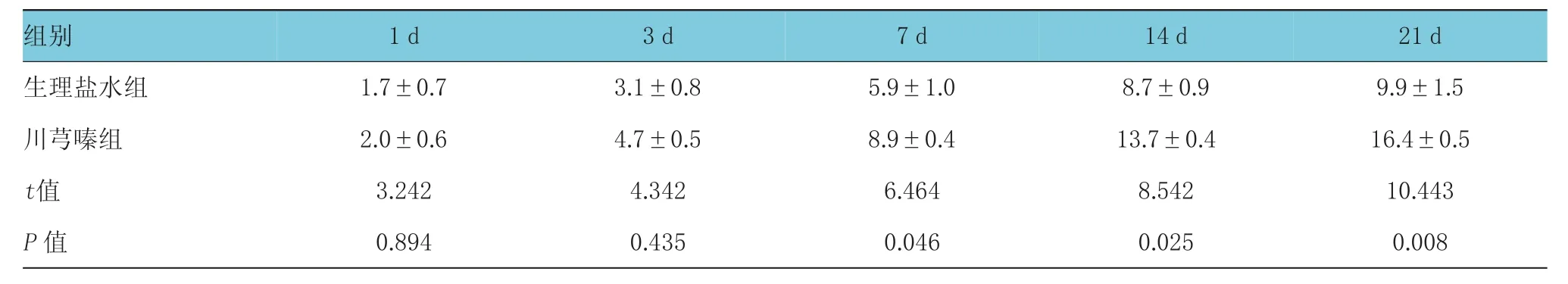
表1 两组术后不同时间点BBB评分比较 (n=39,分,±s)
21 d生理盐水组 1.7±0.7 3.1±0.8 5.9±1.0 8.7±0.9 9.9±1.5川芎嗪组 2.0±0.6 4.7±0.5 8.9±0.4 13.7±0.4 16.4±0.5t值 3.242 4.342 6.464 8.542 10.443P值 0.894 0.435 0.046 0.025 0.008组别1 d 3 d 7 d 14 d
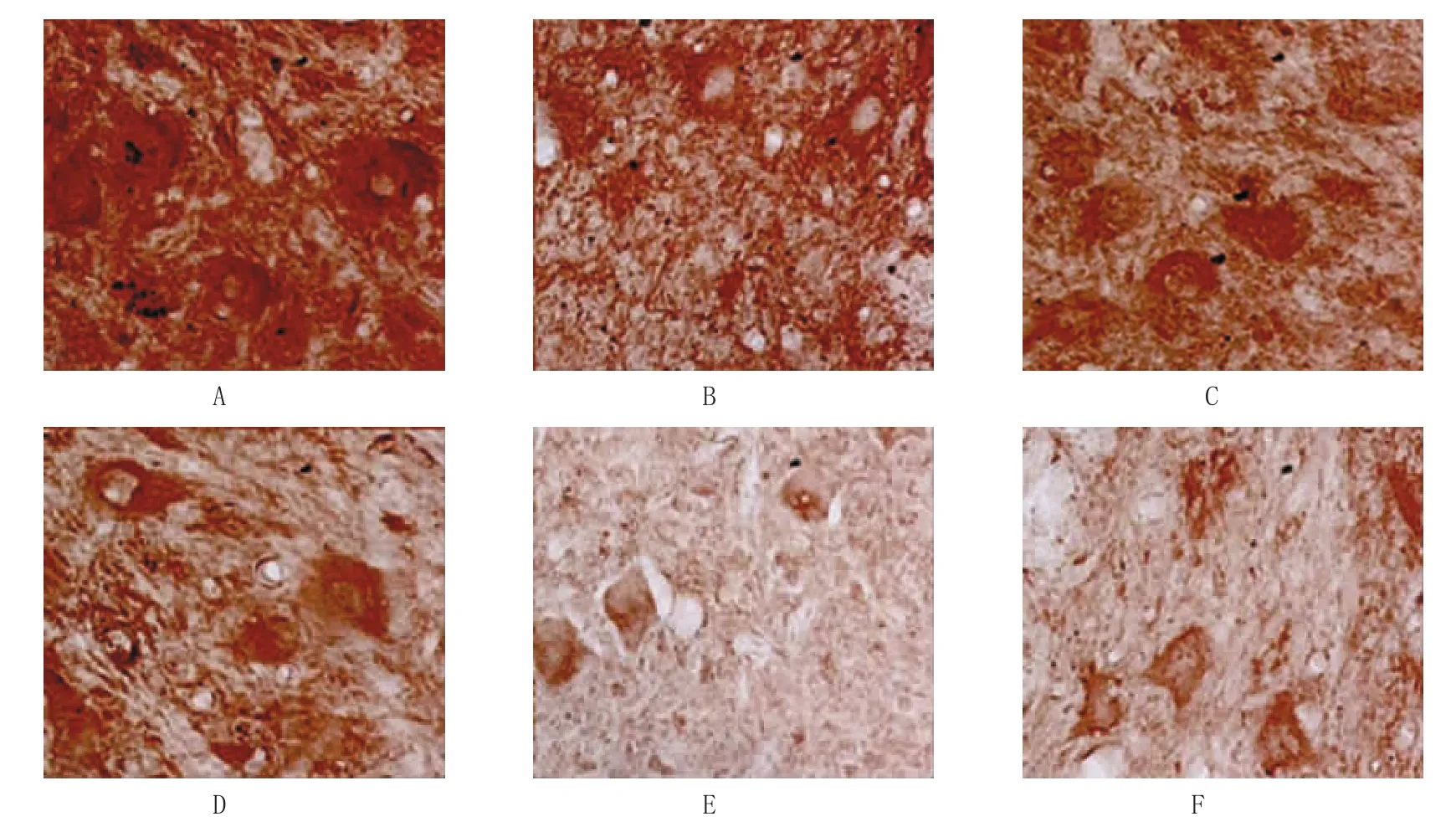
图1 两组不同时间点cPLA2表达 (×400)
表2 两组不同时间点cPLA2表达阳性面积比较 (n=39,μm2,±s)
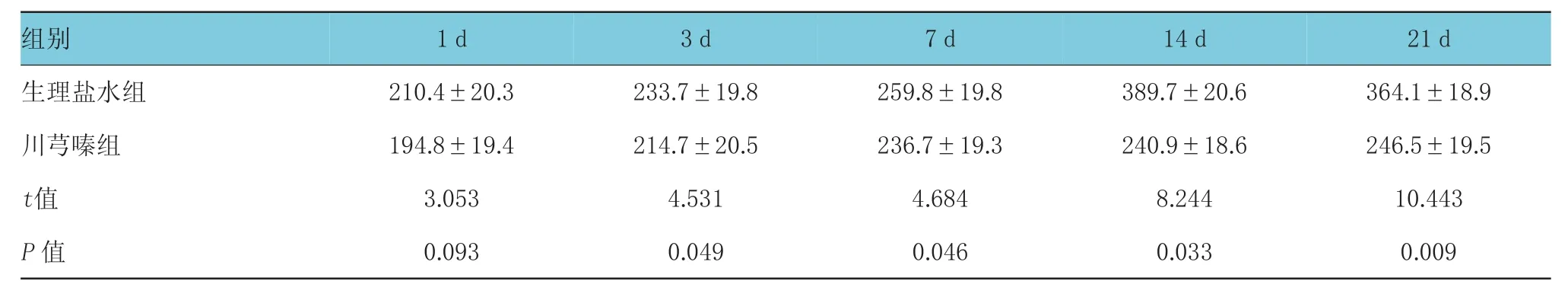
表2 两组不同时间点cPLA2表达阳性面积比较 (n=39,μm2,±s)
21 d生理盐水组 210.4±20.3 233.7±19.8 259.8±19.8 389.7±20.6 364.1±18.9川芎嗪组 194.8±19.4 214.7±20.5 236.7±19.3 240.9±18.6 246.5±19.5t值 3.053 4.531 4.684 8.244 10.443P值 0.093 0.049 0.046 0.033 0.009组别1 d 3 d 7 d 14 d
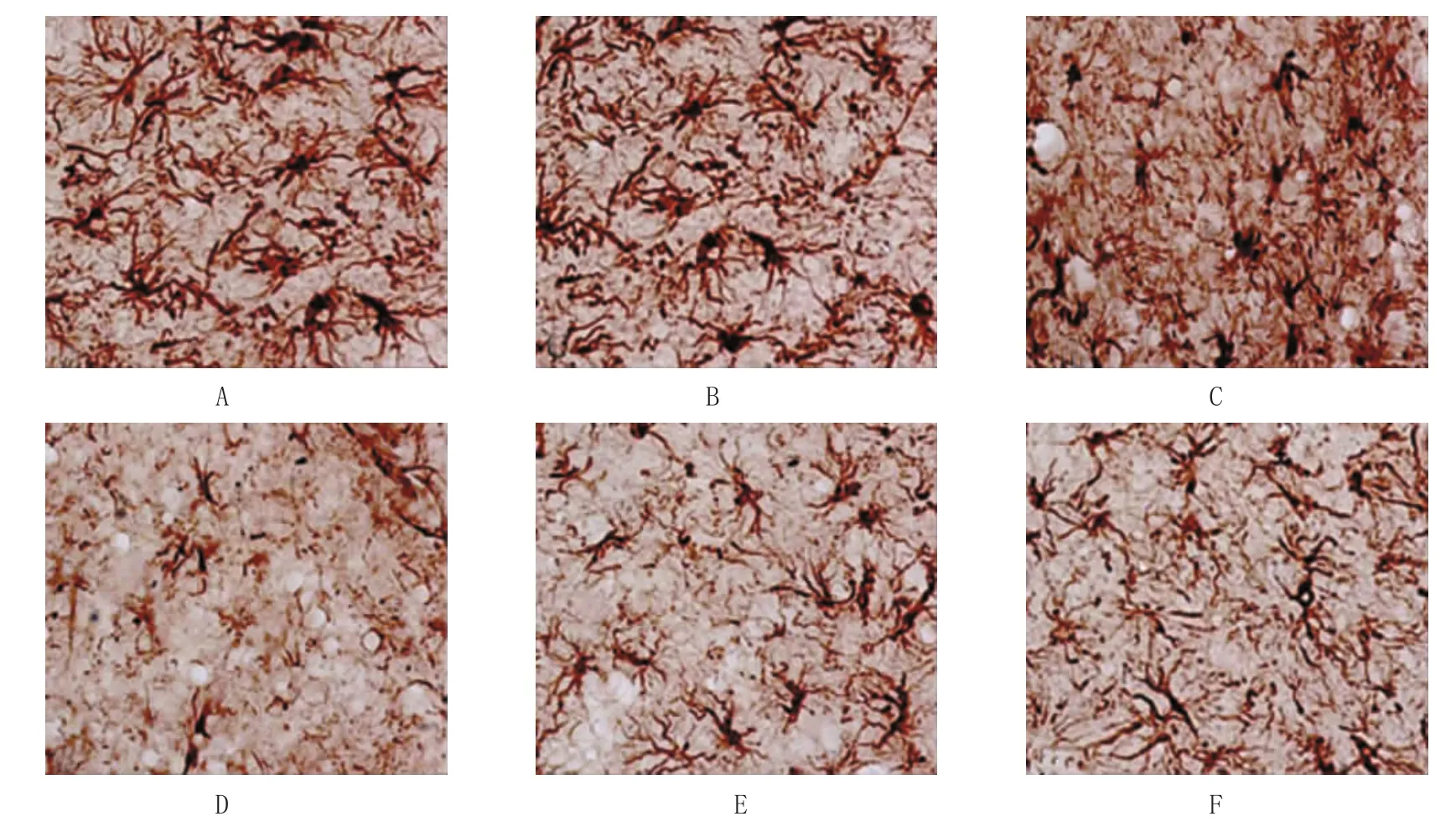
图2 两组不同时间点GFAP表达 (×400)
表3 两组不同时间点GFAP表达阳性面积比较 (n=39,μm2,±s)
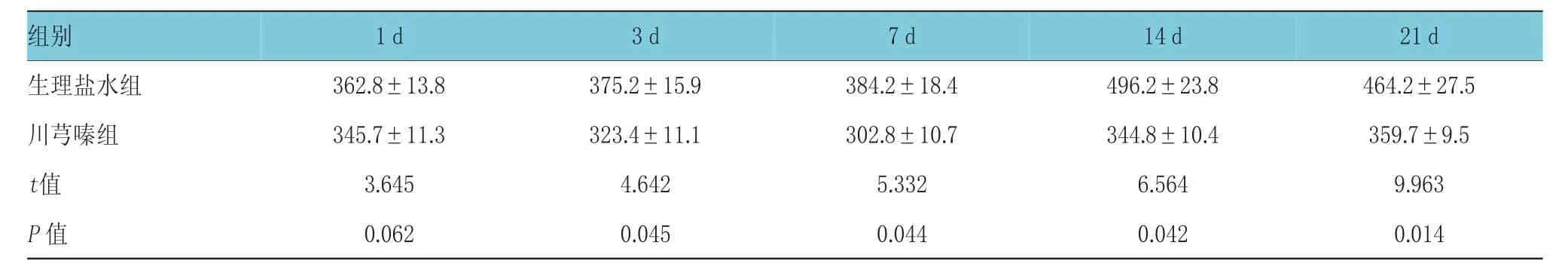
表3 两组不同时间点GFAP表达阳性面积比较 (n=39,μm2,±s)
21 d生理盐水组 362.8±13.8 375.2±15.9 384.2±18.4 496.2±23.8 464.2±27.5川芎嗪组 345.7±11.3 323.4±11.1 302.8±10.7 344.8±10.4 359.7±9.5t值 3.645 4.642 5.332 6.564 9.963P值 0.062 0.045 0.044 0.042 0.014组别1 d 3 d 7 d 14 d
2.4 GFAP、cPLA2相关性分析
对川芎嗪组及生理盐水组GFAP及cPLA2表达阳性面积进行相关性分析,结果显示,GFAP及cPLA2在整个治疗周期中呈正相关,相关系数r=0.826,P=0.043。见图3。
2.5 HE染色结果
对术后21 d假手术组、生理盐水组、川芎嗪组进行HE染色。其中图4A为假手术组,其脊髓组织可见清晰灰白质界限,灰质内神经细胞体大,核仁丰富,可见尼氏小体;图4B为生理盐水组,可见损伤区域已经塌陷且重建基本完成,可见片胶质瘢痕;图4C为川芎嗪组,其灰质内可见部分出血,红细胞堆积现象,但未见明显胶质瘢痕生成。
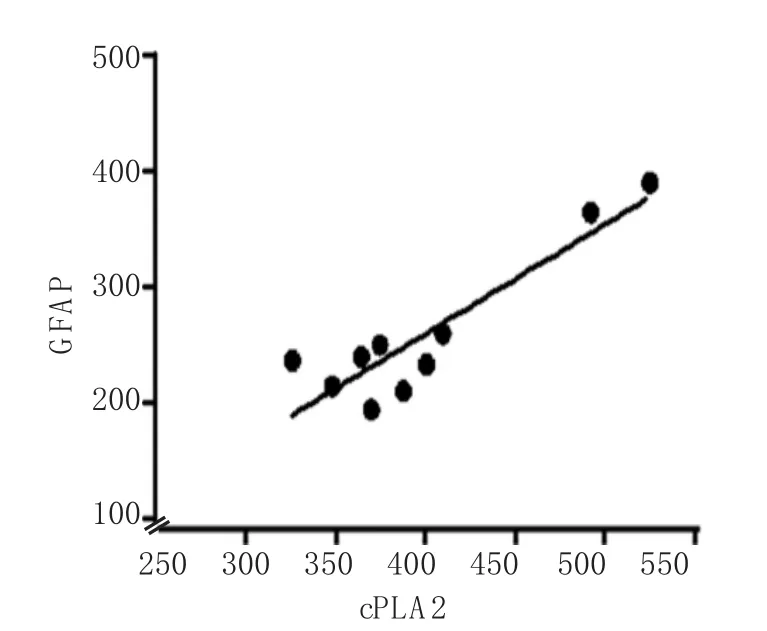
图3 GFAP、cPLA2相关性分析
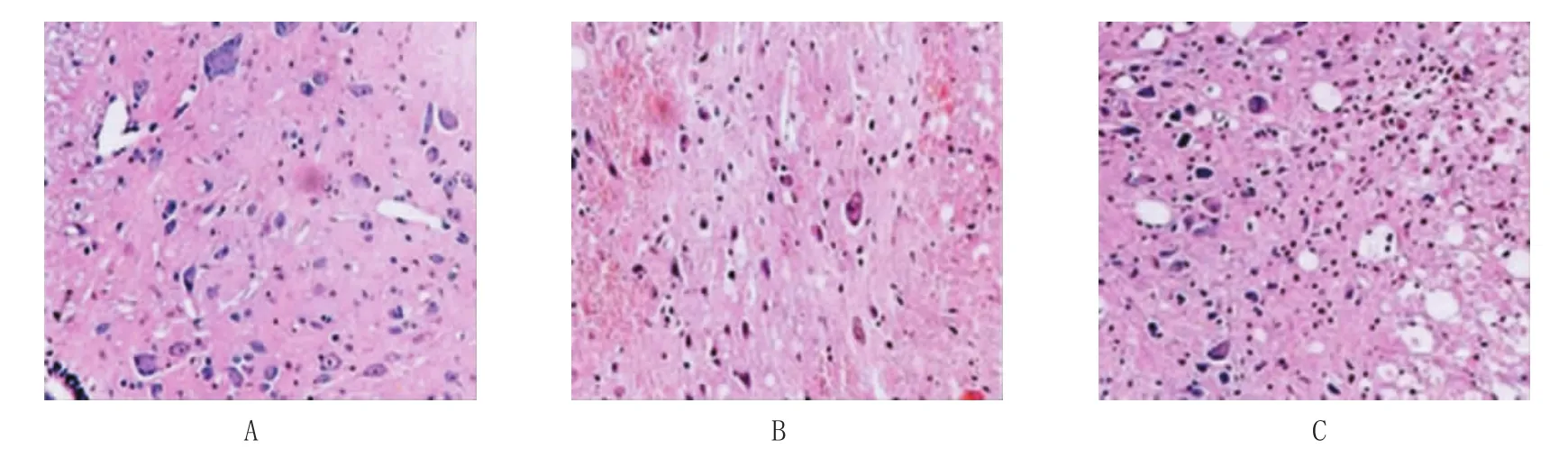
图4 3组损伤区脊髓组织染色结果 (HE染色×400)
3 讨论
临床上,大致可将急性脊髓损伤分为急性创伤期、继发损伤期和慢性损伤期3个时期[5]。而当脊髓损伤患者送至医院时,多数原创损伤已不可逆转,因此,治疗上也以继发损伤期及慢性损伤期为主。而研究表明[7],多数因脊髓损伤致残的主要原因在于继发损伤期未得到及时、有效地治疗,以至于损伤扩大,加重脊髓神经功能受损。此外,继发性损伤期牵涉因素较多,致损机制繁多且相互影响,也给目前治疗方案增大了难度。而当病程进入慢性损伤期,此时,神经系统的再生则对于扭转脊髓损伤,改善脊髓功能具有重要意义。然而,由于神经组织损伤不可逆行,使得目前对于诱发神经再生未能取得实时性成果,但是,有一点笔者可以确认,即脊髓组织的修复及功能恢复必须依赖良好的血液微环境为受损血管及组织提供营养[8]。TMP正好具有此类功能,TMP是川芎根茎提取的一种生物活性单体,因其具有扩张血管、抑制血小板聚集、拮抗Ca2+内流、消除氧气自由基等作用已被广泛应用于心血管及神经内科治疗。但是,对于其在急性脊髓损伤中的保护作用机制仍不明确,因此,仍有必要从分子水平分析TMP在脊髓损伤中的保护机制。
本研究通过改良Allen重物打击法复制大鼠急性脊髓损伤模型,以假手术组作为模型复制对照组,并以BBB评价模型复制情况,从而保证了后期实验的真实性。而通过免疫组织化学结果可知,随着术后时间的延迟,生理盐水组及川芎嗪组cPLA2阳性产物均呈现上升趋势,但后者上升趋势较为缓慢。由于cPLA2主要介导炎症反应及氧化应激反应,属于急性期反应蛋白,两组在术后第1天,表达cPLA2阳性产物均高于假手术组。随后两组cPLA2表达阳性率差异逐渐明显。由于炎症因子释放多为旁分泌或自分泌,即大量炎症因子可导致炎症细胞进一步释放炎症因子[9]。生理盐水组因自身短期内炎症因子释放增加而得不到有效抑制,以至于cPLA2表达阳性细胞在术后14 d增加迅猛;而川芎嗪组,由于TMP可降低前列腺素合成,并抑制淋巴细胞、中性粒细胞等释放肿瘤坏死因子-α及白细胞介素-1β等炎症因子,从而减轻了炎症反应;此外cPLA2具有明显Ca2+依赖性,而TMP其作用之一即是拮抗Ca2+内流[10]。另外,TMP还具有改善缺血部位血流速度,减少血管外周阻力,从而改善局部血液微循环,而这也有利于减少白细胞浸润,避免组织受到反复刺激产生炎症因子[11]。
对GFAP,其与cPLA2呈正相关。在AS增殖早期,其能分泌如bFGF等促神经生长因子来减少脊髓损伤,因此,早期cPLA2高表达时,往往也可出现GFAP表达增高,但是当AS细胞过度增殖乃至形变后,其将形成胶质瘢痕,从而成为阻碍脊髓修复的物理及化学屏障,以至于一旦胶质瘢痕形成,脊髓功能修复往往效果较差[12]。而从本研究看,生理盐水组随着术后时间延长,GFAP表达增加,但在术后21 d,其表达阳性面积反而有所下降;川芎嗪组则GFAP表达则一直缓慢增加,并在SCI后14 d及21 d无明显差别。由于GFAP是AS细胞骨架中起支承功能的结构蛋白,其大量表达,可以说明AS细胞不仅增殖还可能出现了肿胀和形变。而生理盐水组在术后21 d出现了GFAP表达阳性面积下调,其很有可能是部分AS细胞已经出现凋亡,并形成胶质瘢痕。而川芎嗪组GFAP表达量则维持较小增幅,并未出现表达阳性面积突增或下调。因此笔者认为AS大多是出现增殖现象。而通过HE染色更直观的证实了以上观点。生理盐水组细胞呈现增多,密集且形态不规则,而川芎嗪组虽然AS细胞也有所增加,但仍可见清晰完整的胶质细胞结构。
综上所述,cPLA2与GFAP在表达量具有一定的相关性,而川芎嗪又可以作用cPLA2,从而对急性脊髓损伤起到一定治疗效果。
[1]KABU S,GAO Y,KWON B K,et al.Drug delivery,cell-based therapies,and tissue engineering approaches for spinal cord injury[J].Journal of Controlled Release,2015,219:141-154.
[2]李在望,张剑平,王兰,等.脊髓损伤后星形胶质细胞增生动态变化分析[J].神经损伤与功能重建,2013,8(3):165-170.
[3]侯建雄,马海燕,李莉.手术配合丹参川芎嗪,甲基泼尼松龙治疗颈椎骨折伴脊髓损伤的临床观察[J].河北医药,2013,35(14):2110-2112.
[4]许光.急性脑梗死患者血清脂蛋白相关性磷脂酶A2水平的变化及意义[J].中国实用神经疾病杂志,2013,16(21):20-21.
[5]顾一飞,杨立利,袁文.急性脊髓损伤并发肺损伤机制的研究进展[J].中国脊柱脊髓杂志,2013,22(12):1121-1124.
[6]BASSO D M,BEATTIE M S,BRESNAHAN J C.A sensitive and reliable locomotor rating scale for open field testing in rats[J].Journal of Neurotrauma,1995,12(1):1-21.
[7]何霏,张雯,杨蓉,等.脊髓损伤患者肺康复治疗的现状和进展[J].中国康复医学杂志,2014,29(2):176-179.
[8]SABELSTRÖM H,STENUDD M,RÉU P,et al.Resident neural stem cells restrict tissue damage and neuronal loss after spinal cord injury in mice[J].Science,2013,342(6158):637-640.
[9]王涛丽,顾兵,李华南,等.急性脊髓损伤后的炎症反应及其抗炎治疗[J].中国药理学通报,2015,31(4):452-457.
[10]钟建,阳明明,蒋电明.含川芎嗪UW液保存不同时间对异体神经再生的影响[J].第三军医大学学报,2013,35(19):2065-2068.
[11]MOTHE A J,TATOR C H.Review of transplantation of neural stem/progenitor cells for spinal cord injury[J].International Journal of Developmental Neuroscience,2013,31(7):701-713.
[12]WILEMS T S,SAKIYAMA-ELBERT S E.Sustained dual drug delivery of anti-inhibitory molecules for treatment of spinal cord injury[J].Journal of Controlled Release,2015,213:103-111.
(张蕾 编辑)
Effect of Ligustrazine on GFAP and cPLA2 expressions in ratmodel of acute spinal cord injury
Xing Chen,Yong-liDing,Xian-lin Li,Ming-ming Zhao
(The First Affiliated Hospital,Henan University of Traditional Chinese Medicine, Zhengzhou,Henan 450000,China)
ObjectiveTo investigate the effects of Ligustrazine(Tetramethylpyrazine,TMP)on acute spinal cord injury in SD ratmodel and the expressions of glial fibrillary acidic protein(GAFP)and cytosolic phospholipase A2 (cPLA2)in the injuried spinal cord.MethodsEighty-seven SD ratswere randomly divided into sham group(n=9), saline group(n=39)and TMP group (n=39).The sham group underwent laminectomy,while in the saline group and the TMP group modified Allen's combat was used to make ratmodel of acute spinal cord injury.BBB(Basso, Beattie,Bresnahan)scores were applied to evaluate the spinal cord function of the rats.After operation,the TMP group was treated with TMP injection by 200 mg/kg,and the sham group and the saline group were injected with equal amount of saline.Part of the rats were sacrificed on postoperative day 1,3,7,14 or 21 to obtain the specimens of injuried spinal cord.By immunohistochemistry GFAP and cPLA2 expressions were compared.Tissue damage was observed in each group by HE staining.The correlation of GFAP and cPLA2 was analyzed.ResultsFrom the 7th postoperative day,BBB scores of the TMP group were higher than those of the saline group,the differencewas statistically significant(P<0.05).In addition,the expressions of cPLA2 and GFAP in the TMP group were significantly lower than those in the normal saline group at each time period.The expressions of GFAP andcPLA2 are positively correlated(r=0.826,P=0.043).On the 21st day of spinal cord injury,HE staining revealed glial scar in the saline group and only ischemic changes in the TMP group.ConclusionsTMP can down-regulate the expressions of GFAP and cPLA2,and play a protective role in acute spinal cord injury.
Tetramethylpyrazine;acute spinal cord injury;glial fibrillary acidic protein;cytosolic phospholipase A2
R-332
A
10.3969/j.issn.1005-8982.2017.07.003
1005-8982(2017)07-0009-06
2016-09-30

