人肺动脉平滑肌细胞对人肺动脉内皮细胞增殖的影响*
刘宇伟,樊再雯,吴娟娟,张帅,张波
(空军总医院1.呼吸内科,2.肿瘤内科,北京 100142)
人肺动脉平滑肌细胞对人肺动脉内皮细胞增殖的影响*
刘宇伟1,樊再雯2,吴娟娟2,张帅1,张波1
(空军总医院1.呼吸内科,2.肿瘤内科,北京 100142)
目的 探讨缺氧条件下,细胞共培养体系中人肺动脉平滑肌细胞(HPASMCs)经由Survivin信号通路调控人肺动脉内皮细胞(HPAECs)的增殖。方法建立Transwell共培养体系将HPASMCs和HPAECs分别接种于下室和上室,根据HPASMCs是否行YM 155(Survivin抑制剂)预处理进行实验分组:常氧条件下HPASMCs与HAPECs共培养对照组(N组),常氧条件下YM 155(终浓度100 nmol/l)预处理HPASMCs与HPAECs共培养组(NY组),缺氧条件下HPASMCs与HAPECs共培养组(H组)和缺氧条件下YM 155预处理HPASMCs与HPAECs共培养组(HY组)。采用活细胞计数(CCK8)法检测各组中HPASMCs与HPAECs的增殖活性(吸光度,A值),实时定量PCR检测HPASMCs中Survivin mRNA的表达,W estern blot检测HPASMCs中Survivin蛋白的表达。结果N组HPASMCs与HPAECs增殖活性(0.561±0.007)、(0.619±0.013)与H组(0.777±0.030)、(0.875±0.021)比较,差异有统计学意义(q=16.615和21.333,P<0.05)。HY组HPASMCs与HPAECs增殖活性为(0.661±0.027)、(0.723±0.025),与H组比较差异有统计学意义(q=8.923和12.667,P<0.05)。共培养体系中N组HPASMCs未见mRNA和Survivin蛋白(0.017±0.001)表达,H组中HPASMCs可见mRNA(4 506±849)和Survivin蛋白(0.932±0.018)表达。HY组HPASMCs mRNA和Survivin蛋白含量为(677±183)和(0.426±0.022),与H组比较差异有统计学意义(q=15.25和50.6,P<0.05)。结论缺氧导致HPASMCs和HPAECs异常增殖,缺氧条件下共培养体系中HPASMCs经由Survivin信号通路调控HPAECs的增殖。
肌细胞;平滑肌;内皮细胞;缺氧;生存素;共培养
缺氧性肺动脉高压(hypoxia pulmonary hypertension,HPH)是一种渐进性、致死性疾病,其病理生理基础包括肺血管收缩、肺动脉平滑肌(pulmonary arterial smooth cells,PASMCs)增生和肺动脉内皮细胞(pulmonary arterial endothelial cells,PAECs)功能失调[1]。HPH形成的关键是缺氧肺血管重构,而缺氧条件下PASMCs和PAECs的异常增殖在肺血管重建中起着主导作用。缺氧条件下PASMCs和PAECs彼此是否相互影响?其之间是否存在信号传递?其具体机制又是什么?目前都尚未清楚。本实验建立缺氧条件下人肺动脉平滑肌细胞(HPASMCs)和人肺动脉内皮细胞(HPAECs)共培养体系,从生存素(Survivin)信号通路角度探讨HPASMCs对HPAECs增殖的影响。
1 材料与方法
1.1 主要试剂与材料
HPASMCs、HPAECs、平滑肌细胞和内皮细胞培养基均购自美国Scien Cell公司,DMEM(高糖)培养基、胰蛋白酶、PBS购自美国Invitrogen公司,胎牛血清购自美国Gibco公司,活细胞计数盒(CCK-8,批号:CK04)购自日本Dojindo公司,TRNzol-A+总RNA提取试剂、SYBR Premix、SuperReal PreMix Plus(SYBR Green)、FastQuantRTKit(With gDNase)均购自北京天根生化科技公司,蛋白裂解液、BCA蛋白定量试剂盒购自广州碧云天公司,兔抗人生存素单克隆抗体购自英国Abcam公司,山羊抗兔单克隆抗体购自美国Sigma公司,Survivin、GAPDH引物由上海桑尼公司合成,YM155购自美国Selleck公司,Transwell孔板(孔径0.4μm,货号:3412)购自美国Corning公司,其他试剂均为国产分析纯。
1.2 HPASMCs与HPAECs共培养和分组
按美国Scien Cell公司的说明书复苏HPASMCs和HPAECs,将细胞状态调整到最佳。以105个细胞接种6孔板,待细胞生长稳定,汇合度80%左右,用胰酶消化传代,取4~8代细胞用于实验。建立Transwell共培养体系,实验分组为4组:常氧对照组(N组),HPASMCs及HPAECs细胞分别铺于Transwell小室的上下室,下室为HPASMCs细胞,上室为HPAECs细胞,培液更换成DMEM无血清培养液,置于37℃、5%CO2常氧培养箱中培养24 h;常氧条件下 YM155(100 nmol/L)预处理的 HPASMCs与HPAECs共培养组(NY组),Transwell下室为YM155预处理24 h的HPASMCs与上室的HPAECs共培养,培养条件同正常对照组;缺氧培养组(H组),Transwell上室为 HPAECs细胞,下室为HPASMCs细胞,细胞更换成DMEM无血清培养液,置于37℃、2.5%O2、5%CO2、92.5%N2培养箱中培养24 h;缺氧条件下应用YM155(100 nmol/L)预处理的PASMCs与PAECs共培养组(HY组),Transwell下室为YM155预处理24 h的HPASMCs与上室的HPAECs共培养,培养条件同缺氧对照组。
1.3 实验方法
1.3.1 CCK-8法检测细胞活性 Transwell共培养体系中HPASMCs活性:干预方式及给药同上述分组,每组设3个复孔,同时设空白组(只有培养液,无细胞)。每孔溶液的总体积为100μl,置于培养箱中培养。检测时每孔加入10μl的CCK-8试剂后继续培养箱中培养,于培养后的48 h用酶标仪在450 nm处测定HPASMCs每孔的吸光值(A值)。CCK-8法检测Transwell共培养体系中HPAECs活性:此次实验将HPAECs置于Transwell共培养体系中的下室,HPASMCs置于上室,干预方式及给药同前,只改变2种细胞的位置,按照上述CCK-8法检测HPAECs活性的方法,用酶标仪在450 nm处测定HPAECs每孔的A值。
1.3.2 实时定量PCR检测HPASMCs中Survivin mRNA的表达 按Trizol试剂操作说明书提取HPASMCs中总RNA,紫外分光光度计测定RNA的浓度和纯度,取A260/A280值在1.8~2.0的标本。根据逆转录试剂盒说明书合成cDNA,并对其扩增产物行2%琼脂糖凝胶电泳,鉴定产物的长度为设计的长度,GAPDH基因为内参。实时定量PCR检测4组中Survivin mRNA的表达,Survivin正向引物:5'ACTTGGCCCAGTGGGTTTTT-3',反向引物:5'-CA GAAAGGAAAGCGCAACCG-3',产物长度为108 bp。GAPDH正向引物:5'-CACCATCTTCCAGGAGCGAG-3',反向引物:5'-AAATGAGCCCCAGCCTTCTC-3',产物长度为112 bp。PCR反应体系为20μl,其中荧光定量MIX 10μl、cDNA 1μl、正反向引物各1μl。反应条件:95℃预变性10min,95℃变性15 s,60℃退火20 s,72℃延伸30 s,共40个循环。循环完成后分析溶解曲线以确定PCR的特异性。采用2-△△Ct分析目的基因mRNA的表达量。Ct是达到荧光阈值的循环圈数,△△Ct=(Ct目的基因-Ct管家基因)实验组-(Ct目的基因-Ct管家基因)对照组。
1.3.3 W estern blot检测各组HPASMCs中Survivin蛋白的表达 细胞总蛋白的提取:收集Transwell共培养体系中下室的HPASMCs,用4℃预冷的PBS洗3遍,加入细胞裂解液裂解细胞,置于冰上20min后,于4℃、12 000 r/min离心5min,取上清液,用BCA蛋白检测试剂盒测浓度,并将所测蛋白浓度调为均一值。蛋白质变性:每组中取20μg蛋白质加在5×SDS凝胶上样缓冲液中,99℃煮沸变性10min。分离蛋白质:用10%的聚丙烯酰胺进行凝胶电泳分离蛋白质,80 V电压下电泳,当溴酚蓝从浓缩胶进入分离胶后电压改为120 V,电泳1.5 h左右。转膜及封闭:电泳后将蛋白质转移到硝酸纤维素膜上,用5%脱脂奶粉室温封闭1 h。免疫反应:一抗为兔抗人生存素单克隆抗体(1∶1 000),4℃孵育过夜后,TBST洗3次,次日室温孵育二抗山羊抗兔IgG(1∶8 000)1 h,TBST洗膜3次,化学发光显影。Survivin蛋白的相对表达量以目的蛋白条带与GAPDH蛋白条带之比表示。结果采用Quantity One软件进行灰度分析。
1.4 统计学方法
采用SPSS17.0统计软件进行数据分析。实验数据均以均数±标准差(±s)表示,多组数据比较采用单因素方差分析,组间两两比较采用SNK-q检验。P<0.05为差异具有统计学意义。
2 结果
2.1 细胞活性
N组HPASMCs与HPEACs增殖活性分别为(0.561±0.007)、(0.619±0.013),应用YM155预处理 HPASMCs后与 HPEACs共培养,结果显示HPASMCs与HPEACs增殖活性没有明显变化,分别为(0.565±0.014)、(0.626±0.014)。H组HPASMCs与HPAECs增殖活性上升(0.777±0.030)、(0.875±0.021),与N组比较差异有统计学意义(q=16.615和21.333,P<0.05)。HY组HPASMCs与HPEACs增殖活性为(0.661±0.027)、(0.723±0.025),与H组比较差异有统计学意义(q=8.923和12.667,P<0.05),见图1。
2.2 HPASMCs中Survivin mRNA的表达
常氧条件下,N组与 NY组共培养体系中HPASMCs未见Survivin mRNA的表达,缺氧条件下,H组共培养体系HPASMCs mRNA表达与N组比较升高,差异有统计学意义(q=17.95,P<0.05)。而缺氧条件下,应用YM155预处理HPASNCs与HPAECs共培养后,HPASMCs中Survivin mRNA表达量又明显下降,由H组(4 506±849)下降到(677±183),与H组比较差异有统计学意义(q=15.25,P<0.05),见附表。
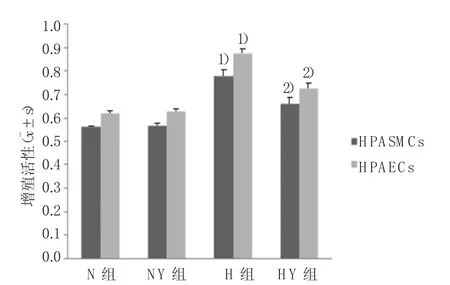
图1 各组HPASMCs和HPAECs的增殖活性
2.3 各组HPASMCs Survivin蛋白的表达
常氧条件下,N组与 NY组共培养体系中HPASMCs Survivin蛋白的表达量极低,分别为(0.017±0.001)和(0.016±0.001),经缺氧条件下共培养,H组HPASMCs Survivin蛋白的表达量上升为(0.932±0.018),与N组比较差异有统计学意义(q=91.5,P<0.05)。而应用YM155预处理HPASNCs与HPAECs共培养后,其HPASMCs中Survivin蛋白表达量下降,为(0.426±0.022),与H组比较差异有统计学意义(q=50.6,P<0.05),见附表,图2。
附表 各组HPASMCs m RNA、蛋白质的表达量 (±s)
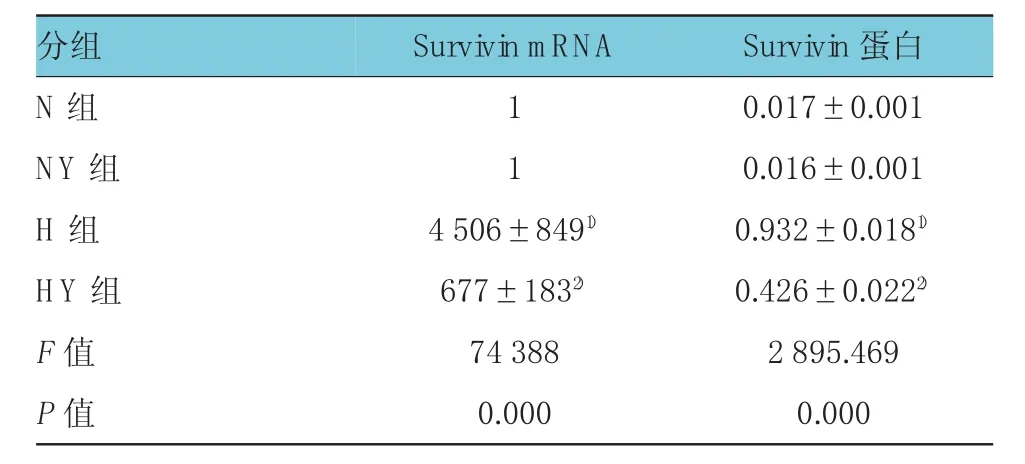
附表 各组HPASMCs m RNA、蛋白质的表达量 (±s)
注:1)与N组比较,P<0.05;2)与H组比较,P<0.05
Survivin蛋白1 0.017±0.001 1 0.016±0.001 H组 4 506±8491) 0.932±0.0181)HY组 677±1832) 0.426±0.0222)F值 74 388 2 895.469P值 0.000 0.000分组N组NY组SurvivinmRNA
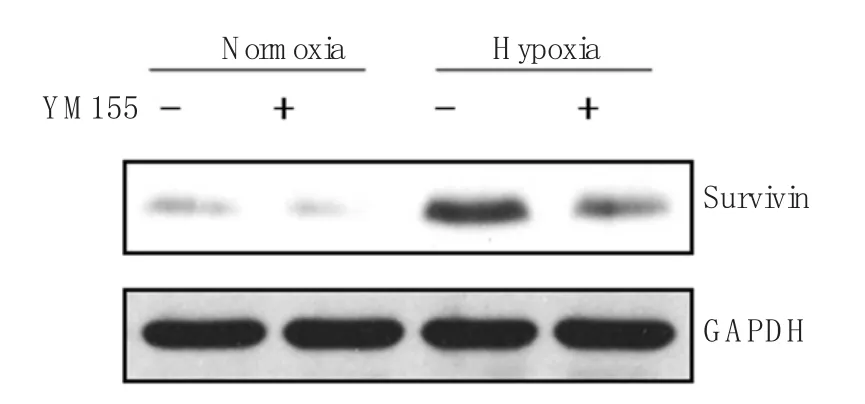
图2 各组HPASMCs Survivin蛋白的表达
3 讨论
HPH的基本病理变化是肺血管重构,引起肺血管重构的机制主要有两方面:缺氧直接作用于PASMCs,促进其增殖[2],缺氧作用于PAECs,使其释放多种细胞因子,这些因子再作用于PASMCs、PAECs和成纤维细胞,并促进其增殖[3]。有研究表明[4],缺氧可刺激PAECs合成和分泌内皮素-1(endothelin 1,ET-1)、5-羟色胺、血小板源性生长因子(platelet-derived growth factor,PDGF)和血栓素A2等因子,促进PASMCs增殖,导致肺动脉高压形成。平滑肌细胞(smooth cells,SMCs)是内皮细胞(endothelial cells,ECs)的周细胞之一,2种细胞在生长与代谢等方面存在相互作用,SMCs主要通过2种方式参与影响ECs:远距离的细胞通讯和细胞间的连接通讯[5]。但是缺氧条件下,PASMCs对PAECs是否产生影响,目前研究甚少。本实验采用Transwell小室共同培养HPASMCs和HPAECs,模拟细胞的生理状态,研究缺氧条件下,HPASMCs对HPAECs增殖的影响。本研究结果显示,Transwell共培养体系在缺氧条件下,HPASMCs和HPAECs增殖活性均升高,而应用YM155后,2种细胞的增殖活性又均下降,并进一步证明在缺氧条件下,共培养体系中的HPASMCs Survivin mRNA与蛋白的表达均高于常氧条件下的表达。这说明Survivin在缺氧共培养体系中可能起介导作用,HPASMCs通过Survivin信号通路调控HPAECs的增殖。
肺动脉血管壁主要是由ECs与SMCs构成的,2种细胞间相互作用、相互影响对维持血管生理功能和血管壁自身结构稳定起重要作用。在肺动脉高压发生发展中,2种细胞势必存在一些物质或生物信号,使其相互影响,促进肺动脉高压的进程。夏世金等[6]研究发现,低氧条件下共培养体系中PAECs经Notch1/Japped1信号通路调控PASMCs的增殖,导致缺氧性肺血管重塑。LIN等[7]研究也证实,ECs通过Notch信号通路调控SMCs表型的变化。有研究显示,PAECs分泌的 ET-1与位于PASMCs上的ET-A受体结合后[8-9],可通过激活PKC(protein kinase C,PKC)、TKs(tyrosine kinases,TKs)及Rho激酶等通路,增加细胞内的Ca2+水平[10],同时还可以诱导MAPK通路和c-fox、c-jun基因的激活,促进PASMCs异常增殖,进而促进HPH的进展。而另一方面,WEDGWOOD等[11]研究新生儿肺动脉高压,通过建立PASMCs与PAECs共培养体系,发现PAECs产生的ET-1与PASMCs上受体反应后,促使PASMCs生成活性氧类(reactive oxygen species,ROS)增多并释放至PAECs,导致PAECs中内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)的表达与活化降低,继而PAECs产生一氧化氮减少,从而促进肺血管的收缩与重构。此外,共培养体系中SMCs通过分泌血管内皮生长因子(vascular endothelial growth factor,VEGF)刺激ECs产生表型变化,包括细胞增殖、分化、迁移、基底膜细胞基质蛋白沉着,从而影响血管生成和成熟[12]。本实验表明在缺氧条件下共培养体系中HPASMCs经Survivin信号通路影响HPAECs的增殖,从而促进肺血管的重构。
Survivin是凋亡抑制蛋白(inhibitor of apoptosisproteins,IAP)家族的重要一员,具有促进细胞增殖和抑制细胞凋亡的双重功能[13]。Survivin在绝大多数肿瘤中过度表达,并且Survivin的高表达与患者的预后不良密切相关[14-15]。YM155为Survivin的小分子抑制剂,对多数肿瘤细胞组具有抗肿瘤效应[16]。笔者前期的研究表明[17],缺氧条件下单独培养的HPASMCs中可见Survivin表达,并促进HPASMCs增殖,应用YM155干预后可抑制其增殖。而本次实验采 用 Transwell小 室 共培 养 HPASMCs与HPAECs,应用 YM155预处理 HPASMCs后与HPAECs共培养,使得缺氧条件下HPASMCs和HPAECs增殖活性明显降低,表明缺氧条件下Survivin在HPASMCs和HPAECs异常增殖中起重要作用。缺氧条件下共培养体系中HPASMCs经由Survivin信号通路调控HPAECs的增殖,在HPH的发生发展中起重要作用。细胞与细胞之间存在丰富的信息交流与复杂的信号传导,彼此之间还会通过这些路径相互作用、相互影响。本研究结果为治疗HPH提供新的思路和方法。
[1]MONTANI D,CHAUMAIS M C,GUIGNABERT C,et al.Targeted therapies in pulmonary arterial hypertension[J].Pharmacol Ther,2014,141(2):172-191.
[2]WAN J,YAMAMURA A,ZIMNICKA A M,et al.Chronic hypoxia selectively enhances L- and T-type voltage-dependent Ca2+channel activity in pulmonary artery by upregulating Cav1. 2 and Cav3.2[J].Am J Physiol Lung Cell Mol Physiol,2013, 305(2):L154-L164.
[3]SWENSON E R.Hypoxic pulmonary vasoconstriction[J].High Alt Med Biol,2013,14(2):101-110.
[4]FIRTH A L,CHOI I W,PARK W S.Animal models of pulmonary hypertension:Rho kinase inhibition[J].Prog Biophys Mol Biol,2012,109(3):67-75.
[5]GAIRHE S,BAUER N N,GEBB S A,et al.Serotonin passes through myoendothelial gap junctions to promote pulmonary arterial smooth muscle cell differentiation[J].Am J Physiol Lung Cell Mol Physiol,2012,303(9):L767-L777.
[6]夏世金,汪海东,张晓丽,等.低氧条件下共培养体系中肺动脉内皮细胞经Notch1/Jagged1信号通路调控肺动脉平滑肌细胞的增殖[J].中国老年学杂志,2011,31(4):603-606.
[7]LIN C H,LILLY B.Notch signaling governs phenotypic modulation of smooth muscle cells[J].Vascul Pharmacol,2014,63(2): 88-96.
[8]SHAO D,PARK J E S,WORT S J.The role of endothelin-1 in the pathogenesis of pulmonary arterial hypertension[J].Pharmacological Research,2011,63(4):504-511.
[9]FREDENBURGH L E,MA J,PERRELLA M A.Cyclooxygenase-2 inhibition andhypoxia-induced pulmonary hypertension: effects on pulmonary vascular remodeling and contractility[J]. Trends Cardiovasc Med,2009,19(2):31-37.
[10]LUKE T,MAYLOR J,UNDEMET C,et al.Kinase-dependent activation of voltage-gated Ca2+channels by ET-1 in pulmonary arterial myocytes during chronic hypoxia[J].AJP:Lung Cellular and Molecular Physiology,2012,302(10):L1128-L1139.
[11]WEDGWOOD S,BLACK S M.Endothelin-1 decreases endothelial NOS expression and activity through ETA receptor-mediated generation of hydrogen peroxide[J].Am J Physiol Lung Cell Mol Physiol,2005,288(3):L480-L487.
[12]EVENSEN L,MICKLEM D R,BLOIS A,et al.Mural cell associated VEGF is required for organotypic vessel formation[J]. PLoS One,2009,4(6):e5798.
[13]COUMAR M S,TSAI F Y,KANWAR J R,et al.Treat cancers by targeting survivin:just a dream or future reality[J].Cancer Treat Rev,2013,39(7):802.
[14]HIRANO H,MAEDA H,YAMAGUCHI T,et al.Survivin expression in lung cancer:association with smoking,histological types and pathological stages[J].Oncol Lett,2015,10(3):1456-1462.
[15]ADAMKOV M,VYBOHOVÁ D,TUPÁ V,et al.Expression and significance of survivin in colorectal high grade and low grade adenomas[J].Acta Histochem,2015,117(6):590-594.
[16]ZHAO N,MAO Y,HAN G,et al.YM155,a survivin suppressant,triggers PARP-dependent cell death (parthanatos)and inhibits esophageal squamous-cell carcinoma xenografts in mice[J]. Oncotarget,2015,6(21):18445-18459.
[17]张帅,刘波,樊再雯,等.生存素表达对缺氧人肺动脉平滑肌细胞凋亡与增殖的影响[J].中华结核和呼吸杂志,2015,1(38):45-49.
(张蕾 编辑)
Human pulmonary arterialsmoothmuscle cells regulate proliferation of human pulmonary arterial endothelial cells via survivin signaling pathway under hypoxic condition*
Yu-weiLiu1,Zai-wen Fan2,Juan-juanWu2,ShuaiZhang1,Bo Zhang1
(1.Department of Respiratory Medicine,2.Departmentof Oncology,General Hospital of PLA Air Force,Beijing 100142,China)
ObjectiveTo investigate the effect of hypoxic human pulmonary arterial smooth muscle cells (HPASMCs)on the proliferation of human pulmonary arterialendothelial cell(HPAECs)and themechanism.MethodsA Transwell coculture system of HPASMCs and HPAECs was constructed.HPAECs were put into the upper chamber while HPASMCs were put into the lower chamber.The Transwell coculture system included the following groups∶normoxic coculture of HPASMCs and HPAECs(N group),normoxic coculture of HPASMCs pretreated withYM155(inhibitor of survivin)and HPAECs(NY group),hypoxic coculture of HPASMCs and HPAECs(H group),and hypoxic coculture of HPASMCs pretreated with YM155 and HPAECs(HY group).Cell proliferation was determined using a Cell Counting Kit-8(CCK-8).The mRNA and protein expressions of survivin in the HPASMCs were measured by qRT-PCR and Western blot respectively.ResultsThe proliferation of HPASMCs and HPAECs in the H group [(0.777±0.030)and(0.875±0.021)respectively]was significantly increased compared with that of the N group [(0.561±0.007)and(0.619±0.013),q=16.615 and 21.333,P<0.05].As compared with the H group,the proliferation of HPASMCs and HPAECs in the HY group [(0.661±0.027)and (0.723±0.025)respectively] significant decreased(q=8.923 and 12.667,P<0.05).The mRNA and protein of survivin were expressed in HPASMCs of the H group[(4506±849)and(0.932±0.018)],but not in those of the N group(0.017±0.001).As compared with the H group,the survivinmRNA and protein expressions of HPASMCs in the HY group[(677±183) and(0.426±0.022)]significant decreased(q=15.25 and 50.6,P<0.05).ConclusionsHypoxia leads to abnormal proliferation of HPASMCs and HPAECs,and under hypoxic condition HPASMCs regulate the proliferation of HPAECs via survivin signaling pathway in the coculture system.
myocyte;smoothmuscle;endothelial cell;hypoxia;survivin;coculture
R 563
A
10.3969/j.issn.1005-8982.2017.07.006
1005-8982(2017)07-0025-05
2016-07-27
国家自然科学基金(No:81170045)
樊再雯,E-mail:kzzaiwenfan@163.com
张帅现工作单位为沧州市人民医院

