不同补肾阴方药对慢性哮喘气道重构的调节作用及其作用机制研究
佟雷+孙琳林+刘金丽+高月娟
[摘要] 左歸丸、六味地黄丸均含有“三补方”的组分,均对慢性哮喘具有治疗作用。为研究3种补肾阴方剂的抗哮喘作用差异及其分子机制,以卵清白蛋白建立BALB/c小鼠慢性哮喘模型。模型动物分别灌胃给予左归丸、六味地黄丸或三补方。给药后观察抓鼻次数、打喷嚏次数;肺部病理切片测定气道平滑肌厚度、基底膜厚度、胶原沉积面积及杯状细胞数;Western blot,RT-PCR法检测肺组织MMP-9,TGF-β1,Smad2,Smad3,Smad7的表达。结果显示左归丸组抓鼻次数、打喷嚏次数显著低于三补方组,气道重构抑制程度显著高于三补方组;六味地黄丸组抓鼻次数、打喷嚏次数显著低于三补方组,胶原沉积面积及杯状细胞数显著低于三补方组。4种气道重构相关因子中,左归丸组MMP-9,TGF-β1,Smad2,Smad3显著低于三补方组,Smad7显著高于三补方组。六味地黄丸组Smad7显著高于三补方组,MMP-9与模型组及三补方组均无显著差异。提示3种补肾阴药方抗哮喘作用存在显著差异,左归丸对MMP-9的调节作用及六味地黄丸对Smad7的调节作用可能与3种组方对气道重构抑制作用的差异有关。
[关键词] 左归丸; 六味地黄丸; 哮喘;气道重构
Antiasthmatic effects of different tonifying kidney-Yin formulas and
their effects on airway remodeling in chronic asthma
TONG Lei1, SUN Lin-lin2, LIU Jin-li2, GAO Yue-juan2*
(1. Mudanjiang Medical University, Mudanjiang 157011, China;
2. Hongqi Hospital, Mudanjiang Medical University, Mudanjiang 157011, China)
[Abstract] Both of Zuogui Wan(ZGW) and Liuwei Dihuang Wan(LWDHW) contain ingredients of Sanbufang(SBF), which have been proven to have antiasthmatic effects. In order to study the antiasthmatic effects of the three tonifying kidney-Yin formulas and their mechanisms, BALB/c mice were randomly divided into 5 groups. Chronic asthma was induced by ovalbumin. Mice in treated groups were respectively given 49.0 g·kg-1ZGW, 35.0 g·kg-1LWDHW and 22.4 g·kg-1SBF by gavage. Those in normal and model group were given normal saline. After treatment, sneeze and nose scratching times of mice were observed. Histological lung sections were prepared to determine the basement membrane thickness(BMT), smooth muscle thickness(SMT), collagen area(CA) and numbers of goblet cells(GCN). Western blotting and RT-PCR were used to determine the expression levels of MMP-9, TGF-β1, Smad2, Smad3 and Smad7. The results showed that sneeze and nose scratching times of ZGW group were significantly lower than those of SBF group. Its inhibition degree on airway remodeling was significantly higher than SBF group. Sneeze and nose scratching times of LWDHW group were significantly lower than SBF group. Its CA and GCN were significantly lower than SBF group. Regarding the four airway remodeling related factors, MMP-9, TGF-β1, Smad2 and Smad3 of ZGW group were significantly lower than those of SBF group, and its Smad7 was significantly higher than SBF. Smad7 of LWDHW group was significantly higher than SBF. There was no significant difference in MMP-9 between model group and SBF group. The results indicate that there are significant differences in the antiasthma effect of these tonifying kidney-Yin formulas. The regulatory effects of ZGW and LWDHW on MMP-9 and Smad7 may be correlated with the differences in the inhibitory effect of airway remodeling of the three formulas.
[Key Words] Zuogui Wan; Liuwei Dihuang Wan; asthma; airway remodeling
哮喘是由遗传因素及环境因素诱发的肺部炎症反应。在全球各年龄段人群中,其患病人数多达3亿人,以儿童和老年人为主。我国儿童哮喘发病率约为2.38% [1]。早期认为炎症、支气管平滑肌痉挛是哮喘的主要病因,因此临床常用抗毒蕈碱药物、白三烯抑制剂及皮质类固醇药物进行治疗。化学药物对缓解哮喘急性发作具有显著优势,但不宜长期服用。近年来研究表明,气道重构是哮喘的主要病因,也是其易于反复发作的原因之一[2]。
中医学理论认为,哮喘与先天肾脏亏虚及后天肺脏虚损有关。因此补肾法是中医治疗哮喘的常用方法之一[3]。六味地黄丸是常用补肾方剂,已在临床用于哮喘的治疗。其上调肺组织IFN-γ mRNA的作用与布地奈德无显著差异[4]。左归丸出自《景岳全书》,由明代张景岳从六味地黄丸组方中保留“三补”组方,加入补肾阴及补阳益阴中药而得,是我国沈自尹院士治疗哮喘的常用方药之一。
然而,国内外关于左归丸、六味地黄丸的抗哮喘作用机制研究尚少,对不同补肾方剂抗哮喘作用的比较研究也鲜有报道。鉴于左归丸、六味地黄丸及六味地黄丸中的“三补”方具有共同的组方成分,且均为补肾阴方药,本研究对3种补肾阴方药对哮喘模型动物气道重构及相关因子的调节作用进行了比较研究,以期了解其抗哮喘作用差异及其作用机制差异。
1 材料
1.1 药物 左归丸(熟地黄-菟丝子-牛膝-龟板胶-鹿角胶-山药-山茱萸-枸杞子8∶4∶3∶4∶4∶4∶4∶4)及三补方(熟地黄-山药-山茱萸2∶1∶1)药材饮片购自同仁堂药店牡丹江店,加水煎煮3次,合并煎液,左归丸浓缩成含生药6.3 g·mL-1,三补方浓缩成含生药2.8 g·mL-1。六味地黄颗粒(江阴天江药业有限公司,批号1505029;组方:熟地黄-山药-制山茱萸-茯苓-泽泻-牡丹皮8∶4∶4∶3∶3∶3)。
1.2 动物 SPF级雌性BALB/c小鼠,6~8周龄,体重20~25 g,购自北京维通利华实验动物技术有限公司,许可证号SCXK(京)2012-0001。实验动物购入后,检疫7 d,12 h/12 h明暗循环,自由摄食摄水,饲料为灭菌小鼠饲料(北京华阜康生物科技股份有限公司,批号201510220921),饮用水为灭菌水。实验方案经本单位实验动物伦理委员会批准,动物饲养及实验操作均符合实验动物伦理要求。
1.3 试剂 RIPA 裂解液(北京雷根生物技术有限公司);增强化学发光溶液(美国Sigma-Aldrich);卵清白蛋白(Ovalbumin,OVA,美国Sigma-Aldrich公司);无RNA 酶的DNA酶(美国Promega公司);抗小鼠MMP-9,TGF-β1,Smad2,Smad3,Smad7抗体均购自美国Sigma-Aldrich公司。
1.4 仪器 全身式吸入暴露箱(美国NatureGene Corp);QA40超声波喷雾器(美国Qsonica Misonix公司);RM2145病理切片机(德国 LEICA 公司);N-180M双目生物显微镜(宁波永新光学股份有限公司);CMIAS多功能彩色病理图象分析系统(北京航空航天大学图像中心);DY89-1电动玻璃匀浆机(宁波新芝生物科技股份有限公司);ZF-258凝胶成像分析系统(上海嘉鹏科技有限公司)。
2 方法
2.1 造模及给药方案 按随机数字表法将小鼠随机分为5组,每组12只,苦味酸标记编号。参考文献方法采用OVA建立慢性哮喘模型[5],略作修改。分别于第0,7天腹腔注射50 μg OVA,1 mg Al(OH)3(混悬于0.2 mL磷酸盐缓冲液)致敏。将OVA混悬于磷酸盐缓冲液,质量浓度为25 g·L-1,通过超声波雾化器制备OVA气溶胶,微粒直径0.5~20 μm。第12,15,19,22,26,29天将小鼠置于全身式吸入暴露箱,以0.5 cm3·min-1速度通入气溶胶,共通入30 min,使箱內OVA浓度接近3 mg·m-3进行激发。正常组小鼠以磷酸盐缓冲液代替OVA。
第29天开始(激发后),各组动物给药如下:正常组及模型组小鼠灌胃给予生理盐水;左归丸组小鼠灌胃给予左归丸提取液,按生药计算剂量为49.0 g·kg-1;六味地黄丸组灌胃给予六味地黄颗粒水混悬液,按生药计算剂量为35.0 g·kg-1;三补方组灌胃给予三补方提取液,按生药计算剂量为22.4 g·kg-1;各组动物每日给药1次,连续给药14 d。按左归丸、六味地黄丸、三补方组方计算,各组动物熟地黄、山药、山茱萸给药剂量相等。
2.2 小鼠行为学观察 造模过程中对各组小鼠进行行为学观察,观察内容包括毛色光洁程度、呼吸频率、抓鼻次数、打喷嚏次数等。末次给药后24 h内(早9~10时、午13~14时、晚17~18时),对各组小鼠抓鼻次数和打喷嚏次数进行计数。
2.3 小鼠肺组织病理学观察 末次给药后24 h,每组小鼠随机选取6只,3%戊巴比妥钠麻醉处死,开胸腔,取右侧肺叶,10%中性甲醛固定,石蜡包埋,乙醇梯度脱水,切4 μm薄片,每隔6张取1张切片,分别进行苏木精-伊红(hematoxylin and eosin,HE)、阿辛蓝过碘酸雪夫氏染色(Alcian blue-periodic acid-schiff stain,AB-PAS)和Masson染色[6]。数字编码后由病理技术人员盲法阅片,200倍光镜下观察小鼠气道显微结构:道杯状细胞增生及胶原沉积情况。气道平滑肌厚度、基底膜厚度测定中每个气道取5个观察点。杯状细胞计数时,以每500个细胞中的杯状细胞个数表示(n/500)。胶原沉积面积以气道上皮基底膜上的胶原沉积面积(μm2)/气道上皮长度(μm)表示。
2.4 Western blot检测 参考文献方法[7],采用 Western blot法测定小鼠肺组织气道重构相关蛋白MMP-9,TGF-β1及Smad2,Smad3,Smad7的蛋白含量。末次给药后24 h,每组剩余小鼠取左侧肺叶,剪碎,加入RIPA 裂解液(含50 mmol·L-1Tris-HCl,150 mmol·L-1NaCl,1%NP-40,0.1%十二烷基硫酸钠),冰上溶胀10 min,4 ℃下15 000 r·min-1离心15 min。上清液上10%SDS-PAGE凝胶电泳,转至硝酸纤维素膜,PBST(磷酸盐缓冲液含0.1%吐温20)洗膜,脱脂奶粉封闭(5%脱脂乳-磷酸盐缓冲液溶液)1 h,PBST洗膜后分别加入抗小鼠MMP-9(1∶1 000),TGF-β1(1∶1 000),Smad2(1∶1 000),Smad3(1∶2 000),Smad7(1∶1 000)抗体孵育1 h。再次PBST洗膜后加入辣根过氧化物酶标记的羊抗小鼠IgG(1∶1 000)孵育1 h。GPADH作为内参。增强化学发光溶液显色,采用凝胶成像分析系统进行分析。
2.5 RT-PCR检测 参考文献方法[8] ,采用RT-PCR法测定小鼠肺组织气道重构相关MMP-9,TGF-β1及Smad2,Smad3,Smad7 mRNA的表达,末次给药后24 h,每组剩余小鼠取右侧肺叶,Trizol试剂提取总RNA,采用无RNA酶的DNA酶处理RNA样品以除去污染的DNA。cDNA扩增引物包括:MMP-9上游引物5′-GGAGACCTGAGAACCAATCTC-3′,下游引物5′-TCCAATAGGTGATGTCGT-3′,277 bp;TGF-β1上游引物5′-ACCTGCAAGACCATCGACAT-3′,下游引物5′-GGTTTTCTCATAGATGGCGT-3′,279 bp;Smad2上游引物5′-GCCACATGTTATATATTGCC-3′,下游引物5′-TTACACACTGTTGCAGGGT-3′,220 bp;Smad3上游引物5′-GGGCTCCCTCATGTCATCTA-3′,下游引物5′-GGCTCGCAGTAGGTAACTGG-3′,176 bp;Smad7上游引物5′-CTCCTGCTGTGCAAATGTTTC-3′,下游引物5′-CAGGCTCCAGAAGAAGTTGG-3′,207 bp;GAPDH上游引物 5′-CCCATCTATGAGGGTTACGC-3′,下游引物 5′-TTTAATGTCACGCACGATTTC-3′,150 bp。94 ℃变性3 min,然后94 ℃变性3 s,60 ℃引物退火30 s,72 ℃延伸1 min(35个循环),最后72 ℃延伸10 min。2-ΔΔCt法定量分析。
2.6 统计学分析 数据以±s表示,采用SPSS 17.0进行分析。组间比较采用t检验。P<0.05为显著差异,P<0.01为极显著差异。
3 结果
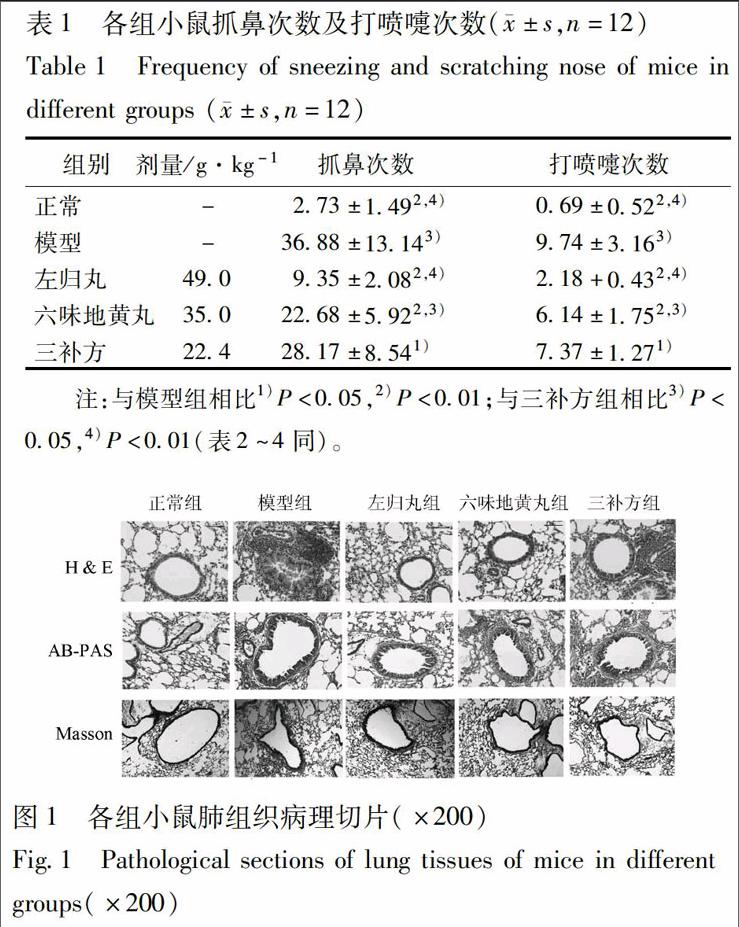
3.1 行为学评价 除正常组小鼠外,其余各组小鼠OVA激发后表现出明显的症状,包括呼吸急促、趴卧、鼻痒抓鼻、打喷嚏、竖毛、点头呼吸等。分别于激发结束后首次给药前及末次给药结束24 h,计数各组小鼠在早中晚3个时间段共3 h内的鼻痒抓鼻次数和打喷嚏次数,见表1。模型组及给药组抓鼻次数、打喷嚏次数均极显著高于正常组(P<0.01)。左归丸组小鼠抓鼻次数、打喷嚏次数极显著低于模型组和三补方组(P<0.01);六味地黄丸组抓鼻次数、打喷嚏次数极显著低于模型组(P<0.01),显著低于三补方组(P<0.05)。
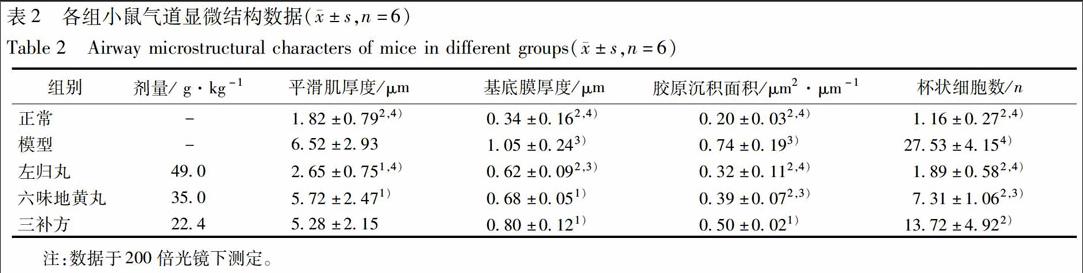
3.2 肺组织病理学观察 分别采用3种染色方法对小鼠肺组织切片进行染色,以观察小鼠气道病理改变。与正常组小鼠相比,模型组小鼠肺组织病理切片中支气管及血管周围炎性细胞数量显著增多,黏液分泌增多,并存在基底膜增厚、平滑肌增厚和胶原沉积现象。各组小鼠典型的肺组织病理切片见图1。
比较各组动物肺组织平滑肌厚度、基底膜厚度、胶原沉淀面积及杯状细胞数。与正常组比较,模型组小鼠平滑肌厚度、基底膜厚度、胶原沉淀面积及杯狀细胞数均显著升高(P<0.01)。左归丸组基底膜厚度、胶原沉淀面积和杯状细胞个数均显著高于正常组(P<0.05),低于模型组(P<0.01)和三补方组(P<0.05或P<0.01),平滑肌厚度显著低于三补方组(P<0.01),与正常组无显著差异。六味地黄组平滑肌厚度、基底膜厚与三补方组无显著差异,但胶原沉淀面积和杯状细胞数均显著低于三补方组(P<0.05),见表2。
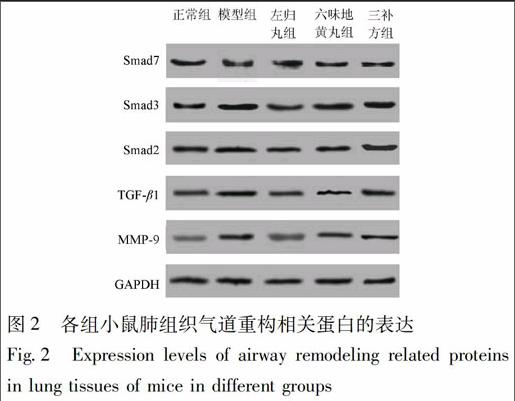
3.3 Western blot检测 左归丸组小鼠肺组织中TGF-β1,Smad2,Smad3表达量极显著高于正常组(P<0.01),极显著低于模型组(P<0.01);其中TGF-β1,Smad2表达量显著低于三补方组(P<0.05),Smad3表达量极显著低于三补方组(P<0.01)。该组小鼠MMP-9表达量显著高于正常组(P<0.05),极显著低于模型组和三补方组(P<0.01)。其Smad7表达量显著低于正常组(P<0.05),极显著高于模型组和三补方组(P<0.01)。
六味地黄丸组小鼠肺组织中TGF-β1,Smad2表达量极显著高于正常组(P<0.01),显著低于模型组(P<0.05),与三补方组无显著差异。该组小鼠MMP-9表达量极显著高于正常组(P<0.01),与模型组和三补方组无显著其差异。Smad7表达量极显著低于正常组(P<0.01),极显著高于模型组(P<0.01),显著高于三补方组(P<0.05)。结果见图2、表3。
3.4 RT-PCR检测 在MMP-9 mRNA方面,左归丸组表达水平显著高于正常组(P<0.05),显著低于模型组(P<0.05),极显著低于三补方组(P<0.01);六味地黄丸组表达水平极显著高于正常组(P<0.01),与模型组和三补方组无显著差异。
在Smad7 mRNA方面,左归丸组表达水平显著低于正常组(P<0.05),极显著高于模型组(P<0.01)和三补方组(P<0.01);六味地黄丸组表达水平极显著低于正常组(P<0.01),极显著高于模型组(P<0.01),显著高于三补方组(P<0.05)。
在TGF-β1 mRNA和Smad2 mRNA方面,左归丸组表达水平极显著高于正常组(P<0.01),极显著低于模型组(P<0.01),显著低于三补方组(P<0.05);六味地黄丸组表达水平极显著高于正常组(P<0.01),显著高于模型组(P<0.05),与三补方组无显著差异;三补方组显著低于模型组(P<0.05)。
在Smad3 mRNA方面,左归丸组表达水平极显著高于正常组(P<0.01),极显著低于模型组和三补方组(P<0.01);六味地黄丸组表达水平极显著高于正常组(P<0.01),显著高于模型组(P<0.05),与三补方组无显著差异;三补方组与模型组无显著差异。结果见图3、表4。
4 讨论
哮喘是一种以气道高反应和可逆性气道阻塞为特征的慢性气道炎症性疾病。气道炎症、组织损伤及随后的异常修复会导致哮喘患者气道壁的结构变化,包括平滑肌增厚、基底膜增厚、胶原沉积、杯状细胞增多等,统称为气道重构。已有大量证据显示,气道重构是导致肺部不可逆或部分可逆性气流阻塞,以及哮喘致死的主要原因[9]。
目前关于气道重构具体机制尚不清楚。其中可能的机制之一被认为是细胞外基质产生与胶原降解失衡所致。基质金属蛋白酶-9(matrix metalloproteinase-9,MMP-9)在控制胶原降解及组织修复中发挥着重要作用[10]。
而转化生长因子β1(transforming growth factor beta1,TGF-β1)则被证明与气道重构相关的大多数细胞生物学过程相关[11],包括促进平滑肌和杯状细胞增生,促进气道胶原沉积和基底膜增厚等[12]。TGF-β1主要通过对Smad(mothers against decapentaplegic homology)蛋白对气道重构的影响,包括Smad2,Smad3,Smad7等。其中Smad2,Smad3与气道重构正相关,Smad7与气道重构负相关[13]。
左归丸演化自六味地黄丸,具有补而不泄,阳中求阴的特点,与六味地黄丸含有同等比例的熟地黄、山药、山茱萸(三补方)。该研究比较了3种补肾阴药方对慢性哮喘小鼠的抗哮喘作用及其对小鼠哮喘模型气道重构的影响。六味地黄颗粒具有抑制哮喘动物模型气道基底膜增厚的作用,与文献报道一致[4]。
通过对比研究表明,左归丸对小鼠哮喘的抑制作用以及对气道显微结构和气道重构相关因子TGF-β1,Smad2,Smad3,Smad7的调节作用均优于六味地黄丸(P<0.05或P<0.01)。其中左归丸对MMP-9具有下调作用,而六味地黄丸组及三补方组MMP-9表达水平与模型组无显著差异。六味地黄丸对小鼠哮喘的抑制作用显著优于三补方(P<0.05),对气道胶原沉积及杯状细胞增生的抑制作用也优于三补方(P<0.05),但二者对MMP-9及TGF-β1表達的抑制作用无显著差异。
从3种药方的组方构成分析,左归丸药方中加入的补肾阴中药可能是导致其对哮喘抑制作用优于六味地黄丸和三补方的原因,其中枸杞已被证明对哮喘具有治疗作用[12]。说明补肾阴药物的加入有利于增强中药复方的抗哮喘作用。六味地黄丸与三补方相比存在三泻成分(茯苓、泽泻、丹皮),具有补而不腻的功效,其中茯苓已在临床用于哮喘的治疗[12]。通过与三补方的药效对比可见,三泻成分对三补成分的抗哮喘作用无显著降低作用。
结合作用机制分析,左归丸对哮喘小鼠气道MMP-9表达的显著下调作用,可能与其加入的补肾阴药物有关。而六味地黄丸三泻成分的加入,可能是其对Smad7下调作用低于三补方(P<0.05)及对胶原沉积和杯状细胞增生抑制作用高于三补方(P<0.05)的原因。已有文献报道,Smad7与气道黏液分泌增多及细胞外基质沉积有关[13]。但由于中药多为复方,其中化学成分较为复杂。因此尚需对3种组方进行拆方研究,以进一步明确各种组方成分对药效及作用机制的贡献。另外,通过上述研究可以发现,补肾阴方抗哮喘作用机制复杂,涉及多种相关蛋白表达,因此有必要采用现代分子生物学手段,在分子水平上对补肾阴方药的配伍规律进行更为细致的研究,研发抗哮喘作用强、成分明确、作用机制清楚的安全有效的中药新药。
[参考文献]
[1] 全国儿科哮喘协作组.第三次中国城市儿童哮喘流行病学调查[J].中华儿科杂志, 2013,51(10):727.
[2] Gagliardo R, Chanez P, Gjomarkaj M, et al. The role of transforming growth factor-β1 in airway inflammation of childhood asthma[J]. Int J Immunopathol Pharmacol, 2013, 26(3):725.
[3] 张雄飞,黄娟萍,李碧云,等.中药治疗哮喘作用机制的研究进展[J].中国实验方剂学杂志,2013, 19(15):344.
[4] 王力宁,王英,黄小琪,等.六味地黄颗粒对哮喘大鼠气道炎症的抑制作用及对肺组织干扰素-γ信使RNA表达的影响[J].中国实验方剂学杂志,2010,16(10): 108.
[5] Stumm C L, Halcsik E, Landgraf R G, et al. Lung remodeling in a mouse model of asthma involves a balance between TGF-β1 and BMP-7[J]. PLoS ONE, 2014, 9(4): e95959.
[6] Wei M, Chu X, Guan M, et al. Protocatechuic acid suppresses ovalbumin-induced airway inflammation in a mouse allergic asthma model[J]. Int Immunopharmacol, 2013, 15(4): 780.
[7] Sun Z M, Li F F, Qian P, et al. Changes in transforming growth factor (TGF)-β and mothers against decapentaplegic homolog (Smad) expression in chronic asthmatic rats induced by ovalbumin and aluminum hydroxide[J]. Afr J Biotechnol, 2012, 11(29): 7528.
[8] Kim D Y, Kwon E Y, Hong G U, et al. Cigarette smoke exacerbates mouse allergic asthma through Smad proteins expressed in mast cells[J]. Respir Res, 2011, 12(1): 49.
[9] Shifren A, Witt C, Christie C, et al. Mechanisms of remodeling in asthmatic airways[J]. J Allergy (Cairo), 2012, 2012 (2012): 316049.
[10] Farhat A A,Mohamad A S,Shareef M M,et al. Asthma remodeling: the pathogenic role of matrix metalloproteinase-9[J]. Egy J Chest Dis Tubercul, 2014, 63(4): 755.
[11] Halwani R, Al-Muhsen S, Al-Jahdali H, et al. Role of transforming growth factor-β in airway remodeling in asthma[J]. Am J Respir Cell Mol Biol, 2011, 44(2): 127.
[12] 陳静,赵文娟,李玉卿,等.TGF -β1、MMP- 9 在哮喘大鼠气道重建模型中的表达及丹参的干预作用[J].世界中医药,2016,11(3):479.
[13] Shen Z J, Braun R K, Hu J, et al. Pin1 protein regulates Smad protein signaling and pulmonary fibrosis[J]. J Biol Chem, 2012, 287(28): 23294.
[14] 谢文康.茯苓枸杞子加味汤治疗哮喘举隅[J].实用中医药杂志,2009, 25(11):769.
[15] Luo X L, Ding Q R, Wang M, et al. In vivo disruption of TGF-β signaling by Smad7 in airway epithelium alleviates allergic asthma but aggravates lung carcinogenesis in mouse[J]. PLoS ONE, 2010, 5(4): e10149.
[责任编辑 张宁宁]

