糖基化交联反应对酪蛋白胶凝和乳化性质的影响
宋春丽,陈佳鹏,任 健
(齐齐哈尔大学 农产品加工黑龙江省普通高校重点实验室,黑龙江 齐齐哈尔161006)
油料蛋白
糖基化交联反应对酪蛋白胶凝和乳化性质的影响
宋春丽,陈佳鹏,任 健
(齐齐哈尔大学 农产品加工黑龙江省普通高校重点实验室,黑龙江 齐齐哈尔161006)
利用转谷氨酰胺酶催化酪蛋白与壳寡糖发生糖基化交联反应,控制反应时间 (1、2 h和4 h) 制备3种糖基化交联蛋白质(修饰酪蛋白),分析糖基化交联反应对酪蛋白胶凝和乳化性质的影响。结果表明:修饰酪蛋白的凝胶时间显著缩短(约50%);凝胶的持水能力为99%(800 r/min条件下离心10 min),较高;凝胶的微观结构发生了显著的变化,而且随着反应时间的延长,凝胶的空间网络结构更加规则;糖基化交联反应对酪蛋白的乳化活性及乳化稳定性影响较大。
酪蛋白;糖基化;胶凝性质;乳化性质;转谷氨酰胺酶
利用转谷氨酰胺酶(E.C. 2.3.2.13,TGase)能够催化蛋白质分子内/间发生交联作用[1],制备交联蛋白质,改善蛋白质的功能性质,相关应用相当广泛[2]。目前,利用该酶催化蛋白质分子中的谷氨酰胺残基与伯胺类物质发生反应特性,将具有伯胺基团的糖分子导入到蛋白质分子中[1],制备糖基化交联蛋白质,是一种新型的蛋白质糖基化交联修饰技术。其相关的研究很少,主要集中在蛋白质与氨基葡萄糖的糖基化制备及功能性质的研究上[3-5]。壳寡糖是壳聚糖通过水解多聚链制得的低相对分子质量糖,它的基本单位是D-氨基葡萄糖,单糖之间以β-(1,4)糖苷键连接[6],具有较好的溶解性。相对于氨基葡萄糖,壳寡糖具有更多的亲水性羟基,更大的分子体积,理论上该糖基对蛋白质的功能性质会具有显著的影响,然而目前对酪蛋白的壳寡糖糖基化交联修饰,尤其是不同催化时间产物的胶凝和乳化性质的研究未见报道。
本研究以酪蛋白及亲水性的壳寡糖为底物,通过TGase催化蛋白质与壳寡糖反应,制备糖基化交联蛋白质,采用流变学方法分析不同反应时间对所制得的糖基化交联蛋白质(修饰酪蛋白)的胶凝性质(凝胶点及模量变化)、凝胶微观结构及乳化性质的影响,为酶法糖基化制备功能性配料提供理论依据和技术支持。
1 材料与方法
1.1 实验材料
酪蛋白:购于Sigma公司;TGase:江苏一鸣精细化工有限公司;壳寡糖(相对分子质量为1 kDa):浙江金壳生物化学有限公司;其他试剂均为分析纯。
Kinexus pro+型高级旋转流变仪,英国马尔文公司;TDZ5-WS型离心机,湘仪离心机仪器有限公司;S-3400型扫描电子显微镜,日本日立公司。
1.2 实验方法
1.2.1 糖基化交联酪蛋白的制备
酪蛋白质量浓度为50 g/L,壳寡糖浓度为150 mmol/L(壳寡糖添加量是酪蛋白中酰基供体摩尔数的3倍),TGase添加量为10 U/g,pH为7.5、37℃恒温振荡,反应时间分别为1、2 h和4 h,随后85℃灭酶5 min,冷却,酸沉、水洗去除未反应的壳寡糖,将沉淀溶解并调节pH 至7.0,冻干备用。
1.2.2 流变性质分析
配制40 g/L的蛋白质分散液(pH 7.0),加入葡萄糖酸内酯(GDL),加入量为20%(以蛋白质质量计),于25℃搅拌2 min后,用流变仪测定蛋白质酸凝胶形成过程中的动态流变性质,夹具为PP 60,25℃保温5 min,应变值为0.1%。测定在线性黏弹区内,样品在0~4.5 h内的弹性模量(G′)随时间的变化。凝胶点定义为G′ ≥1 Pa时对应的时间[7]。
1.2.3 凝胶持水能力和容重的测定
配制40 g/L的蛋白质分散液(pH 7.0),充填至干燥且称重的同一规格离心管中,加入葡萄糖酸内酯(GDL),加入量为20%(以蛋白质质量计),于25℃水浴形成凝胶,取出4℃保存,次日称量其质量,800 r/min离心10 min,排净水分,称量离心管总质量。凝胶的持水能力(WHC,%)由下式计算:
式中:W0为空离心管的质量,g;W1为凝胶后样品加离心管质量,g;W2为离心后样品加离心管质量,g。
配制40g/L的蛋白质分散液(pH7.0),充填至同一规格的烧杯中,加入葡萄糖酸内酯(GDL),加入量为20%(以蛋白质质量计),于25℃水浴形成凝胶,取出4℃保存,次日称量其质量以及测定凝胶高度,容重(ρ,g/cm3)按下式计算:
式中:m为凝胶质量,g;d为凝胶直径,cm;h为凝胶高度,cm。
1.2.4 凝胶微观结构观察
凝胶微观结构的观察采用Haga等[8]的方法。首先按照1.2.3的方法制备凝胶,挑取中心凝块,用戊二醛溶液固定1h(2.5%,4℃),随后用磷酸缓冲液(pH6.8)冲洗两次,每次10min;然后捶击使之自然断裂。分别用50%、70%和90%乙醇溶液进行梯度洗脱,每次洗脱15min,然后用无水乙醇洗脱(3次,每次15min);用1∶1的无水乙醇-叔丁醇的混合溶液及叔丁醇分别置换15min;将样品冷冻抽干。利用扫描电子显微镜观察所处理的凝胶微观结构,样品放大倍数为10 000倍。
1.2.5 乳化活性及乳化稳定性的测定
参照Pearce等[9]的方法,采用比浊法测定酪蛋白及其修饰产物的乳化活性及乳化稳定性。
2 结果与讨论
2.1 时间扫描分析
利用流变学方法观察溶胶-凝胶转变过程中的凝胶点与最终弹性模量的变化。主要对在线性黏弹区内,监测酪蛋白及其修饰产物的分散液在酸化过程中G′随时间的变化,结果如图1所示。

注:a、b、c和d分别为酪蛋白、1h修饰酪蛋白、2h修饰酪蛋白和4h修饰酪蛋白,下同。
图1 酪蛋白及其修饰产物分散液酸化过程的时间扫描曲线
从图1可以看出,在时间扫描分析的前期,酪蛋白分散液的弹性模量(G′)几乎没有发生变化,而酸化到一定时间后,G′均出现骤然增加的现象。依据G′≥1Pa时对应的时间为凝胶点这一理论[7],相对于酪蛋白,糖基化交联酪蛋白分散液的凝胶时间显著缩短,约为酪蛋白的50%。转谷氨酰胺酶催化的蛋白质糖基化交联反应会很大程度上缩短凝胶时间。糖基的导入,有利于氢键的形成,进而会缩短凝胶时间[10]。此外可以看出,在测试终点(4.5h)时,酪蛋白修饰产物对应的G′都接近于或者高于酪蛋白,较高的弹性模量(G′)表明,酪蛋白修饰产物具有黏弹性固体的性质。结果表明,糖基化交联反应对凝胶的流变特性影响较大。
2.2 凝胶持水能力及容重变化
酪蛋白及其修饰产物酸凝胶的持水能力及容重测定结果如图2所示。
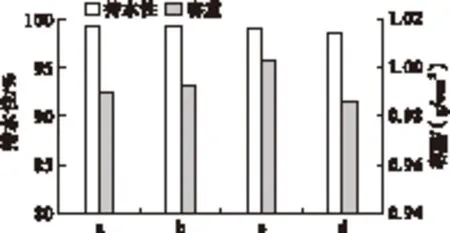
图2 酪蛋白及其修饰产物酸凝胶的持水能力及
从图2可以看出,与酪蛋白相比,其修饰产物的酸凝胶的持水能力约为99%,并没有发生显著的变化,表明在低离心力(800r/min)的情况下,酪蛋白及其修饰产物都具有较好的持水能力。这表明在低离心力下,酪蛋白凝胶结构比较稳定,不易被坏破,凝胶中束缚的水不易游离出来。此外,从容重的数据可以看出,随着反应的进行,糖基化交联酪蛋白的容重发生了变化,这一定程度上表明凝胶的网络结构存在差异。
2.3 凝胶微观结构
利用扫描电子显微镜观察分析凝胶的微观结构,进一步分析酪蛋白及其修饰产物酸凝胶的性质。酪蛋白及其修饰产物所制凝胶的微观结构分析结果如图3所示。


图3 酪蛋白及其修饰产物凝胶的扫描电子显微镜图
从图3可以看出,相对于酪蛋白,酪蛋白修饰产物所制酸凝胶的微结构发生了变化。在反应的初期(1 h修饰酪蛋白),酪蛋白凝胶的粒子相互交联的程度不明显,没有建立起明显的空间网络结构,形成了不规则的粗链。随着反应的进行,这种交联作用逐渐增强,凝胶粒子结构伸展,而且结构更加规则,最终使酪蛋白酸凝胶的空间网络结构更加规则(2 h修饰酪蛋白和4 h修饰酪蛋白)。转谷氨酰胺酶催化酪蛋白分子发生的交联作用对形成规则的网络结构贡献较大[11-12]。可见糖基化交联反应能够显著改变酪蛋白凝胶的网络结构。
2.4 乳化活性和乳化稳定性
酪蛋白及其修饰产物的乳化活性及乳化稳定性分析结果如图4所示。

图4 酪蛋白及其修饰产物的乳化活性及乳化稳定性
从图4可以看出,与酪蛋白相比,修饰酪蛋白的乳化活性从47.5 m2/g下降到34.1~39.6 m2/g,乳化稳定性从92.6%下降到60.6%~83.3%。结果表明,3种修饰酪蛋白的乳化活性和乳化稳定性均下降,但是程度不同。转谷氨酰胺酶催化的β-酪蛋白的交联修饰作用降低了酪蛋白的乳化活性和乳化稳定性[13]。转谷氨酰胺酶催化的糖基化交联反应,在糖基导入到蛋白质的同时会发生蛋白质的交联。可见糖基化交联反应对修饰酪蛋白的乳化性影响较大。
3 结 论
本文研究了转谷氨酰胺酶催化的壳寡糖糖基化交联反应对酪蛋白的胶凝和乳化性质的影响。该反应显著缩短了凝胶时间(约50%),改变了凝胶内部的网络结构,凝胶的持水能力较高。同时,该反应对酪蛋白的乳化性质影响较大。
[1] DEJONG G, KOPPELMAN S. Transglutaminase catalyzed reactions: impact on food applications[J]. J Food Sci, 2002, 67(8): 2798-2806.
[2] GASPAR A L, DE GES-FAVONI S P. Action of microbial transglutaminase (MTGase) in the modification of food proteins: a review[J]. Food Chem, 2015, 171: 315-322.
[3] JIANG S J, ZHAO X H. Transglutaminase-induced cross-linking and glucosamine conjugation in soybean protein isolates and its impacts on some functional properties of the products [J]. Eur Food Res Technol, 2010, 231(5): 679-689.
[4] 周利敏, 刘晓兰, 刘玥, 等. TGase催化玉米醇溶蛋白糖基化改性[J]. 食品科学, 2014, 35(24): 15-19.
[5] HONG P K, NDAGIJIMANA M, BETTI M. Glucosamine-induced glycation of hydrolysed meat proteins in the presence or absence of transglutaminase: chemical modifications
and taste-enhancing activity[J]. Food Chem, 2016, 197: 1143-1152.
[6] 蒋挺大. 壳聚糖[M]. 北京: 化学工业出版社, 2001.
[7] ERCILI-CURA D, LILLE M, LEGLAND D, et al. Structural mechanisms leading to improved water retention in acid milk gels by use of transglutaminase[J]. Food Hydrocoll, 2013, 30(1): 419-427.
[8] HAGA S, OHASHI T. Heat-induced gelation of a mixture of myosin B and soybean protein[J]. Agric Biol Chem, 1984, 48(4): 1001-1007.
[9] PEARCE K N, KINSELLA J E. Emulsifying properties of proteins: evaluation of a turbidimetric technique[J]. J Agric Food Chem, 1978, 26(3): 716-723.
[10] SONG C L, ZHAO X H. Rheological, gelling and emulsifying properties of a glycosylated and cross-linked caseinate generated by transglutaminase[J]. Int J Food Sci Technol, 2013, 48(12): 2595-2602.
[11] SCHORSCH C, CARRIE H, NORTON I T. Cross-linking casein micelles by a microbial transglutaminase: influence of cross-links in acid-induced gelation[J]. Int Dairy J, 2000, 10(8): 529-539.
[12] FAERGEMAND M, QVIST K B. Transglutaminase: effect on rheological properties, microstructure and permeability of set style acid skim milk gel[J]. Food Hydrocoll, 1997, 11(3): 287-292.
[13] LIU M, DAMODARAN S. Effect of transglutaminase-catalyzed polymerization ofβ-casein on its emulsifying properties[J]. J Agric Food Chem, 1999, 47(4): 1514-1519.
Effects of glycation cross-linking reaction on gelling and emulsifying properties of casein
SONG Chunli, CHEN Jiapeng, REN Jian
(Key Laboratory of Processing Agricultural Products of Heilongjiang Province,Qiqihar University, Qiqihar 161006, Heilongjiang, China)
Transglutaminase was used to catalyze glycation cross-linking reaction of casein and oligochitosan. Three kinds of glycation cross-linked proteins (modified casein) were prepared by controlling reaction time of 1, 2, 4 h. The effects of glycation cross-linking reaction on gelling and emulsifying properties of casein were analyzed. The results showed that the gelation time of the modified casein nearly reduced by 50%. The water holding capacity (centrifugation at 800 r/min for 10 min) of the gel was higher, reaching 99%. The microstructure of the gel changed significantly, and the spatial network structure of the gel was more regular with the reaction time prolonging. The effects of glycation cross-linking reaction on the emulsifying activity and emulsion stability were great.
casein; glycation; gelling property; emulsifying property; transglutaminase
2016-05-04;
2016-10-22
黑龙江省自然科学基金项目(B201421)
宋春丽(1980),女,副教授,研究方向为蛋白质化学(E-mail)songchunlilily@sina.com。
Q518.3;O63
A
1003-7969(2017)02-0098-04

