肉制品中沙门氏菌荧光定量PCR标准质粒的构建
於颖+顾其芳+陈敏+张红芝


摘要:目的 制备用于检测肉制品中沙门氏菌荧光定量PCR的标准质粒。方法 设计针对沙门氏菌invA基因的引物,扩增特异片段,转入质粒载体中构建重组质粒。将构建的重组质粒作为标准品,进行优化后的实时荧光定量PCR,建立标准曲线,并考察该标准品灵敏性及稳定性。结果 成功构建含有沙门氏菌invA基因的质粒标准品,用其建立的标准曲线循环阈值(Ct值)与模板的拷贝数呈良好线性关系(r2=0.9979),最低可以检出10 拷贝/反应。该标准质粒经验证具有良好的稳定性。用该质粒标准品检测肉制品中的沙门氏菌,经2h增菌后,可在7h内完成对样本的检测。结论 所构建的质粒标准品可用于荧光定量PCR检测肉制品中的沙门氏菌,为考量实验质量提供参考依据。
关键词:质粒标准品;荧光定量PCR;沙门氏菌;肉制品;
当前,微生物污染引起的食源性疾病已引发人们的普遍关注和深入研究。在各类食源性病原菌及危害因子中,沙门氏菌是主要致病因子[1]。根据我国统计数据显示,由沙门氏菌导致的食源性疾病占总数的10.2%,且以肉制品受污染居多[2,3]。建立有效手段快速检测肉制品中沙门氏菌,对防控和监测这类食源性疾病意义重大。
荧光定量PCR(real-time quantitative polymerase chain reaction, qPCR)方法可快速并灵敏地对沙门氏菌进行检测,而拥有可靠的标准品保证了检测的稳定和可重复性[4]。目前,获得荧光定量PCR标准品的方法有许多,包括菌液提取模板DNA、PCR扩增产物纯化、PCR扩增目的片段割胶纯化以及构建含与目的基因片段相同序列的重组质粒等,其中以质粒作为标准品最为稳定,且制备简单,使用方便。本研究选择质粒作为荧光定量PCR的标准品,设计选取了沙门氏菌invA基因特异性片段,将其转入质粒载体中构建重组质粒,以此保证快速、准确检测肉制品中沙门氏菌,为快速检测该致病菌导致的食源性疾病提供技术依据。
1.材料和方法
1.1材料和试剂
1.1.1试验菌株
本实验采用菌株:鼠伤寒沙门氏菌(ATCC 14028)、阪崎肠杆菌(ATCC 51329)、大肠埃希菌(ATCC 25922)、副溶血弧菌(ATCC 17802)、銅绿假单胞菌(ATCC 27853)、宋内志贺菌(ATCC 11060)、创伤弧菌(总18-85)、小肠结肠耶尔森菌(Y1)。ATCC菌株购自美国标准生物品收藏中心,其余菌株为本实验室收集、鉴定、编号并保存的菌株。
1.1.2主要试剂和仪器
LB培养液(上海市疾病预防控制中心试剂供应研究中心);mericon DNA Bacteria Kit(Qiagen公司);pMD? 18-T Vector Cloning Kit、大肠埃希菌DH5α感受肽细胞(日本TaKaRa公司);TaqMan? Environmental Master Mix 2.0,ABI 7900HT荧光定量PCR仪(美国lifetechnologies公司);NanoDrop2000核酸蛋白仪(赛默飞世尔科技(上海)有限公司)。
1.2方法
1.2.1引物设计和探针制备
根据GenBank公布的沙门氏菌invA基因(GenBank: M90846.1)的高保守序列[5],利用引物设计软件Oligo 7设计引物、探针,并用BLAST检查序列的特异性。引物序列为:invA-F:5-TCTACATTGACAGAAT-3,invA-R:5- CGAACGTGGCGATAATTTC-3;探针序列:invA-P:5'-FAM-CAACGTTTCCTGCGGTACTGTTAAT-TAMRA-3',克隆质粒扩增引物:invA-S:5-CGGCAATAGCGTCACCTT-3,invA-AS:5-AGTGCTCGTTTACGACCTG-3。由生物工程(上海)有限公司合成。
1.2.2细菌DNA提取:
按照细菌DNA提取试剂盒的说明书提取模板DNA。DNA模板保存于-20 ℃备用。
1.2.3荧光定量PCR反应体系的建立及优化:
对加入模板DNA、引物、探针的量进行优化,并选择最佳退火温度。在20 μL反应体系中, TaqMan? Environmental Master mix10 μL,引物invA-F和invA-R终浓度为0.75 μM,探针invA-P终浓度为0.2 μM ,模板DNA2 μL,ddH2O补足至反应总体积。反应条件:95℃变性5s,60℃退火30s,共进行40个循环。每个样本设3个平行。用SDS2.4软件(Life technologies)分析结果。
1.2.4 重组质粒标准品的制备:
用invA-S和invA-AS引物扩增PCR产物电泳以后用胶回收试剂盒回收产物片段,再连接到pMD18-T载体后,转入大肠埃希菌DH5α感受肽细胞中,筛选阳性克隆菌落,经PCR及测序(生工生物工程(上海)有限公司测序)来鉴定片段序列。
1.2.5重组质粒荧光定量PCR检测:
将所制备的重组质粒与8株标准菌株进行荧光定量PCR检测,其中鼠伤寒沙门氏菌为阳性对照,其他7株非沙门氏菌(阪崎肠杆菌、大肠埃希菌、副溶血弧菌、铜绿假单胞菌、宋内志贺菌、创伤弧菌、小肠结肠耶尔森菌等)为阴性对照,以检验所制备的质粒标准品含有沙门氏菌invA基因特异序列。
1.2.6标准曲线的建立
提取质粒DNA,用核酸蛋白仪测定质粒DNA的浓度,换算成基因的拷贝数。将制备的重组质粒进行梯度稀释至10-3~10-10,作为标准模板溶液,进行荧光定量PCR反应,并绘制标准曲线。
1.2.7稳定性实验:
将重组质粒置-20℃冷冻保存6个月,分别在每个月取出稀释至100、10-3、10-6进行荧光定量PCR检测,考察质粒标准品的稳定性。
1.2.8肉制品样本的检测
采集市售肉制品样本35份,称取25g剪碎后加入225mL 胰大豆肉汤培养基,置37℃增菌2h。吸取待测样本1mL于离心管中,经13000×g离心5分钟,吸弃上清,再加入1mL灭菌去离子水重悬沉淀[6]。随后提取DNA,进行荧光定量PCR检测。同时与培养分离方法作对照。
2. 结 果
2.1 质粒标准品的构建结果
将构建的重组质粒提取DNA得到沙门氏菌的质粒DNA,长度为577bp。将测序结果与Genbank中沙门氏菌invA基因序列进行BLAST比对,符合率达100%。(见图1)经测,质粒DNA的浓度为78 ng/μL,转换得到质粒标准品的原始浓度为2.0×1010 copies/μL。
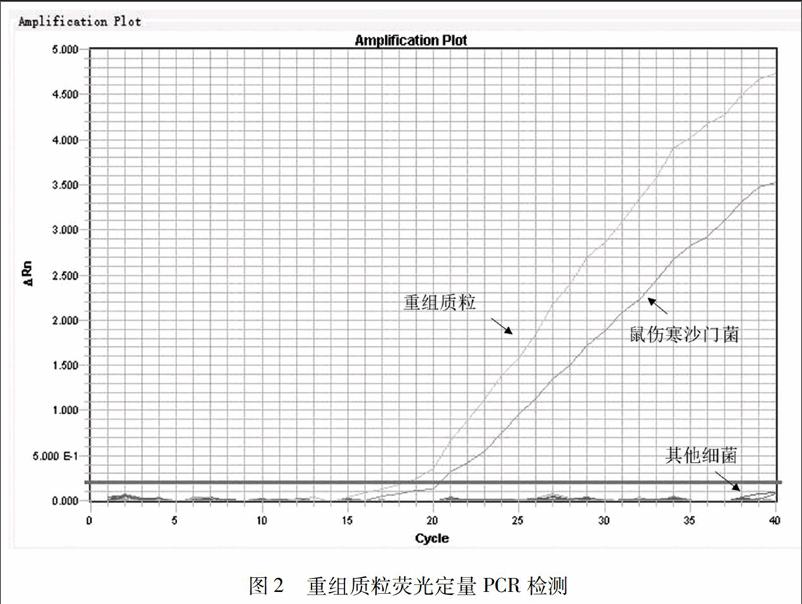
2.2 重组质粒荧光定量PCR分析:
对已构建的重组质粒和8株菌株进行荧光定量PCR检测,结果见图2。重组质粒可收集到明显的荧光信号,Ct值为18.64。阳性对照菌株(鼠伤寒沙门氏菌标准菌株)也可见明显荧光扩增信号指数期,Ct值为20.23。其他菌株作为阴性对照均未见明显扩增信号。由此可见,成功构建含有沙门氏菌invA基因特异序列的重组质粒。
2.3标准曲线的建立:
将重组质粒10倍梯度稀释,制成1×101~1×108 copies/反应浓度范围的标准品溶液。由拷贝数的对数值和Ct值对应建立的标准曲线(图3),建立标准曲线。重组质粒的拷贝数与Ct值之间存在对应线性关系,相关系数r?=0.9979,斜率为-3.2548,PCR的扩增效率为102.88%在可接受范围内,且方法误差较小,最低可以检出10 copies/反应的沙门氏菌。
2.4稳定性实验结果:
将保存1-6个月的质粒标准品取出,分别对经稀释后1010、107、104浓度水平的质粒进行荧光定量PCR测Ct值,由表1可知,构建的重组质粒在6个月内测定值无显著差异。
2.5 肉制品样本的检测
对35份样本分别进行实时荧光定量PCR方法和分离培养方法的检测,结果均检出有3份样品受沙门氏菌污染。由建立的标准曲线上可得知,三份样本的细菌浓度分别为2.4×106copies/μL 、4.3×105copies/μL和1.1×106copies/μL。对比两种方法,本研究方法在7小时内便能得到检测结果,而传统分离培养方法需4-5天(见表2)。
3. 讨 论
沙门氏菌是污染肉制品的主要致病菌之一,我国是肉制品消费大国,沙门氏菌污染造成的危害更为严重。目前对沙门氏菌的检测主要还是通过培养和分离鉴定,但传统方法所需时间较长,且需花费大量人力、物力,使用TaqMan探针进行的荧光定量PCR检测技术因其灵敏、快速、特异性等优点受到研究者的亲睐[7-9]。在荧光定量PCR反應中,利用一系列已知浓度的标准品反应测得的Ct值制作标准曲线,再将目的样本基因的检测结果在标准曲线上进行判读,从而获得靶基因的量。稳定的标准品为荧光定量PCR提供了可靠的标准曲线,而同样的反应条件使样本基因与标准品具有相同的扩增效率,同时也减少了样本模板基因抽提对检测结果的影响。因此,要保证检测结果的一致性和可重复性必须构建稳定、可靠的标准品。质粒具有环状闭合结构,将其作为标准品可长期保存,具有良好的稳定性[10]。相较于菌液提取DNA模板,无须多次制作,减少了每次实验的步骤,且保证初始浓度一致,使用更为便捷。
本研究沙门氏菌invA基因为基础,选择特异性片段,该基因主要编码沙门氏菌吸附和侵袭上皮细胞的表面蛋白——侵袭蛋白,并决定其致病能力,且是沙门氏菌A-E群中高度保守基因 [11-12]。通过设计了引物和探针,对特异性序列进行扩增,并转入质粒载体。经测序与GenBank中invA基因进行比对,符合率达到100%。经荧光定量PCR试验,结果呈阳性,证明成功构建了含有invA基因特异片段的重组质粒标准品。由其建立标准曲线,Ct值与拷贝数的对数值呈现理想的线性关系,最低能检测10 copies/反应。通过稳定性实验验证,不同保存时间的克隆质粒检测结果稳定,可作为荧光定量PCR的标准品,且适合长期使用。
使用所构建的质粒标准品对35份肉制品样本进行的检测,在2h增菌以后,结果显示与传统方法结果的符合率一致,并将检测时间从原来的4-5天缩短至7小时,大大提高了检测的时效。
综上所述,使用本研究建立的质粒标准品进行荧光定量PCR可帮助快速、准确地检测肉制品中的沙门氏菌,且操作简便、结果稳定。尤其在应对感染性腹泻等突发群体事件时,可快速筛查病原菌,缩短响应时间,为保障食品安全,加强现场处置及时提供准确依据。
4. 参考文献
[1] 国家卫生计生委办公厅.关于 2015 年全国食物中毒事件情况的通报 [EB/OL].(2016-04-01)[2016.12.26].http://www.nhfpc.gov.cn/yjb/s7859/201604/8d34e4c442c54d33909319954c433 11c.shtml.
[2] 毛雪丹,胡俊峰,刘秀梅.2003-2007年中国1060起细菌性食源性疾病流行病学特征分析[J].中国食品卫生杂志,2010,22(03):224-228.
[3] 孙康德,李洁琼,陈福祥等.食源性沙门氏菌感染的实验室诊断及鼠伤寒沙门氏菌同源性分析[J].检验医学,2012,27(11):913-916.
[4] POSTOLLEC F, FALENTIN H, PAVAN S, et al. Recent advances in quantitative PCR (qPCR) applications in food microbiology[J].Food Microbiology,2011,28(5):848-861.
[5] RAHN K,DEGRANDIS SA,CLARKE RC,et al.Amplification of an invA gene sequence of Salmonella typhimurium by polymerase chain reaction as a specific method of detection of Salmonella[J].Mol Cell Probes,1992,6(4):271-279.
[6] 肖建伟,王兰芳,沈利等.样品前处理方法对食品中沙门菌PCR检测结果的影响[J]上海预防医学杂志,2011,23(9):441-443.
[7] 刘军.食源性致病菌定量检测技术研究近况[J].中国卫生检验杂志,2016,26(2):302-304.
[8] 周晓红,徐佩华,孙明华等.实时荧光定量PCR技术在食源性致病菌快速检测中的应用[J].上海预防医学,2014,26(6):313-317.
[9] 王怡倩,叶长芸.建立检测产气肠杆菌的TaqMan荧光定量PCR和普通PCR方法[J].疾病监测,2016,31(2):153-158.
[10] 谭安娜,黄宗艳.铜绿假单胞菌quiP基因实时荧光定量PCR标准质粒的构建[J]临床血液学杂志,2011,24(4):204-206.
[11] 黄冠军,刘天强,杨晓玲等.沙门氏菌入侵基因研究进展[J].亚太传统医学,2013,9(11):65-67.
[12] 向辉,朱海,刘钢等. 5种食源性致病微生物毒力基因重组质粒的构建、克隆表达与表达产物的研究[J].华南预防医学,2014,40(5):409-415.

