高效液相色谱法测定海洋生物中牛磺酸的含量
柳小英 毛丽沙 鲍敏洁 周瑾 金火喜


摘要[目的]建立牛磺酸的高效液相色谱分析方法,并通过该方法测定不同海洋生物中牛磺酸的含量。[方法]应用邻苯二甲醛(OPA)柱前衍生法,研究流动相比例、流速、衍生剂比例、衍生时间等因素对牛磺酸检测的影响。[结果]当牛磺酸∶OPA=1∶2,衍生时间2 min,流动相乙腈∶水=15∶85,流速为0.5 mL/min,检测波长为360 nm时,牛磺酸浓度为10~400 μg/mL时具有良好的线性关系(R2>099),平行样品的相对标准偏差为2.9%~7.4%。利用该方法检测不同海产品中牛磺酸的含量,所选择的海洋贝类、甲壳类、鱼类中均含有牛磺酸,其中海瓜子中含量最高,达11.2 mg/g。不同组织比较,鱼肉中牛磺酸含量较高,而鳃中较低。[结论]该研究结果丰富了海洋生物中牛磺酸含量的数据,为进一步研究牛磺酸在不同组织中的合成机制提供了参考。
关键词海产品;高效液相色谱;牛磺酸
中图分类号S-3文献标识码A文章编号0517-6611(2017)31-0001-03
Abstract[Objective]The aim was to establish the analytical method of taurine by high performance liquid chromatograph and detect the taurine content in different seafood tissues. [Method]The precolumn derivatization of ophthalaldehyde (OPA) was used to detect the taurine by studying the effects of flow phase ratio, flow rate, ratio of derivatization agent and derivatization time. [Result]The linear range (R2> 0.99) was in the range of 10-400 μg/mL at the taurine∶OPA=1∶2, derivatization time 2 min, acetonitrile∶water=15∶85, flow rate 0.5 mL/min, wavelength 360 nm. The relative standard deviation of the parallel samples was 2.9%-7.4%. The content of taurine in different seafood was tested by using this method. The results showed that taurine was determined in all selected marine shellfish, crustaceans and fish. The highest content of taurine was observed in the baby clam, which was up to 11.2 mg/g. Compared with different tissues of fish, the content of taurine in muscle was the higher, while the lower in gill. [Conclusion]The results of this study enrich the data of taurine content in marine life, and provide reference for the further study of the synthesis mechanism of taurine in different tissues.
Key wordsSeafood;High performance liquid chromatography;Taurine
牛磺酸,分子式C2H7NO2S,是一种含硫的特殊氨基酸,在体内不参与蛋白质合成,以游离状态存在。牛磺酸具有广泛的生理功能,它的缺乏能造成视网膜退化,最终导致失明[1];具有保护肝细胞的作用,能降低细菌毒素、次级胆酸及四氯化碳等对肝的损伤[2-3];具有良好的抗氧化功效,能有效降低脑组织的氧化损伤[4-5];能促进免疫器官的发育,增强动物的免疫机能[6-7];能促进动物对某些营养物质的吸收和转运,从而促进动物的生长发育[8-9]。此外,研究还发现牛磺酸对动物的大脑发育有着至关重要的作用,牛磺酸的缺乏会导致中枢神经系统发育受阻,智力低下[10-11]。因此,在嬰幼儿时期,饮食中需适当补充一定量的牛磺酸,特别是用牛乳代替母乳喂养的婴幼儿。随着对牛磺酸研究的不断深入,其越来越多的生理作用被挖掘。牛磺酸不仅在临床上被用于心血管、糖尿病、眼部等疾病的治疗[12-14],还被用作食品添加剂添加到一些功能饮料及营养保健品中。
牛磺酸广泛分布于哺乳动物和海洋生物中。哺乳动物的主要脏器,如心脏、脑、肝脏等中均含有一定量的牛磺酸;海洋生物是牛磺酸的天然宝库,尤其是螺类、贝类等软体动物,其牛磺酸含量十分丰富[15-17]。据文献报道,牡蛎、翡翠贻贝、马氏珠母贝和蝾螺,其体内牛磺酸的含量均超过8 000 mg/kg[18]。随着对牛磺酸研究的日渐深入,其检测方法也日趋完善。从早期灵敏度较低的滴定法和比色法等逐渐发展到现在的氨基酸自动分析法和高效液相色谱法(HPLC)等。氨基酸自动分析法由于设备价格昂贵且使用范围较窄(一般仅用于检测分析氨基酸),限制了其广泛使用。高效液相色谱法是目前检测牛磺酸最主要的方法,根据衍生试剂的不同又分为异硫氰酸苯酯(PITC)衍生法、丹磺酰氯(Dansyl-Cl)衍生法[19]和邻苯二甲醛(OPA)衍生法[15-17]等,其中邻苯二甲醛衍生法由于安全无毒、操作简便而备受青睐。
目前,有关海洋生物体内牛磺酸的检测已有相关文献报道,但基本都针对单一物种。
为此,笔者采用邻苯二甲醛为衍生剂,巯基乙醇为保护剂,建立了峰形良好、快速准确的牛磺酸检测方法,并用该方法检测了不同海洋生物体内牛磺酸的含量。
1材料与方法
1.1材料
1.1.1试验材料。
美国红鱼、贻贝、白蛤等海洋生物购于舟山市乐购超市。
1.1.2试剂与药剂。
牛磺酸、邻苯二甲醛、乙腈(色谱纯)、硼酸、氢氧化钠、巯基乙醇、磷酸氢二钠、磷酸二氢钠等试剂均购于阿拉丁公司。
衍生试剂:称取0.01 g邻苯二甲醛,用1.00 mL甲醇溶解,再加入0.01 mL巯基乙醇,用硼酸钠缓冲液(0.4 mol/L,pH 9.5)定容至10.00 mL,在冰箱中密封避光保存。牛磺酸標准液(1 mg/mL):称取0.05 g牛磺酸,用磷酸缓冲液(pH 7.4)定容至50.00 mL。
1.1.3仪器。
Agilent 1200高效液相色谱仪(美国Agilent公司),Agilent XDB-C18色谱柱(4.6 mm × 150.0 mm,5 μm),FS-1高速匀浆机(江苏金坛市环宇科学仪器厂)。
1.2方法
1.2.1牛磺酸分析方法的建立。
在1.5 mL离心管中加入250 μL牛磺酸标样,于37 ℃恒温水浴锅预热3 min,加入一定量衍生剂进行衍生化反应2 min。反应液经0.45 μm微孔滤膜过滤,立刻进样20 μL于高效液相色谱仪中,记录其峰面积及其保留时间。根据峰型、保留时间等指标对流动相比例、流速等条件进行优化。初始条件:色谱柱XDB-C18,乙腈∶水=20∶80,牛磺酸∶衍生剂=1∶2,流速0.5 mL/min,衍生3 min,波长360 nm。
1.2.2牛磺酸标准曲线的绘制。
将牛磺酸标准液(1 mg/mL)用磷酸缓冲液(pH 7.4)依次稀释成0.40、0.20、0.10、0.05、0.02、0.01 mg/mL 6个浓度梯度。按照“1.2.1”所述步骤对牛磺酸浓度进行测定。以牛磺酸浓度为横坐标,峰面积为纵坐标制作标准曲线。
1.2.3精密度测试。
分别取0.01、0.10、0.40 mg/mL的牛磺酸标准溶液,按照“1.2.1”所述步骤对牛磺酸浓度进行测定。每种浓度平行测定3次,记录峰面积,并计算相对标准偏差。
1.2.4样品中牛磺酸含量检测。
取20 g洗净的海洋生物组织(肉、内脏、鳃等),加入2.5倍体积磷酸盐缓冲液(0.02 mol/L,pH 7.4),在冷水循环控温下匀浆30 min后离心20 min(4 ℃,8 000 r/min)去沉淀。上清液中加入2倍体积的无水乙醇脱蛋白,10 000 r/min离心15 min,按照上述方法检测上清液中牛磺酸的含量。
2 结果与分析
2.1流动相比例选择
选用乙腈与水作为流动相,分别选择体积比15∶85、20∶80、30∶70、40∶60进行试验。由表1可知,随着乙腈比例的增加,牛磺酸与相邻峰的分离度变差,保留时间不断缩短,但吸收峰面积也逐渐减小。在牛磺酸浓度为0.10 mg/mL下,当乙腈∶水=20∶80时,牛磺酸达到基线分离,保留时间为2.98 min,峰面积为172.8;当乙腈∶水=15∶85时,牛磺酸保留时间延长到3.92 min,但峰面积增加到345.3;继续减小乙腈的比例,保留时间会进一步延长。综合考虑吸收峰面积及保留时间,选择流动相乙腈和水的比例为15∶85。
2.2流动相流速选择
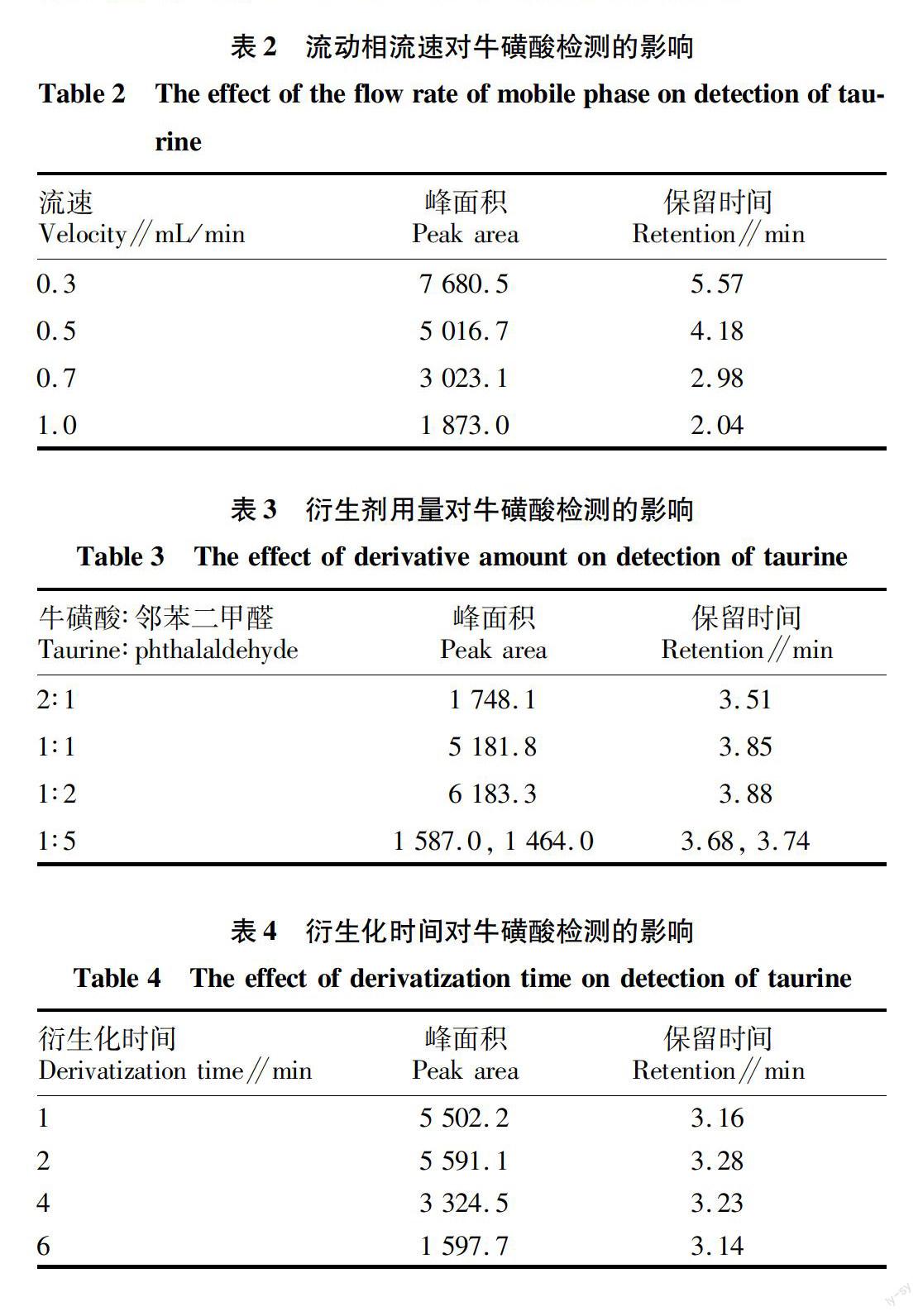
流动相流速是影响高效液相色谱检测的重要因素,流速太慢,目标物质保留时间延长,峰型变宽;流速增快可以缩短保留时间,但过快则容易导致目标物质尚未完全检测,峰面积变小。该试验选择波长360 nm,乙腈和水(15∶85)为流动相,考察不同流速(0.3、0.5、0.7、1.0 mL/min)对牛磺酸(1.0 mg/mL)检测的影响。结果发现,不同流速下牛磺酸均有良好的分离效果,但保留时间和峰面积均随流速的增大而减小(表2)。综合考虑峰面积和保留时间,选择0.5 mL/min为最终流动相的流速。
2.3衍生剂用量的选择
衍生剂用量也是影响牛磺酸检测的重要因素,衍生剂过少,反应不完全,结果准确性差;衍生剂过多则容易影响峰型。该试验选择不同量的衍生剂(牛磺酸标样和衍生剂邻苯二甲醛的摩尔比为2∶1、1∶1、1∶2、1∶5),通过观察峰面积和峰型,最终确定衍生剂的最适用量。由表3可知,随着衍生剂用量的增加,牛磺酸峰面积也逐渐增加,保留时间则变化不大。但当衍生剂与底物摩尔比达5∶1时,牛磺酸标样出现2个分裂峰,保留时间分别为3.68和3.74 min,分离度差,未达到基线分离,说明衍生剂过量确实会影响峰型。综上考虑,最终选择底物牛磺酸与衍生剂邻苯二甲醛摩尔比为1∶2。
2.4衍生时间的选择
牛磺酸与衍生试剂邻苯二甲醛反应迅速,灵敏度高,但衍生产物并不稳定,衍生时间过长,产物分解,峰面积减小。该试验考察了不同衍生时间(1、2、4、6 min)对牛磺酸检测的影响。由表4可知,衍生时间为2 min时,牛磺酸峰面积达到最大;继续延长衍生时间,峰面积逐渐减小,衍生时间为6 min时,峰面积下降至1 597.7,说明衍生物已经部分分解。因此,确定衍生时间为2 min。
2.5牛磺酸标准曲线
在上述最优条件下,牛磺酸标样的色谱如图1所示。以牛磺酸标准品浓度为横坐标,峰面积为纵坐标制得牛磺酸标准曲线(图2)。当牛磺酸浓度在10~400 μg/mL时,牛磺酸的浓度与峰面积呈良好的线性关系,回归方程为y=6.516 3x+30.192,R2=0.997 3。
2.6方法的精密度
選择3个不同浓度的牛磺酸标样,分别为低浓度(10 μg/mL)、中浓度(100 μg/mL)和高浓度(400 μg/mL),同一样品重复测定3次,峰面积见表5。该3种浓度的牛磺酸标样的相对标准偏差分别为2.9%、7.4%和3.4%,说明该方法的精密度较高,具有良好的重现性。
2.7海洋生物样品中牛磺酸含量的检测
选择了十几种常见的海洋生物,对其不同组织中牛磺酸含量进行了检测。由表6可知,所选择的海洋生物,包括贝类、鱼类和甲壳类,均检测到相当浓度的牛磺酸。特别是贝类和螺类,其牛磺酸含量十分丰富,如芝麻螺中含量达10.3 mg/g,而海瓜子中更是高达11.2 mg/g,蛏子、蛤蜊和血蛤中含量也较高。据文献报道[18],牡蛎、蝾螺和翡翠贻贝中牛磺酸含量在8 000 mg/kg以上,马氏珠母贝中含量更是高达13 830 mg/kg。该试验中,蛏子、芝麻螺和海瓜子中牛磺酸含量也在9 000 mg/kg以上。由文献报道和该试验结果可知,牛磺酸在贝类和螺类中最丰富。相比于贝类和螺类,海洋鱼类中牛磺酸含量相对偏低,但不同组织内牛磺酸含量有所不同。一般来说,鱼肉中牛磺酸含量较高,而鳃中则较少,如大黄鱼,鱼肉中牛磺酸含量为4.8 mg/g,而鳃中只有0.8 mg/g。此外,牛磺酸含量在内脏中的分布也因鱼种的不同而不同。在海鲈鱼的肝脏、肠和鳃3种内脏中,肝脏中牛磺酸含量最高,为4.6 mg/g,而鳃中含量最低,为1.8 mg/g。然而,在美国红鱼的3种内脏中,牛磺酸含量的差异并不大。
迄今为止,有关海洋生物中牛磺酸含量的检测已有不少文献报道,该研究是对前人工作的进一步补充和丰富。当然,生物体内牛磺酸的含量受到其生长环境的影响,同一种生物在不同的生长水域和季节以及不同的个体大小,其牛磺酸含量均可能存在差异。因此,不同的学者对同一种生物进行测量,可能会得到不同的结果。
3结论
该研究成功建立了快速准确的牛磺酸高效液相色谱分析方法。应用邻苯二甲醛(OPA)为柱前衍生试剂,衍生时间2 min,牛磺酸∶OPA=1∶2,流动相乙腈∶水=15∶85、流速为05 mL/min,色谱柱Agilent Eclipse XDB-C18,检测波长为360 nm。该方法牛磺酸含量在10~400 μg/mL时具有良好的线性关系(R2>0.99),平行样品的相对标准偏差为2.9%~
74%。不同海产品中牛磺酸含量检测结果表明,所选择的海洋生物中均含有一定量牛磺酸,尤其是贝类和螺类中含量最丰富,最高达11.2 mg/g。不同组织比较,鱼肉中牛磺酸含量较高,而内脏中鳃中含量较低。该试验结果丰富了海洋生物中牛磺酸含量检测的相关研究,为进一步研究和分析牛磺酸在不同组织中的合成机制提供了参考。
参考文献
[1] 张剑利,苏小玫.牛磺酸与视网膜功能的关系[J].眼科,2003,12(5):311-313.
[2] 李静员,杨雅娟,冯艳,等.牛磺酸对实验性肝纤维化大鼠保护作用的研究[J].天津中医药,2017,34(5):336-340.
[3] ABDRABOU A A,ZOHEIR K M,AHMED H H.Potential impact of curcumin and taurine on human hepatoma cells using Huh7 cell line[J].Clin Biochem,2012,45(16/17):1519-1521.
[4] WINIARSKA K,SZYMANSKI K,GORNIAK P,et al.Hypoglycaemic,antioxidative and nephroprotective effects of taurine in alloxan diabetic rabbits[J].Biochimie,2009,91(2):261-270.
[5] 李乐慧,徐兆发,刘巍,等.牛磺酸对甲基汞致大鼠脑氧化损伤的保护作用[J].环境与职业医学,2014,31(6):469-471.
[6] 曾德寿,高振华,赵京辉,等.牛磺酸对肉仔鸡生产性能、免疫器官发育及抗氧化能力的影响[J].中国兽医学报,2009,29(6):774-778.
[7] SCHULLERLEVIS G B,PARK E.Taurine and its chloramine:Modulators of immunity[J].Neurochemical research,2004,29(1):117-126.
[8] MATSUNARI H,FURUITA H,YAMAMOTO T,et al.Effect of dietary taurine and cystine on growth performance of juvenile red sea bream Pagrus major [J].Aquaculture,2008,274(1):142-147.
[9] KIM S K,TAKEUCHI T,YOKOYAMA M,et al.Effect of dietary taurine levels on growth and feeding behavior of juvenile Japanese flounder Paralichthys olivaceus[J].Aquaculture,2005,250(3/4):765-774.
[10] RAK K,VLKER J,JRGENS L,et al.Neurotrophic effects of taurine on spiral ganglion neurons in vitro[J].Neuroreport,2014,25(16):1250-1254.
[11] KHIMSUKSRI S,WYSS J M,THAEOMOR A,et al.Perinatal taurine exposure programs patterns of autonomic nerve activity responses to tooth pulp stimulation in adult male rats[J].Adv Exp Med Biol,2013,775(4):121-134.
[12] BESSHO M,MURASEMISHIBA Y,IMAGAWA A,et a1.Possible contribution of taurine to distorted glucagon secretion in intraislet insulin deficiency:A metabolome analysis using a novel αcell model of insulindeficient diabetes[J].PLoS One,2014,9(11):113254.
[13] SCHAFFER S W,SHIMADA K,JONG C J,et al.Effect of taurine and potential interactions with caffeine on cardiovascular function[J].Amino Acids,2014,46(5):1147-1157.
[14] 孫建,许振,徐雷.牛磺酸滴眼液联合泪道探通治疗新生儿泪囊炎的疗效观察[J].齐齐哈尔医学院学报,2014,35(4):539-540.
[15] 叶思平,陈悦娇,陈海光,等.高效液相色谱测定益智仁中的牛磺酸含量[J].食品科学,2013,34(10):204-206.
[16] 陈申如,胡阳,倪辉,等.高效液相色谱法测定牡蛎中牛磺酸含量[J].中国食品学报,2013,13(2):193-198.
[17] 高加龙,章超桦,刘书成,等.邻苯二甲醛柱前衍生高效液相色谱法测定马氏珠母贝中牛磺酸含量[J].广东海洋大学学报,2007,27(1):55-58.
[18] 谭乐义,章超桦,薛长湖,等.牛磺酸的生物活性及其在海洋生物中的分布[J].湛江海洋大学学报,2000,20(3):75-79.
[19] UBUKA T,OKADA A,NAKAMURA H.Production of hypotaurine from Lcysteinesulfinate by rat liver mitochondria[J].Amino Acids,2008,35(1):53-58.
——以青岛市为例

