水温骤降和缓降胁迫对褐篮子鱼血液生理生化指标的影响
宁军号,秦宇博,胡伦超,张伟杰,李磊,常亚青,宋坚(.大连海洋大学农业部北方海水增养殖重点实验室,辽宁大连602;2.中国科学院海洋研究所实验海洋生物学重点实验室,山东青岛26607;.辽宁省海洋环境预报与防灾减灾中心,辽宁沈阳000)
水温骤降和缓降胁迫对褐篮子鱼血液生理生化指标的影响
宁军号1、2,秦宇博3,胡伦超1,张伟杰1,李磊1,常亚青1,宋坚1
(1.大连海洋大学农业部北方海水增养殖重点实验室,辽宁大连116023;2.中国科学院海洋研究所实验海洋生物学重点实验室,山东青岛266071;3.辽宁省海洋环境预报与防灾减灾中心,辽宁沈阳110001)
为探讨水温骤降和缓降胁迫对褐篮子鱼Siganus fuscescens血液生理生化指标的影响,水温骤降试验以24益为对照,将体质量为(37.12依5.60)g的试验鱼由24益直接浸入20益海水中,适应1 h取样,维持24 h后将剩余试验鱼浸入16益海水中适应1 h取样,以此类推直到水温降至8益维持1 h取样;水温缓降试验水温由24益按1益/3 h的降温速度降至20益,维持3 d取样,以此类推直到水温降至8益维持3 d取样,并测定试验鱼血液的各种生理生化指标。结果表明:在水温骤降试验中,试验鱼血液中红细胞(RBC)、血红蛋白(HGB)、红细胞压积(Hct)在8益时均显著降低(P<0.05);谷丙转氨酶(ALT)和碱性磷酸酶(AKP)活力均呈先升后降的趋势,ALT活力除20益时外,其他控温点均显著高于对照组(P<0.05),AKP活力在20益时显著升高;谷草转氨酶(AST)活力呈波动变化,在各控温点均显著升高(P<0.05);血清葡萄糖(GLU)含量在8益时显著升高,在其他控温点均显著低于对照组(P<0.05);胆固醇(CHOL)、总蛋白(TP)、白蛋白(ALB)含量除20益时外,其他控温点均显著低于对照组(P< 0.05);甘油三酯(TG)含量在20益时显著升高,在其他控温点均显著低于对照组(P<0.05);肌酐(CREA)含量在20益时显著升高(P<0.05)。在水温缓降试验中,试验鱼血液中RBC、HGB显著降低(P<0.05),其余指标均无显著性差异(P>0.05);ALT活力在12益时显著升高并达最大值,AST活力在20、12益时显著升高,AKP活力除16益组外均显著高于对照组(P<0.05);GLU含量在8益时显著升高, CHOL含量在16、12益时显著低于对照组(P<0.05),TG、TP和CREA均呈先升高后降低的趋势,不同之处是TP含量不能恢复至初始水平;ALB含量除20益时外,其他控温点均显著低于对照组(P<0.05)。研究表明,在本试验条件下,褐篮子鱼能够存活的最低温度为12益,8~9益是褐篮子鱼的致死温度下限。
褐篮子鱼;低温胁迫;血清酶;生化指标
水温是影响鱼类生存、分布的重要生态因子,水温变化可引起鱼类生理机能、激素水平、抗氧化能力、免疫功能、血液学和血清生化指标的改变。研究表明,温度骤降(acute temperature)和冷驯化(cold acclimation)是研究水产动物抗寒性能的有效手段[1-3],两者均属低温胁迫。当鱼类受到低温胁迫时,首先试图通过自我调节适应低温环境;若低温胁迫超出鱼类承受能力,鱼体内稳态将发生不可逆改变,最终导致死亡。鱼类血液参与机体的营养运输、物质代谢、免疫调控过程,在受到外在胁迫时,机体神经-体液调节和组细胞代谢将发生改变,并首先反映在血液学和血清生化指标中[4-5]。因此,研究低温胁迫对鱼类血液学和血清生化指标的影响具有重要的意义。
褐篮子鱼Siganus fuscescens隶属于鲈形目Per-ciformes、篮子鱼科Siganidae、篮子鱼属Siganus,分布于热带、亚热带海域,系一种杂食、广盐、暖水性近海小型鱼类[6]。篮子鱼喜偏植物食性饵料,可摄食浒苔Enteromorpha prolifra、石莼Ulva lactuca等大型藻类,对环境适应能力强,与名贵海珍品混养,能有效控制网箱、池塘内野杂藻增殖,既利于养殖环境的优化,又可节约资源,增加点篮子鱼的养殖规模,是一种健康的生态养殖模式[7-8]。近年来,中国北方海藻泛滥对海区大型、小型生物群落均产生了不同程度的干扰,给近海养殖区带来较大困扰[9-10]。鉴于此,由中国南方向北方沿海的篮子鱼引种工作逐渐兴起。研究表明,点篮子鱼幼鱼不能适应14益的低温,水温在16益时其存活率高达97.5%,但仍表现出较强应激反应[11]。因此,篮子鱼引种过程需克服南北养殖海区水温差异,对其进行水温缓降和骤降驯化势在必行。目前,有关低温胁迫对褐篮子鱼血液生理生化指标的相关研究报道较少,本研究中探讨了温度缓降和骤降两种模式对褐篮子鱼血液生理生化指标的影响,旨在为褐篮子鱼增殖增产和引种工作提供理论参考。
1 材料与方法
1.1 材料
试验用鱼于2015年11月取自大连湾室内养殖场越冬苗,在同一池塘内挑选规格均匀、健康无伤的褐篮子鱼160尾,体长为(12.62依0.50)cm,体质量为(37.12依5.60)g。充气后运回实验室暂养,暂养密度为40尾/m3,水温为(24.0依0.5)益,盐度为32.20,pH为8.05,溶解氧大于6 mg/L。暂养期间每天8:00、20:00各投喂新鲜石莼、裙带菜Undaria pinnatifida 1次,投喂1 h后吸出残饵并换水,换水量为总水量的20%。
1.2 方法
1.2.1 低温胁迫试验设计降温模式是根据常玉梅等[2]和陈超等[3]的方法稍加修改。将试验鱼放入水温(24.0依0.5)益的控温循环水槽(180 cm伊100 cm伊70 cm)中,暂养7 d后进行低温胁迫试验。降温前,水温缓、骤降试验组分别在24益控温水槽中随机捞取6尾鱼采血作为对照组。
(1)水温骤降试验。将暂养在水温24益水槽中的50尾试验鱼捞出直接放入20益控温循环水槽中(事先调好水温并充气),适应1 h后随机抽取6尾鱼采血,将剩余试验鱼在20益控温水槽中维持24 h后,直接将试验鱼捞出放入水温16益的控温水槽中,适应1 h后随机取6尾鱼采血,以此类推,直至将剩余试验鱼放入8益适应1 h后随机取6尾鱼采血,每个温度组分别取3个平行全血、血清血样。取样后仍存留的试验鱼少量投喂,并在投喂2 h后吸出食物及残渣。
(2)水温缓降试验。取80尾试验鱼放入控温水槽中进行水温缓降试验。水温缓降模式如下:初始水温为24益,按1益/3 h的降温速度调节至设定温度,每降4益(分别在20、16、12、8益)维持3 d,每个温度下随机抽取6尾试验鱼采血,每个温度组分别取3个平行全血、血清血样。试验过程中记录试验鱼摄食、死亡情况。取样前24 h停止投饵,试验鱼取样后按暂养期间方式投喂。
1.2.2 血液采集及指标测定
(1)全血相关指标。将试验鱼吸干体表水分,用含有少量肝素钠的一次性注射器(2.5 mL)从鱼尾部静脉抽取1.5mL血液,将其中0.5 mL注入含有少量10%乙二胺四乙酸二钾的灭菌离心管中(1.5 mL),快速匀冷藏备用。采用全自动血液分析仪(Sysmex XE-2100D,日本)测定血红蛋白(HGB)、红细胞压积(Hct)、红细胞平均体积(MCV)、红细胞平均血红蛋白含量(MCH)、红细胞平均血红蛋白浓度(MCHC)等血液指标,并计数红细胞(RBC)和白细胞(WBC)。
(2)血清生化指标。将剩余的1.0 mL血液注入灭菌离心管中(1.5 mL),放在冰盘上静置5~6 h后,以3000 r/min离心10 min,收集血清。采用全自动生化分析仪(迈瑞BS-2000M,中国),测定葡萄糖(GLU)、胆固醇(CHOL)、甘油三酯(TG)、谷丙转氨酶(ALT)、谷草转氨酶(AST)、总蛋白(TP)、白蛋白(ALB)、碱性磷酸酶(AKP)、尿素氮(BUN)和肌酐(CREA)等生化指标。所有样品均当天测定完成。
1.3 数据处理
试验数据经Excel 2007软件初步处理后,采用SPSS 17.0软件进行单因素方差分析,使用Duncan法进行多重比较,数据均以平均值依标准误(mean依S.E.)表示。
2 结果与分析
2.1 褐篮子鱼对低温胁迫的反应
试验中,当水温从24益骤降或缓降至20益时,试验鱼均未出现任何不良反应,游动自如,快速规避,摄食强度与对照组无明显差别;当水温降至16益和12益时,试验鱼大多聚堆,躲在控温水槽角落或遮蔽物(循环泵)处,骤降组试验鱼几乎停止摄食,缓降组试验鱼摄食强度下降;当水温由12益骤降至8益时,骤降组试验鱼开始异常活跃,在水中快速游动或跳出水面,表现出极度不适应,30min后,绝大多数试验鱼横躺水槽底部,刺激水槽可做冲刺式游动,3 h后出现死亡个体;当水温缓降至11益时,缓降组试验鱼仍可少量摄食,水温缓降至10益,试验鱼开始成群游动,停止摄食,刺激仍能较快反应,水温缓降至9益时,缓降组试验鱼的应激反应与骤降至8益时的试验鱼表现相似,开始出现死亡现象。
2.2 温度骤降对褐篮子鱼血液生理指标的影响
从表1可见:水温骤降对试验鱼血液中RBC、Hct、MCV、HGB和MCHC均有显著影响(P< 0.05);水温骤降至8益时,RBC、HGB、Hct含量较对照组(24 h)均显著下降(P<0.05),其他指标则随水温骤降呈波动变化,但在水温降到8益时,均恢复至初始水平(P>0.05)。
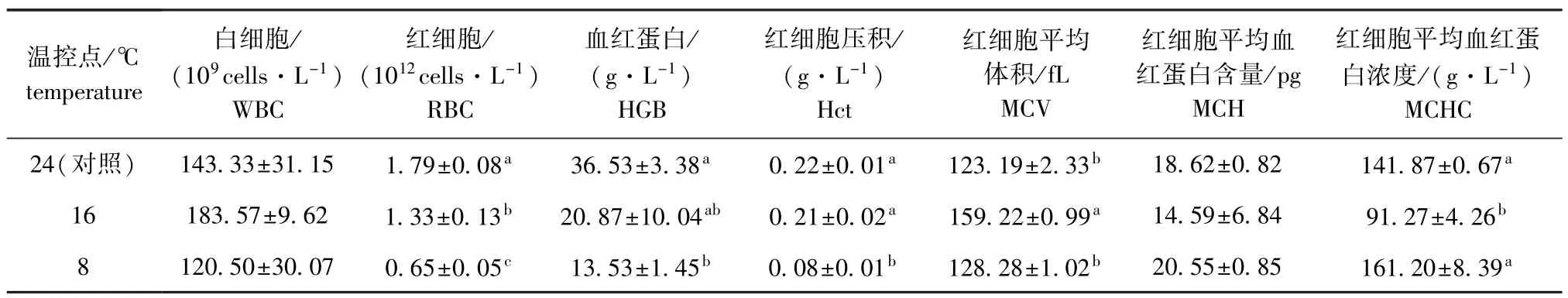
表1 温度骤降胁迫下褐篮子鱼血液指标在3个温控点的比较Tab.1Com parison of blood indices of dusk rabbit fish Siganus fuscescens exposed to sudden decrease in temperature at 3 control temperatures
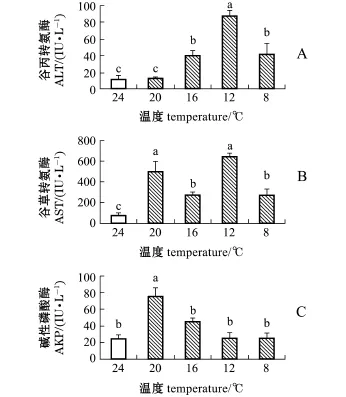
图1 温度骤降胁迫下褐篮子鱼血清的酶活力Fig.1Serum enzyme activities in dust rabbit fish Siga-nus fuscessens exposed to sharp decrease in wa-ter tem perature
2.3 温度骤降对褐篮子鱼血清生化指标的影响
从图1可见:褐篮子鱼血清ALT活力呈先升后降趋势,水温骤降至16益以下时,ALT活力均显著高于对照组(P<0.05),且在12益时达到最大值(P<0.05);AST活力则随水温骤降呈波动变化且显著高于对照组(P<0.05),AST活力亦在水温降至12益时达到最大值;AKP活力呈先升后降趋势,在水温降至20益时显著上升并达到最大值(P<0.05),其他控温组与对照组均无显著性差异(P>0.05)。
从图2可见,除血清BUN水平外,水温骤降对褐篮子鱼血清生化指标均有显著性影响(P< 0.05)。其中,GLU含量在水温降至20益时显著低于对照组(P<0.05),随后GLU含量维持不显著水平至12益,水温骤降至8益时,GLU含量达到最大值,且显著高于对照组(P<0.05);CHOL、TP、ALB含量在水温降至20益时可维持初始水平,水温降至16益时显著低于对照组(P<0.05),并维持此低水平至试验结束;TG、CREA含量在水温降至20益时显著高于对照组(P<0.05),水温降至16益时显著降低(P<0.05),随后维持最低水平至试验结束。
2.4 温度缓降对褐篮子鱼血液生理指标的影响
从表2可见,水温缓降模式亦可引起褐篮子鱼血液学指标发生变化,但不如水温骤降模式变化剧烈。其中,WBC、RBC、HGB 3个指标在水温降至16益和8益时,均显著低于对照组(P<0.05),其余指标均无显著性变化(P>0.05),且除MCH略有上升趋势外,其余指标均呈波动变化。
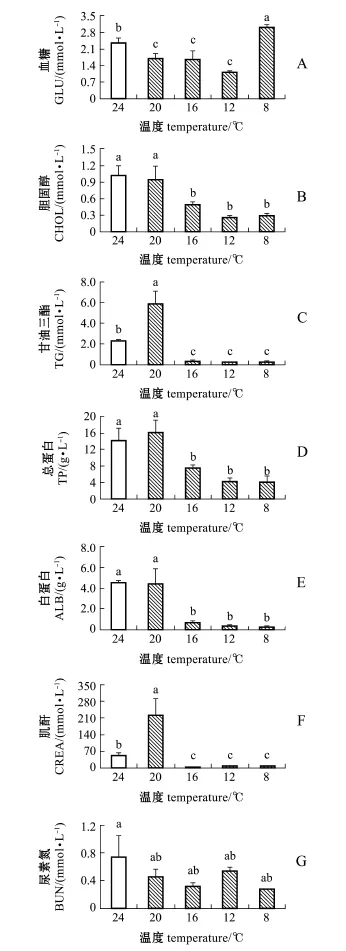
图2 温度骤降胁迫下褐篮子鱼血清的生化指标Fig.2Serum biochem ical indices in dust rabbit fish Si-ganus fuscescens exposed to sharp decrease in water tem perature
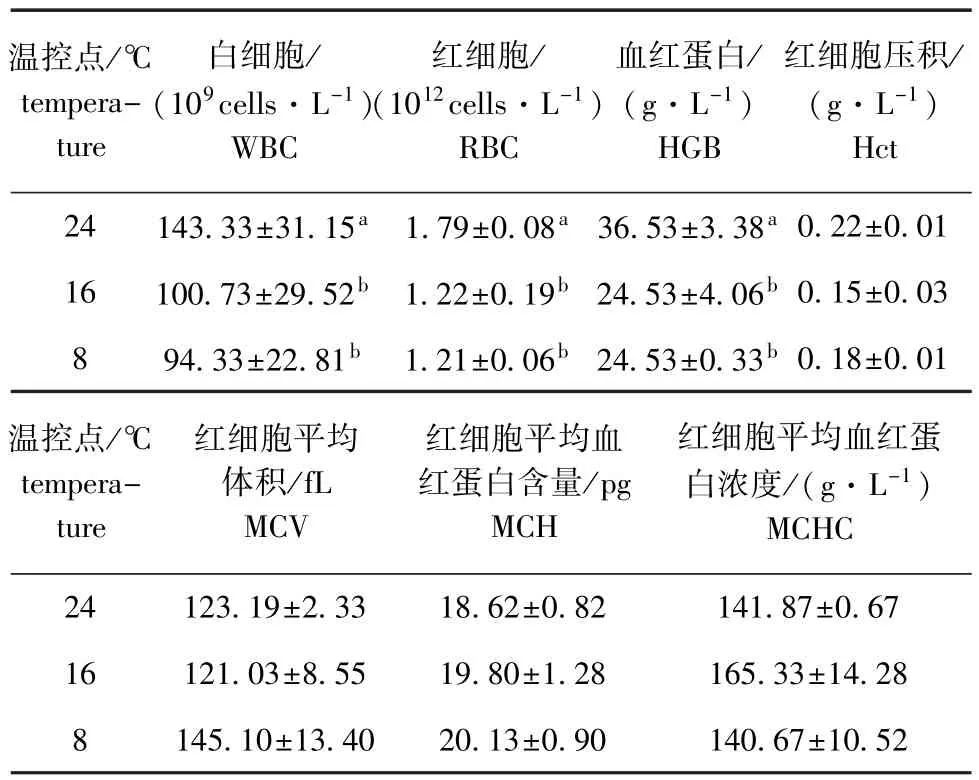
表2 温度缓降胁迫下褐篮子鱼血液指标在3个温控点的比较Tab.2Comparison of blood indices of dust rabbit fish Si-ganus fuscescens exposed to gradual derease in temperature at 3 control tem peratures
2.5 温度缓降对褐篮子鱼血清生化指标的影响
从图3可见,水温缓降模式对褐篮子鱼血清代谢酶均有显著影响(P<0.05)。其中,ALT活力呈先缓升再缓降趋势,在水温降至12益时,其活力显著高于对照组(P<0.05),并达到最大值;AST活力在水温缓降胁迫中呈波动变化,其活力分别在水温降至20益和12益时显著高于对照组(P< 0.05);AKP活力呈波动变化,其活力分别在水温降至20、12、8益时显著高于对照组(P<0.05)。
从图4可见,水温缓降模式对褐篮子鱼血清生化指标均有显著影响(P<0.05)。其中,GLU含量维持初始水平至12益(P>0.05),水温缓降至8益时显著高于对照组(P<0.05);CHOL含量呈先降后升趋势,其含量在水温降至16益和12益时显著低于对照组(P<0.05);TG、TP和CREA含量呈先升后降趋势,在水温降至20益时显著高于对照组(P<0.05),随后降低并维持低水平至试验结束;ALB含量在水温缓降至16益以下时显著降低(P<0.05),并维持该水平至试验结束;BUN含量在水温缓降胁迫中波动变化,但与对照组无显著性差异(P>0.05)。
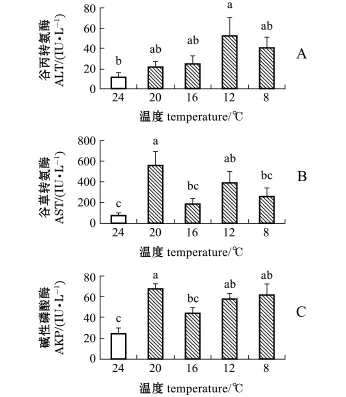
图3 温度缓降胁迫下褐篮子鱼血清的酶活力Fig.3Serum enzyme activities in dust rabbit fish Siga-nus fuscescens exposed to gradual derease in wa-ter temperature
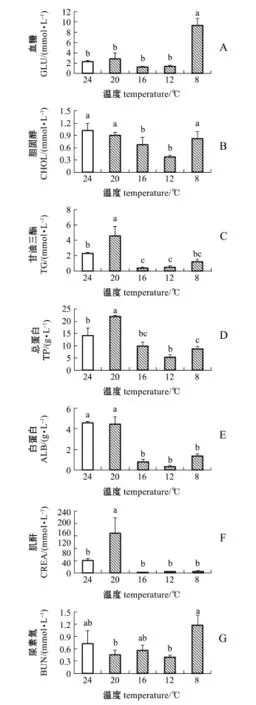
图4 温度缓降胁迫下褐篮子鱼血清的生化指标Fig.4Serum biochem ical indices in dust rabbit fish Si-ganus fuscescens exposed to gradual derease in water tem perature
3 讨论
3.1 降温模式对褐篮子鱼行为的影响
鱼类在自然水域环境中经常面临水温变化,而水温变化快慢和胁迫时间长短都将影响鱼类的正常代谢和存活。本研究中的两种降温模式中,水温由24益降至16益和12益时,试验鱼均出现低温胁迫反应,但未出现死亡,表明试验鱼可能通过自身调节进入内稳态恢复阶段[2]。当水温骤降至8益或缓降至9益时,试验鱼表现出强烈应激反应,同时在短时间(3 h内)出现死亡;血液中RBC和HGB指标均发生显著降低,以降低血液中氧气和二氧化碳的运输效率[2]。而血红蛋白氧和能力下降可能导致试验鱼供氧不足;CO2排泄率降低导致血液pH下降[11],也可能是引起试验鱼死亡的重要原因。本研究结果表明,水温8~9益是褐篮子鱼致死温度下限,而宋志明等[12]研究发现,在水温14益控温组,点篮子鱼幼鱼3 h时的存活率为15%,96 h存活率为2.5%,认为14益为点篮子鱼幼鱼的低温耐受极限,比本研究结果温度高5~ 6益,这主要与试验鱼种类不同有关。在水温缓降驯化过程中,水温降至12益时褐篮子鱼仍可少量摄食,且所测血清生化指标如ALT、AST、GLU、CHOL等的极值多出现在12益这一控温点,推测12益是褐篮子鱼可存活的低温阈值。温度驯化是一个鱼类等生物有机体通过调节自身生理反应或表现对环境温度变化产生应答反应的过程,可作为在鱼类引种过程中锻炼其表型可塑性的重要手段[13]。
3.2 降温模式对褐篮子鱼血清代谢酶活力的影响
鱼类血清酶活力高低与相应组织器官代谢水平和功能状态有关,其变化可间接反映组织器官的功能状态变化[3,14]。血清ALT和AST常作为肝脏代谢过程中受损伤程度的两种重要酶[15-16]。正常情况下,ALT在血清中含量较少,其在肝细胞中含量较高;AST在维持心肌正常生理功能方面有重要作用,临床上常用于检测心肌功能指标[3]。本研究中,水温骤降模式中除ALT在20益外,血清ALT和AST含量均发生显著升高,表明褐篮子鱼在温度骤降过程中肝脏正常代谢发生异常,肝细胞中ALT释放到血液中引起血清ALT活力升高。这与低温胁迫对七带石斑鱼Epinephelus septemfasciatus[3]和吉富罗非鱼GIFT Oreochromis niloticus[14]血清生化指标的研究结果一致。血清AST活力升高可能是心肌细胞正常生理功能受损或通透性增加的结果[4]。水温缓降模式中,褐篮子鱼血清ALT和AST活力在降温过程中均有显著升高,在试验结束时均恢复至初始水平,表明低温驯化已对试验鱼肝脏、心肌正常生理功能造成一定损伤,鱼体通过自身调节或强烈应激产生应答,这对褐篮子鱼的引种工作具有重要意义。
AKP在动物体内广泛存在,是动物溶酶体酶系重要组成部分,在鱼类免疫防御中发挥重要作用[17-19]。本研究中,AKP活力在水温骤降模式中呈先升后降趋势,表明试验鱼遭受水温骤降时首先通过调节体内代谢酶活力积极适应环境变化,随胁迫时间延长,鱼体内AKP活力因消耗或受抑制而逐渐降低。李强等[20]在研究温度对凡纳滨对虾Litopenaeusvannamei血淋巴免疫系统中AKP指标影响时得出了相似结论。在水温缓降模式中,AKP活力呈先升后降再升的波动变化,且AKP活力与对照组相比有明显升高趋势。七带石斑鱼血清AKP活力在低温胁迫过程中亦呈相似波动变化[3],血清AKP活力波动变化是否对褐篮子鱼免疫力有积极作用有待进一步研究。表明褐篮子鱼在低温驯化过程中会通过血清酶活力调节积极响应外界水温变化,有利于褐篮子鱼引种过程中低温驯化工作的顺利进行。
3.3 降温模式对褐篮子鱼血清葡萄糖、总蛋白、甘油三酯等生化指标的影响
血清GLU、TP、TG、CREA等生化指标是血液学的重要指标,是反映动物有机体在胁迫环境中体内正常代谢和组织器官功能状态的重要特征[3],被广泛应用于评价鱼类健康状况,可作为鱼类重要的生理、病理指标[14]。鱼类在低温胁迫时的应激反应是一个耗能过程。一般认为,鱼类在降温初期的适应阶段,以GLU代谢增加为主,通过GLU分解代谢产生热量增强机体御寒能力[21];随低温胁迫加强或胁迫时间延长,机体因大量消耗GLU御寒、应激致使血清GLU水平下降[14]。本研究水温骤降模式中,GLU含量在水温骤降至8益前呈下降趋势,这可能是温度骤降短时间内大量消耗试验鱼体内的GLU;水温骤降至8益时,GLU水平显著升高可能是褐篮子鱼体内剧烈应激反应的表现。常玉梅等[22]研究低温对鲤Cyprinus carpio的胁迫效应时,初期并未发现GLU水平升高,在胁迫后期出现血清糖原含量增加现象,这与本研究结果相一致。本研究水温缓降模式中,GLU浓度在水温降至8益前呈先升后降趋势,基本维持在初始水平,表明褐篮子鱼在驯化温度低至12益时,仍能维持体内较为正常的GLU水平,GLU含量在8益时显著升高,推测褐篮子鱼试图增加血清GLU水平以适应8益低温。
鱼类能自身合成胆固醇,血液中70%~80%的CHOL来自肝脏,血清CHOL含量急剧升高说明肝细胞功能发生障碍[23]。本研究水温骤降模式中,试验鱼血清CHOL含量除在20益控温点外,其他控温点均显著降低,与上述研究有所不同。但常玉梅等[22]研究认为,血清CHOL含量显著降低也可能是肝脏代谢功能障碍引起的,低温胁迫引起肝脏损伤使CHOL不能正常通过肠肝循环被肝脏重新吸收,导致血清CHOL含量下降。本研究水温缓降模式中,血清CHOL含量呈先降后升趋势,试验结束时恢复至初始水平,表明水温缓降胁迫对试验鱼肝脏正常代谢造成一定影响,但试验鱼通过应激反应或主动适应等方式能够维持血清CHOL水平。刘波等[14]研究发现,温度骤降应激致使暖水性的吉富罗非鱼血清CHOL含量显著上升,与本研究结果有所不同,这可能与试验鱼品种、应激强度和胁迫时间有关。
甘油三酯是细胞膜的重要组分,也是动物细胞贮存脂肪的主要形式。本研究中,两种降温模式中试验鱼血清TG含量均呈先升后降趋势,不同之处为水温缓降模式中血清TG在试验结束时能恢复到初始水平。血清TG水平升高可能是皮质醇在低温胁迫时升高加速脂肪代谢的结果[14],TG含量增加亦有利于鱼类应激御寒。关于血清TG水平降低,常玉梅等[22]研究认为,低温引起肝细胞功能障碍,阻碍了TG通过肠肝循环进入肝脏的重吸收作用,而使血清中TG水平下降。本研究水温缓降模式中血清TG可恢复至初始水平,陈超等[3]解释为受低温胁迫后鱼类的一种应激反应,试验鱼开始动用体内贮存脂肪来维持生存代谢。
血清蛋白参与鱼类各种生理活动,在鱼类低温应激过程中起重要调节作用[4]。本研究中,血清TP和ALB含量在水温骤降模式中均呈先维持后显著降低的趋势,试验结束时达最低值,表明温度骤降对褐篮子鱼造成极大伤害,肝脏功能障碍降低或失去了合成蛋白能力。与此同时,水温骤降模式下褐篮子鱼停止摄食也可能是造成血清蛋白下降的原因之一。陈超等[3]研究低温对七带石斑鱼幼鱼血清生化指标的影响中得出了相似结论。本研究水温缓降模式中,试验鱼血清TP水平呈先升后降的变化,表明褐篮子鱼对水温缓降驯化存在积极的应激反应,通过提高血清TP含量以适应外界低温环境。Ning等[1]研究温度缓降和骤降对刺参Apos-tichopus japonicus的胁迫效应时认为,温度缓降过程中刺参体内可溶性蛋白含量先升后降的变化是在积极响应水温缓降胁迫,与本研究结果相一致。
血清尿素氮是蛋白质代谢产物之一,可作为一种衡量鱼类肾功能代谢的指标,较低的血清BUN水平表明机体蛋白合成效率高[23]。本研究中,与初始水平相比,水温缓、骤降并没有引起褐篮子鱼血清BUN含量的显著变化,表明褐篮子鱼体内BUN代谢较为正常。
血清肌酐是肌酸的代谢产物,CREA经过肾小球滤过再排出体外,是用来检测鱼类肾脏、鳃功能的重要指标之一[24]。本研究中,血清CREA含量在两种降温模式中均呈先升后降的变化。试验鱼血清CREA水平升高,可能是低温胁迫对试验鱼肾脏和鳃造成伤害,从而弱化了CREA的排泄功能[24]。然而,随低温胁迫时间延长,试验鱼血清CREA恢复到初始水平。而七带石斑鱼血清CREA水平随低温胁迫时间的延长而下降[3],表明鱼类血清CREA在低温胁迫过程中会因种类不同而存在差异。
综上所述,两种降温模式均对褐篮子鱼血液和血清生化指标有显著影响,水温骤降比缓降对褐篮子鱼造成的伤害更大,甚至有些伤害是不可逆的,如温度骤降模式中TG、TP、CREA、ALB等指标发生不可逆降低。因此,褐篮子鱼低温驯化过程中应尽量避免水温骤降带来的危害。本研究中,褐篮子鱼能够存活的最低温度为12益,8~9益是褐篮子鱼致死的低温极限,褐篮子鱼引种过程中应注意上述关键控温点并优选大规格鱼驯化引种。考虑到温度骤降影响褐篮子鱼的摄食活动,建议对褐篮子鱼进行低温驯化时降温幅度不应超过4益,且降温速率不宜过快。
[1]Ning Junhao,Chang Yaqing,Liu Wei,et al.Stress responses to mild and acute temperature decrease for two strains of sea cucum-ber Apostichopus japonicus[J].Aquaculture,2015,448:552-563. [2]常玉梅,匡友谊,曹鼎臣,等.低温胁迫对鲤血液学和血清生化指标的影响[J].水产学报,2006,30(5):701-706.
[3]陈超,施兆鸿,薛宝贵,等.低温胁迫对七带石斑鱼幼鱼血清生化指标的影响[J].水产学报,2012,36(8):1249-1255.
[4]何福林,向建国,李常健,等.水温对虹鳟血液学指标影响的初步研究[J].水生生物学报,2007,31(3):363-369.
[5]吴丹华,郑萍萍,张玉玉,等.温度胁迫对三疣梭子蟹血清中非特异性免疫因子的影响[J].大连水产学院学报,2010,25(4): 370-375.
[6]马强,刘静.中国沿海常见蓝子鱼形态比较研究[J].海洋科学,2006,30(9):16-22.
[7]刘鉴毅,章龙珍,庄平,等.点篮子鱼人工繁育技术研究[J].海洋渔业,2009,31(1):73-81.
[8]王妤,庄平,章龙珍,等.盐度对点篮子鱼的存活、生长及抗氧化防御系统的影响[J].水产学报,2011,35(1):66-73.
[9]华尔,阎鹏旭,贺阳阳,等.大型绿藻暴发对砂质潮间带小型底栖动物群落的影响[J].海洋湖沼通报,2015(3):55-63.
[10]王洪法,李新正,王金宝,等.青岛近海浒苔暴发期大型底栖动物群落的生态研究[J].海洋科学,2011,35(5):10-18.
[11]Taylor SE,Egginton S,Taylor EW,et al.Estimation of intracel-lular pH in muscle of fishes from different thermal environments [J].Journal of Thermal Biology,1999,24(3):199-208.
[12]宋志明,刘鉴毅,庄平,等.低温胁迫对点篮子鱼幼鱼肝脏抗氧化酶活性及丙二醛含量的影响[J].海洋渔业,2015,37 (2):142-150.
[13]Wakeling JM,Cole N J,Kemp K M,et al.The biomechanics and evolutionary significance of thermal acclimation in the common carp Cyprinus carpio[J].American Journal of Physiology.Regula-tory,Integrative and Comparative Physiology,2000,279(2): R657-R665.
[14]刘波,王美垚,谢骏,等.低温应激对吉富罗非鱼血清生化指标及肝脏HSP70基因表达的影响[J].生态学报,2011,31 (17):4866-4873.
[15]De Smet H,Blust R.Stress responses and changes in protein me-tabolism in carp Cyprinus carpio during cadmium exposure[J]. Ecotoxicology and Environmental Safety,2001,48(3):255-262.
[16]Cho Y J,Kim Y Y,Lee N G,et al.Basic studies on developing e-quipment for waterless transportation of live fish[J].Bulletin of the Korean Fishery Society,1994,27(5):501-508.
[17]孙虎山,李光友.栉孔扇贝血淋巴中ACP和AKP活性及其电镜细胞化学研究[J].中国水产科学,1999,6(4):6-9.
[18]王卓,么宗利,林听听,等.碳酸盐碱度对青海湖裸鲤幼鱼肝和肾SOD、ACP和AKP酶活性的影响[J].中国水产科学, 2013,20(6):1212-1218.
[19]宁军号,常亚青,刘伟,等.温度骤降对光滑河兰蛤的胁迫效应[J].水产科学,2016,35(2):117-122.
[20]李强,李华,姜传俊,等.温度对凡纳滨对虾血淋巴免疫指标的影响[J].大连水产学院学报,2008,23(2):132-135.
[21]Panserat S,Perrin A,Kaushik S.High dietary lipids induce liver glucose-6-phosphatase expression in rainbow trout(Oncorhyn-chusmykiss)[J].The Journal of Nutrition,2002,132(2):137-141.
[22]常玉梅,曹鼎臣,孙效文,等.低温胁迫对鲤血清生化指标的影响[J].水产学杂志,2006,19(2):71-75.
[23]章龙珍,朱卫,王妤,等.饲料脂肪水平对点篮子鱼消化酶活性和血液主要生化指标的影响[J].海洋渔业,2014,36(2): 170-176.
[24]Sano T.Haematological studies of the culture fishes in Japan[J]. Journal of Tokyo University of Fisheries,1962,48(1):105-109.
Effects of abrupt and gradual decreases in water tem perature on blood physiological and biochem ical parameters in dusty rabbit fish Siganus fuscescens
NING Jun-hao1,2,QIN Yu-bo3,HU Lun-chao1,ZHANGWei-jie1,LILie1,CHANG Ya-qing1,SONG Jian1
(1.Key Laboratory of Mariculture&Stock Enhancement in North China蒺s Sea,Ministry of Agriculture,Dalian Ocean University,Dalian 116023,China; 2.Key Laboratory of Experimental Marine Biology,Institute of Oceanology,Chinese Academy of Sciences,Qingdao266071,China;3.Liaoning Prov-ince Marine Environmental Forecasting Center,Shenyang 110001,China)
In this study,hematology and serum biochemical parameterswere investigated in dusty rabbit fish Siga-nus fuscescens with body weight of(37.12依5.60)g exposed to abrupt(24益in control group--20益--16益--8益,sampled in 1 h acclimatization)and gradual(24益in control group--20益--8益at a rate of1益/3 h, sampled in 1 h acclimatization)decreases in water temperature.The results showed that the number of red blood count(RBC),hemoglobin(HGB),and hematocrit(Hct)in hematology were significantly decreased at8益,in the abrupt decrease temperature groups,with first increase-then decrease in activities of glutamyl-transpeptidase (ALT)and alkaline phosphatase(AKP).Therewas significantly higher ALT activity than that in control group ex-cept in group 20益,with significantly higher AKP activity at 20益(P<0.05).Glutamate-oxaloacetate(AST) activity was shown to be a fluctuation tendency,significant increase from the initial level(P<0.05).Glucose (GLU)concentration in serum was significantly increased at 8益,while significantly lower in the other tempera-ture treatments than the initial level(P<0.05).There was significantly lower concentrations of cholesterol (CHOL),total protein(TP)and albumin(ALB)in the other temperature except for 20益than those in the con-trol group.The triglyceride(TG)and creatinine(CREA)concentrationswere significantly increased at20益,sig-nificantly lower TG at the other temperature than the initial level(P<0.05).In gradual decrease in water tempera-ture,however,RBC and HGB were decreased significantly(P<0.05),without significant differences in the other hematology parameters(P>0.05).There were significantly higher ALT activities at12益than those in the control group,and significantly higher AST activities at 20益and 12益than those in control group.It was found that AKP activitieswere significantly increased in all groups except for at16益(P<0.05).GLU concentration was sig-nificantly increased at8益,and CHOL concentration significantly decreased at16益and 12益(P<0.05).The concentration of TG,TP and CREA showed a increase-decrease trend,the TP concentration being not recovered to the initial level.ALB concentration was significantly decreased compared to the initial level except for at20益(P< 0.05).The findings suggest that dusty rabbit fish have lower limit temperature for survival at12益,and lethal low temperature of 8-9益.
Siganus fuscescens;low-temperature stress;serum enzyme;biochemical parameter
S968.1
A
10.16535/j.cnki.dlhyxb.2017.03.007
2095-1388(2017)03-0294-08
2016-07-27
辽宁省科技攻关重大项目(2015203003)
宁军号(1988—),男,博士研究生。E-mail:ningjunhaook@126.com
宋坚(1971—),男,研究员。E-mail:dlmel@163.com

